factor,血小板衍生生长因子)、egf(epidermal growth factor,表皮生长因子)、至少一种磷脂及至少一种脂肪酸。
17.在本发明的一方面的生物组织损伤修复剂的制造方法中,在上述培养步骤中,将间充质干细胞至少传代一次。
18.为了解决上述课题,本发明的一方面的生物组织损伤修复剂含有如下间充质干细胞:编码血管生成素样4(angiopoietin-like 4)的基因、编码脂肪酸结合蛋白3(fatty acid binding protein 3)的基因、编码delta样2同系物(delta-like 2homolog)(果蝇(drosophila))的基因、编码果糖二磷酸醛缩酶c(fructose-bisphosphate aldolase c)的基因、编码trpm8通道相关因子2(trpm8channel-associated factor 2)的基因及编码rest协阻抑制因子2(rest corepressor2)的基因的表达量至少为以5%以上的氧气浓度在含血清培养基中培养的间充质干细胞的3倍以上。
19.本发明的一方面的生物组织损伤修复剂(i)用于抑制生物组织纤维化、(ii)用于抑制炎症细胞浸润、或(iii)用于控制巨噬细胞的活性。
20.在本发明的一方面的生物组织损伤修复剂中,上述生物组织损伤是与急性肾损伤、慢性肾病、慢性肾衰竭、慢性肾小球肾炎、糖尿病性肾病、肾硬化症、急进性肾小球肾炎、多囊性肾病、肾小管间质性肾炎、药物性肾炎、狼疮性肾炎、肾积水、痛风肾、肝硬化、肺纤维化、烧伤、间质性肺炎、药物性肺炎、放射性肺炎、慢性阻塞性肺疾病、急性呼吸窘迫综合征、软骨损伤、骨缺损、脊髓损伤、牙周病、多发性硬化症、类风湿关节炎、系统性红斑狼疮、克罗恩病、糖尿病、动脉硬化、心肌梗塞、中风、阿尔茨海默病、黄斑变性、病毒性肝炎、酒精性肝炎、非酒精性脂肪性肝炎、颌骨重建、腭裂、骨替代材料、骨缺损、骨系统疾病、干眼症、角膜病变、咽炎、关节炎、癌症、癌周纤维化或纤维症相关的组织损伤。
21.发明效果
22.根据本发明的一实施方式,可以提供一种新型生物组织损伤修复剂及该修复剂的制造方法,其生物组织损伤修复效果显著高于包含使用无血清培养基以大气程度的常规氧气浓度培养的间充质干细胞的生物组织损伤修复剂。
附图说明
23.图1是示出本发明的一实施例中的利用蛋白质印迹法检测α-sma的结果的图像。
24.图2是本发明的一实施例中的α-sma、i型胶原蛋白(collagen type i)及iii型胶原蛋白(collagen type iii)的免疫染色结果的图像。
25.图3是示出本发明的一实施例中的利用蛋白质印迹法检测α-sma的结果的图像。
26.图4是示出本发明的一实施例中的利用蛋白质印迹法检测α-sma的结果的图像。
27.图5是本发明的一实施例中的对用作修复剂的来自人骨髓的间充质干细胞中表达的表面抗原的表达量进行对比的图表。
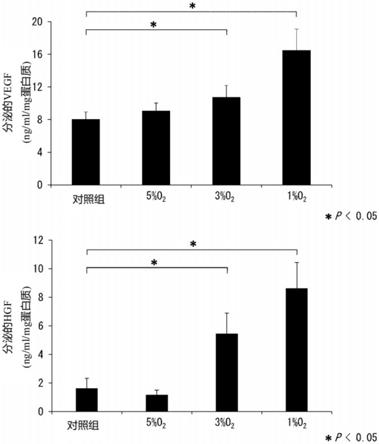
28.图6是本发明的一实施例中的在氧气浓度不同的条件下对来自人骨髓的间充质干细胞中的vegf及hgf的表达量进行对比的图表。
29.图7是本发明的一实施例中的在培养时间不同的条件下对来自人骨髓的间充质干细胞中的vegf的表达量进行对比的图表。
30.图8是本发明的一实施例中的对来自人骨髓的间充质干细胞中表达的基因的表达
量进行对比的图表。
31.图9是本发明的一实施例中的对来自人骨髓的间充质干细胞的细胞数进行对比的图表。
32.图10是本发明的一实施例中的在培养基及氧气浓度不同的条件下对来自人骨髓的间充质干细胞中的vegf及hgf的表达量进行对比的图表。
具体实施方式
33.下面,对本发明的实施方式进行说明。本发明并不限于以下所说明的各构成,可以在权利要求书所示的范围内进行各种变更,适当组合不同的实施方式或实施例中分别公开的技术方案所得到的实施方式及实施例也包含在本发明的技术范围内。此外,本说明书中所记载的学术文献及专利文献整体作为参考文献并入本说明书中。另外,在本说明书中如无特别说明,则表示数值范围的“a~b”意指“a以上且b以下”。
34.〔1.修复剂的制造方法〕
35.本发明的一实施方式的生物组织损伤修复剂的制造方法(以下也称为“本实施方式的制造方法”)包括以下步骤:在无血清培养基中以低于5%的氧气浓度培养间充质干细胞。
36.上述无血清培养基的组成只要是可以进行间充质干细胞的培养的无血清培养基,便无特别限定,可以适当使用众所周知的无血清培养基。作为众所周知的无血清培养基,可以使用例如stk1(twocells股份有限公司)、stk2(twocells股份有限公司)、人间充质干细胞专用完全合成培养基试剂盒(mscgm-cd bulletkit)(lonza)、间充质干细胞增殖培养基dxf:mesenchymal stem cell growth medium dxf(ready-touse)(promocell gmbh.)、stem pro msc sfm xeno free(thermo fisher scientific inc.)、及mesencult-acf medium kit(stemcell technologies inc.)等。
37.作为上述无血清培养基的具体组成,例如可以列举(i)含有fgf、pdgf、egf、至少一种磷脂及至少一种脂肪酸的无血清培养基、(ii)含有fgf、pdgf、egf、tgf-β(transforming growth factor-β,转化生长因子-β)、至少一种磷脂及至少一种脂肪酸的无血清培养基、(iii)含有fgf、pdgf、egf、地塞米松、胰岛素、血清白蛋白、至少一种磷脂及至少一种脂肪酸的无血清培养基、(iv)含有fgf、pdgf、egf、tgf-β、地塞米松、胰岛素、血清白蛋白、至少一种磷脂及至少一种脂肪酸的无血清培养基。另外,若无血清培养基含有地塞米松、胰岛素及血清白蛋白中的至少任一种,则会起到延长间充质干细胞的存活期及促进间充质干细胞增殖亢进的效果。
38.另外,上述(i)及(iii)的无血清培养基也可以不含tgf-β及/或hgf。并且,上述(ii)及(iv)的无血清培养基也可以不含hgf。
39.作为上述磷脂,并无特别限定,例如可以列举磷脂酸、溶血磷脂酸、磷脂酰肌醇、磷脂酰丝氨酸、磷脂酰乙醇胺、磷脂酰胆碱及磷脂酰甘油等,这些磷脂既可以单独使用,也可以组合(例如,将磷脂酸与磷脂酰胆碱组合)使用。这些磷脂既可以来自动物,也可以来自植物。
40.作为上述脂肪酸,并无特别限定,例如可以列举亚油酸、油酸、亚麻酸、花生四烯酸、肉豆蔻酸、棕榈酰酸、棕榈酸及硬脂酸等,这些脂肪酸既可以单独使用,也可以组合使
factor)家族的生长因子,优选为pdgf-bb或pdgf-ab。
52.egf意指选自表皮生长因子(egf:epidermal growth factor)家族的生长因子。
53.并且,在一实施方式中,无血清培养基也可以进一步含有选自由结缔组织生长因子(ctgf:connective tissue growth factor)、血管内皮生长因子(vegf:vascular endothelial growth factor)及抗坏血酸化合物所组成的组中的至少两种因子。
54.本说明书中所使用的抗坏血酸化合物意指抗坏血酸(维生素c)或抗坏血酸-2-磷酸酯、或与它们类似的化合物。
55.在一个方面中,无血清培养基优选含有脂质抗氧化剂。在一实施方式中,无血清培养基中含有的脂质抗氧化剂可以为dl-α-生育酚乙酸酯(维生素e)。无血清培养基也可以进一步含有表面活性剂。在一实施方式中,无血清培养基中含有的表面活性剂可以为pluronic f-68或tween 80。
56.无血清培养基也可以进一步含有胰岛素、转铁蛋白、地塞米松、血清白蛋白及硒酸盐。本说明书中所使用的胰岛素可以是胰岛素样生长因子,既可以来自天然细胞,也可以通过基因重组产生。
57.在预培养步骤中,将通过以往众所周知的方法从人等动物组织中分离出的间充质干细胞接种至上述无血清培养基,并培养至增殖至所需细胞数(当然,在预培养步骤中,也可以不使间充质干细胞增殖,而仅维持在无血清培养基中)。作为培养条件,优选将从1~500mg的组织片(包含间充质干细胞)中分离出的间充质干细胞接种至1ml的培养基,培养温度优选为37℃
±
1℃,且培养间充质干细胞的环境中的二氧化碳(co2)的浓度优选为10%以下。
58.在一实施方式中,tgf-β相对于上述基础培养基的含量以最终浓度计,优选为0.5~100ng/ml,进一步优选为10ng/ml。
59.在预培养步骤中,接种间充质干细胞,并培养至增殖至所需细胞数。作为培养条件,优选为将1~2
×
104个间充质干细胞接种至1ml的培养基,培养温度优选为37℃
±
1℃,且培养间充质干细胞的环境中的二氧化碳(co2)的浓度优选为5%以下。
60.细胞培养时间只要是可以充分获得目标细胞数的培养时间,便无特别限定。例如,培养时间可以为1~5小时,可以为1~10小时,可以为1~20小时,可以为1小时~1天,可以为1小时~10天,可以为1小时~30天,可以为1小时~50天。
61.在预培养步骤中,用于培养的培养容器只要可以使间充质干细胞增殖,便无特别限定。例如,可以优选使用falcon公司生产的75cm2烧瓶、住友电木(sumitomo bakelite)公司生产的75cm2烧瓶等。其中,根据细胞的不同,有时细胞的培养会因所使用的培养容器的种类而受到影响。因此,为了更高效地培养间充质干细胞,优选针对每个成为培养对象的间充质干细胞(以下也称为“培养对象细胞”),使用适合培养的培养容器来进行预培养步骤。
62.用于预培养步骤的间充质干细胞并无特别限制,优选为初始的间充质干细胞、即从人等动物组织中采集后一次也未经传代培养的细胞。
63.并且,为了在预培养步骤中使间充质干细胞更高效地增殖,优选针对每个成为在预培养步骤中培养的对象的间充质干细胞(以下也称为“预培养对象细胞”),使用适合培养的培养容器来进行预培养步骤。作为适合培养预培养步骤对象细胞的培养容器的选择方法,例如可以列举使预培养步骤对象细胞选择最优的培养容器的方法。具体来说,可以准备
多种培养容器,除培养容器的种类不同以外,其他均在相同的培养条件下使预培养步骤对象细胞增殖,通过众所周知的方法来测量培养开始起两周后的细胞数,按细胞数由多到少依次判断其是否为适合培养预培养步骤对象细胞的培养容器。并且,当上述预培养步骤对象细胞的增殖速度较快时,即使培养开始起还未到两周,也可以按达到汇合状态的80~90%的细胞数的时间由短到长,依次判断其是否为适合培养预培养步骤对象细胞的培养容器。
64.在本实施方式的制造方法的预培养步骤中,当适合预培养步骤对象细胞增殖的培养容器已经明确时,使用该培养容器即可。与此相对,当适合培养预培养步骤对象细胞的培养容器不明确等时,本实施方式的制造方法也可以在预培养步骤之前进一步包含“培养容器选择步骤”,以选择适合培养预培养步骤对象细胞的培养容器。
65.另外,对间充质干细胞的增殖来说,细胞粘附于培养容器为必须条件,因此,当间充质干细胞相对于培养容器的粘附较弱时,优选在预培养步骤中,使上述无血清培养基进一步含有细胞粘附分子。作为上述“细胞粘附分子”,例如可以列举纤连蛋白、胶原蛋白、明胶等。这些细胞粘附分子既可以单独使用一种,也可以组合使用多种。
66.并且,在预培养步骤中,也可以将间充质干细胞至少传代一次。由于间充质干细胞以支架依赖性的方式增殖,所以当间充质干细胞局部不均匀地增殖等时,可以通过在所述预培养步骤的中途将间充质干细胞传代,来改善培养条件。另外,预培养步骤优选在初代培养(p0)~第三次传代(p3)的期间进行。
67.作为间充质干细胞的传代方法,并无特别限定,可以使用以往众所周知的间充质干细胞的传代方法进行传代。由于传代后的间充质干细胞的状态良好,所以优选在上述预培养步骤中,在进行传代时使用不含来自哺乳类及微生物的成分的细胞剥离剂,来剥离上述间充质干细胞。作为上述“不含来自哺乳类及微生物的成分的细胞剥离剂”,例如可以列举accutase(innovative cell technologies,inc.)。
68.此处,对使用accutase作为上述“不含来自哺乳类及微生物的成分的细胞剥离剂”时的传代方法的一例进行说明。按照(i)~(vi)的顺序将间充质干细胞剥离、传代。另外,在以下所说明的传代方法中,对使用t-25烧瓶(falcon公司)作为培养容器的情况进行说明。
69.(i)使用5ml的pbs(-)清洗烧瓶上的细胞层。
70.(ii)向细胞层中添加2ml的accutase。
71.(iii)将细胞层在室温下静置2分钟左右,在确认细胞从烧瓶剥离后,将包含剥离后的细胞的pbs(-)移至离心管。
72.(iv)向烧瓶中添加7ml的pbs(-),并冲洗该烧瓶的底面。
73.(v)将上述(iv)的溶液移至上述(iii)的离心管,以1500rpm(200~1000
×
g)离心5分钟。
74.(vi)从离心管中除去上清液,以5,000个-细胞/cm2的接种浓度,使用无血清培养基,将细胞接种至新烧瓶上。
75.(b.低氧培养步骤)
76.在本实施方式的制造方法中,在上述预培养步骤之后,在无血清培养基(例如,含有fgf、pdgf、egf、至少一种磷脂及至少一种脂肪酸的无血清培养基,更优选为进一步含有地塞米松、胰岛素及血清白蛋白中的至少任一种的无血清培养基)中,以低于5%的氧气浓
度培养间充质干细胞(以下称为“低氧培养步骤”)。另外,无血清培养基可以不含也可以含有tgf-β及/或hgf。
77.在培养间充质干细胞时该间充质干细胞(更具体来说,用于培养间充质干细胞的培养基)可接触到的气体(以下也称为“培养间充质干细胞的环境”)中所含的氧气的浓度可以低于5%,可以为4%以下,可以为3%以下,可以为2%以下,可以为1%以下,优选为3%以下,若为1%以下,则更好。上述气体中所含的氧气的浓度的下限值并无特别限定,例如可以设定为高于0%。上述气体中所含的氧气的浓度的下限值只要为间充质干细胞能够生长发育而不死亡的程度即可。
78.通过培养间充质干细胞的环境中的氧气浓度低于5%,所培养的间充质干细胞的生物组织损伤修复作用(例如,抗纤维化作用、炎症细胞浸润抑制作用、巨噬细胞的活性控制作用)得以增强。
79.在培养间充质干细胞的环境中,可以包含除氧气以外的气体成分。关于该气体成分,只要间充质干细胞在气体成分中能够生长发育而不会死亡,便无特别限定,也可以是大气中所含的除氧气以外的气体成分(例如,氮气、二氧化碳、氩气或它们的混合物)。
80.在本说明书中,更具体来说,表示氧气等气体成分的浓度的“%”是指“体积%”。
81.对于用于培养间充质干细胞的气体,可以在培养间充质干细胞时通常所用的培养箱等设备的内部充满该气体,也可以在培养箱等设备的内部设置气密性容器,并在该容器的内部充满该气体,也可以按照包围培养箱等设备的方式设置气密性容器(例如房间),并在该气密性容器的内部充满该气体。另外,该气体优选包含5%左右的二氧化碳(co2),以调整培养基的ph。
82.此处,低氧培养步骤中的“无血清培养基”也可以含有tgf-β。在本说明书中,有时将预培养步骤中使用的无血清培养基称为“无血清培养基a”,将低氧培养步骤中使用的无血清培养基称为“无血清培养基b”。关于除tgf-β以外的成分(fgf、pdgf、egf、地塞米松、胰岛素、血清白蛋白、至少一种磷脂及至少一种脂肪酸等)及基础培养基,与在上述预培养步骤的部分对无血清培养基a的说明相同,因此,此处省略其说明。并且,预培养步骤中使用的无血清培养基a中含有的上述成分的含量可以与对无血清培养基b所说明的含量相同。另外,可以使用无血清培养基b作为无血清培养基a。
83.低氧培养步骤中的培养时间只要是间充质干细胞达到目标细胞数的培养时间,便无特别限定。例如,培养时间可以为6~12小时,可以为6小时~24小时(1天),可以为6小时~48小时,可以为12小时~24小时,可以为24小时~48小时,优选为12小时以上,若为24小时,则更好。
84.作为适合低氧培养步骤对象细胞增殖的培养容器的选择方法,如上述“预培养步骤”部分所述,因此,此处省略其说明。
85.并且,当间充质干细胞相对于培养容器的粘附较弱时,也可以使上述无血清培养基b进一步含有细胞粘附分子。关于上述细胞粘附分子,如上述“预培养步骤”部分所述,因此,此处省略其说明。
86.在低氧培养步骤中,也可以将间充质干细胞至少传代一次。可以通过在低氧培养步骤的中途将间充质干细胞传代,来改善培养条件。
87.另外,优选将从人等动物组织采集后经第一次传代(p1)或更多次传代后的间充质
干细胞供至低氧培养步骤。
88.关于在上述低氧培养步骤的中途将间充质干细胞传代的方法及将预培养步骤后的细胞供至低氧培养步骤时的传代方法,如上述“预培养步骤”部分所述,因此,此处省略其说明。
89.本实施方式的制造方法也可以在上述低氧培养步骤之前(或上述预培养步骤之前),进一步包含培养容器选择步骤,以选择适合间充质干细胞增殖的培养容器。作为适合间充质干细胞增殖的培养容器的选择方法,如上述“预培养步骤”部分所述,因此,此处省略其说明。
90.(c.筛选步骤)
91.本实施方式的制造方法可以在预培养步骤及/或低氧培养步骤之后,进一步包含筛选步骤,以从间充质干细胞中筛选出不具有致肿瘤性的间充质干细胞,也可以不包含筛选步骤。
92.通过使用在筛选步骤中筛选出的间充质干细胞作为修复剂,能够实现含有不具有致肿瘤性的间充质干细胞的修复剂,从而能够提高修复剂的安全性。
93.在筛选步骤中,可以通过利用体内(in vivo)的高灵敏度免疫缺陷小鼠(nog小鼠)进行的致肿瘤性试验法,来研究间充质干细胞的致肿瘤性。
94.具体来说,将在上述无血清培养基中以低于5%的氧气浓度培养的间充质干细胞(例如1,000,000个)及hela细胞(例如1,000个)分别移植到nog小鼠的皮下10处。此时,若在能够确认到hela细胞的致肿瘤性(具体来说,移植部位的肿瘤的发生)的条件下(例如,特定的小鼠饲养时间等),无法确认到无血清培养基中培养的间充质干细胞的致肿瘤性,则可以判断该间充质干细胞是不具有致肿瘤性的间充质干细胞。
95.〔2.生物组织损伤修复剂〕
96.本发明的一实施方式的生物组织损伤修复剂(以下也称为“本实施方式的修复剂”)含有如下间充质干细胞:编码血管生成素样4(angiopoietin-like 4)(或其同源物)的基因、编码脂肪酸结合蛋白3(fatty acid binding protein 3)(或其同源物)的基因、编码delta样2同系物(delta-like 2homolog)(果蝇(drosophila))的基因、编码果糖二磷酸醛缩酶c(fructose-bisphosphate aldolase c)(或其同源物)的基因、编码trpm8通道相关因子2(trpm8 channel-associated factor 2)(或其同源物)的基因及编码rest协阻抑制因子2(rest corepressor2)(或其同源物)的基因的表达量至少为以5%以上的氧气浓度在含血清培养基中培养的间充质干细胞的3倍以上(优选为各基因独立地为3倍以上、4倍以上、5倍以上、10倍以上、20倍以上、40倍以上或50倍以上)。
97.并且,本实施方式的修复剂含有如下间充质干细胞:编码血管生成素样4(angiopoietin-like 4)(或其同源物)的基因、编码脂肪酸结合蛋白3(fatty acid binding protein 3)(或其同源物)的基因、编码delta样2同系物(delta-like 2homolog)(果蝇(drosophila))的基因、编码果糖二磷酸醛缩酶c(fructose-bisphosphate aldolase c)(或其同源物)的基因、编码trpm8通道相关因子2(trpm8 channel-associated factor 2)(或其同源物)的基因及编码rest协阻抑制因子2(rest corepressor 2)(或其同源物)的基因的表达量至少为以1%以下的氧气浓度在含血清培养基中培养的间充质干细胞的2倍以上(优选为各基因独立地为3倍以上、4倍以上、5倍以上、10倍以上或15倍以上)。
98.此外,本实施方式的修复剂含有如下间充质干细胞:编码血管生成素样4(angiopoietin-like 4)(或其同源物)的基因、编码脂肪酸结合蛋白3(fatty acid binding protein 3)(或其同源物)的基因、编码delta样2同系物(delta-like 2homolog)(果蝇(drosophila))的基因、编码果糖二磷酸醛缩酶c(fructose-bisphosphate aldolase c)(或其同源物)的基因、编码trpm8通道相关因子2(trpm8 channel-associated factor 2)(或其同源物)的基因及编码rest协阻抑制因子2(rest corepressor 2)(或其同源物)的基因的表达量为以5%以上的氧气浓度在无血清培养基中培养的间充质干细胞的2倍以上(优选为各基因独立地为3倍以上、4倍以上、5倍以上、7倍以上或10倍以上)。换句话说,本发明的一实施方式的生物组织损伤修复剂也可以含有在无血清培养基中以低于5%的氧气浓度培养的间充质干细胞。
99.血管生成素样4(angiopoietin-like 4)是参与糖类代谢及脂质代谢的蛋白质,在人体中由angptl4基因编码。
100.脂肪酸结合蛋白3(fatty acid binding protein 3)是脂肪酸结合蛋白质,在人体中由fabp3基因编码。
101.delta样2同系物(delta-like 2homolog)(果蝇(drosophila))是表皮生长因子样蛋白质,由dlk2基因编码。
102.果糖二磷酸醛缩酶c(fructose-bisphate aldolase c)是c型醛缩酶,在人体中由aldoc基因编码。
103.trpm8通道相关因子2(trpm8 channel-associated factor 2)是调节瞬时受体电位melastatin成员8(transient receptor potential melastatin member 8)(trpm8)的蛋白质,在人体中由tcaf2基因编码。
104.rest协阻抑制因子2(rest corepressor 2)是调节神经元的基因表达的蛋白质,在人体中由rcor2基因编码。
105.此处,本实施方式的修复剂意指具有促进生物组织损伤修复的效果的药剂。本实施方式的修复剂可以说是用于抑制生物组织纤维化的药剂(换句话说,纤维化抑制剂),还可以说是用于抑制炎症细胞浸润的药剂(换句话说,炎症细胞浸润抑制剂),也可以说是用于控制巨噬细胞的活性的药剂(换句话说,巨噬细胞活性控制剂)。
106.此处,“抑制生物组织纤维化”意指抑制由结缔组织的异常增殖或者胶原蛋白在结缔组织中的异常累积所引起的组织硬化。例如,若生物组织受到损伤,则在治愈过程中,构成生物组织的结缔组织有时会异常增殖。“抑制生物组织纤维化”意指例如在生物组织受到损伤后,抑制由构成生物组织的结缔组织的异常增殖或者胶原蛋白在结缔组织中的异常累积所引起的组织硬化。
107.此处,“抑制炎症细胞浸润”意指抑制炎症细胞(例如,巨噬细胞、淋巴细胞及中性粒细胞等)破坏组织或者侵入组织中并增殖。
108.此处,“控制巨噬细胞活性”意指改变巨噬细胞的表型。“控制巨噬细胞活性”意指例如使巨噬细胞从促进组织炎症的促炎表型(pro-inflammatory phenotype)(m1型)巨噬细胞变为免疫调节表型(immune-regulatory phenotype)(m2型)巨噬细胞。通过使巨噬细胞从m1型变为m2型,例如也可以镇静组织炎症。
109.并且,当培养间充质干细胞时,可以仅在单一的无血清培养基中培养间充质干细
胞,也可以在多个无血清培养基中培养间充质干细胞。当在多个无血清培养基中培养间充质干细胞时,例如,还可以在所需的无血清培养基中培养间充质干细胞后,将该所需的无血清培养基替换为另一无血清培养基,进一步在该另一无血清培养基中培养间充质干细胞。
110.上述无血清培养基的组成在上述〔1.修复剂的制造方法〕部分已说明,因此,此处省略其说明。
111.本实施方式的修复剂中所使用的间充质干细胞不仅包含从骨髓、脂肪、滑膜、牙髓及牙周膜等组织中分离出的间充质干细胞,还包含从胎盘、脐带血及脐带等组织中分离出的间充质干细胞。从实现修复作用更高的修复剂的观点出发,优选从脂肪中分离出的间充质干细胞。并且,本实施方式的修复剂中所使用的间充质干细胞也可以是人间充质干细胞(例如,所采集的人间充质干细胞),大鼠及作为对象的生物组织并无特别限定,例如可以列举肾脏、肝脏、肺、皮肤、软骨、骨、脊髓、牙齿、关节、血管(动脉及静脉)、心脏、脑、下巴、口部、眼睛、角膜以及咽部。即,上述修复剂可以修复这些生物组织的损伤。
112.与使用无血清培养基以大气程度的常规氧气浓度培养的间充质干细胞相比,本发明中所使用的间充质干细胞明显具有更高的组织纤维化抑制效果、炎症细胞浸润抑制效果及使炎症促进型巨噬细胞(m1)变为炎症抑制型巨噬细胞(m2)的效果。
113.作为上述修复剂可发挥功效的伴有生物组织损伤的病症,并无特别限定。作为病症,例如可以列举急性肾损伤、慢性肾病、慢性肾衰竭、慢性肾小球肾炎(iga肾病、膜性肾病、膜增生性肾小球肾炎、局灶性肾小球硬化等)、其他肾脏病(例如糖尿病性肾病、肾硬化症、急进性肾小球肾炎、多囊性肾病、肾小管间质性肾炎、药物性肾炎、狼疮性肾炎、肾积水、痛风肾等)、肝硬化、肺纤维化、烧伤、间质性肺炎、药物性肺炎、放射性肺炎、慢性阻塞性肺疾病、急性呼吸窘迫综合征、软骨损伤、骨缺损、脊髓损伤、牙周病、多发性硬化症、类风湿关节炎、系统性红斑狼疮、克罗恩病、糖尿病、动脉硬化、心肌梗塞、中风、阿尔茨海默病、黄斑变性、病毒性肝炎、酒精性肝炎、非酒精性脂肪性肝炎、颌骨重建、腭裂、骨替代材料、骨缺损、骨系统疾病、干眼症、角膜病变、咽炎、关节炎、癌症、癌周纤维化或纤维症等。
114.本实施方式的修复剂除了包含间充质干细胞以外,还可以包含药学上可接受的添加剂(例如,缓冲剂、抗氧化剂、增稠剂及赋形剂),所述间充质干细胞的编码血管生成素样4(angiopoietin-like 4)的基因、编码脂肪酸结合蛋白3(fatty acid binding protein 3)的基因、编码delta样2同系物(delta-like 2homolog)(果蝇(drosophila))的基因、编码果糖二磷酸醛缩酶c(fructose-bisphosphate aldolase c)的基因、编码trpm8通道相关因子2(trpm8 channel-associated factor 2)的基因及编码rest协阻抑制因子2(rest corepressor 2)的基因的表达量至少为以5%以上的氧气浓度在含血清培养基中培养的间充质干细胞的3倍以上。
115.上述添加剂的量并无特别限定,例如,可以是本实施方式的修复剂的0.01~50重量%、0.01~40重量%、0.01~30重量%、0.01~20重量%、0.01~10重量%或0.01~1重量%。
116.本实施方式的修复剂中所含的间充质干细胞的数量并无特别限定,可以根据给药对象的体重适当设定。例如,每剂(单次给药)可以为1
×
102细胞~1
×
10
10
细胞、1
×
103细胞~1
×
10
10
细胞、1
×
104细胞~1
×
10
10
细胞、1
×
105细胞~1
×
10
10
细胞、1
×
106细胞~1
×
10
10
细胞。当然,每剂(单次给药)也可以为10
10
细胞以上。
117.作为上述修复剂的给药方法,例如可以列举血管注射及局部(脊髓(例如脊髓腔)、肌肉、关节、脑等)注射。
118.本发明的一实施方式的生物组织损伤修复剂的给药对象并无特别限定。作为上述给药对象,可以列举人及除人以外的哺乳类(牛、猪、绵羊、山羊、马、狗、猫、兔子、小鼠、大鼠等)。
119.本实施方式的修复剂的单次给药量并无特别限定,对给药对象的每1kg体重所给药的间充质干细胞的数量可以为1
×
106细胞~1
×
107细胞、1
×
105细胞~1
×
108细胞、1
×
104细胞~1
×
109细胞。每人所给药的间充质干细胞的数量可以为1
×
104细胞~1
×
109细胞,考虑到给药对象与人的体表面积的差异,可以为2
×
103细胞~2
×
108细胞。
120.〔3.其他〕
121.本发明也可以按照以下方式构成。另外,以下所记载“生物组织损伤的修复方法”也可以是“生物组织损伤的预防方法”或“生物组织损伤的治疗方法”。
122.《1》一种生物组织损伤的修复方法,其特征在于,包括以下步骤:将含有间充质干细胞的生物组织损伤修复剂给药至对象生物(例如,人或除人以外的哺乳类(牛、猪、绵羊、山羊、马、狗、猫、兔子、小鼠、大鼠等)),所述间充质干细胞的编码血管生成素样4(angiopoietin-like 4)的基因、编码脂肪酸结合蛋白3(fatty acid binding protein 3)的基因、编码delta样2同系物(delta-like2homolog)(果蝇(drosophila))的基因、编码果糖二磷酸醛缩酶c(fructose-bisphosphate aldolase c)的基因、编码trpm8通道相关因子2(trpm8 channel-associated factor 2)的基因及编码rest协阻抑制因子2(rest corepressor 2)的基因的表达量至少为以5%以上的氧气浓度在含血清培养基中培养的间充质干细胞的3倍以上。
123.《2》根据《1》所述的修复方法,其特征在于,上述生物组织损伤修复剂(i)用于抑制生物组织纤维化、(ii)用于抑制炎症细胞浸润、或(iii)用于控制巨噬细胞的活性。
124.《3》根据《1》或《2》所述的修复方法,其特征在于,上述生物组织损伤是与急性肾损伤、慢性肾病、慢性肾衰竭、慢性肾小球肾炎、糖尿病性肾病、肾硬化症、急进性肾小球肾炎、多囊性肾病、肾小管间质性肾炎、药物性肾炎、狼疮性肾炎、肾积水、痛风肾、肝硬化、肺纤维化、烧伤、间质性肺炎、药物性肺炎、放射性肺炎、慢性阻塞性肺疾病、急性呼吸窘迫综合征、软骨损伤、骨缺损、脊髓损伤、牙周病、多发性硬化症、类风湿关节炎、系统性红斑狼疮、克罗恩病、糖尿病、动脉硬化、心肌梗塞、中风、阿尔茨海默病、黄斑变性、病毒性肝炎、酒精性肝炎、非酒精性脂肪性肝炎、颌骨重建、腭裂、骨替代材料、骨缺损、骨系统疾病、干眼症、角膜病变、咽炎、关节炎、癌症、癌周纤维化或纤维症相关的组织损伤。
125.实施例
126.〔实施例1〕
127.对通过移植使用无血清培养基培养的间充质干细胞来抑制肾纤维化的效果进行研究。
128.《方法:msc的制作》
129.在本实施例1中,将使用无血清培养基(stk2培养基,twocells股份有限公司:对应于“含有fgf、pdgf、egf、至少一种磷脂及至少一种脂肪酸的无血清培养基”)培养的人间充质干细胞用作msc。
130.在实施例中,使用在1%氧气环境下培养24小时后的来自人骨髓的间充质干细胞(1%o2hmsc)。另一方面,在比较例中,使用在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞(21%o2hmsc)。另外,任一来自人骨髓的间充质干细胞均在大气压下培养。
131.制备包含氧气(1%或21%)、二氧化碳5%及氮气(94%或74%)的气体,从储存该气体的储气瓶将该气体供给至培养来自人骨髓的间充质干细胞的环境。
132.《方法:疾病模型的制作》
133.肾纤维化模型是通过在将8周龄、雄性sprague dawley大鼠(sd大鼠)的左肾动脉阻断60分钟后解除该阻断(肾缺血再灌注损伤(iri))来制作。iri是依据众所周知的方法。
134.《方法:药剂的给药》
135.分别使所制作的msc(21%o2hmsc及1%o2hmsc)50万个细胞(cells)悬浮于200μl的pbs。将悬浮的msc给药至实施iri后的sd大鼠的血管内(也将给药21%o2hmsc的组称为“21%o2hmsc组”,将给药1%o2hmsc的组称为“1%o2hmsc组”)。作为对照,仅将200μl的pbs给药至实施iri后的sd大鼠的血管内(也称为“pbs组”)。
136.在“21%o2hmsc组”中,n=2(从两只实施iri后的sd大鼠中采集左肾),在“pbs组”及“1%o2hmsc组”中,n=3(从三只实施iri后的sd大鼠中采集左肾),以此来评价药剂的影响。
137.《方法:宰杀及采样》
138.在药剂(1%o2hmsc、21%o2hmsc或pbs)给药21天后,采集sd大鼠的左肾。对于所采集的肾脏,通过使用抗α-sma抗体的蛋白质印迹法、及使用抗α-sma抗体、抗i型胶原蛋白(collagen type i)抗体、抗iii型胶原蛋白(collagen type iii)抗体的免疫染色,对由肾纤维化及伴随肾纤维化所产生的细胞外基质的增减进行评价。另外,蛋白质印迹法是基于众所周知的蛋白质印迹法的协议进行确认。并且,免疫染色是使用市售的抗体,基于众所周知的协议来进行。
139.《结果》
140.图1中示出了使用抗α-sma抗体的蛋白质印迹法的结果,图2中示出了使用抗α-sma抗体、抗i型胶原蛋白(collagen type i)抗体及抗iii型胶原蛋白(collagen type iii)抗体的免疫染色的结果。
141.如图1所示,在“21%o2hmsc组”中,与“pbs组”相比,作为肾纤维化的分子标志物的α-sma的表达受到抑制。此外,在“1%o2hmsc组”中,与“21%o2hmsc组”相比,α-sma的表达进一步受到抑制。
142.如图2所示,与“pbs组”相比,在“21%o2hmsc组”中,通过对sd大鼠实施iri所诱导的作为肾纤维化的分子标志物的α-sma、以及表达随着肾纤维化而增强的细胞外基质i型胶原蛋白(collagen type i)及iii型胶原蛋白(collagen type iii)的表达受到抑制。此外,在“1%o2hmsc组”中,与“21%o2hmsc组”相比,α-sma、i型胶原蛋白(collagen type i)及iii型胶原蛋白(collagen type iii)的表达受到更强的抑制。
143.《总结》
144.观察到与在常规氧气浓度的环境中培养24小时后的来自人骨髓的间充质干细胞(21%o2hmsc组)相比,在低氧气浓度的环境中培养24小时后的来自人骨髓的间充质干细胞(1%o2hmsc组)抑制肾纤维化进展的作用增强。
145.〔实施例2-1〕
146.对在无血清培养基中培养的来自人骨髓的间充质干细胞的培养上清液对纤维化的抑制效果进行研究。
147.通过利用tgf-β1刺激对人近端肾小管细胞(hk2)进行纤维化诱导,向该人近端肾小管细胞(hk2)中加入来自人骨髓的间充质干细胞的培养上清液(以下也称为“msc-cm”),并对α-sma的表达水平进行评价。
148.《培养上清液的制作》
149.使用stk2培养基将来自人骨髓的间充质干细胞在21%氧气环境下培养24小时。从培养物中除去stk2培养基,得到来自人骨髓的间充质干细胞后,使用无血清(serum-free)dmem将该人间充质干细胞在21%氧气环境下培养24小时。将培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“21%o2msc-cm”。
150.并且,使用stk2培养基将来自人骨髓的间充质干细胞在1%氧气环境下培养24小时。从培养物中除去stk2培养基,得到来自人骨髓的间充质干细胞后,使用无血清(serum-free)dmem将该来自人骨髓的间充质干细胞在1%氧气环境下培养24小时。将培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“1%o2msc-cm”。另外,“21%o2msc-cm”及“1%o2msc-cm”均是在大气压下培养来自人骨髓的间充质干细胞。
151.制备包含氧气(1%或21%)、二氧化碳5%及氮气(94%或74%)的气体,从储存该气体的储气瓶将该气体供给至培养来自人骨髓的间充质干细胞的环境。
152.《评价方法》
153.以1
×
105细胞/孔将人近端肾小管细胞(hk2)接种至6孔板,在含10%牛血清的dmem培养基(sigma-aldrich公司)中培养18小时,经确认,培养后的细胞数达到亚汇合(汇合状态的80~90%的细胞数)。然后,吸除含10%牛血清的dmem培养基,用pbs清洗hk2。将该hk2接种至无血清(serum-free)dmem后,添加21%o2msc-cm或1%o2msc-cm,在大气气氛下培养24小时。培养24小时后,向培养物中添加tgf-β1。将tgf-β1添加至培养物中后,再培养12小时,之后,利用蛋白质印迹法对hk2中的α-sma的表达进行评价。
154.《结果》
155.图3中示出了hk2中的使用抗α-sma抗体的蛋白质印迹法的结果。图3示出了(i)未添加培养上清液及tgf-β1(添加无血清(serum-free)
156.dmem,而未添加tgf-β1)时的α-sma的表达水平(从图3的左侧起1~3泳道)、(ii)未添加培养上清液而添加tgf-β1(添加无血清(serum-free)dmem及tgf-β1)时的α-sma的表达水平(从图3的左侧起4~6泳道)、(iii)添加21%o2msc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平(从图3的左侧起7~9泳道)、(iv)添加1%o2msc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平(从图3的左侧起10~12泳道)。
157.如图3所示,与添加无血清(serum-free)dmem、而未添加tgf-β1时的α-sma的表达水平相比,添加无血清(serum-free)dmem及tgf-β1时的α-sma的表达水平上升。这表示可以通过tgf-β将人近端肾小管细胞诱导为纤维化状态。
158.观察到与添加无血清(serum-free)dmem及tgf-β1时的α-sma的表达水平相比,添加21%o2msc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平受到抑制。
159.观察到与添加21%o2msc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表
达水平相比,添加1%o2msc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平进一步受到抑制。
160.《总结》
161.与在氧气浓度为21%的环境中培养的来自人骨髓的间充质干细胞(21%o2msc-cm)相比,在低氧气浓度(氧气浓度为1%)的环境中培养24小时以上的来自人骨髓的间充质干细胞(1%o2msc-cm)更强地抑制了由tgf-β1刺激引起的纤维化诱导。
162.〔实施例2-2〕
163.使用来自人脂肪的间充质干细胞作为msc,与〔实施例2-1〕同样地,对在无血清培养基中培养的来自人脂肪的间充质干细胞的培养上清液对纤维化的抑制效果进行研究。
164.《培养上清液的制作》
165.使用stk2培养基将来自人脂肪的间充质干细胞在21%氧气环境下培养24小时。从培养物中除去stk2培养基,得到来自人脂肪的间充质干细胞后,使用无血清(serum-free)dmem将该来自人脂肪的间充质干细胞在21%氧气环境下培养24小时。将培养24小时后的来自人脂肪的间充质干细胞的培养上清液设为“21%o2amsc-cm”。
166.并且,使用stk2培养基将来自人脂肪的间充质干细胞在1%氧气环境下培养24小时。从培养物中除去stk2培养基,得到来自人脂肪的间充质干细胞后,使用无血清(serum-free)dmem将该来自人脂肪的间充质干细胞在1%氧气环境下培养24小时。将培养24小时后的来自人脂肪的间充质干细胞的培养上清液设为“1%o2amsc-cm”。另外,“21%o2amsc-cm”及“1%o2amsc-cm”均是在大气压下培养来自人脂肪的间充质干细胞。
167.制备包含氧气(1%或21%)、二氧化碳5%及氮气(94%或74%)的气体,从储存该气体的储气瓶将该气体供给至培养来自人脂肪的间充质干细胞的环境。
168.《评价方法》
169.以1
×
105细胞/孔将人近端肾小管细胞(hk2)接种至6孔板,在含10%牛血清的dmem培养基(sigma-aldrich公司)中培养18小时,经确认,培养后的细胞数达到亚汇合(汇合状态的80~90%的细胞数)。然后,吸除含10%牛血清的dmem培养基,用pbs清洗hk2。将该hk2接种至无血清(serum-free)dmem后,添加21%o2amsc-cm或1%o2amsc-cm,在大气气氛下培养24小时。培养24小时后,向培养物中添加tgf-β1。将tgf-β1添加至培养物中后,再培养12小时,之后,利用蛋白质印迹法对hk2中的α-sma的表达进行评价。
170.《结果》
171.图4中示出了hk2中的使用抗α-sma抗体的蛋白质印迹法的结果。图4示出了(i)未添加培养上清液及tgf-β1(添加无血清(serum-free)dmem,而未添加tgf-β1)时的α-sma的表达水平(从图4的左侧起1~3泳道)、(ii)未添加培养上清液而添加tgf-β1(添加无血清(serum-free)dmem及tgf-β1)时的α-sma的表达水平(从图4的左侧起4~6泳道)、(iii)添加21%o2amsc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平(从图4的左侧起7~9泳道)、(iv)添加1%o2amsc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平(从图4的左侧起10~12泳道)。
172.如图4所示,与添加无血清(serum-free)dmem、而未添加tgf-β1时的α-sma的表达水平相比,添加无血清(serum-free)dmem及tgf-β1时的α-sma的表达水平上升。这表示可以通过tgf-β将人近端肾小管细胞诱导为纤维化状态。
173.观察到与添加无血清(serum-free)dmem及tgf-β1时的α-sma的表达水平相比,添加21%o2amsc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平受到抑制。
174.观察到与添加21%o2amsc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平相比,添加1%o2amsc-cm作为培养上清液、进一步添加tgf-β1时的α-sma的表达水平受到同等程度的抑制。
175.《总结》
176.在氧气浓度为21%的环境中培养的来自人脂肪的间充质干细胞(21%o2amsc-cm)及在低氧气浓度(氧气浓度为1%)的环境中培养24小时以上的来自人脂肪的间充质干细胞(1%o2amsc-cm)均强效地抑制了由tgf-β1刺激引起的纤维化诱导。即,在氧气浓度为21%的环境中培养的来自人脂肪的间充质干细胞(21%o2amsc-cm)及在低氧气浓度(氧气浓度为1%)的环境中培养24小时以上的来自人脂肪的间充质干细胞(1%o2amsc-cm)均使因tgf-β1刺激而增加的α-sma的表达水平恢复至正常的α-sma的表达水平。
177.如已在上述〔实施例2-1〕中示出的那样,与在低氧气浓度(氧气浓度为1%)的环境中培养的间充质干细胞相比,在氧气浓度为21%的环境中培养的间充质干细胞对由tgf-β1刺激引起的纤维化诱导的抑制作用较弱。在该〔实施例2-2〕中,即使是对由tgf-β1刺激引起的纤维化诱导的抑制作用较弱的、在氧气浓度为21%的环境中培养的来自人脂肪的间充质干细胞(21%o2amsc-cm),也使因tgf-β1刺激而增加的α-sma的表达水平恢复到了正常的α-sma的表达水平。这表明来自人脂肪的间充质干细胞对由tgf-β1刺激引起的纤维化诱导的抑制作用强于来自人骨髓的间充质干细胞。
178.并且,由于1%o2amsc-cm及21%o2amsc-cm强效地抑制了由tgf-β1刺激引起的纤维化诱导,因此,表明即使在低氧气环境中培养,来自人脂肪的间充质干细胞的较强的纤维化抑制作用也维持在较高水平。
179.〔实施例3〕
180.图5示出了使用stk2培养基在大气程度的氧气环境下(换句话说,在未制备气体成分的环境下)培养24小时的来自人骨髓的间充质干细胞(以下也称为“stk”)、与使用stk2培养基以大气程度的氧气浓度(换句话说,在未制备气体成分的环境下)培养后在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞(以下也称为“stk h”)中表达的来自人骨髓的间充质干细胞的表面抗原的表达量的比较结果。
181.制备包含氧气(1%)、二氧化碳5%及氮气(94%)的气体,从储存该气体的储气瓶将该气体供给至培养人间充质干细胞的环境。
182.《比较方法》
183.使用人白细胞抗原(hla)i类的抗hla-a、b、c抗体(biolegend,san diego,ca)、hla ii类抗hla-dr抗体(biolegend)、还有作为间充质干细胞标志物的抗cd-29抗体(biolegend)、抗cd-44抗体(biolegend)、抗cd-73抗体(biolegend)、抗cd-90抗体(biolegend)及抗cd-44抗体(biolegend),通过使用bd facsverse(becton,dickinson and company,franklin lakes,nj)的流式细胞(flow cytometry)法对表面抗原的表达量进行分析。
184.《结果》
185.在图5中,将表示hla-a、b、c抗体的表达量的图表示于101,将hla-a、b、c抗体的表
达量的计数值示于102。并且,将表示hla-dr抗体的表达量的图表示于103,将hla-dr抗体的表达量的计数值示于104。并且,将表示cd-29抗体的表达量的图表示于105,将cd-29抗体的表达量的计数值示于106。并且,将表示cd-44抗体的表达量的图表示于107,将cd-44抗体的表达量的计数值示于108。并且,将表示cd-73抗体的表达量的图表示于109,将cd-73抗体的表达量的计数值示于110。并且,将表示cd-90抗体的表达量的图表示于111,将cd-90抗体的表达量的计数值示于112。
186.如表示hla-a、b、c抗体的表达量的图表101及hla-a、b、c抗体的表达量的计数值102所示,在stk中表达的抗hla-a、b、c抗体的表达量与在stk h中表达的hla-a、b、c抗体为同等程度。并且,如表示hla-dr抗体的表达量的图表103及hla-dr抗体的表达量的计数值104所示,在stk及stk h中均未观察到hla-dr抗体的表达。此外,在stk及stk h两者中观察到了在间充质干细胞中表达的标志物cd-29、cd-44、cd-73及cd-90的表达,两者中的表达量没有差异(请参考105~112)。另外,虽然在图5中未示出,但在两者中未观察到在人间充质干细胞中不表达的标志物(阴性标志物)cd-11b、cd-34及cd-45。
187.《总结》
188.在使用stk2培养基在21%o2环境下培养24小时的来自人骨髓的间充质干细胞、与使用stk2培养基在1%o2环境下培养24小时的来自人骨髓的间充质干细胞中,未观察到在来自人骨髓的间充质干细胞中表达的特定的表面抗原发生变化。因此,暗示了不会影响在1%o2环境下培养24小时的来自人骨髓的间充质干细胞的免疫耐受性及移植来自人骨髓的间充质干细胞时的安全性。
189.〔实施例4〕
190.对在无血清培养基中培养的来自人骨髓的间充质干细胞的培养上清液中所含的vegf及hgf的表达量进行研究。
191.《培养上清液(conditioned medium)的制作》
192.使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在5%氧气环境下培养24小时。将在5%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“5%o
2”。
193.使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在3%氧气环境下培养24小时。将在3%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“3%o
2”。
194.使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在1%氧气环境下培养24小时。将在1%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“1%o
2”。
195.作为对照,使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在21%氧气环境下培养24小时。将在21%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“对照组(control)”。
196.制备包含氧气(1%或21%)、二氧化碳5%及氮气(94%或74%)的气体,从储存该气体的储气瓶将该气体供给至来自人骨髓的间充质干细胞的培养环境中的1%氧气环境及21%氧气环境。另一方面,将以合适的比例混合供给至1%氧气环境的气体与供给至21%氧气环境的气体所得到的气体供给至3%氧气环境及5%氧气环境。
197.《评价方法》
198.通过用于测定vegf浓度的elisa试剂盒(r&d systems,minneapolis,mn,usa),在各组n=6的情况下测定所采集的培养上清液(5%o2、3%o2、1%o2及对照组(control))中所含的vegf的浓度。将vegf浓度的平均值示于图6的上侧图中。另外,测定值是用培养上清液中所含的总蛋白量来校正,并通过mann-whitney u检验进行与对照组(control)的显著性差异检验。
199.并且,通过用于测定hgf浓度的elisa试剂盒(r&d systems,minneapolis,mn,usa),在各组n=6的情况下测定所采集的培养上清液(5%o2、3%o2、1%o2及对照组(control))中所含的hgf的浓度。将hgf浓度的平均值示于图6的下侧图中。另外,测定值是用培养上清液中所含的总蛋白量来校正,并通过mann-whitney u检验进行与对照组(control)的显著性差异检验。
200.《结果》
201.如图6的上侧图所示,在3%o2中,与对照组(control)相比,观察到vegf显著增加。并且,在1%o2中,相对于对照组(control)来说,观察到vegf的增加比3%o2更强。
202.如图6的下侧图所示,在3%o2中,与对照组(control)相比,观察到hgf显著增加。并且,在1%o2中,相对于对照组(control)来说,观察到hgf的增加比3%o2更强。
203.《总结》
204.在来自人骨髓的间充质干细胞中,提高vegf及hgf的分泌能力所需的氧气浓度低于5%,优选为3%以下,最优选为1%以下。
205.〔实施例5〕
206.对在1%氧气环境下的无血清培养基中培养来自人骨髓的间充质干细胞时的培养上清液中所含的vegf的量的经时变化进行研究。
207.《培养上清液的制作》
208.使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在21%氧气环境下培养18小时后,在1%氧气环境下培养6小时。将在1%氧气环境下培养6小时后的来自人骨髓的间充质干细胞的培养上清液设为“1%o
2 6hr”。
209.使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在21%氧气环境下培养12小时后,在1%氧气环境下培养12小时。将在1%氧气环境下培养12小时后的来自人骨髓的间充质干细胞的培养上清液设为“1%o
2 12hr”。
210.使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在1%氧气环境下培养24小时。将在1%氧气环境下培养24小时后的人间充质干细胞的培养上清液设为“1%o
2 24hr”。
211.作为对照,使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem,在21%氧气环境下培养24小时。将在21%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“对照组(control)”。
212.制备包含氧气(1%或21%)、二氧化碳5%及氮气(94%或74%)的气体,从储存该气体的储气瓶将该气体供给至培养来自人骨髓的间充质干细胞的环境。
213.《评价方法》
214.通过用于测定vegf浓度的elisa试剂盒(r&d systems,minneapolis,mn,usa),在各组n=6的情况下测定所采集的培养上清液(1%o
2 6hr、1%o
2 12hr、1%o
2 24hr及对照组(control))中所含的vegf的浓度。将vegf浓度的平均值示于图7。另外,测定值是用培养上清液中所含的总蛋白量来校正,并通过mann-whitney u检验进行与对照组(control)的显著性差异检验。
215.《结果》
216.如图7所示,在1%o
2 12hr中,与对照组(control)相比,观察到vegf显著增加。并且,在1%o
2 24hr中,与对照组(control)相比,观察到vegf的增加比1%o
2 12hr更强。
217.《总结》
218.显然,为了在低氧条件下提高来自人骨髓的间充质干细胞的vegf的分泌能力,培养时间优选为12小时以上,进一步优选为24小时以上。
219.〔实施例6〕
220.《细胞培养及rna的采集》
221.(i)使用含10%fbs的dmem培养基将来自人骨髓的间充质干细胞培养三代以上。之后,在含10%fbs的dmem培养基中,将该来自人骨髓的间充质干细胞在21%氧气环境下培养24小时。之后,按照众所周知的方法,从该来自人骨髓的间充质干细胞采集mrna。以下将该mrna称为mrna(1)。
222.(ii)使用stk培养基将来自人骨髓的间充质干细胞培养三代以上。之后,在无血清培养基中,将该来自人骨髓的间充质干细胞在1%氧气环境下培养24小时。之后,按照众所周知的方法,从该来自人骨髓的间充质干细胞采集mrna。以下将该mrna称为mrna(2)。
223.(iii)使用stk培养基将来自人骨髓的间充质干细胞培养三代以上。之后,在无血清培养基中,将该来自人骨髓的间充质干细胞在21%氧气环境下培养24小时。之后,按照众所周知的方法,从该来自人骨髓的间充质干细胞采集mrna。以下将该mrna称为mrna(3)。
224.(iv)使用含10%fbs的dmem培养基将来自人骨髓的间充质干细胞培养三代以上。之后,在含10%fbs的dmem培养基中,将该来自人骨髓的间充质干细胞在1%氧气环境下培养24小时。之后,按照众所周知的方法,从该来自人骨髓的间充质干细胞采集mrna。以下将该mrna称为mrna(4)。
225.通过将包含氧气(1%或21%)、二氧化碳(5%)及氮气(94%或74%)的气体供给至培养来自人骨髓的间充质干细胞的环境,来调节环境内的氧气浓度。
226.《通过微阵列进行评价》
227.通过dna微阵列(agilent gene expression microarray:sureprint g3 human gene expression),来测定所采集的mrna(1)~(4)分别所含的特定的基因a(例如,
angptl4、fabp3、dlk2、aldoc、tcaf2、rcor2等)的mrna的量。
228.接着,关于各基因,算出“mrna(2)中所含的基因a的mrna量/mrna(1)中所含的基因a的mrna量”、“mrna(3)中所含的基因a的mrna量/mrna(1)中所含的基因a的mrna量”及“mrna(4)中所含的基因a的mrna量/mrna(1)中所含的基因a的mrna量”的值。
229.另外,在下述图8中,将“mrna(2)中所含的基因a的mrna量/mrna(1)中所含的基因a的mrna量”的值表示为“缺氧 无血清(hypoxia serum-free)”,将“mrna(3)中所含的基因a的mrna量/mrna(1)中所含的基因a的mrna量”的值表示为“无血清(serum-free)”,将“mrna(4)中所含的基因a的mrna量/mrna(1)中所含的基因a的mrna量”的值表示为“缺氧(hypoxia)”。
230.《结果》
231.图8的201是表示angptl4的表达量的比较的图表,图8的202是表示fabp3的表达量的比较的图表,图8的203是表示dlk2的表达量的比较的图表,图8的204是表示aldoc的表达量的比较的图表,图8的205是表示tcaf2的表达量的比较的图表,图8的206是表示rcor2的表达量的比较的图表。
232.如图8的201所示,缺氧 无血清(hypoxia serum-free)中的angptl4的表达量约为52倍,无血清(serum-free)中的angptl4的表达量约为22倍,缺氧(hypoxia)中的angptl4的表达量约为6倍。
233.如图8的202所示,缺氧 无血清(hypoxia serum-free)中的fabp3的表达量约为45倍,无血清(serum-free)中的fabp3的表达量约为15倍,缺氧(hypoxia)中的fabp3的表达量约为3倍。
234.如图8的203所示,缺氧 无血清(hypoxia serum-free)中的dlk2的表达量约为24倍,无血清(serum-free)中的dlk2的表达量约为8倍,缺氧(hypoxia)中的dlk2的表达量约为2倍。
235.如图8的204所示,缺氧 无血清(hypoxia serum-free)中的aldoc的表达量约为18倍,无血清(serum-free)中的aldoc的表达量约为2倍,缺氧(hypoxia)中的aldoc的表达量约为7倍。
236.如图8的205所示,缺氧 无血清(hypoxia serum-free)中的tcaf2的表达量约为14倍,无血清(serum-free)中的tcaf2的表达量约为3倍,缺氧(hypoxia)中的tcaf2的表达量约为5倍。
237.如图8的206所示,缺氧 无血清(hypoxia serum-free)中的rcor2的表达量的比例约为13倍,无血清(serum-free)中的rcor2的表达量约为3倍,缺氧(hypoxia)中的rcor2的表达量约为3倍。
238.《总结》
239.从在无血清培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的基因a的表达量均为从在含10%fbs的dmem培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的基因a的表达量的3倍以上。
240.从在含10%fbs的dmem培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的dlk2的表达量为从在含10%fbs的dmem培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的dlk2的表达量的约2
倍。并且,从在含10%fbs的dmem培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中除dlk2以外的基因a的表达量为从在含10%fbs的dmem培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中除dlk2以外的表达量的3倍以上。
241.从在无血清培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的aldoc的表达量为从在含10%fbs的dmem培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的aldoc的表达量的约2倍。并且,从在无血清培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中除aldoc以外的基因a的表达量为从在含10%fbs的dmem培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中采集的mrna中的dlk2的表达量的3倍以上。
242.并且,对于任一基因a来说,在无血清培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量均为在无血清培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量的至少2倍以上。并且,对于任一基因a来说,在无血清培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量均为在含10%fbs的dmem培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量的至少2倍以上。即,通过在无血清培养基中在1%氧气环境下将来自人骨髓的间充质干细胞培养24小时,与在含10%fbs的dmem培养基中在1%氧气环境下培养24小时、及在无血清培养基中在21%氧气环境下培养24小时的情况相比,基因a的表达量大幅增加。
243.并且,在无血清培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量大于在无血清培养基中在21%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量与在含10%fbs的dmem培养基中在1%氧气环境下培养24小时的来自人骨髓的间充质干细胞中所含的基因a的mrna量的总和,显示出在1%氧气环境下培养与在无血清培养基中培养的协同效应。
244.〔实施例7〕
245.《msc的制作》
246.将使用stk2培养基传代三次以上的来自人骨髓的间充质干细胞在stk2培养基中在1%氧气环境下培养24小时。将该来自人骨髓的间充质干细胞设为“stk h”。并且,将使用stk2培养基传代三次以上的来自人骨髓的间充质干细胞在stk2培养基中在21%氧气环境下培养24小时。将该来自人骨髓的间充质干细胞设为“stk”。
247.将使用含10%牛血清的dmem培养基传代三次以上的来自人骨髓的间充质干细胞在含10%牛血清的dmem培养基中在1%氧气环境下培养24小时。将该来自人骨髓的间充质干细胞设为“10%fbs h”。并且,将使用含10%牛血清的dmem培养基传代三次以上的来自人骨髓的间充质干细胞在含10%牛血清的dmem培养基中在21%氧气环境下培养24小时。将该来自人骨髓的间充质干细胞设为“10%fbs”。
248.《评价方法》
249.在96孔皿中添加100μl/孔的stk2培养基或含10%牛血清的dmem培养基。将stk h或stk分别以2500个细胞/孔接种至stk2培养基。将10%fbs h或10%fbs分别以2500个细
胞/孔接种至含10%牛血清的dmem培养基。
250.stk h及10%fbs h在1%氧气环境下继续培养,stk及10%fbs在21%氧气环境下继续培养。在0小时后、12小时后、24小时后,以10μl/孔向每个孔中添加premix wst-1(takara bio)。添加后经4小时后,在450nm的波长下测定吸光度,基于该测定值,对细胞数进行定量(各组n=5)。
251.《结果》
252.如图9所示,表明与10%fbs相比,10%fbs h、stk、stk h的细胞数在所有时间点(0小时、12小时、24小时)均显著增多,细胞增殖亢进。stk h的细胞增殖能力最高,与stk相比,细胞数在所有时间点均显著增多。
253.《总结》
254.表明与含10%牛血清的dmem培养基相比,无血清培养基中的培养使得在1%氧气环境下及21%氧气环境下,来自人骨髓的间充质干细胞的增殖能力亢进。还表明使用无血清培养基在1%氧气环境下培养的来自人骨髓的间充质干细胞的细胞增殖能力最亢进。
255.〔实施例8〕
256.对在含fbs的dmem培养基或无血清培养基stk2中进行传代培养的来自人骨髓的间充质干细胞的培养上清液中所含的vegf及hgf的表达量进行研究。
257.《培养上清液(conditioned medium)的制作及评价方法》
258.使用含10%fbs的dmem培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从含10%fbs的dmem培养基更换为无血清(serum-free)dmem培养基,在1%氧气环境下或21%氧气环境下培养24小时。将在1%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“dmem 1%o
2”,将在21%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“dmem 21%o
2”。
259.并且,使用stk2培养基,将传代三次以上的来自人骨髓的间充质干细胞接种至6孔板,并培养至达到亚汇合。培养后,将培养液从stk2培养基更换为无血清(serum-free)dmem培养基,在1%氧气环境下或21%氧气环境下培养24小时。将在1%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“stk2 1%o
2”,将在21%氧气环境下培养24小时后的来自人骨髓的间充质干细胞的培养上清液设为“stk2 21%o
2”。
260.作为对照,使用无血清(serum-free)dmem培养基,将人肾近端小管上皮细胞(hk2细胞)在21%氧气环境下培养24小时。将在21%氧气环境下培养24小时后的人肾脏细胞的培养上清液设为“hk2”。
261.制备包含氧气(1%或21%)、二氧化碳5%及氮气(94%或74%)的气体,从储存该气体的储气瓶将该气体供给至来自人骨髓的间充质干细胞的培养环境中的1%氧气环境及21%氧气环境。
262.对于每种培养上清液,利用与实施例4同样的方法来测定vegf浓度及hgf浓度。
263.《结果》
264.如图10所示,表明与在含10%fbs的dmem培养基中传代培养时相比,在stk2培养基中传代培养时,vegf及hgf的表达量下降。另一方面,可知在含10%fbs的dmem培养基中传代培养及在stk2培养基中传代培养这两种情况下,与在21%氧气下培养时相比,在1%氧气下
培养时,vegf及hgf的表达量上升。并且,表明在stk2培养基中传代培养时的vegf及hgf的表达量远多于hk2的vegf及hgf的表达量。
265.《总结》
266.表明与人肾近端小管上皮细胞相比,来自人骨髓的间充质干细胞中的vegf及hgf的分泌能力极高。并且,表明当在无血清培养基中将来自人骨髓的间充质干细胞传代培养时,vegf及hgf的分泌能力下降,但通过在1%氧气下培养,vegf及hgf的表达量恢复。
267.产业上的可利用性
268.本发明及通过本发明的制造方法制作的修复剂可以用于生物组织损伤修复剂。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。