1.本发明涉及生物医学技术领域,具体地说是一种用于阿尔茨海默症早期检测的芯片试剂盒。
背景技术:
2.阿尔茨海默症(ad)是一类慢性发展的中枢神经系统慢性病,也是目前造成人类主要死因但又缺乏特效治疗方案的疾病。因此,在临床中,早期筛查、诊断对ad的防治尤为重要。病理性生物标志物的确立是做到对ad患者早期诊断和筛查的前提,也是检验医学中的热门难题。数十年来,“aβ瀑布假说”是ad发病机制中的最经典的理论之一,该理论解释阿尔茨海默症是由于aβ在大脑皮层和海马区大量沉积,出现后续的由磷酸化的tau蛋白介导的细胞内神经元纤维缠结,进而导致神经元凋亡,损伤影响患者的认知功能。根据美国国立老化研究院和阿尔茨海默症协会(nia-aa)最新的atn诊断标准,明确将aβ、总tau和磷酸化的tau蛋白的浓度变化作为诊断ad的重要标志,而目前上述生物标志物需要通过采集脑脊液进行检测。脑脊液虽然能够较好的反映脑内的代谢情况,但是获取脑脊液需要侵入性腰穿,其有创性和高成本导致无法大规模和重复取样,因此无法进行长期监测。相对于脑脊液,血液样本获取便利,而且创伤性小,在短时间内可多次采血,患者的接受度较高,然而血液中ad标志物由于其含量极低且特异性不高,检测难度较大。
3.外泌体是一种由细胞分泌的胞外囊泡,作为胞间信使在细胞间的通讯中扮演着重要角色。神经退行性病如朊蛋白病、帕金森病等病的相关致病蛋白都可以通过外泌体释放到细胞外。有研究证实ad相关病理蛋白(aβ、tau)是通过外泌体进行运输的,意味着从血液里提取的外泌体中的aβ和tau蛋白可以替代从脑脊液提取从而诊断ad。而如何将可作为ad新型生物标志物的外泌体快速精确的分离出来是需要解决的一个关键问题。
4.常规的外泌体分离方法有高速离心、共沉淀以及免疫亲和等,这些方法虽然能够很好的分离外泌体,但其缺点在于时间长、费用高等。而对比这些常规的外泌体分离方法,微流控芯片作为一种新型技术在外泌体的分离领域展现出巨大的优势:高速、高通量、自动化、集成和便捷等。不仅如此,微流控芯片还可以将外泌体的分离及分析集成在一张芯片上,具有高效、便捷以及高灵敏度等优点。尽管血液中ad的特征性病理蛋白(aβ、tau)的浓度相对于脑脊液要低10-100倍,但是通过微流控芯片能将外周血来源的外泌体富集,达到浓缩aβ、tau蛋白的目的,大大提高了ad生物标志物的可检测浓度;对于微流控的蛋白检测方式,目前常用的有荧光免疫技术(fia)、磁敏免疫技术(mi)以及化学发光免疫技术(clia)。其中荧光免疫技术需要激发光,对仪器要求较高且测定对象有限。而磁敏免疫技术由于其芯片成本较高,测试通量有限也限制了它们的推广。而化学发光免疫技术因其不需要激发光源、灵敏度高、信号稳定、线性范围宽,非常适合于现场分析。
技术实现要素:
5.本发明之目的是弥补上述之不足,向社会公开检测方便,检测速度快的一种用于
阿尔茨海默症早期检测的芯片试剂盒。
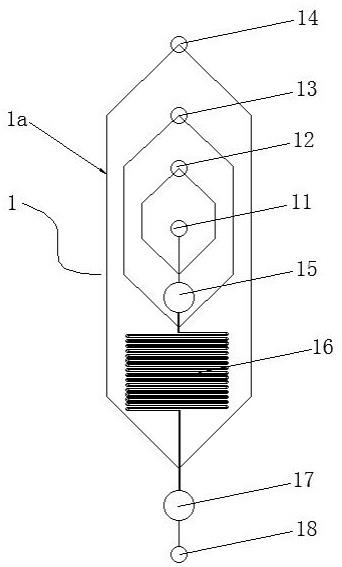
6.本发明的技术方案是这样实现的:一种用于阿尔茨海默症早期检测的芯片试剂盒,包括有微流控芯片,所述的微流控芯片包括有pdms层和玻璃层,所述的微流控芯片上设置有一第一进口,用于输入血浆与磁珠的混合液;一第二进口,用于输入清洗缓冲液、裂解液、洗脱液;一第三进口,用于输入aβ或tau的免疫磁珠混合液、aβ或tau的抗体、酶联二抗;一第四进口,用于输入荧光酶底物;一外泌体捕获区,用于捕获、裂解外泌体;一蛋白&免疫磁珠混合区,用于携带aβ或tau抗体的磁珠与外泌体释放的特异蛋白的混合;一特异蛋白捕获区,用于捕获、富集特异蛋白;一出口,用于检测过程中废液的排出;所述的第一进口通过微流道与所述外泌体捕获区相通,所述的外泌体捕获区经蛋白&免疫磁珠混合区与所述特异蛋白捕获区相通,所述的特异蛋白捕获区通过微流道与所述出口相通;所述的第二进口通过两侧对称设置的微流道构成的内圈流道连通于所述第一进口和外泌体捕获区之间,所述的第三进口通过两侧对称设置的微流道构成的中圈流道连通于所述外泌体捕获区和蛋白&免疫磁珠混合区之间,所述的第四进口通过两侧对称设置的微流道构成的外圈流道连通于所述蛋白&免疫磁珠混合区和特异蛋白捕获区之间。
7.进一步优化本技术方案的措施是:作为改进,所述的内圈流道呈六边形结构,所述的中圈流道呈六边形结构,所述的外圈流道呈六边形结构,所述的内圈流道、中圈流道和外圈流道从内至外依次嵌套设置。
8.作为改进,所述的微流道的宽为100 μm,其深度为50 μm。
9.作为改进,所述的第一进口、第二进口、第三进口和第四进口均为圆柱体空腔结构,其直径均为1 mm,高度均为3 mm。
10.作为改进,所述的外泌体捕获区为圆柱体空腔结构,所述的外泌体捕获区的直径为4 mm,其深度50 μm。
11.作为改进,所述的蛋白&免疫磁珠混合区呈连续的s形结构。
12.作为改进,所述的蛋白&免疫磁珠混合区的长度为25 cm,所述的蛋白&免疫磁珠混合区的宽度为300 μm、深度为50 μm。
13.作为改进,所述的蛋白&免疫磁珠混合区的半圆形弯道的内径r1为100 μm,外径r2为400 μm。
14.作为改进,所述的特异蛋白捕获区为圆柱体空腔结构,所述的特异蛋白捕获区的直径为4 mm,其深度是50 μm。
15.作为改进,所述的出口呈圆柱体空腔结构,所述的出口的直径为1 mm,出口的高度为3 mm。
16.本发明与现有技术相比的优点是:(1)本发明的一种用于阿尔茨海默症早期检测的芯片试剂盒,本发明的微流控芯
片通过微流控技术对极少量外周血(30
ꢀµ
l)中的外泌体在芯片原位进行富集,以达到浓缩阿尔茨海默症病理蛋白(aβ、tau)的目的,从而提高阿尔茨海默症检测的灵敏性,达到早期筛查和诊断阿尔茨海默症的目的。(2)对比常规脑脊液取样的有创性,血液测试更容易实施,也更容易推广。(3)通过血液采集便可以完成检测,检测更为方便,能够将阿尔茨海默症的检测时间缩短至1.5个小时。
附图说明
17.图1是本发明的结构示意图;图2是图1中蛋白&免疫磁珠混合区的结构示意图;图3是图2中a部放大图。
18.本发明附图中各附图标记的名称是:微流控芯片1、微流道1a、第一进口11、第二进口12、第三进口13、第四进口14、外泌体捕获区15、蛋白&免疫磁珠混合区16、特异蛋白捕获区17、出口18。
具体实施方式
19.下面结合附图进一步详细描述本发明:如图1至图3所示,一种用于阿尔茨海默症早期检测的芯片试剂盒,包括有微流控芯片1,所述的微流控芯片1包括有pdms层和玻璃层,所述的微流控芯片1上设置有一第一进口11,用于输入血浆与磁珠的混合液;一第二进口12,用于输入清洗缓冲液、裂解液、洗脱液;一第三进口13,用于输入aβ或tau的免疫磁珠混合液、aβ或tau的抗体、酶联二抗;一第四进口14,用于输入荧光酶底物;一外泌体捕获区15,用于捕获、裂解外泌体;一蛋白&免疫磁珠混合区16,用于携带aβ或tau抗体的磁珠与外泌体释放的特异蛋白的混合;一特异蛋白捕获区17,用于捕获、富集特异蛋白;一出口18,用于检测过程中废液的排出;所述的第一进口11通过微流道1a与所述外泌体捕获区15相通,所述的外泌体捕获区15经蛋白&免疫磁珠混合区16与所述特异蛋白捕获区17相通,所述的特异蛋白捕获区17通过微流道1a与所述出口18相通;所述的第二进口12通过两侧对称设置的微流道1a构成的内圈流道连通于所述第一进口11和外泌体捕获区15之间,所述的第三进口13通过两侧对称设置的微流道1a构成的中圈流道连通于所述外泌体捕获区15和蛋白&免疫磁珠混合区16之间,所述的第四进口14通过两侧对称设置的微流道1a构成的外圈流道连通于所述蛋白&免疫磁珠混合区16和特异蛋白捕获区17之间。
20.所述的内圈流道呈六边形结构,所述的中圈流道呈六边形结构,所述的外圈流道呈六边形结构,所述的内圈流道、中圈流道和外圈流道从内至外依次嵌套设置。外圈流道、中圈流道、内圈流道相互之间不相交。
21.所述的微流道1a的宽为100 μm,其深度为50 μm。微流道1a的截面为矩形结构。
22.所述的第一进口11、第二进口12、第三进口13和第四进口14均为圆柱体空腔结构,其直径均为1 mm,高度均为3 mm。
23.所述的外泌体捕获区15为圆柱体空腔结构,所述的外泌体捕获区15的直径为4 mm,其深度50 μm。
24.所述的蛋白&免疫磁珠混合区16呈连续的s形结构。
25.所述的蛋白&免疫磁珠混合区16的长度为25 cm,所述的蛋白&免疫磁珠混合区16的宽度为300 μm、深度为50 μm,蛋白&免疫磁珠混合区16的截面同样为矩形结构。蛋白&免疫磁珠混合区16处流道宽度大于微流道1a的宽度。
26.所述的蛋白&免疫磁珠混合区16的半圆形弯道的内径r1为100 μm,外径r2为400 μm。
27.所述的特异蛋白捕获区17为圆柱体空腔结构,所述的特异蛋白捕获区17的直径为4 mm,其深度是50 μm。
28.所述的出口18呈圆柱体空腔结构,所述的出口18的直径为1 mm,出口18的高度为3 mm。
29.本发明的一种用于阿尔茨海默症早期检测的芯片试剂盒,所述的芯片试剂盒内主要包括有微流控芯片1,该微流控检测芯片的制作过程如下:微流控芯片1由pdms层和玻璃层嵌合而成,采用负性光刻胶(su8)在4英寸的硅片上制作流道模板,将质量比为10:1的pdms预聚物和固化剂搅拌均匀并使用真空釜去除气泡,随后将su8硅模板固定在培养皿中,再注入去除了气泡的pdms,将培养皿放置在80℃的培养箱中烘烤30 min,待pdms固化后将其从硅片上揭下并用打孔器在设定位置上进行打孔,最后将pdms层与玻璃层进行嵌合形成封闭的微流道1a。
30.所制成的微流控芯片1中,形成大小不一的呈六边形结构的微流道1a(内圈流道、中圈流道和外圈流道),中圈流道的下端通过微流道1a向上与第一个微液池(外泌体捕获区15)相联通,并向上延伸与内圈流道、第一进口11相连通,中圈流道的下端向下与连续s形结构构成的蛇形通道(蛋白&免疫磁珠混合区16),蛋白&免疫磁珠混合区16的总长为25 cm,蛋白&免疫磁珠混合区16下端与外圈流道相连通,并向下延伸连通至第二个微液池(特异蛋白捕获区17)。在微观尺度下,由于表面积与体积的比值急剧增大,表面力和粘性力的影响占主导地位,惯性力大大减弱,加之微流道中的流速一般很小,流体的流动属于层流流动。因此,必须需要采取措施提高混合效果,减少流体充分混合所需的时间。呈连续s形结构的蛋白&免疫磁珠混合区16的主要混合机理是在半圆形弯道处产生管道横截面方向的二次流,因此有利于不同液体的充分混合。
31.所制成的微流控芯片1上形成有第一进口11,用于输入血浆与磁珠的混合液;第二进口12,用于输入裂解液、洗脱液;第三进口13,用于输入aβ或tau的免疫磁珠混合液、aβ或tau的抗体、酶联二抗;第四进口14,用于输入荧光酶底物;外泌体捕获区15,用于捕获、裂解外泌体;蛋白&免疫磁珠混合区16,用于携带aβ或tau抗体的磁珠与外泌体释放的特异蛋白的混合;特异蛋白捕获区17,用于捕获、富集aβ或tau蛋白;出口18,用于检测过程中废液的排出。
32.上述试剂通过自动进样泵的程序设置以设定流速注入对应进口,并进入微流道1a内。
33.本发明芯片试剂盒的检测方法,包括以下步骤:步骤一:外泌体捕获。这里外泌体捕获采用免疫磁珠捕获法,本发明中使用链霉亲和素修饰的磁珠(直径为2.8
ꢀµ
m)将外泌体标志物蛋白cd63的抗体与磁珠通过生物素-链霉亲和素连接,得到每1 mg磁珠携带10
ꢀµ
g的抗体的免疫磁珠。预先将20
ꢀµ
l的磁珠(1 mg/ml)与30-150
ꢀµ
l的血浆混合30 min,然后通过进样泵以2
ꢀµ
l/min的速度从第一进口11注入微流控芯片1,将永磁铁置于第一个微液池(外泌体捕获区15)下面,磁珠被磁力吸附在表面。随后通过第二进口12注入清洗缓冲液(pbs 0.01%tween20)清洗10 min,目的是清洗未被磁珠吸附的液体。
34.捕获的外泌体将通过电镜分析(tem)、粒径分析(nta)以及特异蛋白分析(western blot)进行表征。
35.步骤二:外泌体的裂解。将裂解液(5%triton x-100)通过第二进口12以1 μl/min的速度注入微流控芯片1,停止进样泵10 min使外泌体裂解充分,使外泌体内部蛋白在裂解后被充分释放出来以便下一步的特异蛋白捕获。
36.步骤三:特异蛋白捕获。将aβ或tau的抗体分别与磁珠(直径为2.8
ꢀµ
m)通过环氧胺共价修饰在37℃下进行耦联,得到每1 mg的磁珠携带5-8
ꢀµ
g的抗体。将携带抗体的磁珠通过第三进口13以1 μl/min的速度注入微流控芯片1,移除永磁铁,携带aβ或tau抗体的磁珠与外泌体释放的蛋白在连续的s形通道(蛋白&免疫磁珠混合区16)内充分混合,磁珠捕获的aβ或tau蛋白将在第二个微液池(特异蛋白捕获区17)用永磁铁进行富集。
37.步骤四:特异蛋白的检测。这里通过“三明治免疫夹心法”检测捕获的aβ或tau的蛋白含量。具体操作如下:将aβ或tau的抗体(稀释浓度为1:100)通过第三进口13以1 μl/min的速度通过微流道进入第二个微液池(特异蛋白捕获区17),随后将aβ或tau的酶联二抗(稀释浓度为1:100)通过第三进口13以1 μl/min的速度通过微流道进入第二个微液池(特异蛋白捕获区17),最后将1 mm的荧光酶底物difmup通过第四进口14以1 μl/min的速度注入微流道中,并在第二个微液池(特异蛋白捕获区17)中培养6 min后进行化学荧光检测,并通过荧光显示屏显示反应结果。
38.检测后,芯片中的废液从出口18处排出。
39.步骤五:检测结果分析。(1)首先分别选取年龄和性别均匹配的对照组(样本量大于3)和检测组(样本量大于3)的血液样本用此试剂盒进行检测,然后用统计学分析方法(t-test)进行两组样本的均值比较。当检测组样本中目的蛋白(aβ,tau)浓度显著高于对照组时(p《0.05),进行如下处理。(2)临床家族史的问询调查,如果被检测病人的直系亲属中曾经或已经存在阿尔茨海默症患者,则基本可以将此患者确定为高危险人群。(3)临床随访。对此病人用此试剂盒进行为期5年的定期复查,观察自身血液中的目的蛋白含量(aβ,tau)是否随时间推移不断升高。如果含量不断升高,则基本可以确定此患者会在将来发展为阿尔茨海默症病人,要结合临床及时进行干预治疗。
40.综上,本发明的芯片试剂盒可在血液中检测低至0.1-10 pg/ml的目的蛋白(aβ,tau)含量,达到用末梢外周血检测ad的目的。采样方便,耗时短(整个检测过程只需1.5小时),待测者接受度高。
41.本发明的最佳实施例已被阐明,由本领域普通技术人员做出的各种变化或改型都不会脱离本发明的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。