基于一维hnco核磁共振光谱检测sirts去乙酰化酶活性的方法及应用
技术领域
1.本发明涉及酶活性检测技术领域,尤其涉及基于一维hnco核磁共振光谱检测sirts去乙酰化酶活性的方法及应用。
背景技术:
2.肿瘤作为当今世界发病率和病死率的增长最快的疾病,其发病机制复杂,变异程度高,已经成为人类十大死亡原因之一,是影响人类的身体健康和正常的生产生活的重大疾病,遗传和基因的异常通常被认为是肿瘤发病的原因,而过去几十年的研究证明,表观遗传调控也参与了癌症发展进程。
3.表观遗传调控(epigenetic regulation)又称表观遗传学,遗传外修饰学或后成论,是研究基因的活性或功能的遗传变化,研究在基因的核苷酸序列不发生改变的情况下,基因表达的可遗传的变化的一门学科。它是研究基因表达调控的新领域,是现代分子生物学研究的重要课题之一。表观遗传学主要包括组蛋白翻译后修饰,染色质重塑,dna甲基化以及非编码rna的靶向作用等,与细胞命运关系密切,对细胞的分裂,增殖和衰老等生理过程具有重要调节作用,表观遗传修饰异常是肿瘤发生发展的重要因素。
4.组蛋白修饰是指在相关酶作用下组蛋白发生甲基化,乙酰化,磷酸化和泛素化等修饰的过程,可以通过直接影响染色质结构(顺式作用)或影响与染色质或组蛋白结合蛋白的结合(反式作用)调控染色质结构和功能,对转录激活与延伸,dna复制与细胞周期等过程至关重要,对基因组稳定性的维持具有重要作用。由于染色质是由dna双链缠绕组蛋白形成的,因此组蛋白修饰状况或与dna结合的紧密程度对dna转录及表达调控有着重要的调节意义。
5.为了执行细胞功能,已经证实的组蛋白修饰有16种,包括乙酰化,甲基化,磷酸化等等,而作为第一个被鉴定出的修饰,乙酰化也是组蛋白的最佳修饰之一。组蛋白的乙酰化则主要发生在n端赖氨酸残基末端nh3的正电荷上。如果组蛋白低乙酰化,由于组蛋白n端富含正电荷的氨基酸,与带负电的dna靠静电招募结合紧密,因此转录因子很难与dna的启动子区域结合,基因表达被抑制。而当组蛋白发生乙酰化时,由于乙酰化中和了组蛋白赖氨酸残基的正电荷,因此也就降低了与dna相互作用的能力,使转录因子可以很容易地与dna的启动子区域相结合,诱导基因表达。
6.通常情况下,组蛋白的乙酰基化过程总是维持着动态平衡,这种平衡是由组蛋白乙酰基转移酶(hats)和组蛋白去乙酰化酶(hdacs)的共同作用来维持的。乙酰辅酶a是乙酰基团的供体。组蛋白乙酰基转移酶(hats)转移乙酰基团到组蛋白内部的赖氨酸残基末端的ε-nh3上。相反的反应由去乙酰化酶(hdacs)催化。
7.目前共发现18种不同的hdacs,根据其结构差异将其分为4组,即i类、ii类、iii类和iv类hdacs。i类和ii类hdacs被认为是“经典”hdacs,经典的hdacs去除赖氨酸残基的乙酰基,利用zn
2
离子和保守的去乙酰化酶的核心区域,生成未乙酰化的赖氨酸和醋酸盐。第iv
类hdacs是其自身的一个非典型类别,完全基于其dna序列与其他的相似性。第iii类hdacs是一个家族的烟酰胺腺嘌呤二核苷酸(nad )依赖性蛋白。第iii类hdacs通常称为sirtuins,以酵母同源基因“沉默配对型信息调节2”命名。在nad 存在的情况下,sirtuins起赖氨酸去乙酰化酶的作用,也参与决定细胞凋亡、细胞存活和细胞增殖之间的平衡。在生理环境中,sirtuins的催化活性被nam非竞争性地抑制。有证据表明sirtuins蛋白与肿瘤发生发展密切相关。在人类中,已经发现了7种sirtuins亚型(sirt1-7),它们定位于细胞核、细胞质或线粒体。目前已知的是,sirt7通过与肿瘤抑制相关的基因启动子上的h3k18去乙酰化来促进肿瘤进展,稳定癌细胞的转化状态。
8.sirt7是一种哺乳动物sirtuin,其生化活性、分子靶点和生理功能尚不清楚。全基因组结合研究显示,sirt7与一组特定基因靶点的启动子结合,在那里它能去乙酰化h3k18并促进转录抑制。sirt7靶基因的谱,部分是由其与癌症相关的e26转化特异性(ets)转录因子elk4的相互作用确定的,它包含许多与肿瘤抑制有关的基因。值得注意的是,h3k18乙酰化与病毒癌蛋白e1a的细胞转化和致癌转化有关,并且在患者中与恶性肿瘤表型和不良预后有关。sirt7对h3k18ac的去乙酰化对于维持人类癌细胞的基本特性是必要的。
9.当前,对去乙酰化酶活性的检测,基于抗体的检测方法虽然具有高灵敏度的特性,但其易淬灭的特点会对准确性造成影响,额外的洗脱步骤会增加检测所用的时间,并且需要大量的肽段底物。质谱分析能直接检测去乙酰化反应的底物,灵敏度较高,但需要优化样品,去除额外的成分,且当研究酶活性的时间依赖性时需要分别收集不同时间的样品。由于以上方法都存在相应的局限性,故需要建立更简便和准确的方法来直接测定去乙酰化酶活性,并评估其酶活性。
10.因此,现有技术还有待于改进和发展。
技术实现要素:
11.鉴于上述现有技术的不足,本发明的目的在于提供基于一维hnco核磁共振光谱检测sirts去乙酰化酶活性的方法及应用,旨在解决现有检测方法复杂、且准确性低的问题。
12.本发明的技术方案如下:
13.本发明提供基于一维hnco核磁共振光谱检测sirts去乙酰化酶活性的方法,其中,包括步骤:
14.步骤1、将h3蛋白质粒转入大肠杆菌,将所述大肠杆菌加入培养液中,向所述培养液中加入氮15标记的氯化氨和碳13标记的乙酸,进行培养,经纯化处理,得到氮15和碳13共价链接的h3蛋白;
15.步骤2、在反应缓冲液中加入所述氮15和碳13共价链接的h3蛋白,进行温育,得到待测体系1;
16.步骤3、利用一维hnco核磁共振光谱对所述待测体系1进行检测,得到一维hnco核磁共振谱图1;
17.步骤4、在反应缓冲液中加入所述氮15和碳13共价链接的h3蛋白和sirts去乙酰化酶,进行温育,得到待测体系2;
18.步骤5、利用一维hnco核磁共振光谱对所述待测体系2进行检测,得到一维hnco核磁共振谱图2;
19.步骤6、根据所述一维hnco核磁共振谱图1和一维hnco核磁共振谱图2,判断sirts去乙酰化酶的活性。
20.下面以sirts家族中sirt7为例,对本发明做详细介绍。
21.本发明首先将h3蛋白质粒转入大肠杆菌(e.coli)。培养此大肠杆菌时加入氮15标记的氯化氨(
15
nh4cl)和碳13标记的乙酸(
13
c-acetate)到培养液中。表达出来的h3蛋白赖氨酸末端的氮会标记为氮15。赖氨酸位点自发发生乙酰化时会使用碳13标记的乙酸(
13
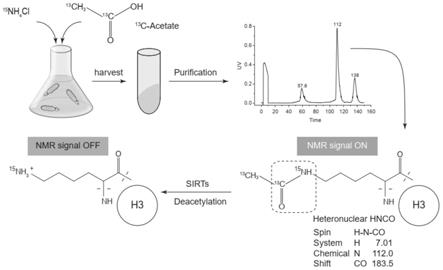
c-acetate),因而乙酰基标记为碳13。最终可以得到乙酰化的h3蛋白,且特定位点(h3k18,h指的是histone蛋白,h3就是histone3,k指的是氨基酸中的赖氨酸,18指的是第18个赖氨酸)的乙酰化形成氮15和碳13共价链接(见图1)。然后经纯化得到氮15和碳13共价链接的h3蛋白。利用核磁共振的1维heteronuclear hnco旋转系统(spin system),可测得信号(nmr signal on)。
22.在反应缓冲液中加入纯化的氮15和碳13共价链接的h3蛋白后,进行温育,此过程中由于未加入sirt7蛋白,因此h3蛋白中的氮15和碳13共价键未受到破坏,所以利用一维hnco核磁共振谱光谱仪检测时,可测得信号。而在反应缓冲液中加入纯化的氮15和碳13共价链接的h3蛋白和sirt7蛋白后,进行温育,此过程中sirt7蛋白会对氮15和碳13共价链接的h3蛋白进行去乙酰化反应,破坏氮15和碳13共价链接,所以再利用一维hnco核磁共振谱光谱仪检测时,信号减弱或者消失。基于上述两个谱图对比,可以判断出sirts去乙酰化酶的活性。本发明方法还可应用到酶抑制剂的筛查。
23.本发明利用核磁共振一维hnco光谱特异性的监测底物氮15和碳13共价链接的h3蛋白信号的变化评价sirts去乙酰化酶活性的方法。该方法选择性和特异性较高。此特异性的方法还能够应用到抗肿瘤药物的筛查。
24.需说明的是,上述步骤2和步骤4基本相同,不同之处仅在于:步骤2中未加入sirts去乙酰化酶,步骤4中加入sirts去乙酰化酶。
25.步骤1中,进一步地,所述向所述培养液中加入氮15标记的氯化氨和碳13标记的乙酸的同时,还向所述培养液中加入iptg(异丙基-β-d-硫代吡喃半乳糖苷)。加入iptg可催化表达大量h3蛋白。更进一步地,向所述培养液中加入最终浓度为1mm iptg。
26.进一步地,所述进行培养的步骤中,所述培养的温度为30-42℃,所述培养的时间为10-16小时。
27.进一步地,所述h3蛋白质粒为his标签的h3蛋白质粒,所述纯化处理的步骤,具体包括:
28.将培养完成后的大肠杆菌进行离心,收集菌液,弃去上清液;
29.向所述菌液中加入裂解液进行裂解;
30.所述裂解完成后转移至管中,放置冰上,使用超声波细胞粉碎机裂解,然后离心,取上清液;
31.向所述上清液中加ni-nta珠子,在4
°
转盘式混匀仪孵育;
32.所述液结束后进行离心,弃去上清,使用his b溶液洗珠子;
33.加入his c溶液,放置在4
°
转盘混匀仪上洗脱;
34.在高速台式制冷离心机4
°
离心,收集上清;使用超滤管进行超滤浓缩,并用反应缓冲液以5倍体积进行置换,至终体积为250-500μl。
35.his标签和ni-nta珠子具有亲和力,可以纯化得到氮15和碳13共价链接的h3蛋白。纯化后的该蛋白,跑胶确认纯度,纯度不够高时,可选择fplc(快速蛋白液相色谱,fast protein liquid chromatography)进一步纯化。
36.进一步地,所述h3蛋白质粒加入的质量为1-5μg,所述氮15标记的氯化氨加入的质量为1-5g,所述碳13标记的乙酸加入的质量为1-5g。
37.进一步地,所述培养液可以为m9缓冲液,该缓冲液中包括以下成分:1mm mgso4,0.01%thiaminin,0.1mm cacl2。
38.进一步地,所述温育的温度为37℃,所述温育的时间为4-24小时,如6小时。
39.步骤4中,进一步地,所述在反应缓冲液中加入所述氮15和碳13共价链接的h3蛋白和sirts去乙酰化酶的步骤中,所加入的氮15和碳13共价链接的h3蛋白的终浓度为0.1-10mm,如1mm,所加入的sirts去乙酰化酶的终浓度为0.1-10mm,如1mm。
40.进一步地,所述反应缓冲液中包括以下成分:ph为8.0的10mm tris-hcl,4mm mgcl2,1mm nad,1mm dtt,占反应缓冲液体积分数5%的甘油。
41.本发明还提供如上所述的方法在sirts去乙酰化酶抑制剂筛选中的应用。
42.进一步地,所述sirts去乙酰化酶抑制剂可以为nam。
43.本发明还提供如上所述的方法在抗肿瘤药物筛选中的应用。
44.有益效果:本发明利用核磁共振一维hnco光谱实时监测sirts去乙酰化酶底物的变化评价此类酶活性的方法。本方法可测定酶活性以及可以应用到酶抑制剂的开发。本发明利用核磁共振光谱仪选择性以及特异性的检测sirts底物的变化,从而测定得到酶活性。
45.与现有检测方法相比,本发明的检测方法具有以下技术优势:
46.本发明基于核磁共振的检测方法不会对样品的特性及状态造成改变,能保证样品的完整性,因此可用于化学反应的实时监测。而现有其他的分析方法检测前的样品处理步骤具有一定破坏性。
附图说明
47.图1为本发明基于一维hnco核磁共振光谱检测sirts去乙酰化酶活性的流程示意图。
48.图2为sirt7介导的去乙酰化反应检测结果图。
49.图3为sirt7的底物随时间变化的检测结果图。
50.图4为抑制效应检测结果图。
具体实施方式
51.本发明提供基于一维hnco核磁共振光谱检测sirts去乙酰化酶活性的方法及应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
52.本发明利用核磁共振一维hnco光谱实时监测sirts去乙酰化酶底物的变化评价此类酶活性的方法。sirts家族中以sirt7为例对本发明进行详细介绍。
53.一、获得sirt7的底物h3蛋白的方法:
54.1)将his标签的h3蛋白质粒转入大肠杆菌在37℃下在含有卡那霉素的500ml lb培
养基中培养,直到od600达到0.4左右。然后,添加最终浓度为1mm iptg,并在16℃下进行过夜诱导h3蛋白的表达,得到未标记的h3蛋白。
55.2)将his标签的h3蛋白质粒转入大肠杆菌(e.coli),将该大肠杆菌培养在m9缓冲液(1mm mgso4,0.01%thiaminin,0.1mm cacl2)中,加入1g葡萄糖(作为营养源),1g氮15标记的氯化氨(
15
nh4cl),1g碳13标记的乙酸(
13
c-acetate),培养和诱导h3蛋白表达的方法同上。
56.收集大肠杆菌以及纯化蛋白:诱导h3蛋白后的大肠杆菌在12000rpm超高速离心机4
°
(智能型高速离心机)离心15min,收集菌液,弃去上清液,每200ml菌液中加入10ml的裂解液(his a,10%np40,1%ck),使用移液枪吹打重悬和涡流振荡器混旋菌液,冰上裂解10min;转移至50ml管中,放置冰上,使用超声波细胞粉碎机进一步裂解(8min,功率35%,5s/5s),超高速离心机4
°
18000rpm离心15min,取上清;加400ul ni-nta珠子,在4
°
转盘式混匀仪孵育2h。1000rpm 4
°
离心1min,弃去上清,使用his b溶液洗珠子三次,每次1000rpm 4
°
离心1min。最后加入5ml的his c溶液,放置在4
°
转盘混匀仪上洗脱30min;12000rpm在高速台式制冷离心机4
°
离心10min,收集上清;使用超滤管以5000g/min进行超滤浓缩,并用1x反应缓冲液(10mm tris-hcl,ph 8.0,4mm mgcl2,1mm nad,1mm dtt,和5%甘油)以5倍体积进行置换,至终体积为350μl。纯化后的蛋白,跑胶确认纯度,纯度不够高时,可选择fplc进一步纯化。最终得到纯化的氮15和碳13共价链接的h3蛋白。
57.二、sirt7的去乙酰化方法以及核磁共振光谱仪检测:
58.1)在反应缓冲液(ph为8.0的10mm tris-hcl,4mm mgcl2,1mm nad,1mm dtt,占反应缓冲液体积分数5%的甘油)中加入纯化的碳13和氮15标记的h3蛋白(1mm)和sirt7蛋白(0.1mm)后,在37℃温育6小时,此过程中sirt7蛋白对氮15和碳13共价链接的h3蛋白进行去乙酰化反应,破坏氮15和碳13共价链接。
59.2)测核磁共振前,需在样品中加入5%的d2o(%为体积百分比),用于测定锁定信号。
60.3)本实施例使用仪器为配备低温探头的bruker公司(瑞士)avance系列600mhz超导傅里叶变化核磁共振波谱仪。将样品管插入转子,用定深量筒控制样品管高度。将转子按序列放入进样器,设置采集参数。sirt7酶反促应时间依赖性实验中扫描温度为310k,使用预饱和脉冲序列进行12h的采样。测试完成后,对谱图进行傅里叶变换、相位校正、基线校正等处理,氮15和碳13共价链接的h3蛋白乙酰化峰出现在7.92ppm附近。
61.图1为检测sirts蛋白活性的流程示意图。转入his标签h3蛋白质粒的大肠杆菌,培养时加入氮15标记的氯化氨(
15
nh4cl)和碳13标记的乙酸(
13
c-acetate)以及加入iptg催化表达h3蛋白,得到特定赖氨酸(lysine,k)位点末位氮15和乙酰化的两个碳13标记的h3蛋白。利用ni-nta珠子和fplc纯化出氮15和碳13共价链接的h3蛋白后,氮15和碳13共价链接的h3蛋白作为底物作体外sirts蛋白活性实验。特定位点的乙酰化在大肠杆菌自主发生,且乙酰化反应使h3蛋白存在氮15和碳13标记的共价键(虚线内标出),当利用核磁共振的1维heteronuclear hnco旋转系统(spin system),可测得信号(nmr signal on)。当sirts蛋白与氮15和碳13共价链接的h3蛋白共存时,因为sirts蛋白的去乙酰化(deacetylation)活性,去除此共价键,最终会失去信号(nmr signal off)。
62.图2为sirt7介导的去乙酰化反应。其中,a为iptg诱导全长h3蛋白表达后,使用
h3k18、h3k14、h3k36、h3k27和泛乙酰化抗体,利用免疫印迹方法检测h3蛋白的h3k18、h3k14、h3k36、h3k27乙酰化和泛乙酰化的表达水平。b为含有纯化的全长h3蛋白(10μg)的反应缓冲液(10mm tris-hcl,ph 8.0,4mm mgcl2,1mm nad,1mm dtt和5%甘油)中加入或者不加入纯化的sirt7蛋白(10μg),在37℃温育6小时,然后利用所示抗体通过免疫印迹方法检测分析。c为h3蛋白第18位赖氨酸乙酰化的一维hnco核磁共振谱图。在含有碳13乙酰基、氮15赖氨酸标记的或未标记的h3蛋白(10μg)反应缓冲液中,加入或不加入sirt7蛋白(100μm),以及加入或未加入sirt7抑制剂nam(2mm),在37℃温育16小时后,测得的一维hnco核磁共振谱图。d为酶促反应后,利用免疫印迹方法检测h3k18乙酰化水平。从图2中a可知,大肠杆菌表达的h3蛋白确实含有各个赖氨酸位点的乙酰化修饰;从图2中b可知,本实施例建立及验证了体外实验体系;从图2中c可知,未标记的h3蛋白中没有核磁信号;加入sirt7后,标记的h3k8ac(指乙酰化的h3k18)信号减少,加入抑制剂后抑制了酶促反应;从图2中d可知,核磁实验结束后,用免疫印迹法得到验证。以上结果表明,基于一维hnco的检测方法对sirt7催化反应具有较高特异性,有sirt7作用下可以观察到h3k18ac信号的减弱,而加入抑制剂的情况下h3k18ac信号维持再较高水平,有着抑制sirt7酶活性的作用。
63.图3为sirt7的底物随时间变化的检测结果图。基于核磁共振的检测方法不会对样品的特性及状态造成改变,能保证样品的完整性,因此可用于化学反应的实时监测。而其他的分析方法检测前的样品处理步骤具有一定破坏性,如果对酶活性的时间依赖性进行检测,则需要分别收集反应进行不同时间的样品。为验证本实施例建立的方法对酶促反应进行实时监测的可行性,对同一sirt7催化反应进行了连续12小时的实时监测,图3为该反应在6个不同时间点的一维hnco核磁共振谱图。在含有碳13乙酰基、氮15赖氨酸标记的h3蛋白(10μg)反应缓冲液中,加入sirt7蛋白(100μm),放入核磁共振管,温度调到37℃进行实时检测。碳13乙酰基、氮15赖氨酸标记的h3k18一维hnco信号,随着时间推移,信号逐渐减少。
64.图4为抑制效应检测结果图。在不含抑制剂(左上)或含已知抑制剂nam(2mm,右上)或含10μm各种天然化合物木霉素a(oroxylin a)(b)、吴茱萸次碱(rutaecarpine)(c)、五味子素b(wuweizisu b)(d)、吴茱萸碱(rutaevin)(e)、伞形花序酮(umbelliferone)(f)、依普黄酮(ipriflavone)(g)、异维甲酸(isotretinoin)(h)的缓冲液中,分别检测碳13乙酰基、氮15赖氨酸标记的h3k18一维hnco信号。从图可知,7种化合物处理后所检测到的信号峰强度和对照组(no inhibitor)相比维持在较高水平,表明这些化合物作用对sirt7酶活性的干扰较小。这些实验结果表明基于一维hnco的检测方法可以准确反映出抑制剂对sirt7酶活性的干扰作用,因此可以应用于抑制剂筛选的研究中。并且本实施例在sirt7催化反应结束后不需要任何的样品制备步骤,可以在核磁共振管中完成催化反应和随后的一维hnco检测,因此可以使用样品自动更换器高效获得多个样品的一维hnco谱图,很快速的筛查抑制剂。
65.综上所述,本发明首先将his标签的h3蛋白质粒转入大肠杆菌(e.coli)。培养此大肠杆菌时加入氮15标记的氯化氨(
15
nh4cl)和碳13标记的乙酸(
13
c-acetate)到培养液中。加入iptg可催化表达大量h3蛋白。表达出来的h3蛋白赖氨酸末端的氮会标记为氮15。赖氨酸位点自发发生乙酰化时会使用碳13标记的乙酸(
13
c-acetate),因而乙酰基标记为碳13。最终可以得到乙酰化的h3蛋白,且特定位点h3k18的乙酰化形成氮15和碳13共价链接。his标签和ni-nta珠子有亲和力,以及用fplc,可以纯化出氮15和碳13共价链接的h3蛋白。利用核
磁共振的1维heteronuclear hnco旋转系统(spin system),可测得信号(nmr signal on)。
66.在反应缓冲液(10mm tris-hcl,ph 8.0,4mm mgcl2,1mm nad,1mm dtt,和5%甘油,其中该“%”为体积百分比)中加入纯化的氮15和碳13共价链接的h3蛋白(1mm)和sirt7蛋白(0.1mm)后,在37℃温育6小时,此过程中sirt7蛋白对氮15和碳13共价链接的h3蛋白进行去乙酰化反应,破坏氮15和碳13共价链接,所以再利用一维hnco核磁共振谱光谱仪检测时,信号减弱或者消失。本方法可测定酶活性以及可以应用到酶抑制剂的筛查。
67.应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。