一种玉米mirna的应用
技术领域
1.本发明属于玉米mirna技术领域,具体涉及一种玉米mirna的应用。
背景技术:
2.拟轮枝镰孢菌(fusarium verticillioides)是一种能引起众多作物流行性病害的病原真菌,尤其对于玉米(zea mays l.)的危害最为严重。玉米是我国最重要的粮食作物之一,也是重要的饲料和工业原料,其生产对我国粮食安全起着举足轻重的作用。然而,在玉米的整个生长发育过程中,常常会遭受拟轮枝镰孢菌的侵害,进而发生苗枯、茎腐、穗腐和种腐等多种病害。在玉米幼苗发育早期,感染拟轮枝镰孢菌会影响玉米的发芽率、幼苗群体的长势、植株的高度等,严重者造成幼苗枯萎死亡。在玉米发育中期,拟轮枝镰孢菌感染会造成玉米茎秆腐烂枯败,进而导致植株断裂倒伏。在玉米籽粒灌浆期,拟轮枝镰孢菌会侵染玉米籽粒或者穗轴,造成穗轴和籽粒霉变腐烂,因此严重影响玉米产量。在玉米种子贮藏期,携带拟轮枝镰孢菌的种子会霉变,或者在种子发芽后引起新一轮的幼苗、茎秆或穗子的感染。最重要的是,拟轮枝镰孢菌可产生伏马菌素(fumonisin),这是一种真菌毒素,与牲畜和人类的多种疾病有关,并被列为可能的致癌物。因此,挖掘植物抵抗拟轮枝镰孢菌相关的基因、提高植物对拟轮枝镰孢菌的抵抗能力至关重要。
3.micrornas(mirnas)是一类在真核生物中广泛存在的由20-24个核苷酸组成的内源性非编码rna,主要在转录后水平上调控蛋白编码基因的表达。mirnas通过促进靶基因mrna的降解或抑制其翻译来负调控基因的表达,而靶基因的命运取决于其与mirna序列的互补程度。越来越多的证据表明,mirnas参与了植物抵抗病原菌过程。例如:mir393是第一个被发现参与植物免疫反应的mirna,它可以被细菌鞭毛蛋白衍生的肽诱导,并通过抑制生长素信号来抑制丁香假单胞菌的生长;mir159a在水稻抵抗稻瘟病菌(magnaporthe oryzae)中发挥积极作用;mir156在水稻抵抗水稻黄单胞菌引起的白叶枯病中发挥负调控作用。mirna可以通过正调控或者负调控抗病相关基因的表达水平来参与植物对病原菌的抵抗作用。鉴于mirnas对抗病基因的广泛调控作用,进一步鉴定响应病原菌的mirnas对于减轻病原菌危害并最终确保作物生产具有重要作用。
技术实现要素:
4.本发明所要解决的技术问题在于针对上述现有技术的不足,提供一种玉米mirna的应用,该玉米的mirna(zma-unmir4)可以响应拟轮枝镰孢菌(fusarium verticillioides)的侵染,在拟轮枝镰孢菌接菌后,zma-unmir4的初级转录本在抗病玉米自交系bt-1中下调,在感病玉米自交系n6中上调。并通过在拟南芥中异源过表达zma-unmir4可调控植株对拟轮枝镰孢菌的抵抗能力。
5.为解决上述技术问题,本发明采用的技术方案是:一种玉米mirna的应用,所述玉米mirna命名为zma-unmir4,所述zma-unmir4响应拟轮枝镰孢菌(fusarium verticillioides)的侵染,用于调控植株对拟轮枝镰孢菌(fusarium verticillioides)的
抵抗能力,所述zma-unmir4的成熟转录本核苷酸序列如seq id no:1所示。
6.优选地,所述zma-unmir4响应拟轮枝镰孢菌fusarium verticillioides的侵染时,所述zma-unmir4的初级转录本在抗病玉米杂交系bt-1中下调,在感病玉米自交系n6中上调;所述zma-unmir4的初级转录本的核苷酸序列如seq id no:2所示。
7.优选地,所述zma-unmir4通过在拟南芥中异源表达,调节拟南芥对拟轮枝镰孢菌的抵抗能力。
8.优选地,所述zma-unmir4通过在拟南芥中异源表达的方法为:
9.s1、用xhoi/saci双酶切pjim19载体,在温度为37℃的条件下酶切反应6h,将酶切产物用1%琼脂糖凝胶分离,切下11kb大小的条带,用dna凝胶回收试剂盒回收产物,得到xhoi/saci双酶切pjim19载体的回收产物;
10.所述酶切反应的体系为:xhoi酶1μl,saci酶1μl,cutsmart buffer 5μl,pjim19载体10μl,灭菌超纯水补至50μl;
11.s2、以玉米自交系b73的cdna文库为模板,进行pcr扩增,克隆zma-unmir4的初级转录本,将扩增产物用1%琼脂糖凝胶分离,切下498bp大小的条带,用dna凝胶回收试剂盒回收pcr产物,得到pcr回收产物,即为zma-unmir4的初级转录本;
12.所述pcr扩增的体系为:2
×
kod mix 10μl,特异性引物f1μl、特异性引物r1μl、玉米自交系b73的cdna文库1μl,灭菌超纯水补至20μl;所述特异性引物f的核苷酸序列如seq id no:3所示,所述特异性引物r的核苷酸序列如seq id no:4所示;
13.所述pcr扩增的程序为:98℃预变性10min;98℃变性10s,55℃退火10s,68℃延伸40s,扩增40个循环;68℃延伸10min;
14.s3、利用同源重组方法将zma-unmir4的初级转录本连接至pjim19载体的xhoi/saci之间,在温度为50℃的条件下连接反应25min,得到连接产物,将所述连接产物转化到大肠杆菌中,扩增繁殖,利用质粒提取试剂盒,得到pjim19-zma-unmir4载体质粒;
15.所述zma-unmir4的初级转录本的核苷酸序列如seq id no:2所示;
16.所述pjim19-zma-unmir4载体质粒能表达所述zma-unmir4的成熟转录本的核苷酸序列;
17.所述连接反应的体系为:2
×
hieffclone enzyme premix 5μl,s1中得到的xhoi/saci双酶切pjim19载体的回收产物2μl,s2中得到的pcr回收产物1μl,灭菌超纯水补至10μl;
18.s4、转基因植株的种子获得:
19.将步骤1中得到的pjim19-zma-unmir4载体质粒导入农杆菌gv3101后,得到重组农杆菌,侵染拟南芥花絮20s,将侵染后的拟南芥花絮所结的种子收获,得到转基因植株的种子;
20.s5、阳性转基因植株的鉴定:将s4中得到的转基因植株的种子播在含有30μg/ml的ms固体板上,能够正常生长的植株为阳性转基因植株;
21.s6、鉴定阳性转基因植株中zma-unmir4初级转录本的表达量:
22.s601、第一链cdna的合成:提取s5中得到的阳性转基因植株的总rna,测量所述总rna的浓度,取1μg的所述总rna用1μl的dnase i在37℃的条件下消化处理30min,然后在70℃的条件下加热10min,之后放置冰上,依照promega反转录试剂盒的用量加入反转录所需
试剂,42℃孵育1h,95℃变性5min后,将反应体系置于冰上,加入四倍体积的灭菌超纯水,得到第一链cdna;
23.s602、rt-pcr检测分析:
24.以s601中得到的第一链cdna为模板进行rt-pcr扩增;
25.所述rt-pcr扩增的体系为:s601中得到的第一链cdna 1μl、2
×
tag mix 10μl、zma-unmir4 q-f引物1μl、zma-unmir4 q-r引物1μl、灭菌超纯水补至20μl;
26.所述zma-unmir4 q-f的核苷酸序列如seq id no:5所示,所述引物zma-unmir4 q-r的核苷酸序列如seq id no:6所示;
27.所述rt-pcr扩增的反应条件为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,扩增30个循环;72℃延伸5min;
28.并以哥伦比亚野生型拟南芥作为对照,所述哥伦比亚野生型拟南芥所使用的引物为actin q-f和actin q-r;
29.所述actin q-f的核苷酸序列如seq id no:7所示,所述引物actin q-r的核苷酸序列如seq id no:8所示;
30.利用rt-pcr的方法检测s5中得到的阳性转基因植株中zma-unmir4初级转录本的相对积累量,利用s602中所述zma-unmir4 q-f引物和zma-unmir4 q-r引物,能够扩增出286bp的条带,并且利用imagej软件分析条带亮度,条带越亮,所述阳性转基因植株中zma-unmir4初级转录本的相对积累量越高。
31.本发明与现有技术相比具有以下优点:
32.本发明的玉米的mirna(zma-unmir4)可以响应拟轮枝镰孢菌(fusarium verticillioides)的侵染,在拟轮枝镰孢菌接菌后,zma-unmir4的初级转录本在抗病玉米自交系bt-1中下调,在感病玉米自交系n6中上调。并通过在拟南芥中异源过表达zma-unmir4可调控植株对拟轮枝镰孢菌的抵抗能力。
33.下面结合附图和实施例对本发明作进一步详细说明。
附图说明
34.图1是本发明的实施例1中用于确定玉米中zma-unmir4的存在的norther blotting图。
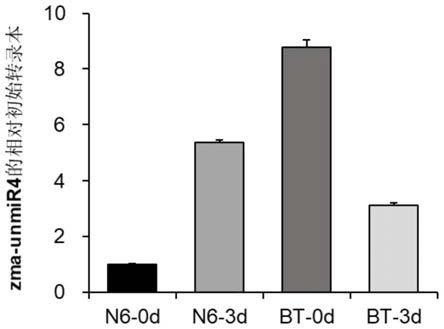
35.图2是本发明的实施例1的zma-unmir4的初级转录本响应拟轮枝镰孢菌侵染的定量图。
36.图3是本发明的实施例1的rt-pcr检测拟南芥转基因阳性植株中zma-unmir4的初级转录本相对积累量差异图。
37.图4是本发明的实施例1的zma-unmir4 oe#2、zma-unmir4 oe#3和野生型拟南芥接种拟轮枝镰孢菌和接种水对照的叶片病变情况比较图。
38.图5是本发明的实施例1的zma-unmir4 oe#2、zma-unmir4 oe#3和野生型拟南芥接种拟轮枝镰孢菌和接种水对照的种子霉变情况比较图。
具体实施方式
39.实施例1
verticillioides seed rot resistance in maize by combining qtl mapping and genome-wide association analysis,《scientific reports》2017年第7期”中公开过,公众可从河南农业大学生命科学学院获得。玉米自交授粉后15d,通过按压苞叶确定籽粒密集的区域,使用兽用注射器将lml拟轮枝镰孢菌孢子重悬液(浓度为5
×
106个孢子/ml)注入进籽粒密集区中央的籽粒内,然后使用医用胶布封住针孔以防昆虫和病原菌感染。在接菌0d、3d分别取bt-1和n6的籽粒,提取rna。总rna的提取采用trizol提取法:取样前用酒精灯火焰灼烧取样所需的镊子、剪刀、刀片,将用于rna提取的材料取下放入锡箔纸包好后迅速投入液氮中速冻,不立即提取rna的样品可以转移到-80℃超低温冰箱中备用。取适量组织在研钵中充分研磨至粉末状,加入1ml trizol提取液快速转动研钵棒使trizol充分盖住植物组织,待融化后用研钵棒充分研磨混合液至澄清透明,转移研磨液至rnase-free的1.5ml离心管中,室温静置5min,4℃,12,000rpm离心5min,转移上清至新的离心管中,加入五分之一体积的氯仿,剧烈振荡15s后室温静置5min,4℃,12,000rpm离心15min,转移上清至新的离心管中,加入等体积异丙醇,轻柔混合后室温静置10min,4℃,12,000rpm离心10min后弃去上清液,用75%乙醇洗涤沉淀,4℃,12,000rpm离心5min弃去乙醇,用枪头小心吸取残留乙醇,室温干燥5min至rna边缘呈现透明状态,加入30μl的depc水待反转录;
47.第一链cdna的合成:用nanodrop仪器测量rna的浓度,取1μg的总rna用1μl的dnase i(thermo scientific)在37℃消化处理30min,70℃加热10min使dnase i变性,之后放置冰上,依照promega反转录试剂盒的用量加入反转录所需试剂,42℃孵育1h,95℃变性5min后立即将反应体系置于冰上,使cdna第一链和rna模板分离,加入四倍体积的灭菌超纯水,-20℃保存备用;
48.qrt-pcr鉴定zma-unmir4的初级转录本积累量:以第一链cdna为模板,进行pcr扩增;
49.所述pcr扩增的体系为:第一链cdna 2μl、sybr green master i酶预混液10μl、zma-unmir4 q-f引物1μl、zma-unmir4 q-r引物1μl、灭菌超纯水补至20μl;
50.所述zma-unmir4 q-f的核苷酸序列如seq id no:5所示,所述引物zma-unmir4 q-r的核苷酸序列如seq id no:6所示;
51.pcr的反应条件为:94℃5min;94℃5s;相应引物的退火温度(55℃)15s;72℃10s;45个循环,以玉米ef1a基因作为内参,所述玉米基因ef1a所使用的引物为ef1a q-f和ef1a q-r;
52.所述ef1a q-f的核苷酸序列如seq id no:10所示,所述引物ef1a q-r的核苷酸序列如seq id no:11所示;
53.计算每个样品中zma-unmir4的初始转录本的相对积累量,结果如图2所示,在拟轮枝镰孢菌接菌后,zma-unmir4的初级转录本在抗病玉米自交系bt-1中下调,在感病玉米自交系n6中上调,说明zma-unmir4响应拟轮枝镰孢菌的侵染。
54.(3)本实施例中zma-unmir4通过在拟南芥中异源表达,调节拟南芥对拟轮枝镰孢菌的抵抗能力。
55.所述zma-unmir4通过在拟南芥中异源表达的方法为:
56.s1、用xhoi/saci双酶切pjim19载体,在温度为37℃的条件下酶切反应6h,将酶切产物用1%琼脂糖凝胶分离,切下11kb大小的条带,用dna凝胶回收试剂盒回收产物,得到
xhoi/saci双酶切pjim19载体的回收产物;
57.所述酶切反应的体系为:xhoi酶1μl,saci酶1μl,cutsmart buffer 5μl,pjim19载体10μl,灭菌超纯水补至50μl;
58.s2、以玉米自交系b73的cdna文库为模板,进行pcr扩增,克隆zma-unmir4的初级转录本,将扩增产物用1%琼脂糖凝胶分离,切下498bp大小的条带,用dna凝胶回收试剂盒回收pcr产物,得到pcr回收产物,即为zma-unmir4的初级转录本;
59.所述pcr扩增的体系为:2
×
kod mix 10μl,特异性引物f1μl、特异性引物r1μl、玉米自交系b73的cdna文库1μl,灭菌超纯水补至20μl;所述特异性引物f的核苷酸序列如seq id no:3所示,所述特异性引物r的核苷酸序列如seq id no:4所示;
60.所述pcr扩增的程序为:98℃预变性10min;98℃变性10s,55℃退火10s,68℃延伸40s,扩增40个循环;68℃延伸10min;
61.s3、利用同源重组方法将zma-unmir4的初级转录本连接至pjim19载体的xhoi/saci之间,在温度为50℃的条件下连接反应25min,得到连接产物,将所述连接产物转化到大肠杆菌中,扩增繁殖,利用质粒提取试剂盒,得到pjim19-zma-unmir4载体质粒;
62.所述zma-unmir4的初级转录本的核苷酸序列如seq id no:2所示;
63.所述pjim19-zma-unmir4载体质粒能表达所述zma-unmir4的成熟转录本的核苷酸序列;
64.所述连接反应的体系为:2
×
hieffclone enzyme premix 5μl,s1中得到的xhoi/saci双酶切pjim19载体的回收产物2μl,s2中得到的pcr回收产物1μl,灭菌超纯水补至10μl;
65.s4、转基因植株的种子获得:
66.将步骤1中得到的pjim19-zma-unmir4载体质粒导入农杆菌gv3101后,得到重组农杆菌,侵染拟南芥花絮20s,将侵染后的拟南芥花絮所结的种子收获,得到转基因植株的种子;
67.s5、阳性转基因植株的鉴定:将s4中得到的转基因植株的种子播在含有30μg/ml的ms固体板上,能够正常生长的植株为阳性转基因植株;
68.s6、鉴定阳性转基因植株中zma-unmir4初级转录本的表达量:
69.s601、第一链cdna的合成:以哥伦比亚野生型拟南芥为对照,提取5种s5中得到的阳性转基因植株的总rna(zma-unmir4 oe#1~zma-un mir4 oe#5);
70.总rna的提取采用trizol提取法:取样前用酒精灯火焰灼烧取样所需的镊子、剪刀、刀片,将用于rna提取的材料取下放入锡箔纸包好后迅速投入液氮中速冻,不立即提取rna的样品可以转移到-80℃超低温冰箱中备用。取适量组织在研钵中充分研磨至粉末状,加入1ml trizol提取液快速转动研钵棒使trizol充分盖住植物组织,待融化后用研钵棒充分研磨混合液至澄清透明,转移研磨液至rnase-free的1.5ml离心管中,室温静置5min,4℃,12000rpm离心5min,转移上清至新的离心管中,加入五分之一体积的氯仿,剧烈振荡15s后室温静置5min,4℃,12000rpm离心15min,转移上清至新的离心管中,加入等体积异丙醇,轻柔混合后室温静置10min,4℃,12000rpm离心10min后弃去上清液,用75%乙醇洗涤沉淀,4℃,12000rpm离心5min弃去乙醇,用枪头小心吸取残留乙醇,室温干燥3~5min至rna边缘呈现透明状态,加入30μl的depc水待反转录;
71.测量所述总rna的浓度,取1μg的所述总rna用1μl的dnase i在37℃的条件下消化处理30min,然后在70℃的条件下加热10min,之后放置冰上,依照promega反转录试剂盒的用量加入反转录所需试剂,42℃孵育1h,95℃变性5min后,将反应体系置于冰上,加入四倍体积的灭菌超纯水,得到第一链cdna;
72.s602、qrt-pcr检测分析:
73.以s601中得到的第一链cdna为模板进行rt-pcr扩增;
74.所述rt-pcr扩增的体系为:s601中得到的第一链cdna 1μl、2
×
tag mix 10μl、zma-unmir4 q-f引物1μl、zma-unmir4 q-r引物1μl、灭菌超纯水补至20μl;
75.所述zma-unmir4 q-f的核苷酸序列如seq id no:5所示,所述引物zma-unmir4 q-r的核苷酸序列如seq id no:6所示;
76.所述rt-pcr扩增的反应条件为:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,扩增30个循环;72℃延伸5min;
77.并以哥伦比亚野生型拟南芥作为对照,所述哥伦比亚野生型拟南芥所使用的引物为actin q-f和actin q-r;
78.所述actin q-f的核苷酸序列如seq id no:7所示,所述引物actin q-r的核苷酸序列如seq id no:8所示;
79.利用rt-pcr的方法检测s5中得到的阳性转基因植株zma-unmir4oe#2和zma-unmir4 oe#3中zma-unmir4初级转录本的相对积累量,所用引物为zma-unmir4 q-f和zma-unmir4 q-r。利用该引物,哥伦比亚野生型拟南芥无法扩增出条带,而zma-unmir4 oe#2和zma-unmir4 oe#3能够扩增出286bp的条带,而且利用imagej软件分析条带亮度,条带越亮,说明zma-unmir4的相对积累量越高,如图3所示,相比于野生型,zma-unmir4 oe#2和zma-unmir4 oe#3转基因植株能够扩增出286bp的条带,为拟南芥zma-unmir4过表达的植株,可以用于后续的表型鉴定。
80.以的zma-unmir4 oe#2和zma-unmir4 oe#3为材料,在拟南芥中异源过表达zma-unmir4可调控植株对拟轮枝镰孢菌的抵抗能力的试验:
81.通过对拟南芥叶片接种拟轮枝镰孢菌(fusarium verticillioides)和接种水,发现被接种植株的叶片在接种拟轮枝镰孢菌后均出现明显的黄色病斑,但是zma-unmir4 oe#2和zma-unmir4 oe#3的病斑面积要明显大于wt(野生型拟南芥)(图4)。而接水组三者的叶片表型没有明显差异。叶片接菌的具体方法为:选取4周龄的健康拟南芥莲座叶,用干净的去头一毫升注射器抽取浓度为5
×
106/ml的拟轮枝镰孢菌孢子悬浮液,从拟南芥莲座叶叶片背部进行渗透法注射,每片叶注射量为20微升。将注射过后的拟南芥置于培养箱中培养,5天后观察表型。
82.通过对拟南芥种子接种拟轮枝镰孢菌(fusarium verticillioides)和接种水,发现接菌后zma-unmir4 oe#2和zma-unmir4 oe#3的种子出现严重的霉变情况,而wt(野生型拟南芥)种子的霉变情况则相对较轻(图5)。种子接菌的具体方法为:选取健康的拟南芥种子,1%的次氯酸钠灭菌15分钟后,用灭菌水洗3次,浸泡入5
×
106/ml的拟轮枝镰孢菌孢子悬浮液中48小时,期间置于28℃培养箱内避光保存。然后用无菌水洗3遍;将厚滤纸放入培养皿,添加5ml灭菌水,将处理过的种子均匀点在厚滤纸上,每组50颗3组重复,放于28℃无光照培养箱中培养6天观察表型。
83.以上所述,仅是本发明的较佳实施例,并非对本发明作任何限制。凡是根据发明技术实质对以上实施例所作的任何简单修改、变更以及等效变化,均仍属于本发明技术方案的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。