一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒以及检测方法
技术领域
1.本发明涉及铜离子检测试纸盒及检测方法,具体涉及一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒以及检测方法。
背景技术:
2.在自然界中,铜的含量较高,具有良好的导电性、耐用性和易迁移性,因而被广泛应用于轻工业、制造业和国防工业等。在生理上,铜又是生物体必需的微量元素之一,经常参与生物体内一些重要的酶催化过程,在一定程度上有利于生物体的生长。当生物体摄取低剂量的铜离子时,会出现头疼、恶心等症状;当长期摄取高浓度的铜离子时,会使生物体的生长停滞,甚至出现肝中毒、急性肾衰竭等重大疾病。因此,开发一种快速检测环境中铜的方法对人体健康具有重要意义。检测铜离子的传统方法主要是原子光谱法、共振散射光谱法以及电化学分析法等,这些方法的灵敏度高,准确性好,但是检测过程繁琐,需要大量的专业技术人员和昂贵的设备仪器,更不能进行实时监测。
3.自2001年起,“点击化学”的出现为人们检测环境中的铜离子提供了便利,其主要是利用末端叠氮基和炔基,在还原剂和cu
2
的存在下,通过环加成反应合成1,2,3三唑。该方法反应条件温和,在反应过程中无副反应发生,同时又具有很高的选择性。cu
可以通过抗坏血酸钠还原cu
2
产生。基于cu
的点击化学已经用于可视化检测cu
2
,其检测的原理多是基于比色法,操作复杂,重复性差,并且,这些方法的灵敏度都有待进一步提高。
技术实现要素:
4.本发明的目的在于提供一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒以及检测方法,该检测试纸盒方便携带、操作简单、重复性好、方便长期保存使用,能够高效快速、高选择性、高灵敏度地对铜离子进行实时检测,降低分析成本和对环境的污染,检测结果通过肉眼就能观察到,可广泛推广使用。
5.为了实现上述目的,本发明提供了一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒,包括3’端修饰叠氮基团和5’端修饰炔基基团的脱氧核糖核酸储备液、还原性溶液、铜离子荧光探针储备液和k
缓冲溶液;
6.所述3’端修饰叠氮基团和5’端修饰炔基基团的脱氧核糖核酸储备液的制备方法为:将一条3’端修饰叠氮基团的脱氧核糖核酸的核苷酸序列和一条5’端修饰炔基基团的脱氧核糖核酸的核苷酸序列分别溶解于超纯水中配制成浓度为100μm的脱氧核糖核酸储备液,振荡混匀,离心1min后于冰箱冷藏,备用;
[0007]3’
端修饰叠氮基团的脱氧核糖核酸的核苷酸序列为5
’‑
gtgggtagg-n=n=n-3’、5'-gggtgggt-n=n=n-3’、5
’‑
gggtagg-n=n=n-3’、5
’‑
ggtggtggtggtt-n=n=n-3’中的一种;
[0008]5’
端修饰炔基基团的脱氧核糖核酸的核苷酸序列为5
’‑
ch≡c-gcgggttggg-3’、5’‑
ch≡c-gggtgggt-3'、5
’‑
ch≡c-gtggtggtggtgg-3’中的一种;
[0009]
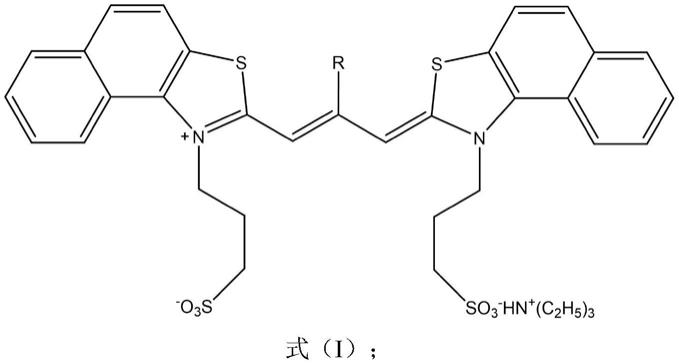
所述铜离子荧光探针储备液的制备方法为:将菁染料荧光探针分子溶解于dmso中配制成浓度为1~5mm的铜离子荧光探针储备液,菁染料荧光探针分子的结构式如下式(ⅰ)所示:
[0010][0011]
其中,r选自甲基或乙基。
[0012]
优选的,所述还原性溶液是抗坏血酸钠溶液、抗坏血酸溶液、柠檬酸三钠溶液中的一种。
[0013]
优选的,抗坏血酸钠溶液的浓度是1-10mm。
[0014]
优选的,所述k
缓冲溶液是kcl溶液或k2so4溶液,k
缓冲溶液中的k
浓度为0.1-5mol/l。
[0015]
本发明另一目的还在于提供根据本发明所述的一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒的铜离子检测方法,该检测方法简单,适于广泛推广应用。
[0016]
为了实现上述目的,本发明还提供了一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒的铜离子检测方法,包括以下步骤:
[0017]
1)将3’端修饰叠氮基团和5’端修饰炔基基团的脱氧核糖核酸储备液、还原性溶液以及待测样品溶液先后加入超纯水体系中,在室温下震荡2h;
[0018]
2)向震荡结束后的混合溶液中加入铜离子荧光探针储备液和k
缓冲溶液,震荡混匀后离心,避光静置等待20min;
[0019]
3)观察混合液的颜色变化,若待测样品溶液中含有cu
2
,被修饰的两条核酸序列连接成一条新的1,2,3-三唑偶联核酸序列,此时溶液呈蓝色;若待测样品溶液中无cu
2
,被炔基修饰的核酸序列形成g-四链体,此时溶液呈粉色;
[0020]
4)将上述混合液转移到酶标板中,使用酶标仪或紫外分光光度计测量混合溶液在580nm和650nm的吸收值,对cu
2
的含量进行定量分析。
[0021]
优选的,步骤1)中,还原性溶液为抗坏血酸钠溶液。
[0022]
本发明试剂盒的检测原理:一条3’端修饰叠氮基团的脱氧核糖核酸的核苷酸序列和一条5’端修饰炔基基团的脱氧核糖核酸的核苷酸序列,在超纯水/k
体系中,两条修饰后的脱氧核糖核酸的核苷酸序列、还原性溶液、铜离子菁染料探荧光针构成检测体系。
[0023]
菁染料超分子聚集体对于环境敏感,可实现不同聚集体之间的转化,同时伴随着
谱学信号转化和显著的颜色改变。相对于单分子探针,超分子聚集可级联放大识别信号。一般来说,染料分子因短程范德华力而发生自聚,在溶液中以四种形式存在,分别是单体、二聚集体、h-聚集体、j-聚集体。与单体相比,j-聚集体和h-聚集体是通过染料分子的头头堆积和面面堆积形成的二级结构。
[0024]
如图1所示,若溶液中不存在铜离子时,炔基团修饰的核苷酸序列在钾离子中形成g-四链体结构,与菁染料的单体作用后,体系成肉眼可见的淡粉色;若溶液中存在铜离子,二价铜离子在还原剂的作用下被还原为一价铜离子,在cu
中,两条被修饰后的富含鸟嘌呤(g)的序列发生click反应,即发生环加成偶联反应连接成一条新的1,2,3-三唑偶联的脱氧核糖核酸序列,新形成的序列不能形成g-四链体,菁染料的单体转变成j-聚集体,溶液由粉色变成蓝色,实现可视化检测。
[0025]
与现有技术相比,本发明具有以下优点:
[0026]
本发明中的检测试纸盒能够高效快速、高选择性、高灵敏度地对铜离子进行实时检测,具有方便携带、操作简单、重复性好、方便长期保存使用的优点,具有良好的应用前景;该检测方法简单,其检测结果通过肉眼就能观察到,对检测自来水和环境中的铜离子具有重要意义,适于广泛推广应用。
附图说明
[0027]
图1是本发明所述的铜离子检测试剂盒以及检测方法的原理图;
[0028]
图2是本发明实施例一的检测体系中加入铜离子的紫外光谱图;
[0029]
图3是本发明实施例一的检测体系中加入不同浓度的铜离子的紫外光谱图;
[0030]
图4是本发明实施例一的检测体系中加入不同浓度的铜离子的颜色直观改变图;
[0031]
图5是本发明实施例二的检测体系中加入铜离子的紫外光谱图;
[0032]
图6是本发明实施例二的检测体系中加入不同浓度的铜离子的紫外光谱图;
[0033]
图7是本发明实施例二的检测体系中加入不同浓度的铜离子的颜色直观改变图;
[0034]
图8是本发明实施例三的检测体系中加入铜离子的紫外光谱图;
[0035]
图9是本发明实施例三的检测体系中加入不同浓度的铜离子的紫外光谱图;
[0036]
图10是本发明实施例三的检测体系中加入不同浓度的铜离子的颜色直观改变图。
具体实施方式
[0037]
下面结合附图和具体实施例对本发明作进一步说明。
[0038]
本实施例中3’端修饰叠氮基团的脱氧核糖核酸的核苷酸序列和5’端修饰炔基基团的脱氧核糖核酸的核苷酸序列均通过生物工程(上海)股份有限公司购得。
[0039]
以下实施例中两种菁染料荧光探针分子的制备方法如下所示:
[0040]
mtc菁染料荧光探针分子:
[0041]
取2-甲基萘并噻唑0.50g与1,3-丙烷磺酸内酯1.00g(摩尔比约为1:3)置于厚壁耐压管中,在170℃下反应5h,产物呈黄褐色。再加入适量甲醇,捣碎固体,洗涤弃去上层黄色液体,多次重复洗涤,至上清液接近无色。弃去水层后,待甲醇挥发干,得到中间体淡黄色粉末状固体,经计算中间体产率为64.49%。
[0042]
取中间体0.21g,苯酚0.60g,原乙酸三乙酯0.21g,混合加热至60℃,使三者融化,
充分混合后,再加入三乙胺0.2ml,升高温度至120℃,反应1.5h,溶液呈紫黑色。冷却后加入5ml乙醚,洗涤去过量的苯酚和原料,重复3次。再加入2ml甲醇,溶解瓶中的mtc固体。取0.2ml管中溶液,置于1.5mlep管中,每管内加入1ml乙醚,静置15min后离心(9000r/min,1min)。之后向ep管内加入0.2ml甲醇,重复上述操作约10次,至上清液为淡紫色,得到mtc粗品固体,为紫黑色偏黄固体。流动相纯化采用甲醇:三乙胺:水=50:1:1的比例进行配置,得到mtc纯净产品,产率为40.9%。
[0043]
etc菁染料荧光探针分子:
[0044]
取2-甲基萘并噻唑0.50g与1,3-丙烷磺酸内酯1.00g(摩尔比约为1:3),置于厚壁耐压管中,在170℃下反应5h,产物呈黄褐色。再加入适量甲醇,捣碎固体,洗涤弃去上层黄色液体,多次重复洗涤,至上清液接近无色。弃去水层后,待甲醇挥发干,得到中间体淡黄色粉末状固体,经计算中间体产率为64.49%。
[0045]
取中间体0.21g,苯酚0.60g,原丙酸三乙酯0.28g,混合加热至60℃,使三者融化,充分混合后,再加入三乙胺0.2ml,升高温度至120℃,反应1.5h。冷却后加入5ml乙醚,洗涤去过量的苯酚和原料,重复3次。再加入2ml甲醇,溶解瓶中的etc固体。取0.2ml管中溶液,置于1.5ml ep管中,每管内加入1ml乙醚,静置15min后离心(9000r/min,1min)。之后向ep管内加入0.2ml甲醇,重复上述操作约10次,得到etc粗品固体。流动相纯化采用甲醇:三乙胺:水=50:1:1的比例进行配置,得到etc纯净固体,产率为34.6%。
[0046]
实施例一
[0047]
一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒,包括3’端修饰叠氮基团(5
’‑
gtgggtagg-n=n=n-3’)和5’端修饰炔基基团(5
’‑
ch≡c-gcgggttggg-3’)的脱氧核糖核酸储备液、2mm的抗坏血酸钠溶液、5mm的mtc铜离子荧光探针储备液和2mol/l的kcl溶液;
[0048]
所述3’端修饰叠氮基团和5’端修饰炔基基团的脱氧核糖核酸储备液的制备方法为:将一条3’端修饰叠氮基团的脱氧核糖核酸的核苷酸序列和一条5’端修饰炔基基团的脱氧核糖核酸的核苷酸序列分别溶解于105μl和107μl的超纯水中配制成浓度为100μm的脱氧核糖核酸储备液,振荡混匀,离心1min后于冰箱冷藏,备用;
[0049]3’
端修饰叠氮基团的脱氧核糖核酸的核苷酸序列为5
’‑
gtgggtagg-n=n=n-3’;末端修饰叠氮的序列结构如下式(ⅱ)所示,式中oligo为核酸缩写;
[0050]
[0051]5’
端修饰炔基基团的脱氧核糖核酸的核苷酸序列为5
’‑
ch≡c-gcgggttggg-3’;末端修饰炔基的序列结构如下式(ⅲ)所示,式中oligo为核酸缩写;
[0052][0053]
所述铜离子荧光探针储备液的制备方法为:将菁染料mtc(3,3`-二(3-磺丙基)-4,5,4,5-2苯并-9-甲基-噻碳菁染料三乙胺盐)溶解于dmso中配制成浓度为5mm的铜离子荧光探针储备液,振荡混匀,离心1min;从5mm的铜离子荧光探针储备液中吸取10μl加入到90μl的超纯水中,配制成500μm的mtc荧光探针储备液,振荡混匀,离心1min后放置于冰箱冷藏,备用。菁染料mtc的结构式如下式(ⅰ)所示:
[0054][0055]
其中,r选自甲基。
[0056]
将抗坏血酸钠溶解于超纯水中配制成浓度为2mm的还原剂储备液,振荡混匀,离心1min后于冰箱冷藏,备用。
[0057]
将kcl溶解于超纯水中配制成浓度为2mol/l的k
缓冲溶液,振荡混匀,离心1min后放置于室温,备用。
[0058]
一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒的铜离子检测方法,包括以下步骤:
[0059]
1)将3’端修饰叠氮基团和5’端修饰炔基基团的脱氧核糖核酸储备液、抗坏血酸钠溶液以及待测样品溶液先后加入超纯水体系中,在室温下震荡2h;
[0060]
2)向震荡结束后的混合溶液中加入铜离子荧光探针储备液和k
缓冲溶液,震荡混匀后离心,避光静置等待20min;
[0061]
3)观察混合液的颜色变化,若待测样品溶液中含有cu
2
,被修饰的两条核酸序列连
接成一条新的1,2,3-三唑偶联核酸序列,此时溶液呈蓝色;若待测样品溶液中无cu
2
,被炔基修饰的核酸序列形成g-四链体,此时溶液呈粉色;
[0062]
4)将上述混合液转移到酶标板中,使用酶标仪或紫外分光光度计测量混合溶液在580nm和650nm的吸收值,对cu
2
的含量进行定量分析。
[0063]
下面对本实施例一制备的铜离子检测试剂盒进行功能性验证:
[0064]
将硫酸铜溶解于超纯水中配制成浓度为5mm的铜离子标准溶液,振荡混匀,离心1min后放置于室温,用水稀释成浓度为500μm、600μm、625μm、1mm的铜离子标准溶液,备用。
[0065]
(1)菁染料荧光探针分子对铜离子的响应实验
[0066]
取出2个无菌的1.5ml ep管,将其分成含铜离子和不含铜离子的两组后分别向其中依次加70μl和59μl的超纯水,然后再向其中分别加入10μl的100μm脱氧核糖核酸(5
’‑
gtgggtagg-n=n=n-3’和5
’‑
ch≡c-gcgggttggg-3’)储备液,振荡混匀,离心1min后再加入0μl和12μl 600μm的铜离子溶液以及5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将2个样品放置于室温下振荡2h;振荡结束后向2个样品中加入2μl 500μm的mtc荧光探针储备液和5μl 2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后用酶标仪或紫外分光光度计测定其紫外吸收光度,实验结果如图2所示。从图中可以看出,紫外吸收光度在650nm和580nm的变化非常明显,说明该试剂盒对铜离子有很好的响应。
[0067]
(2)菁染料荧光探针分子对不同浓度铜离子响应变化趋势
[0068]
取9个无菌的1.5ml ep管,向其中依次加入69μl、50μl、44μl、41μl、40μl、59μl、56.5μl、54μl、49μl的超纯水后,再分别加入10μl 100μm脱氧核糖核酸(5
’‑
gtgggtagg-n=n=n-3’和5
’‑
ch≡c-gcgggttggg-3’)储备液,振荡混匀后离心1min;将0μl 500μm、9μl 500μm、25μl 500μm、28μl 500μm、29.6μl 625μm、10μl 5mm、12.5μl 5mm、15μl 5mm、20μl 5mm铜离子标准溶液依次加到9个ep管中,再向9个ep管中分别加入5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将9个样品放置于室温下振荡2h;然后均加入2μl 500μm的mtc荧光探针储备液和5μl 2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后用酶标仪或紫外分光光度计测定其紫外吸收光度,实验结果如图3所示。从图中可以看出,580nm吸光度与650nm的吸光度在铜离子浓度0-400μm具有很好的转化趋势。
[0069]
(3)菁染料荧光探针分子对不同浓度铜离子的可视化实验
[0070]
取2个无菌的1.5ml ep管,然后向其中依次加入74μl、57μl的超纯水后,再分别加入10μl 100μm两管脱氧核糖核酸储备液,振荡混匀后离心1min;将0μl 5mm、12μl 5mm铜离子标准溶液依次加到2个ep管中,再向2个ep管中分别加入5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将2个样品放置于室温下振荡2h;然后均加入2μl 500μm的mtc荧光探针储备液和5μl 2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后直接观察其颜色变化实验结果如图4所示。从图4中可以看出,没有加入铜离子标准液的为粉色,加入铜离子标准液后体系颜色由粉色转变成蓝色。这说明此试剂盒操作简单,结果明显,能够达到快速检测铜离子的目的。
[0071]
实施例二
[0072]
一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒,包括3’端修饰叠氮基团(5'-gggtgggt-n=n=n-3’)和5’端修饰炔基基团(5
’‑
ch≡c-gggtgggt-3')的脱氧核糖核酸储备液、2mm的抗坏血酸钠溶液、5mm的etc铜离子荧光探针储备液和2mol/l
2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后用酶标仪或紫外分光光度计测定其紫外吸收光度,实验结果如图6所示。从图中可以看出,580nm吸光度与650nm的吸光度在铜离子浓度0-600μm具有很好的转化趋势。
[0084]
(3)菁染料荧光探针分子对不同浓度铜离子的可视化实验
[0085]
取2个无菌的1.5ml ep管,然后向其中依次加入74μl、57μl的超纯水后,再分别加入10μl 100μm两管脱氧核糖核酸储备液,振荡混匀后离心1min;将0μl 5mm、12μl 5mm铜离子标准溶液依次加到2个ep管中,再向2个ep管中分别加入5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将2个样品放置于室温下振荡2h;然后均加入2μl 500μm的etc荧光探针储备液和5μl 2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后直接观察其颜色变化实验结果如图7所示。从图中能够看出,没有加入铜离子标准液的为粉色,加入铜离子标准液后体系颜色由粉色转变成蓝色。这说明此试剂盒操作简单,结果明显,能够达到快速检测铜离子的目的。
[0086]
实施例三
[0087]
一种基于菁染料聚集体转变和click反应的可视化铜离子检测试剂盒,包括3’端修饰叠氮基团(5
’‑
gggtagg-n=n=n-3’)和5’端修饰炔基基团(5
’‑
ch≡c-gcgggttggg-3’)的脱氧核糖核酸储备液、2mm的抗坏血酸钠溶液、5mm的mtc铜离子荧光探针储备液和2mol/l的kcl溶液;
[0088]
所述3’端修饰叠氮基团和5’端修饰炔基基团的脱氧核糖核酸储备液的制备方法、铜离子荧光探针储备液的制备方法、抗坏血酸钠溶液和kcl溶液的配制过程均同实施例一。
[0089]
本实施例的铜离子检测方法、铜离子标准溶液的配制方法均同实施例一。
[0090]
下面对本实施例三制备的铜离子检测试剂盒进行功能性验证:
[0091]
(1)菁染料荧光探针分子对铜离子的响应实验
[0092]
取出2个无菌的1.5ml ep管,将其分成含铜离子和不含铜离子的两组后分别向其中依次加70μl和59μl的超纯水,然后再向其中分别加入10μl的100μm脱氧核糖核酸(5
’‑
gggtagg-n=n=n-3’和5
’‑
ch≡c-gcgggttggg-3’)储备液,振荡混匀,离心1min后再加入0μl和12μl 600μm的铜离子溶液以及5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将2个样品放置于室温下振荡2h;振荡结束后向2个样品中加入2μl 500μm的mtc荧光探针储备液和5μl 2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后用酶标仪或紫外分光光度计测定其紫外吸收光度,实验结果如图8所示。从图中可以看出,紫外吸收光度在650nm和580nm的变化非常明显,说明该试剂盒对铜离子有很好的响应。
[0093]
(2)菁染料荧光探针分子对不同浓度铜离子响应变化趋势
[0094]
取7个无菌的1.5ml ep管,向其中依次加入69μl、59μl、56μl、54.5μl、61μl、54μl、57μl的超纯水后,再分别加入10μl 100μm脱氧核糖核酸(5
’‑
gggtagg-n=n=n-3’和5
’‑
ch≡c-gcgggttggg-3’)储备液,振荡混匀后离心1min;将0μl 500μm、10μl 1mm、13μl 1mm、14.5μl 1mm、8μl 2mm、15μl 2mm、12μl 5mm铜离子标准溶液依次加到7个ep管中,再向7个ep管中分别加入5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将7个样品放置于室温下振荡2h;然后均加入2μl 500μm的mtc荧光探针储备液和5μl2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后用酶标仪或紫外分光光度计测定其紫外吸收光度,实验结果如图9所示。从图中可以看出,580nm吸光度与650nm的吸光度在铜离子浓度0-600μ
m具有很好的转化趋势。
[0095]
(3)菁染料荧光探针分子对不同浓度铜离子的可视化实验
[0096]
取2个无菌的1.5ml ep管,然后向其中依次加入74μl、57μl的超纯水后,再分别加入10μl 100μm两管脱氧核糖核酸储备液,振荡混匀后离心1min;将0μl 5mm、12μl 5mm铜离子标准溶液依次加到2个ep管中,再向2个ep管中分别加入5μl 2mm的抗坏血酸钠溶液,振荡混匀,离心1min后将2个样品放置于室温下振荡2h;然后均加入2μl 500μm的mtc荧光探针储备液和5μl 2mol/l的k
缓冲溶液,振荡混匀,离心1min,室温下避光静置20min后直接观察其颜色变化实验结果如图10所示。从图中能够看出,没有加入铜离子标准液的为粉色,加入铜离子标准液后体系颜色由粉色转变成蓝色。这说明此试剂盒操作简单,结果明显,能够达到快速检测铜离子的目的。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
