1.本发明涉及一种蛋白含量的测定方法,尤其是涉及一种测定乳清粉中真蛋白含量的方法。
背景技术:
2.乳清粉是利用制造干酪或干酪素的副产品乳清为原料干燥制成的。正常的乳清粉其色泽呈现为白色至浅黄色,有奶香味。乳清是乳制品企业利用牛奶生产干酪时所得的一种天然副产品,它是液态的,将乳清直接烘干后就得到了乳清粉,乳清粉中的乳清蛋白极低,一般为百分之十几,不超过百分之三十。
3.蛋白质的含量是评价饲料、乳制品营养价值的主要指标之一,是饲料、乳制品质量的关键控制因素,目前评判蛋白质通常是采用国家标准方法凯氏定氮法(t/naia 060-2021),通过测定饲料、乳制品中的总氮含量计算而得到的蛋白质含量。
4.中国专利cn112924448a公开了一种利用盐析法检测真蛋白含量的测定方法及其应用,包括:1)称取样品置于容器中,加适量水,加热至沸腾后转为80℃水浴30min;2)从水浴中取出后即刻缓慢加入氢氧化钠,再加入硫酸铜,静置陈化得试液;3)将静置后的试液过滤,洗涤沉淀物数次;4)将沉淀物和滤纸充分干燥后,放入定氮消化管内先加入15ml硫酸,静置,缓慢加热预消解后取下冷却,然后再次加入硫酸、无水硫酸钠、硫酸铜加热到420℃消解至澄清,获得待测试样;5)将上述待测试样用凯氏定氮法进行氮的测定,即得出样品中真蛋白含量。该专利仍然为采用凯氏定氮法进行测量,但是凯氏定氮法存在试剂消耗量多、操作繁琐、再现性差的缺陷,并且采用氢氧化钠和硫酸等强腐蚀性试剂,实验安全性较差,且对检测设备的要求也较高。
技术实现要素:
5.本发明的目的就是为了解决上述问题至少其一而提供一种测定乳清粉中真蛋白含量的方法,通过加入过量的三氯乙酸溶液使试样中的蛋白质沉淀下来,进而用水洗去多余的三氯乙酸,烘干,得到蛋白质沉淀的质量,从而计算出真蛋白含量,实现了真蛋白含量的快速、准确的测定,且稳定性良好,可用于批量化检测乳清粉中真蛋白含量是否达标。
6.本发明的目的通过以下技术方案实现:
7.一种测定乳清粉中真蛋白含量的方法,包括如下步骤:
8.s1:称取试样(质量记为m)并置于水中充分搅拌溶解,得到溶有待测试样的溶液;
9.s2:向步骤s1得到的溶有待测试样的溶液中加入三氯乙酸溶液,混合均匀后静置,随后离心得到沉淀物;
10.s3:将步骤s2得到的沉淀物抽滤并冲洗若干次,直至冲洗液中无氯离子后,将沉淀物干燥并冷却至室温,随后称重(质量即为m1)并计算待测试样中真蛋白含量。
11.优选地,步骤s1中试样与水的比例为10g:90ml,保证试样完全溶解。此处选择稀释9倍可以有效提高含量测定的准确性,如果稀释倍数太低,会导致乳清粉在溶于水中时成团
且溶液较黏稠,这两种情况均会使得真蛋白不易沉淀,进而导致最终的测定结果不准确;稀释倍数太高,乳清粉溶于大量水中会使得真蛋白的浓度太低,在后续步骤的进行中,真蛋白不易析出,也会导致最终的测定结果不准确。
12.优选地,步骤s1中溶解试样的水为45-60℃的温水,加速溶解并保证溶解完全。
13.优选地,步骤s2中加入的三氯乙酸溶液:溶有待测试样的溶液的体积比为2-5:1,使三氯乙酸过量,保证所有蛋白质完全变性。三氯乙酸溶液加入量需要大于2:1,以保证所有蛋白质完全变性,优选加入量为2:1,可以减少试剂的消耗量,进一步提升本发明检测方法的经济性。
14.优选地,所述的三氯乙酸溶液为150-200g/l的的三氯乙酸溶液,该三氯乙酸溶液通过如下步骤进行配置:称取15-20g三氯乙酸,加水溶解并稀释至100ml,混匀。
15.优选地,步骤s2中静置的时间为20-30min。通过静置20-30min可以使三氯乙酸与真蛋白充分混合并发生反应,使溶液中所有的蛋白质均发生变性,暴露出多的疏水基团,达到聚集沉淀的效果。如果静置时间少于20min,则会存在部分蛋白质未发生反应或未完全发生反应,导致最终的测定结果有较大的偏差。
16.优选地,步骤s2中离心的转速为8000-10000r/min,离心时间为5-10min。离心转速过低或离心时间过短会使得沉淀物无法完全得到分离,会影响后续准确数值的计算,而离心转速过高则会引起安全问题以及对设备的要求也会有所提高,离心时间过长会降低整体的检测效率,不适宜批量化检测。
17.优选地,步骤s3中抽滤并冲洗若干次为先用45-60℃的温水将离心后的上清液及沉淀物无损转移至砂芯坩埚中进行抽滤,然后在砂芯坩埚中用45-60℃的温水多次洗涤沉淀物并抽滤。
18.优选地,所述的砂芯坩埚的滤板孔径为5-15μm。砂芯坩埚用于滤除细颗粒沉淀,当孔径大于15μm时,无法通过抽滤分离沉淀和上清液,使得实验无法继续进行;当孔径小于5μm时,抽滤阻力过大,会大幅降低抽滤速度,增加抽滤时间,进而降低实验效率。
19.优选地,所述的砂芯坩埚预先在103
±
2℃下恒重,质量记为m0,以得到准确的砂性坩埚的质量。
20.优选地,步骤s3中直至冲洗液中无氯离子为用10g/l的agno3溶液进行测定,具体步骤如下:取agno3溶液滴于表面皿中,再向表面皿中滴入滤液,在黑色背景下观察应无白色沉淀,说明三氯乙酸已完全除去,不会影响后续计算的准确性。该agno3溶液通过如下步骤配置得到:取0.1g agno3溶于10ml水中,贮于棕色瓶中
21.优选地,步骤s3中干燥并冷却至室温为在103
±
2℃干燥至恒重后,取出并置于干燥器中冷却至室温,防止沉淀物暴露在空气中吸水进而使得测量结果不准确。
22.优选地,步骤s3中通过如下公式进行计算:
[0023][0024]
其中,x为样品真蛋白含量,%(质量百分数);m1为干燥后坩埚和试样沉淀物恒重后的质量,g;m0为砂芯坩埚恒重后的质量,g;m为试样质量,g;9为稀释倍数,上述质量均需要通过精度为0.0001g的称重仪器进行测定,保证计算过程中的精度,以及最终结果的准确性。
[0025]
与现有技术相比,本发明具有以下有益效果:
[0026]
1、凯氏定氮法(参考文件t/naia 060-2021)通过硫酸铜沉淀法对蛋白质进行沉淀,原理是蛋白质在高浓度的金属离子作用下,因盐析作用会生产沉淀。在煮沸的样品中加入硫酸铜溶液,使得蛋白质发生沉淀,非蛋白氮在沸水中溶解,过滤后将二者分离的方式,以达到测定蛋白氮的目的。
[0027]
本发明通过三氯乙酸使蛋白质发生沉淀,原理是三氯乙酸作为蛋白质变性剂可使蛋白质构象发生改变,暴露出较多的疏水基团,使之聚集沉淀,而非蛋白氮易溶于水,用温水洗涤沉淀,将水溶性含氮物洗去,剩余沉淀经丙酮脱水,烘干,达到将非蛋白氮与真蛋白分离的目的。该方法较凯氏定氮法所采用的硫酸铜沉淀法准确度和稳定性更好,且可以规避凯氏定氮法中存在的试剂消耗量多、操作繁琐和再现性较差,采用了氢氧化钠、硫酸等强腐蚀性试剂,且需要加热至420℃,安全性较差等多方面的问题。
[0028]
2、凯氏定氮法(参考文件t/naia 060-2021)中所需试剂至少有6种,其中还涉及到浓硫酸(强腐蚀性)的使用,还需要配制和标定盐酸标准溶液,耗时长,步骤繁琐,并且其中涉及到的滴定过程的滴定终点易受主观影响,使得测定结果不准确。
[0029]
本发明中仅需2种试剂以及水即可完成真蛋白的检测,溶剂配制简单,耗时少,能够较大地节约试剂和时间成本,并且整个操作中基本不涉及人工判断,使得结果更为准确,可以在保障实验人员身心健康同时还避免主观判断引起的误差。
[0030]
3、凯氏定氮法(参考文件t/naia 060-2021)中涉及到消化、蒸馏、滴定等多个步骤,耗时时间长,操作繁琐。
[0031]
本发明中仅需将试样中的蛋白质沉淀后,清洗、烘干沉淀,即可计算出其中真蛋白含量,既简单快捷,又方便操作,省时省力,适合批量化处理。
[0032]
4、凯氏定氮法(参考文件t/naia 060-2021)中需进行滴定步骤,容易因操作人员不同而产生主观误差,再现性较差。
[0033]
本发明的恒重结果容易判断,人为误差较小,测定结果一致性、稳定性好,再现性高,适于真蛋白含量的测定。通过重量法进行蛋白质含量的测定,有效减少了人为因素造成的误差,通过高精度的数据进行计算,大幅提升结果的准确度。可用于批量化检测乳清粉中真蛋白含量是否达标。
具体实施方式
[0034]
下面结合具体实施例对本发明进行详细说明,但绝不是对本发明的限制。
[0035]
以下实施例中:
[0036]
水为实验室用水,符合gb/t 6682中一级用水规格;三氯乙酸溶液为150-200g/l,其中实施例1和4为150g/l三氯乙酸溶液,实施例2和5为200g/l三氯乙酸溶液,实施例3和6为175g/l三氯乙酸溶液,通过如下步骤配置得到:称取15-20g三氯乙酸,加水溶解并稀释至100ml,混匀;agno3溶液为10g/l,通过如下步骤配置得到:取0.1g agno3溶于10ml水中,贮于棕色瓶中;上述使用的试剂除特殊规定外均为分析纯。
[0037]
实施例1
[0038]
本实施例中选用市售的1#高蛋白乳清粉作为试样,样品编号记为1,测定步骤如下:s1:准确称取试样10g,精确至0.0001g,记为m,置于250ml烧杯中,加入90ml温水(60℃,
用于加快溶解速度),搅拌溶解后冷却至室温,吸取10ml于50ml离心管中;s2:量取20ml三氯乙酸溶液,加入上述盛有试样的离心管中,盖紧并摇匀;s3:静置沉淀30min;s4:于8000r/min下离心10min;s5:沉淀物用预先在103℃恒重的玻璃砂坩埚(恒重后质量为m0)抽滤,先用60℃温水将离心管中的上清液及沉淀物无损转移至玻璃砂坩埚(滤板孔径为5μm),然后用温水少量多次洗涤烧杯和沉淀物,直至滤液无氯离子(用agno3溶液检验无沉淀:取agno3溶液滴于表面皿中,滴入滤液,在黑色背景下观察应无白色沉淀);s6:将盛有沉淀物的玻璃砂坩埚置于电热干燥箱中,于103℃烘至恒重,取出,置于干燥器中冷却至室温,称重,记录m1。
[0039]
重复上述步骤进行二次测定,并根据公式进行计算,计算结果见表1。
[0040]
实施例2
[0041]
本实施例中选用市售的2#高蛋白乳清粉作为试样,样品编号记为2,测定步骤如下:s1:准确称取试样10g,精确至0.0001g,记为m,置于250ml烧杯中,加入90ml温水(45℃,用于加快溶解速度),搅拌溶解后冷却至室温,吸取10ml于50ml离心管中;s2:量取50ml三氯乙酸溶液,加入上述盛有试样的离心管中,盖紧并摇匀;s3:静置沉淀20min;s4:于10000r/min下离心5min;s5:沉淀物用预先在105℃恒重的玻璃砂坩埚(恒重后质量为m0)抽滤,先用45℃温水将离心管中的上清液及沉淀物无损转移至玻璃砂坩埚(滤板孔径为10μm),然后用温水少量多次洗涤烧杯和沉淀物,直至滤液无氯离子(用agno3溶液检验无沉淀:取agno3溶液滴于表面皿中,滴入滤液,在黑色背景下观察应无白色沉淀);s6:将盛有沉淀物的玻璃砂坩埚置于电热干燥箱中,于105℃烘至恒重,取出,置于干燥器中冷却至室温,称重,记录m1。
[0042]
重复上述步骤进行二次测定,并根据公式进行计算,计算结果见表1。
[0043]
实施例3
[0044]
本实施例中选用市售的3#高蛋白乳清粉作为试样,样品编号记为3,测定步骤如下:s1:准确称取试样20g,精确至0.0001g,记为m,置于500ml烧杯中,加入180ml温水(55℃,用于加快溶解速度),搅拌溶解后冷却至室温,吸取5ml于50ml离心管中;s2:量取20ml三氯乙酸溶液,加入上述盛有试样的离心管中,盖紧并摇匀;s3:静置沉淀25min;s4:于9000r/min下离心8min;s5:沉淀物用预先在101℃恒重的玻璃砂坩埚(恒重后质量为m0)抽滤,先用55℃温水将离心管中的上清液及沉淀物无损转移至玻璃砂坩埚(滤板孔径为15μm),然后用温水少量多次洗涤烧杯和沉淀物,直至滤液无氯离子(用agno3溶液检验无沉淀:取agno3溶液滴于表面皿中,滴入滤液,在黑色背景下观察应无白色沉淀);s6:将盛有沉淀物的玻璃砂坩埚置于电热干燥箱中,于101℃烘至恒重,取出,置于干燥器中冷却至室温,称重,记录m1。
[0045]
重复上述步骤进行二次测定,并根据公式进行计算,计算结果见表1。
[0046]
实施例4
[0047]
本实施例中选用市售的1#低蛋白乳清粉作为试样,样品编号记为4,测定步骤如
下:s1:准确称取试样10g,精确至0.0001g,记为m,置于250ml烧杯中,加入90ml温水(50℃,用于加快溶解速度),搅拌溶解后冷却至室温,吸取10ml于50ml离心管中;s2:量取20ml三氯乙酸溶液,加入上述盛有试样的离心管中,盖紧并摇匀;s3:静置沉淀22min;s4:于9500r/min下离心7min;s5:沉淀物用预先在103℃恒重的玻璃砂坩埚(恒重后质量为m0)抽滤,先用50℃温水将离心管中的上清液及沉淀物无损转移至玻璃砂坩埚(滤板孔径为8μm),然后用温水少量多次洗涤烧杯和沉淀物,直至滤液无氯离子(用agno3溶液检验无沉淀:取agno3溶液滴于表面皿中,滴入滤液,在黑色背景下观察应无白色沉淀);s6:将盛有沉淀物的玻璃砂坩埚置于电热干燥箱中,于103℃烘至恒重,取出,置于干燥器中冷却至室温,称重,记录m1。
[0048]
重复上述步骤进行二次测定,并根据公式进行计算,计算结果见表1。
[0049]
实施例5
[0050]
本实施例中选用市售的2#低蛋白乳清粉作为试样,样品编号记为5,测定步骤如下:s1:准确称取试样20g,精确至0.0001g,记为m,置于500ml烧杯中,加入180ml温水(60℃,用于加快溶解速度),搅拌溶解后冷却至室温,吸取10ml于50ml离心管中;s2:量取30ml三氯乙酸溶液,加入上述盛有试样的离心管中,盖紧并摇匀;s3:静置沉淀28min;s4:于8500r/min下离心8min;s5:沉淀物用预先在103℃恒重的玻璃砂坩埚(恒重后质量为m0)抽滤,先用60℃温水将离心管中的上清液及沉淀物无损转移至玻璃砂坩埚(滤板孔径为12μm),然后用温水少量多次洗涤烧杯和沉淀物,直至滤液无氯离子(用agno3溶液检验无沉淀:取agno3溶液滴于表面皿中,滴入滤液,在黑色背景下观察应无白色沉淀);s6:将盛有沉淀物的玻璃砂坩埚置于电热干燥箱中,于103℃烘至恒重,取出,置于干燥器中冷却至室温,称重,记录m1。
[0051]
重复上述步骤进行二次测定,并根据公式进行计算,计算结果见表1。
[0052]
实施例6
[0053]
本实施例中选用市售的3#低蛋白乳清粉作为试样,样品编号记为6,测定步骤如下:s1:准确称取试样20g,精确至0.0001g,记为m,置于500ml烧杯中,加入180ml温水(60℃,用于加快溶解速度),搅拌溶解后冷却至室温,吸取20ml于50ml离心管中;s2:量取100ml三氯乙酸溶液,加入上述盛有试样的离心管中,盖紧并摇匀;s3:静置沉淀22min;s4:于10000r/min下离心10min;s5:沉淀物用预先在105℃恒重的玻璃砂坩埚(恒重后质量为m0)抽滤,先用60℃温水将离心管中的上清液及沉淀物无损转移至玻璃砂坩埚(滤板孔径为15μm),然后用温水少量多次洗涤烧杯和沉淀物,直至滤液无氯离子(用agno3溶液检验无沉淀:取agno3溶液滴于表面皿中,滴入滤液,在黑色背景下观察应无白色沉淀);s6:将盛有沉淀物的玻璃砂坩埚置于电热干燥箱中,于105℃烘至恒重,取出,置于干燥器中冷却至室温,称重,记录m1。
[0054]
重复上述步骤进行二次测定,并根据公式进行计算,计算结果见表1。
[0055]
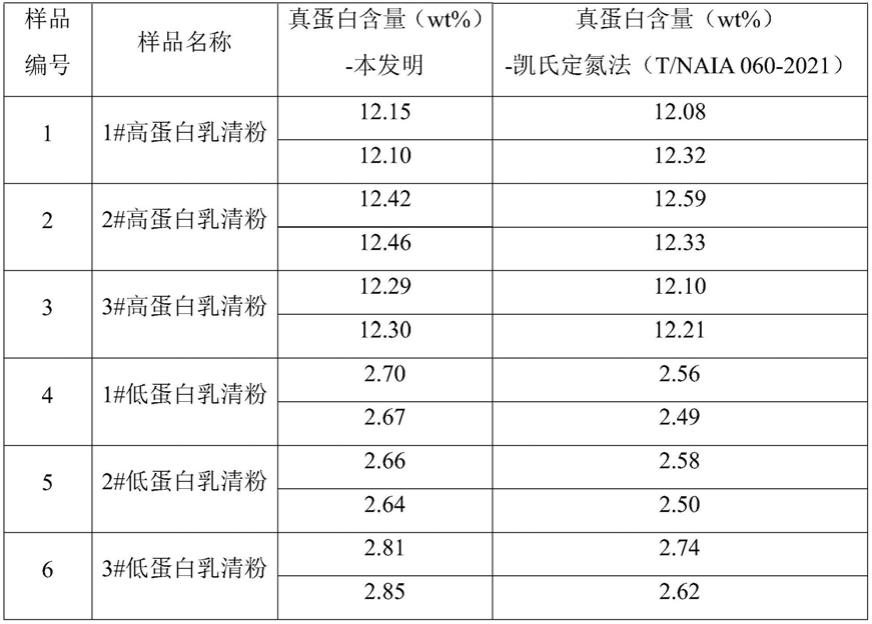
表1实施例1-6(样品1-6)的真蛋白含量检测结果
[0056][0057]
由上表可见,本发明的检测方法与国家标准方法凯氏定氮法(t/naia060-2021)得到的结果基本一致,说明本方法的准确性高,此外,比较对同一样品进行的两次平行测定,也可发现两次测量结果的偏差较凯氏定氮法小,说明本方法的一致性好,可重复性高,适于批量化检测的应用。
[0058]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。