1.本公开涉及酶组合物、其制备方法以及所述酶组合物在酶促水解中的用途。
背景技术:
2.纤维素材料主要由纤维素构成,并且还可包含半纤维素和木质素。它提供了用于产生矿物燃料的替代能源的有吸引力的平台。该材料是可大量得的,并且可以转化为有价值的产物,例如糖或生物燃料(例如生物乙醇)。
3.从纤维素材料生产发酵产物是在本领域中已知的,并且通常包括预处理、水解、发酵和任选地回收发酵产物的步骤。
4.在可包含液化、预糖化和/或糖化步骤的水解期间,纤维素材料中存在的纤维素被纤维素分解酶部分地(通常为30%至95%,取决于酶活性和水解条件)转换为还原糖。水解通常在45℃至50℃的高温和非无菌条件下,在持续6小时至168小时的过程期间进行。
5.通常,由微生物(如酵母)将糖转换为有价值的发酵产物,例如乙醇。发酵在相同或不同容器中以单独的,优选厌氧的过程步骤进行。将发酵期间的温度调节至30℃至33℃,以适应微生物(通常是酵母)的生长和乙醇生产。在发酵过程期间,剩余的纤维素材料通过来自水解步骤的已经存在的酶转换为还原糖,同时产生了微生物生物质和乙醇。一旦纤维素材料被转换为可发酵的糖并且所有可发酵的糖被转换为乙醇、二氧化碳和微生物生物质,发酵就完成了。这可能要耗时长达6天。通常,水解和发酵的整个过程的时间量可长达13天。
6.在从纤维素材料生产发酵产物的整个过程中,酶的生产成本是主要的成本因素。因此,已经采取了几种方法来降低酶和酶组合物的成本,例如,增加由生产微生物产生的酶的量、通过诱变技术调节和构建新的和改进的酶,以及探索遗传多样性。
7.所有这些方法都没有充分提高酶促活性以克服在从纤维素材料生产发酵产物的整个过程中酶生产的高成本。这些方法的一个缺陷已经是一次只聚焦于一种酶,忽略了可能与其他纤维素分解酶的协同作用。
8.已经进行了一些尝试来开发酶组合物,以使纤维素材料的酶促水解最大化。例如,wo 2011/000949描述了篮状菌属(talaromyces)突变株,其产生可用于纤维素材料的酶促水解的特定酶组合物。
9.然而,这些尝试尚未成功开发出具有充分改善的纤维素生物质水解性能的酶组合物。
10.因此,尽管进行了大量的研究工作,仍然需要改进的酶组合物,所述改进的酶组合物降低涉及纤维素材料的水解和发酵的过程中的整体生产成本。
技术实现要素:
11.本公开的目的是提供一种改进的酶组合物、制备所述酶组合物的方法,以及所述酶组合物在从纤维素材料制备糖产物和/或发酵产物的方法中的用途。
具体实施方式
12.在整个说明书和所附权利要求书中,词语“包含(comprise)”和“包括(include)”以及诸如“包含(comprises/comprising)”和“包括(includes/including)”的变型将被包含性地解释。也就是说,在上下文允许的情况下,这些词语旨在传达可能包括未具体叙述的其他要素或整数。冠词“一(a/an)”在本文中用于指代一个(种)或多于一个(种)(即,一个(种)或至少一个(种))该冠词的语法对象。举例来说,“要素”可以表示一个要素或多于一个要素。
13.本公开涉及一种酶组合物,所述酶组合物包含β-葡糖苷酶、内切葡聚糖酶和纤维二糖水解酶i,其中(a)所述内切葡聚糖酶以小于所述酶组合物中的蛋白质总量的10%(w/w)的量存在,并且(b)所述内切葡聚糖酶以由r
eg
所定义的相对于所述内切葡聚糖酶和所述纤维二糖水解酶i的分数存在,其中r
eg
为0.32至0.01。
14.内切葡聚糖酶比率(r
eg
)被定义为酶组合物中内切葡聚糖酶的总重量除以酶组合物中内切葡聚糖酶的总重量和纤维二糖水解酶i的总重量,可通过下式计算:r
eg
=总eg/(总eg 总cbhi)。
15.在一个实施方式中,r
eg
为0.32至0.03。在一个实施方式中,r
eg
为0.31至0.05。在一个实施方式中,r
eg
为0.25至0.08。在一个实施方式中,r
eg
为0.20至0.10。
16.在一个实施方式中,所述内切葡聚糖酶以小于所述酶组合物中的蛋白质总量的10%(w/w)的量存在。这意味着所述酶组合物包含量为小于所述酶组合物中蛋白质总量的10%(w/w)的内切葡聚糖酶。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至小于10%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.9%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.8%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.7%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.6%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.5%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.4%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.3%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.2%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.1%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的0.5%(w/w)至9.0%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的2%(w/w)至9.0%(w/w)的量存在。在一个实施方式中,内切葡聚糖酶以所述酶组合物中蛋白质总量的3%(w/w)至8.0%(w/w)的量存在。
17.如本文所述,本发明的酶组合物包含β-葡糖苷酶、内切葡聚糖酶和纤维二糖水解酶i。应当理解的是,“β-葡糖苷酶”是指“至少一种β-葡糖苷酶”,“内切葡聚糖酶”是指“至少一种内切葡聚糖酶”,并且“纤维二糖水解酶i”是指“至少一种纤维二糖水解酶i”。因此,本公开的酶组合物可包含多于一种β-葡糖苷酶、多于一种内切葡聚糖酶和/或多于一种纤维二糖水解酶i。在存在几种内切葡聚糖酶和/或几种纤维二糖水解酶i的情况下,r
eg
是指酶组
合物中的所有内切葡聚糖酶的重量除以酶组合物中的内切葡聚糖酶和纤维二糖水解酶i的总重量。在酶组合物中有几种内切葡聚糖酶的情况下,内切葡聚糖酶以小于酶组合物中蛋白质总量的10%的量存在。
18.如本文中所用,内切葡聚糖酶是能够催化纤维素、地衣多糖(lichenin)或谷类β-d-葡聚糖中的1,4-β-d-糖苷键的内切水解的酶。它们属于ec 3.2.1.4,并且还可能够水解还含有1,3-键的β-d-葡聚糖中的1,4-键。内切葡聚糖酶还可以称为纤维素酶、微晶纤维素酶、β-1,4-内切葡聚糖水解酶、β-1,4-葡聚糖酶、羧甲基纤维素酶、纤维糊精酶、内切-1,4-β-d-葡聚糖酶、内切-1,4-β-d-葡聚糖水解酶或内切-1,4-β-葡聚糖酶。
19.在一个实施方式中,内切葡聚糖酶包含gh5内切葡聚糖酶和/或gh7内切葡聚糖酶。这意味着酶组合物中的内切葡聚糖酶中的至少一种是gh5内切葡聚糖酶或gh7内切葡聚糖酶。在酶组合物中存在更多的内切葡聚糖酶的情况下,这些内切葡聚糖酶可以是gh5内切葡聚糖酶、gh7内切葡聚糖酶,或gh5内切葡聚糖酶和gh7内切葡聚糖酶的组合。在一个优选的实施方式中,内切葡聚糖酶包含gh5内切葡聚糖酶。gh分类可以在cazy网站上找到。
20.在一个实施方式中,酶组合物包含来自以下的内切葡聚糖酶:木霉属(trichoderma),诸如里氏木霉(trichoderma reesei);曲霉属(aspergillus),例如棘孢曲霉(aspergillus aculeatus)、土曲霉(aspergillus terreus)或白曲霉(aspergillus kawachii);欧文氏菌属(erwinia),例如胡萝卜软腐欧文氏菌(erwinia carotovara);镰刀菌属(fusarium),例如尖孢镰刀菌(fusarium oxysporum);梭孢壳属(thielavia),例如太瑞斯梭孢壳(thielavia terrestris);腐质霉属(humicola),例如灰腐质霉高温变种(humicola grisea var.thermoidea)或特异腐质霉(humicola insolens);白丝菌属(melanocarpus),例如热白丝菌(melanocarpus albomyces);脉孢菌属(neurospora),例如粗糙脉孢菌(neurospora crassa);毁丝霉属(myceliophthora),例如嗜热毁丝霉(myceliophthora thermophila);枝鼻菌属(cladorrhinum),例如多生枝鼻菌(cladorrhinum foecundissimum);和/或金孢子菌属(chrysosporium),例如鲁克文金孢子菌(chrysosporium lucknowense)的菌株。在一个实施方式中,甚至可以使用细菌内切葡聚糖酶,包括但不限于解纤维热酸菌(acidothermus cellulolyticus)内切葡聚糖酶(参见wo 91/05039;wo 93/15186;us 5,275,944;wo 96/02551;us 5,536,655、wo 00/70031、wo 05/093050);嗜热裂孢菌(thermobifida fusca)内切葡聚糖酶iii(参见wo 05/093050);以及嗜热裂孢菌内切葡聚糖酶v(参见wo 05/093050)。
21.在一个实施方式中,内切葡聚糖酶是热稳定的内切葡聚糖酶。如本文所用的“热稳定的”内切葡聚糖酶是指当在10-30分钟之间测量活性时,内切葡聚糖酶的最适温度在45℃至90℃的范围内。热稳定的内切葡聚糖酶可以例如从嗜热或耐热真菌中分离出,或者可以由技术人员设计并人工合成。在一个实施方式中,热稳定的内切葡聚糖酶可以从嗜热或耐热的丝状真菌中分离出或获得,或者从非嗜热或非耐热真菌中分离出,但被发现是热稳定的。在一个实施方式中,热稳定的内切葡聚糖酶是真菌的。在一个实施方式中,热稳定的内切葡聚糖酶获自嗜热或耐热真菌。“嗜热真菌”是指在45℃或更高温度下生长的真菌。“耐热的”真菌是指在20℃或更高,最大接近55℃的温度下生长的真菌。
22.在一个实施方式中,热稳定的内切葡聚糖酶获自包括但不限于以下的真菌属:腐质霉属、根毛霉属(rhizomucor)、毁丝霉属、踝节菌属(rasamsonia)、篮状菌属、青霉菌属
(penicillium)、嗜热丝孢菌属(thermomyces)、嗜热子囊菌属(thermoascus)、曲霉属、柱顶孢霉属(scytalidium)、拟青霉属(paecilomyces)、毛壳菌属(chaetomium)、束梗孢属(stibella)、棒囊壳属(corynascus)、畸枝霉属(malbranchea)或梭孢壳属。这些属的优选物种包括但不限于灰腐质霉高温变种、绵毛状腐质霉、透明嗜热腐殖霉菌(humicola hyalothermophilia)、嗜热毁丝霉、黄褐毁丝霉(myceliophthora hinnulea)、丝衣霉状篮状菌(rasamsonia byssochlamydoides)、踝节菌属埃默森蓝状菌(rasamsonia emersonii)、嗜热赭褐白乔史密斯霉(rasamsonia argillacea)、嗜热象牙白篮状菌(rasamsonia eburnean)、rasamsonia brevistipitata、嗜热柱孢白乔史密斯霉(rasamsonia cylindrospora)、微小根毛霉(rhizomucor pusillus)、米黑根毛霉(rhizomucor miehei)、杆孢篮状菌(talaromyces bacillisporus)、嗜热篮状菌(talaromyces leycettanus)、嗜热踝节菌(talaromyces thermophilus)、埃默森篮状菌(talaromyces emersonii)、疏棉状嗜热丝孢菌(thermomyces lenuginosus)、星状嗜热丝孢菌(thermomyces stellatus)、坚脆嗜热子囊菌(thermoascus crustaceus)、嗜热栖热菌(thermoascus thermophilus)、橙色嗜热子囊菌(thermoascus aurantiacus)、埃默森青霉(penicillium emersonii)、柱状青霉(penicillium cylindrosporum)、土曲霉(aspergillus terreus)、烟曲霉菌(aspergillus fumigatus)、嗜热革节孢(scytalidium thermophilum)、依丝霉拟青霉(paecilomyces byssochlamydoides)、嗜热毛壳菌(chaetomium thermophilum)、chaetomium olivicolor、嗜热束梗孢(stibella thermophila)、瘤孢棒囊孢壳菌(corynascus sepedonium)、樟绒枝霉(malbranchea cinnamonmea)和太瑞斯梭孢壳。
23.在一个优选实施方式中,热稳定的内切葡聚糖酶获自踝节菌属、篮状菌属、嗜热子囊菌属或青霉菌属的真菌。
24.在一个优选实施方式中,内切葡聚糖酶选自(a)与seq id no:2的成熟多肽具有至少60%序列同一性的内切葡聚糖酶,(b)由与seq id no:1的成熟多肽编码序列具有至少60%序列同一性的多核苷酸编码的内切葡聚糖酶,和(c)具有内切葡聚糖酶活性的(a)或(b)的内切葡聚糖酶的片段。
25.seq id no:2的成熟多肽包含seq id no:2的氨基酸19至335。信号肽包含seq id no:2的氨基酸1至18。seq id no:1的成熟多肽编码序列包含seq id no:1的核苷酸55至1008。信号肽包含seq id no:1的核苷酸1至54。
26.在一个实施方式中,内切葡聚糖酶与seq id no:2的成熟多肽具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%的序列同一性。在一个实施方式中,内切葡聚糖酶包含seq id no:2的成熟多肽的氨基酸序列。在一个实施方式中,内切葡聚糖酶的氨基酸序列由seq id no:2的成熟多肽组成。
27.在一个实施方式中,内切葡聚糖酶由与seq id no:1的成熟多肽编码序列具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的多核苷酸编码。在一个实施方式中,内切葡聚
糖酶由包含seq id no:1的成熟多肽编码序列的多核苷酸编码。在一个实施方式中,内切葡聚糖酶由由seq id no:1组成的多核苷酸编码。
28.在一个实施方式中,内切葡聚糖酶是具有内切葡聚糖酶活性的(a)或(b)的内切葡聚糖酶(参见上文)的片段。内切葡聚糖酶活性可以如下测量。使用偶氮羧甲基纤维素(azo-cmc)作为底物,在62℃和ph 4.5下测定内切葡聚糖酶活性。azo-cmc的酶促水解导致低分子量的染色片段的释放,当向反应混合物中添加沉淀剂溶液时,这些片段保留在溶液中。离心去除不溶的高分子量材料,并且上清液的颜色是eg活性的量度。通过将2g azo-cmc粉末溶解在80ml热milliq水(
±
95℃)中,搅拌约20分钟以变得均质,来制备底物溶液。随后,添加5ml乙酸盐缓冲液(2m,ph 4.5),并用milliq水将底物溶液补足至100ml。沉淀溶液是通过将40g乙酸钠和4g乙酸锌二水合物溶解在150ml的milliq水中制成的。用4m hcl将ph调节至5.0,并用milliq水将最终溶液补足至200ml。在使用前,将20ml的该溶液与80ml的乙醇(96%)混合,从而得到最终沉淀溶液。与测定中介于0.15au与1.0au之间的最终吸收相对应,将酶样本基于重量在乙酸钠缓冲液(100mm,ph 4.5,含有
±
25μl triton x-100/l)中稀释。使用恒温混匀仪将底物溶液(200l)在2ml埃彭道夫管(eppendorf tube)中在62℃和800rpm下预热达10分钟。随后,添加200μl稀释的酶样本,并将反应混合物在62℃下孵育另外10分钟。通过添加1ml沉淀溶液终止反应。将反应混合物混合并在室温下平衡10分钟。在此之后,再次混合反应混合物,并在室温下以1000
×
g离心10分钟。使用水将分光光度计校准到零,在590nm处测量上清液的吸光度。空白是以与上文针对酶样本所述相同的方式制备的,只是不是添加稀释的酶样本,而是添加乙酸钠缓冲液(100mm,ph 4.5,含有
±
25μl triton x-100/l))。内切葡聚糖酶活性以每mg蛋白质的单位表示。一个eg单位被定义为导致在所述测定条件(ph 4.5,62℃,10分钟孵育)下在590nm处所测量的azo-cmc每秒增加1mau的酶量。
29.在一个实施方式中,如本文所述的酶组合物包含β-葡糖苷酶、内切葡聚糖酶和纤维二糖水解酶i,其中(a)所述内切葡聚糖酶以小于所述酶组合物中蛋白质总量的10%(w/w)的量存在,(b)所述内切葡聚糖酶以由r
eg
定义的相对于内切葡聚糖酶和纤维二糖水解酶i的分数存在,其中r
eg
为0.32至0.01,并且(c)所述纤维二糖水解酶i以由r
cbh1
定义的相对于纤维二糖水解酶i和β-葡糖苷酶(bg)的分数存在,其中r
cbh1
为0.70至0.99。
30.纤维二糖水解酶i比率(r
cbh1
)被定义为酶组合物中纤维二糖水解酶i的总重量除以酶组合物中纤维二糖水解酶i的总重量和β-葡糖苷酶的总重量,可通过下式计算:r
cbh1
=总cbhi/(总cbhi 总bg)。
31.在一个实施方式中,r
cbh1
为0.71至0.98。在一个实施方式中,r
cbh1
为0.72至0.97。在一个实施方式中,r
cbh1
为0.73至0.96。
32.如本文所述,本发明的酶组合物包含β-葡糖苷酶、内切葡聚糖酶和纤维二糖水解酶i。应当理解的是,“β-葡糖苷酶”是指“至少一种β-葡糖苷酶”,“内切葡聚糖酶”是指“至少一种内切葡聚糖酶”,并且“纤维二糖水解酶i”是指“至少一种纤维二糖水解酶i”。因此,本公开的酶组合物可包含多于一种β-葡糖苷酶、多于一种内切葡聚糖酶和/或多于一种纤维二糖水解酶i。在存在几种内切葡聚糖酶和/或几种纤维二糖水解酶i的情况下,r
eg
是指酶组合物中所有内切葡聚糖酶的重量除以酶组合物中所有纤维二糖水解酶i和所有内切葡聚糖酶的总重量。在存在几种β-葡糖苷酶和/或几种纤维二糖水解酶i的情况下,r
cbh1
是指酶组
合物中所有纤维二糖水解酶i的重量除以酶组合物中所有纤维二糖水解酶i和所有β-葡糖苷酶的总重量。
33.如本文所用,纤维二糖水解酶(ec 3.2.1.91)是能够催化纤维素或纤维四糖中的1,4-β-d-糖苷键水解,从而从链末端释放纤维二糖的任何多肽。该酶也可以称为纤维素酶1,4-β-纤维二糖糖苷酶(cellobiosidase)、1,4-β-纤维二糖水解酶、1,4-β-d-葡聚糖纤维二糖水解酶、微晶纤维素酶、外切-1,4-β-d-葡聚糖酶、外切纤维二糖水解酶或外切葡聚糖酶。
34.在一个实施方式中,酶组合物包含来自曲霉属,例如烟曲霉菌的纤维二糖水解酶i,例如在wo 2011/057140中的seq id no:6或wo 2014/130812中的seq id no:6中公开的cel7a cbhi,或例如在wo 2013/028928或wo 2015/081139中公开的cbhi;来自木霉属,例如里氏木霉的纤维二糖水解酶i;来自毛壳菌属,例如嗜热毛壳菌的纤维二糖水解酶i;来自篮状菌属,例如嗜热篮状菌的纤维二糖水解酶i(例如,如在wo 2015/187935或wo 2016/082771中公开的);或来自青霉菌属,例如埃默森青霉的纤维二糖水解酶i(例如,如在wo 2011/057140中公开的)。在一个优选的实施方式中,酶组合物包含来自踝节菌属,例如踝节菌属埃默森蓝状菌的纤维二糖水解酶i(参见wo 2010/122141)。
35.在一个实施方式中,纤维二糖水解酶i包含gh7纤维二糖水解酶i。
36.在一个优选实施方式中,纤维二糖水解酶i获自以下属的真菌:踝节菌属、篮状菌属、曲霉属、木霉属或青霉属。在一个优选实施方式中,纤维二糖水解酶i获自以下物种的真菌:踝节菌属埃默森蓝状菌、埃默森篮状菌、嗜热篮状菌、烟曲霉菌、里氏木霉或埃默森青霉。
37.在优选实施方式中,纤维二糖水解酶i选自由以下项组成的组:(a)与seq id no:4的成熟多肽具有至少60%序列同一性的纤维二糖水解酶i,(b)由与seq id no:3的成熟多肽编码序列具有至少60%序列同一性的多核苷酸编码的纤维二糖水解酶i,和(c)具有纤维二糖水解酶活性的(a)或(b)的纤维二糖水解酶i的片段。
38.seq id no:4的成熟多肽包含seq id no:4的氨基酸19至455。信号肽包含seq id no:4的氨基酸1至18。seq id no:3的成熟多肽编码序列包含seq id no:3的核苷酸55至1368。信号肽包含seq id no:3的核苷酸1至54。
39.在一个实施方式中,纤维二糖水解酶i选自由以下项组成的组:(a)与seq id no:4的成熟多肽具有至少60%序列同一性的纤维二糖水解酶i,(b)由与seq id no:5的成熟多肽编码序列具有至少60%序列同一性的多核苷酸编码的纤维二糖水解酶i,和(c)具有纤维二糖水解酶活性的(a)或(b)的纤维二糖水解酶i的片段。
40.seq id no:5的成熟多肽编码序列包含seq id no:5的核苷酸55至1368。信号肽包含seq id no:5的核苷酸1至54。
41.在一个实施方式中,纤维二糖水解酶i与seq id no:4的成熟多肽具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%的序列同一性。在一个实施方式中,纤维二糖水解酶i包含seq id no:4的成熟多肽的氨基酸序列。在一个实施方式中,纤维二糖水解酶i的氨基酸序列由seq id no:4的成熟多肽组成。
42.在一个实施方式中,纤维二糖水解酶i由与seq id no:3的成熟多肽编码序列具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的多核苷酸编码。在一个实施方式中,纤维二糖水解酶i由包含seq id no:3的成熟多肽编码序列的多核苷酸编码。在一个实施方式中,纤维二糖水解酶i由由seq id no:3组成的多核苷酸编码。
43.在一个实施方式中,纤维二糖水解酶i由与seq id no:5的成熟多肽编码序列具有至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少86%、至少87%、至少88%、至少89%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%序列同一性的多核苷酸编码。在一个实施方式中,纤维二糖水解酶i由包含seq id no:5的成熟多肽编码序列的多核苷酸编码。在一个实施方式中,纤维二糖水解酶i由由seq id no:5组成的多核苷酸编码。
44.在一个实施方式中,纤维二糖水解酶i是具有纤维二糖水解酶活性的(a)或(b)的纤维二糖水解酶i(参见上文)的片段。纤维二糖水解酶i活性可以如下测量。使用4-硝基苯基-β-d-纤维二糖苷作为底物,在62℃和ph 4.5下测定酶组合物中的纤维二糖水解酶i活性。4-硝基苯基-β-d-纤维二糖苷的酶促水解导致了对硝基苯酚的释放,对硝基苯酚的释放是cbhi活性的一种量度。制备3mm 4-硝基苯基-β-d-纤维二糖苷在100mm乙酸钠(ph 4.5)中的底物溶液。与测定中介于0.15au与1.0au之间的最终吸收相对应,将酶组合物样本基于重量在乙酸钠缓冲液(100mm,ph 4.5,含有
±
25μl triton x-100/l和10mm葡糖酸内酯)中稀释。将0.4ml底物溶液在62℃预热10分钟,在此之后添加0.4ml稀释的酶组合物样本。在62℃下孵育10分钟后,通过添加0.8ml的1m碳酸钠溶液终止反应。在剧烈混合后,用水将分光光度计校准到零,在405nm处测量吸光度。空白是以与上文针对酶样本所述相同的方式制备的,只是不是添加稀释的酶样本,而是添加乙酸钠缓冲液(100mm,ph 4.5,含有
±
25μl triton x-100/l))。如下制备对硝基苯酚校准线。制备在0.025-0.25mm范围内的稀释系列。将0.4ml的稀释系列与0.4ml的乙酸钠(100mm ph 4.5)和0.8ml的碳酸钠(1m)混合。用水作为空白测量,在405nm处测量校准混合物的吸收。使用本领域已知的标准计算方案,通过以下方式来计算对硝基苯酚的含量:绘制od
405
与具有已知浓度的对硝基苯酚校准样本的浓度的曲线,之后使用从校准线生成的方程式计算酶组合物样本的浓度。所释放的对硝基苯酚的量是cbhi活性的量度。
45.在一个实施方式中,酶组合物包含量为所述酶组合物中蛋白质总量的20%(w/w)至85%(w/w)的纤维二糖水解酶i。这意味着纤维二糖水解酶i以所述酶组合物中蛋白质总量的20%(w/w)至85%(w/w)的量存在。在一个实施方式中,纤维二糖水解酶i以所述酶组合物中蛋白质总量的21%(w/w)至80%(w/w)的量存在。在一个实施方式中,纤维二糖水解酶i以所述酶组合物中蛋白质总量的23%(w/w)至75%(w/w)的量存在。
46.在一个实施方式中,本公开的酶组合物可以进一步包含半纤维素酶。如本文所述,本公开的酶组合物优选包含半纤维素酶。应当理解的是,“半纤维素酶”是指“至少一种半纤维素酶”。因此,本发明的酶组合物可包含多于一种半纤维素酶。在一个实施方式中,半纤维素酶包含β-木糖苷酶和/或内切木聚糖酶。
47.如本文所用,β-木糖苷酶(ec 3.2.1.37)是能够催化1,4-β-d-木聚糖水解,以从非
no:5进行编号),或来自棘孢曲霉、黑曲霉(aspergillus niger)或白曲霉(aspergillus kawachi)的β-葡糖苷酶。在另一个实施方式中,β-葡糖苷酶来源于青霉属,例如在wo 2007/019442公开为seq id no:2的巴西青霉(penicillium brasilianum);或来源于木霉属,例如里氏木霉,例如在us 6,022,725、us 6,982,159、us 7,045,332、us 7,005,289、us 2006/0258554、us 2004/0102619中描述的里氏木霉。在一个实施方式中,甚至可以使用细菌β-葡糖苷酶。在另一个实施方式中,β-葡糖苷酶来源于太瑞斯梭孢壳(wo 2011/035029)或囊状长毛盘菌(wo 2007/019442)。在一个优选的实施方式中,酶组合物包含来自rasamsonia,诸如踝节菌属埃默森蓝状菌的β-葡糖苷酶(参见wo 2012/000886或wo 2012/000890)。
57.在一个实施方式中,如本文所述的酶组合物进一步包含裂解性多糖单加氧酶(lpmo)和/或纤维二糖水解酶ii(cbhii)。
58.如本文所用,裂解性多糖单加氧酶是最近被cazy分类为aa9家族(辅助活性家族9)或aa10家族(辅助活性家族10)的酶。因此,存在aa9裂解性多糖单加氧酶和aa10裂解性多糖单加氧酶。裂解性多糖单加氧酶能够打开结晶的葡聚糖结构,并增强纤维素酶对木质纤维素底物的作用。它们是具有纤维素分解增强活性的酶。裂解性多糖单加氧酶也可影响纤维寡糖。根据最新文献(参见isaksen等人,journal of biological chemistry,第289卷,第5期,第2632-2642页),名为gh61的蛋白质(糖苷水解酶家族61或有时称为egiv)是裂解性多糖单加氧酶。gh61最初基于一个家庭成员中非常弱的内切1,4-β-d-葡聚糖酶活性而被分类为内切葡聚糖酶,但最近被cazy重新分类为aa9家族。cbm33(家族33的碳水化合物结合模块)也是一种裂解性多糖单加氧酶(参见isaksen等人,journal of biological chemistry,第289卷,第5期,第2632-4642页)。cazy最近将cbm33重新分类为aa10家族。
59.在一个实施方式中,裂解性多糖单加氧酶包括aa9裂解性多糖单加氧酶。这意味着酶组合物中的裂解性多糖单加氧酶中的至少一种是aa9裂解性多糖单加氧酶。在一个实施方式中,酶组合物中的所有裂解性多糖单加氧酶均为aa9裂解性多糖单加氧酶。
60.在一个实施方式中,所述酶组合物包含来自嗜热子囊菌属(例如橙色嗜热子囊菌)的裂解性多糖单加氧酶,诸如在wo 2005/074656中描述为seq id no:2和在wo2014/130812及wo 2010/065830中描述为seq id no:1的裂解性多糖单加氧酶;或来自梭孢壳属(例如太瑞斯梭孢壳)的裂解性多糖单加氧酶,例如在wo 2005/074647中描述为seq id no:8或在wo2014/130812及wo 2008/148131以及wo 2011/035027中描述为seq id no:4的裂解性多糖单加氧酶;或来自曲霉属(例如烟曲霉菌)的裂解性多糖单加氧酶,例如在wo 2010/138754中描述为seq id no:2或在wo2014/130812中描述为seq id no:3的裂解性多糖单加氧酶;或来自青霉菌属(例如埃默森青霉)的裂解性多糖单加氧酶,诸如在wo 2011/041397中公开为seq id no:2或在wo2014/130812中公开为seq id no:2的裂解性多糖单加氧酶。其他合适的裂解性多糖单加氧酶包括但不限于里氏木霉(参见wo 2007/089290)、嗜热毁丝霉(参见wo 2009/085935、wo 2009/085859、wo 2009/085864、wo 2009/085868)、嗜松青霉((参见wo 2011/005867)、嗜热子囊菌属(参见wo 2011/039319)和甲壳嗜热子囊菌(thermoascus crustaceous)(参见wo 2011/041504)。可包含在酶组合物中的其他纤维素分解酶描述于wo 98/13465、wo 98/015619、wo 98/015633、wo 99/06574、wo 99/10481、wo 99/025847、wo 99/031255、wo 2002/101078、wo 2003/027306、wo 2003/052054、wo 2003/052055、wo 2003/052056、wo 2003/052057、wo 2003/052118、wo 2004/016760、wo 2004/
043980、wo 2004/048592、wo 2005/001065、wo 2005/028636、wo 2005/093050、wo 2005/093073、wo 2006/074005、wo 2006/117432、wo 2007/071818、wo 2007/071820、wo 2008/008070、wo 2008/008793、us 5,457,046、us 5,648,263,以及us 5,686,593(仅举几例)中。在一个优选的实施方式中,所述裂解性多糖单加氧酶来自踝节菌属,例如踝节菌属埃默森蓝状菌(参见wo 2012/000892)。
61.在一个实施方式中,所述酶组合物包含来自曲霉(例如烟曲霉)的纤维二糖水解酶ii,例如在wo 2014/130812中以seq id no:7所示的纤维二糖水解酶ii;或来自木霉属(例如里氏木霉)的纤维二糖水解酶ii;或来自篮状菌属(例如嗜热篮状菌)的纤维二糖水解酶ii;或来自梭孢壳属(例如太瑞斯梭孢壳)的纤维二糖水解酶ii,诸如来自太瑞斯梭孢壳的纤维二糖水解酶ii cel6a。在一个优选的实施方式中,酶组合物包含来自踝节菌属,例如踝节菌属埃默森蓝状菌的纤维二糖水解酶ii(参见wo 2011/098580)。
62.酶组合物优选包含至少两种活性,尽管通常组合物将包含多于两种活性,例如三种、四种、五种、六种、七种、八种、九种或甚至更多种活性。酶组合物可包含每个活性类别中的多于一种酶活性。酶组合物可包含一种类型的纤维素酶活性和/或半纤维素酶活性和/或果胶酶活性。
63.在一个实施方式中,酶组合物包含至少两种纤维素酶。如本文所用,纤维素酶是能够降解或修饰纤维素的任何多肽。该至少两种纤维素酶可以包含相同或不同的活性。所述酶组合物还可包含除纤维素酶以外的至少一种酶,例如半纤维素酶或果胶酶。如本文所用,半纤维素酶是能够降解或修饰半纤维素的任何多肽。如本文所用,果胶酶是能够降解或修饰果胶的任何多肽。该至少一种其他酶可具有辅助酶活性,即直接或间接导致木质纤维素降解的附加活性。此类辅助活性的示例在本文中提及。
64.在一个实施方式中,如本文所述的酶组合物包含一种、两种、三种、四种或更多种类别的纤维素酶,例如一种、两种、三种或四种或全部是裂解性多糖单加氧酶(lpmo)、内切葡聚糖酶(eg)、纤维二糖水解酶i(cbhi)、纤维二糖水解酶ii(cbhii)和β-葡糖苷酶(bg)。
65.在一个实施方式中,如本文所述的酶组合物包含裂解性多糖单加氧酶、内切葡聚糖酶、纤维二糖水解酶i、纤维二糖水解酶ii、β-葡糖苷酶、β-木聚糖酶和内切木聚糖酶。
66.在一个实施方式中,酶组合物还包含以下提及的酶中的一种或多种。
67.如本文所用,β-(1,3)(1,4)-葡聚糖酶(ec 3.2.1.73)是能够催化含有1,3-键和1,4-键的β-d-葡聚糖中的1,4-β-d-糖苷键水解的任何多肽。此类多肽可以作用于地衣多糖和谷类β-d-葡聚糖,但不作用于仅包含1,3-键或1,4-键的β-d-葡聚糖。该酶也可以称为地衣多糖酶(licheninase)、1,3-1,4-β-d-葡聚糖4-葡聚糖水解酶、β-葡聚糖酶、内切-β-1,3-1,4葡聚糖酶、地衣聚糖酶(lichenase)或混合键β-葡聚糖酶。这种酶的替代物是ec 3.2.1.6,被称为内切-1,3(4)-β-葡聚糖酶。当其还原基团参与要水解的键的葡萄糖残基本身在c-3处被取代时,这种酶会水解β-d-葡聚糖中的1,3-键或1,4-键。替代名称包括内切-1,3-β-葡聚糖酶、昆布多糖酶、1,3-(1,3;1,4)-β-d-葡聚糖3(4)葡聚糖水解酶。底物包括昆布多糖、地衣多糖和谷类β-d-葡聚糖。
68.如本文所用,α-l-阿拉伯呋喃糖苷酶(ec 3.2.1.55)是能够作用于α-l-阿拉伯呋喃糖苷、含有(1,2)-键和/或(1,3)-键和/或(1,5)-键的α-l-阿拉伯聚糖、阿拉伯糖基木聚糖和阿拉伯半乳聚糖。该酶也可以称为α-n-阿拉伯糖呋喃糖苷酶、阿拉伯呋喃糖苷酶或阿
拉伯糖苷酶。可包含在酶组合物中的阿拉伯呋喃糖苷酶的示例包括但不限于来自黑曲霉、特异腐质霉dsm 1800(参见wo 2006/114094和wo 2009/073383)和大型亚灰树花菌(m.giganteus)(参见wo 2006/114094)的阿拉伯糖呋喃糖苷酶。
69.如本文所用,α-d-葡糖醛酸糖苷酶(ec 3.2.1.139)是能够催化以下形式的反应的任何多肽:α-d-葡糖醛酸苷 h(2)o=醇 d-葡糖醛酸酯。该酶也可以称为α-葡糖醛酸酶或α-葡糖苷酸酶(alpha-glucosiduronase)。这些酶还可以水解4-o-甲基化的葡糖醛酸,所述4-o-甲基化的葡糖醛酸也可以作为取代基存在于木聚糖中。替代物是ec 3.2.1.131:木聚糖α-1,2-葡糖醛酸苷酶(glucuronosidase),其催化α-1,2-(4-o-甲基)葡糖醛酸基键的水解。可包含在酶组合物中的α-葡糖醛酸酶的示例包括但不限于来自棒曲霉(aspergillus clavatus)、烟曲霉菌、黑曲霉、土曲霉(aspergillus terreus)、特异腐质霉(参见wo 2010/014706)、黄灰青霉(penicillium aurantiogriseum)(参见wo 2009/068565)和里氏木霉的α-葡糖醛酸酶。
70.如本文所用,乙酰木聚糖酯酶(ec 3.1.1.72)是能够催化木聚糖和木糖寡糖的去乙酰化的任何多肽。此类多肽可以催化来自聚合的木聚糖、乙酰化的木糖、乙酰化的葡萄糖、乙酸α-萘酯或乙酸对硝基苯酯的乙酰基的水解,但是通常不催化来自三乙酰基甘油的乙酰基的水解。此类多肽通常不作用于乙酰化的甘露聚糖或果胶。可包含在酶组合物中的乙酰木聚糖酯酶的示例包括但不限于来自棘孢曲霉(参见wo 2010/108918)、球毛壳菌(chaetomium globosum)、细丽毛壳(chaetomium gracile)、特异腐质霉dsm 1800(参见wo 2009/073709)、红褐肉座菌(hypocrea jecorina)(参见wo 2005/001036)、嗜热毁丝霉(见wo 2010/014880)、颖枯壳针孢(phaeosphaeria nodorum)和太瑞斯梭孢壳nrrl 8126(参见wo 2009/042846)的乙酰木聚糖酯酶。在一个优选的实施方式中,酶组合物包含来自踝节菌属,例如踝节菌属埃默森蓝状菌的乙酰木聚糖酯酶(参见wo 2010/000888)。
71.如本文所用,阿魏酰酯酶(ec 3.1.1.73)是能够催化以下形式的反应的任何多肽:阿魏酰糖 h2o=阿魏酸酯 糖。糖可以是例如寡糖或多糖。阿魏酸酯酶通常可以催化来自酯化糖的4-羟基-3-甲氧基肉桂酰基(阿魏酰基)的水解,所述酯化糖通常是“天然”底物中的阿拉伯糖,对硝基苯酚乙酸酯和阿魏酸甲酯通常是较差的底物。该酶也可以称为肉桂酰基酯水解酶、阿魏酸酯酶或羟基肉桂酰基酯酶。它也可以称为半纤维素酶辅助酶,因为它可以帮助木聚糖酶和果胶酶分解植物细胞壁的半纤维素和果胶。可包含在酶组合物中的阿魏酰酯酶(阿魏酸酯酶)的示例包括但不限于:来自特异腐质霉dsm 1800(参见wo 2009/076122)、费氏新萨托菌(neosartorya fischeri)、粗糙脉孢菌(neurospora crassa)、黄灰青霉(参见wo 2009/127729)和太瑞斯梭孢壳(参见wo 2010/053838和wo 2010/065448)的阿魏酰酯酶。
72.如本文所用,香豆酰基酯酶(ec 3.1.1.73)是能够催化以下形式的反应的任何多肽:香豆酰基糖 h(2)o=香豆酸酯 糖。糖可以是例如寡糖或多糖。该酶也可以被称为反式-4-香豆酰基酯酶、反式-对香豆酰基酯酶、对香豆酰基酯酶或对香豆酸酯酶。该酶也落入ec 3.1.1.73之内,因此也可以称为阿魏酰酯酶。
73.如本文所用,α-半乳糖苷酶(ec 3.2.1.22)是能够催化α-d-半乳糖苷中的末端非还原α-d-半乳糖残基水解的任何多肽,所述α-d-半乳糖苷包括半乳糖低聚糖、半乳甘露聚糖、半乳聚糖和阿拉伯半乳聚糖。此类多肽也能够水解α-d-岩藻糖苷。该酶也可以称为蜜二
糖酶。
74.如本文所用,β-半乳糖苷酶(ec 3.2.1.23)是能够催化β-d-半乳糖苷中的末端非还原β-d-半乳糖残基水解的任何多肽。此类多肽也可能够水解α-l-阿拉伯糖苷。该酶也可以称为外切-(1-》4)-β-d-半乳聚糖酶或乳糖酶。
75.如本文所用,β-甘露聚糖酶(ec 3.2.1.78)是能够催化甘露聚糖、半乳甘露聚糖和葡甘露聚糖中的1,4-β-d-甘露糖苷键的随机水解的任何多肽。该酶也可以称为甘露聚糖内切-1,4-β-甘露糖苷酶或内切-1,4-甘露聚糖酶。
76.如本文所用,β-甘露糖苷酶(ec 3.2.1.25)是能够催化β-d-甘露糖苷中的末端非还原β-d-甘露糖残基水解的任何多肽。该酶也可以称为甘露聚糖酶(mannanase)或甘露糖酶(mannase)。
77.如本文所用,内切聚半乳糖醛酸酶(ec 3.2.1.15)是能够催化果胶酸酯和其他半乳糖醛酸聚糖(galacturonan)中的1,4-α-d-半乳糖醛酸键的随机水解的任何多肽。该酶也可以称为聚半乳糖醛酸酶果胶解聚酶、果胶酶(pectinase)、内切聚半乳糖醛酸酶、果胶酶(pectolase)、果胶水解酶、果胶聚半乳糖醛酸酶、聚-α-1,4-半乳糖醛酸苷聚糖水解酶、内切半乳糖醛酸酶;内切-d-半乳糖醛酸酶或聚(1,4-α-d-半乳糖醛酸苷)聚糖水解酶。
78.如本文所用,果胶甲基酯酶(ec 3.1.1.11)是能够催化以下反应的任何酶:果胶 n h2o=n甲醇 果胶酸酯。该酶也可以称为果胶酯酶、果胶脱甲氧基酶、果胶甲氧基酶、果胶甲基酯酶、果胶酶、果胶酯酶或果胶甲酯酶(pectin pectylhydrolase)。
79.如本文所用,内切半乳聚糖酶(ec 3.2.1.89)是能够催化阿拉伯半乳聚糖中的1,4-β-d-半乳糖苷键的内切水解的任何酶。该酶也可以被称为阿拉伯半乳聚糖内切-1,4-β-半乳糖苷酶、内切-1,4-β-半乳糖苷酶、半乳聚糖酶、阿拉伯半乳聚糖酶或阿拉伯半乳聚糖4-β-d-半乳聚糖水解酶。
80.如本文所用,果胶乙酰基酯酶在本文中定义为具有乙酰基酯酶活性的任何酶,该酶催化果胶的galua残基的羟基处的乙酰基的去乙酰化。
81.如本文所用,内切果胶裂解酶(ec 4.2.2.10)是能够催化(1
→
4)-α-d-半乳糖醛酸聚糖甲酯的清除性切割以产生在其非还原末端具有4-脱氧-6-o-甲基-α-d-半乳-4-糖醛酰基的寡糖的任何酶。该酶也称为果胶裂解酶、果胶反式消除酶(pectin trans-eliminase);内切果胶裂解酶、聚甲基半乳糖醛酸反式消除酶、果胶甲基反式消除酶、果胶裂解酶、pl、pnl或pmgl或(1
→
4)-6-o-甲基-α-d-d-半乳糖醛酸聚糖裂解酶。
82.如本文所用,果胶酸裂解酶(ec 4.2.2.2)是能够催化(1
→
4)-α-d-聚半乳糖醛酸聚糖的清除性切割以产生在其非还原末端具有4-脱氧-α-d-半乳糖-4-糖醛酰基的寡糖的任何酶。该酶也可以称为聚半乳糖醛酸反式消除酶、果胶酸反式消除酶、聚半乳糖醛酸酯裂解酶、内切果胶甲基反式消除酶、果胶酸酯反式消除酶、内切半乳糖醛酸反式消除酶、果胶酸裂解酶、果胶裂解酶、α-1,4-d-内切聚半乳糖醛酸裂解酶、pga裂解酶、ppase-n、内切-α-1,4-聚半乳糖醛酸裂解酶、聚半乳糖醛酸裂解酶、果胶反式消除酶、聚半乳糖醛酸反式消除酶或(1
→
4)-α-d-半乳糖醛酸聚糖裂解酶。
83.如本文所用,α鼠李糖苷酶(ec 3.2.1.40)是能够催化α-l-鼠李糖苷或替代地鼠李半乳糖醛酸聚糖中末端非还原α-l-鼠李糖残基水解的任何多肽。该酶也可以称为α-l-鼠李糖苷酶t、α-l-鼠李糖苷酶n或α-l-鼠李糖苷鼠李糖水解酶。
84.如本文所用,外切半乳糖醛酸酶(ec 3.2.1.82)是能够水解来自非还原末端的果胶,从而释放二半乳糖醛酸酯的任何多肽。该酶也可以称为外切-聚-α-半乳糖醛酸苷酶、外切聚半乳糖醛酸苷酶(exopolygalacturonosidase)或外切聚半乳糖苷酶(exopolygalacturanosidase)。
85.如本文所用,外切半乳糖醛酸酶(ec 3.2.1.67)是能够催化以下的任何多肽:(1,4-α-d-半乳糖醛酸苷)n h2o=(1,4-α-d-半乳糖醛酸)
n-1
d-半乳糖醛酸酯。该酶也可以称为半乳聚糖1,4-α-半乳糖醛酸酶、外切聚半乳糖醛酸酶、聚(半乳糖醛酸)水解酶、外切-d-半乳糖醛酸酶、外切-d-半乳糖醛酸酶、外切-d-半乳糖醛酸酶或聚(1,4-α-d-半乳糖醛酸)半乳糖醛酸水解酶。
86.如本文所用,外切半乳糖醛酸裂解酶(ec 4.2.2.9)是能够催化从果胶酸(即去酯化果胶)的还原末端清除性切割4-(4-脱氧-α-d-半乳糖-4-糖醛酰基)-d-半乳糖醛酸酯的任何多肽。该酶可被称为果胶二糖裂解酶、果胶外切裂解酶、外切果酸反式消除酶、外切果胶酸裂解酶、外切聚半乳糖醛酸反式消除酶、pate、外切-pate、外切-pgl或(1
→
4)-α-d-半乳糖醛酸聚糖还原末端-二糖裂解酶。
87.如本文所用,鼠李半乳糖醛酸聚糖水解酶是能够在由二糖[(1,2-α-l-鼠李糖酰-(1,4)-α-半乳糖醛酸]组成的严格交替鼠李半乳糖醛酸聚糖结构中以内切方式水解半乳糖醛糖醛酸与吡喃鼠李糖基之间的键的任何多肽。
[0088]
如本文所用,鼠李半乳糖醛酸聚糖裂解酶是能够通过β-消除在鼠李半乳糖醛酸聚糖中以内切方式切割α-rhap-(1
→
4)-α-d-galpa键的任何多肽。
[0089]
如本文所用,鼠李半乳糖醛酸聚糖乙酰酯酶是催化鼠李半乳糖醛酸聚糖中具有交替的鼠李糖和半乳糖醛酸残基的骨架的去乙酰化的任何多肽。
[0090]
如本文所用,鼠李半乳糖醛酸聚糖半乳糖酸酸水解酶是能够以外切方式从严格交替的鼠李半乳糖醛酸聚糖结构的非还原末端水解半乳糖醛酸的任何多肽。
[0091]
如本文所用,木糖基半乳糖醛酸酶是通过以内切方式切割β-木糖取代的半乳糖醛酸主链而作用于木糖聚半乳糖醛酸的任何多肽。该酶也可以称为木糖聚半乳糖醛酸水解酶。
[0092]
如本文所用,α-l-阿拉伯呋喃糖苷酶(ec 3.2.1.55)是能够作用于α-l-阿拉伯呋喃糖苷、含有(1,2)-键和/或(1,3)-键和/或(1,5)-键的α-l-阿拉伯聚糖、阿拉伯糖基木聚糖和阿拉伯半乳聚糖的任何多肽。该酶也可以称为α-n-阿拉伯糖呋喃糖苷酶、阿拉伯呋喃糖苷酶或阿拉伯糖苷酶。
[0093]
如本文所用,内切阿拉伯聚糖酶(ec 3.2.1.99)是能够催化1,5-阿拉伯聚糖中的1,5-α-阿拉伯呋喃糖苷键的内切水解的任何多肽。该酶也可以称为内切阿拉伯糖酶、阿拉伯聚糖内切-1,5-α-l-阿拉伯糖苷酶、内切-1,5-α-l-阿拉伯糖苷酶、内切-α-1,5-阿拉伯糖苷酶;内切阿拉伯糖苷酶或1,5-α-l-阿拉伯聚糖1,5-α-l-阿拉伯聚糖水解酶。
[0094]“蛋白酶”包括水解肽键的酶(肽酶),以及水解肽与其他部分(诸如糖)之间的键的酶(糖肽酶)。许多蛋白酶根据ec 3.4进行了表征,并且适合用于如本文所述的方法中。蛋白酶的一些特定类型包括半胱氨酸蛋白酶,包括胃蛋白酶、木瓜蛋白酶;以及丝氨酸蛋白酶,包括糜蛋白酶、羧肽酶和金属内肽酶。
[0095]“脂酶”包括水解脂质、脂肪酸和酰基甘油酯(包括磷酸甘油酯、脂蛋白、二酰基甘
油等)的酶。在植物中,脂质被用作限制水分流失和病原体感染的结构组分。这些脂质包括来源于脂肪酸的蜡,以及角质和软木脂。
[0096]“木质素酶”包括能够水解或破坏木质素聚合物结构的酶。能够分解木质素的酶包括木质素过氧化物酶、锰过氧化物酶、漆酶和阿魏酰酯酶,以及其他本领域所述的已知用于解聚或以其他方式破坏木质素聚合物的酶。还包括能够水解在半纤维素糖(特别是阿拉伯糖)与木质素之间形成的键的酶。木质素酶包括但不限于以下组的酶:木质素过氧化物酶(ec 1.11.1.14)、锰过氧化物酶(ec 1.11.1.13)、漆酶(ec 1.10.3.2)和阿魏酰酯酶(ec 3.1.1.73)。
[0097]“己糖基转移酶”(2.4.1-)包括能够催化转移酶反应,但也能催化例如纤维素和/或纤维素降解产物的水解反应的酶。可以使用的己糖基转移酶的示例是β-葡聚糖基转移酶。此类酶可能够催化(1,3)(1,4)葡聚糖和/或纤维素和/或纤维素降解产物的降解。
[0098]“葡糖醛酸酶”包括催化葡糖醛酸苷(例如β-葡糖醛酸苷)的水解以产生醇的酶。许多葡糖醛酸酶已经被表征并且可适于使用,例如β-葡糖醛酸酶(ec 3.2.1.31)、透明质酸-葡糖醛酸酶(ec 3.2.1.36)、葡糖醛酸基-二硫葡糖胺葡糖醛酸酶(3.2.1.56)、甘草酸β-葡糖醛酸基(3.2.1.128)或α-d-葡糖醛酸酶(ec 3.2.1.139)。
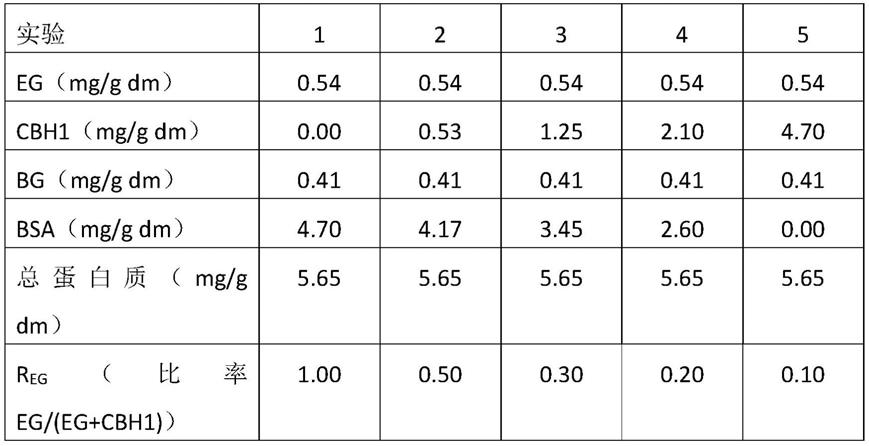
[0099]
扩展蛋白参与植物细胞生长期间细胞壁结构的松弛。已经提出扩展蛋白破坏纤维素与其他细胞壁多糖之间的氢键,但不具有水解活性。认为它们通过这种方式允许纤维素纤维的滑动和细胞壁的扩大。一种扩展蛋白样蛋白质膨胀因子(swollenin)含有n端碳水化合物结合模块家族1结构域(cbd)和c端扩展蛋白样结构域。如本文所述,扩展蛋白样蛋白或膨胀因子样蛋白可包含此类结构域中的一者或两者和/或可破坏细胞壁的结构(例如破坏纤维素结构),任选地不产生可检测量的还原糖。
[0100]
纤维素诱导的蛋白质,例如cip1或cip2基因或类似基因的多肽产物(参见foreman等人,j.biol.chem.278(34),31988-31997,2003);纤维素/纤维素整合蛋白,例如cipa或cipc基因的多肽产物;或支架蛋白或支架蛋白样蛋白质。支架蛋白和纤维素整合蛋白是多功能整合亚基,所述多功能整合亚基可以将纤维素分解亚基组织成多酶复合物。这是通过两个互补类别的结构域(即支架蛋白上的内聚结构域和每个酶单位上的停靠结构域)的相互作用来完成的。支架蛋白亚基还带有纤维素结合模块(cbm),所述cbm可介导纤维小体与其底物的附着。支架蛋白或纤维素整合蛋白可包含此类结构域中的一者或两者。
[0101]
过氧化氢酶:术语“过氧化氢酶”是指催化两个过氧化氢转换为氧气和两个水的过氧化氢:过氧化氢氧化还原酶(ec 1.11.1.6或ec1.11.1.21)。过氧化氢酶活性可以通过基于以下反应监测240nm处的过氧化氢的降解来确定:2h2o2→
2h2o o2。该反应是在25℃下在ph 7.0的50mm磷酸盐中用10.3mm底物(h2o2)和每ml约100单位的酶进行的。在16-24秒内用分光光度法监测吸光度,这应对应于吸光度从0.45降低到0.4。一个过氧化氢酶活性单位可以表示为在ph 7.0和25℃下每分钟降解的一微摩尔h2o2。
[0102]
如本文所用的术语“淀粉酶”是指水解淀粉(直链淀粉和支链淀粉中)的α-1,4-葡糖苷键的酶,例如α-淀粉酶(ec 3.2.1.1)、β-淀粉酶(ec 3.2.1.2)、葡聚糖1,4-α-葡糖苷酶(ec 3.2.1.3)、葡聚糖1,4-α-麦芽四糖水解酶(ec 3.2.1.60)、葡聚糖1,4-α-麦芽四糖苷酶(ec 3.2.1.98)、葡聚糖1,4-α-麦芽三糖水解酶(ec 3.2.1.116)和葡聚糖1,4-α-麦芽糖水解酶(ec 3.2.1.133);以及水解α-1,6-糖苷键(为支链淀粉中支链点)的酶,例如支链淀粉
11601、atcc12892、产黄青霉cbs 455.95、橘青霉(penicillium citrinum)atcc 38065、产黄青霉p2、埃默森篮状菌cbs 393.64、产黄头孢霉(acremonium chrysogenum)atcc 36225或atcc 48272、里氏木霉atcc 26921或atcc 56765或atcc 26921、酱油曲霉atcc11906、鲁克文金孢子菌(chrysosporium lucknowense)c1、garg 27k、vkm f-3500-d、atcc44006以及它们的衍生物。
[0108]
酶(例如以全发酵培养液的形式)可以通过用合适的微生物(例如丝状真菌)发酵合适的底物来制备,其中所述酶由所述微生物产生。可以改变微生物以改进或制造酶。例如,可以通过经典的菌株改良方法或通过重组dna技术使微生物突变。因此,本文提及的微生物可以原样用于产生酶,或者可以经改变以增加产量或产生改变的酶,所述改变的酶可包括异源酶,例如纤维素酶和/或半纤维素酶和/或果胶酶,因此不是该微生物最初产生的酶。优选地,使用真菌,更优选地丝状真菌来产生酶。有利地,使用嗜热或耐热的微生物。任选地,使用诱导由产生酶的微生物进行酶表达的底物。
[0109]
在一个实施方式中,酶组合物是全发酵培养液。在一个实施方式中,酶组合物是真菌,优选丝状真菌,优选踝节菌属真菌的全发酵培养液。全发酵培养液可以由非重组和/或重组丝状真菌的发酵制备。在一个实施方式中,丝状真菌是重组丝状真菌,所述重组丝状真菌包含可与所述丝状真菌同源或异源的一个或多个基因。在一个实施方式中,丝状真菌是重组丝状真菌,所述重组丝状真菌包含与丝状真菌可为同源或异源的一个或多个基因,其中所述一个或多个基因编码能够降解纤维素底物的酶。全发酵培养液可包含本文所述多肽中的任一者,或它们的任何组合。
[0110]
优选地,酶组合物是其中细胞被杀死(即非活的)的全发酵培养液。在一个实施方式中,全发酵培养液包含多肽、有机酸、被杀死的细胞和/或细胞碎片,以及培养基。
[0111]
通常,丝状真菌在适于产生能够水解纤维素底物的酶的细胞培养基中培养。使用本领域已知的方法,在包含碳和氮源以及无机盐的合适的营养培养基中进行培养。适用于生长和纤维素酶和/或半纤维素酶和/或果胶酶生产的合适的培养基、温度范围和其他条件是本领域中已知的。全发酵培养液可以通过使丝状真菌生长到固定相并使丝状真菌保持在有限的碳条件下达足以表达一种或多种纤维素酶和/或半纤维素酶和/或果胶酶的时间段来制备。一旦丝状真菌将诸如纤维素酶和/或半纤维素酶和/或果胶酶的酶分泌到发酵培养基中,就可以使用全发酵培养液。全发酵培养液可包含丝状真菌。在一个实施方式中,全发酵培养液包括在发酵结束时得到的发酵材料的未分级的内容物。通常,全发酵培养液包括用过的培养基和在丝状真菌生长至饱和、在碳限制条件下孵育以允许蛋白质合成(特别是纤维素酶和/或半纤维素酶和/或果胶酶的表达)之后存在的细胞碎片。在一些实施方式中,全发酵培养液包含用过的细胞培养基、细胞外酶和丝状真菌。可以使用本领域已知的方法杀死全发酵培养液中存在的丝状真菌细胞,以产生细胞被杀死的全发酵液。例如,添加有机酸会导致细胞被杀死。如果需要的话,也可以裂解和/或透化细胞。在一个实施方式中,全发酵培养液是细胞被杀死的全发酵培养液,其中全发酵培养液含有被杀死的丝状真菌细胞。换句话说,全发酵培养液包含更多的非活细胞而不是活细胞,优选仅包含非活细胞。在一些实施方式中,通过化学和/或ph处理裂解丝状真菌来杀伤细胞,以产生丝状真菌发酵的细胞被杀伤的全发酵培养液。在一些实施方式中,通过用化学和/或ph处理裂解丝状真菌来杀伤细胞,并将细胞被杀伤的发酵混合物的ph调节至合适的ph。在一个实施方式中,将全发酵培
养液与有机酸混合。
[0112]
如本文所用的术语“全发酵培养液”是指通过细胞发酵产生的制备物,所述制备物不进行或仅进行最小的回收和/或纯化。例如,当微生物培养物生长至饱和,在碳限制条件下孵育以允许蛋白质合成(例如,宿主细胞对酶进行表达)并分泌到细胞培养基中时,会产生全发酵培养液。通常,全发酵培养液是未分级的,并且包含用过的细胞培养基、细胞外酶,以及微生物细胞,优选为非活细胞。
[0113]
在一个实施方式中,可以将全发酵培养液分级,并且可以使用分级的内容物中的一种或多种。例如,可以从全发酵培养液中去除被杀伤的细胞和/或细胞碎片,以提供不含这些组分的酶组合物。
[0114]
全发酵培养液可进一步包含防腐剂和/或抗微生物剂。此类防腐剂和/或试剂是本领域中已知的。在一个实施方式中,用于杀死细胞的有机酸还可以具有防腐剂和/或抗微生物剂的功能。
[0115]
如本文所述的全发酵培养液通常是液体,但是可包含不溶性组分,例如被杀伤的细胞、细胞碎片、培养基组分和/或不溶性酶。在一些实施方式中,可以去除不溶性组分以提供澄清的全发酵培养液。
[0116]
在一个实施方式中,可以向全发酵培养液中补充一种或多种不是内源性表达的或者由丝状真菌以相对较低的水平表达的酶活性,以改善将纤维素底物降解为例如可发酵的糖(诸如葡萄糖或木糖)。补充酶可以作为全发酵培养液的补充物添加,即它们被掺入到全发酵培养液中。附加酶可以以全发酵培养液的形式补充,或者可以作为纯化的、或最低限度回收和/或纯化的酶补充。
[0117]
在一个实施方式中,全发酵培养液可以用至少另一种全发酵培养液补充。另一种全发酵培养液可以来源于相同类型的真菌或来自另一种类型的真菌,例如第一全发酵培养液可以来源于踝节菌属,而第二全发酵培养液可以来源于踝节菌属或曲霉属。
[0118]
在一个实施方式中,全发酵培养液是过表达一种或多种酶以改善纤维素底物降解的重组丝状真菌的发酵的全发酵培养液。或者,全发酵培养液是非重组丝状真菌发酵的全发酵培养液和过表达一种或多种酶以改善纤维素底物降解的重组丝状真菌的全发酵培养液的混合物。在一个实施方式中,全发酵培养液是过表达β-葡糖苷酶的丝状真菌的发酵的全发酵培养液。或者,全发酵培养液是非重组丝状真菌发酵的全发酵培养液和过表达β-葡糖苷酶的重组丝状真菌的发酵的全发酵培养液的混合物。
[0119]
在一个实施方式中,本文所述的酶组合物具有2.0至5.5的ph。优选地,酶组合物具有2.5至5.0的ph。更优选地,酶组合物具有3.0至4.5的ph。因此,酶组合物中的酶能够在低ph下工作。
[0120]
在一个实施方式中,用于制备如本文所述的酶组合物的方法中所使用的酶生产反应器具有至少1m3的体积。优选地,酶生产反应器具有至少1m3、至少2m3、至少3m3、至少4m3、至少5m3、至少6m3、至少7m3、至少8m3、至少9m3、至少10m3、至少15m3、至少20m3、至少25m3、至少30m3、至少35m3、至少40m3、至少45m3、至少50m3、至少60m3、至少70m3、至少75m3、至少80m3、至少90m3的体积。通常,酶生产反应器将小于300m3。
[0121]
在用于制备如本文所述的酶组合物的方法中,在液体或固体培养基中,在适合生长的条件下培养微生物细胞群体,例如丝状真菌细胞。在一个实施方式中,微生物细胞以补
料分批培养、分批培养、连续培养或它们的任何组合进行培养。优选地,丝状真菌以补料分批培养进行培养。本领域技术人员熟知各种培养模式及其条件。在一个实施方式中,培养在需氧条件下进行。本领域技术人员熟知用于需氧培养的发酵罐设计,例如搅拌罐和鼓泡塔。
[0122]
本公开涉及一种用于从纤维素材料制备糖的方法,所述方法包括以下步骤:(a)用如本文所述的酶组合物水解纤维素材料以获得糖,以及(b)任选地,回收所述糖。
[0123]
本公开还涉及一种用于从纤维素材料生产发酵产物的方法,所述方法包括以下步骤:(a)用如本文所述的酶组合物水解纤维素材料以获得糖,(b)通过将所获得的糖与发酵微生物接触来发酵所述获得的糖,以生产发酵产物;以及(c)任选地,回收所述发酵产物。
[0124]
在酶促水解后,水解的纤维素材料可以进行至少一次固/液分离。固/液分离的方法和条件将取决于所使用的纤维素材料的类型,并且完全在技术人员的能力范围内。示例包括但不限于离心、旋风分离、过滤、倾析、筛分和沉降。在一个优选实施方式中,固/液分离是通过离心或沉降执行的。在固/液分离期间,可以使用用于改善分离的手段和/或辅助手段。
[0125]
在一个实施方式中,纤维素材料在酶促水解之前经受预处理步骤。在一个实施方式中,纤维素材料在酶促水解之前经受洗涤步骤。在一个实施方式中,纤维素材料在酶促水解之前经受至少一次固/液分离。因此,在对纤维素材料进行酶促水解之前,可以对所述纤维素材料进行至少一次固/液分离。固/液分离可以在预处理步骤之前和/或之后进行。用于固/液分离的合适方法和条件已在上文中描述。
[0126]
在一个实施方式中,经酶促水解的纤维素材料经受固/液分离步骤,之后是解毒步骤和/或浓缩步骤。
[0127]
在如本文所述的方法中,可以将纤维素材料添加到一个或多个水解反应器中。在一个实施方式中,在添加纤维素材料之前,酶组合物已经存在于一个或多个水解反应器中。在另一个实施方式中,可以将酶组合物添加到一个或多个水解反应器中。在一个实施方式中,在添加酶组合物之前,纤维素材料已经存在于一个或多个水解反应器中。在一个实施方式中,将纤维素材料和酶组合物两者同时添加到一个或多个水解反应器中。一个或多个水解反应器中存在的酶组合物可以是水性组合物。
[0128]
在一个实施方式中,酶促水解至少包括液化步骤和糖化步骤,在该液化步骤中在至少第一水解反应器中水解纤维素材料,并且在该糖化步骤中在至少第一水解反应器中和/或在至少第二水解反应器中水解液化的纤维素材料。糖化可以在与液化相同的水解反应器(即至少第一水解反应器)中进行,其也可以在单独的水解反应器(即至少第二水解反应器)中进行。因此,在酶促水解中,液化和糖化可以进行组合。或者,液化和糖化可以是分开的步骤。液化和糖化可以在不同的温度下执行,但是也可以在单一温度下执行。在一个实施方式中,液化的温度高于糖化的温度。液化优选在60-85℃的温度下进行,并且糖化优选在50-65℃的温度下进行。
[0129]
酶促水解可以在一个或多个水解反应器中执行,但是也可以在一个或多个试管或任何其他连续系统中执行。当酶促水解包括液化步骤和糖化步骤时也是如此。液化步骤可以在一个或多个水解反应器中执行,但是也可以在一个或多个试管或任何其他连续系统中执行,和/或糖化步骤可以在一个或多个水解反应器中执行,但是也可以在一个或多个试管或任何其他连续系统中执行。要使用的水解反应器的示例包括但不限于补料分批搅拌反应
器、分批搅拌反应器、具有超滤的连续流动搅拌反应器和连续活塞流柱反应器。搅拌可以通过一个或多个叶轮、泵和/或静态混合器来完成。
[0130]
在酶促水解中使用的酶可以在酶促水解之前和/或期间添加。如上所述,当纤维素材料在酶促水解之前经受固/液分离时,在酶促水解中使用的酶可以在固/液分离之前添加。或者,它们也可以在固/液分离之后或固/液分离之前和之后添加。酶也可以在酶促水解期间添加。在酶促水解包括液化步骤和糖化步骤的情况下,可以在液化步骤期间和/或之后添加附加酶。可以在糖化步骤之前和/或期间添加附加酶。也可以在糖化步骤之后添加附加酶。
[0131]
在一个实施方式中,总酶促水解时间为10小时或更长时间、12小时或更长时间、14小时或更长时间、16小时或更长时间、18小时或更长时间、20小时或更长时间、30小时或更长时间、40小时或更长时间、50小时或更长时间、60小时或更长时间、70小时或更长时间、80小时或更长时间、90小时或更长时间、100小时或更长时间、110小时或更长时间、120小时或更长时间、130小时或更长时间、140小时或更长时间、150小时或更长时间、160小时或更长时间、170小时或更长时间、180小时或更长时间、190小时或更长时间、200小时或更长时间。
[0132]
在一个实施方式中,总酶促水解时间为10小时至300小时、16小时至275小时,优选20小时至250小时,更优选30小时至200小时,最优选40小时至150小时。
[0133]
用于酶促水解的一个或多个水解反应器中的纤维素材料的粘度介于10cp与20,000cp之间、介于10cp与15,000cp之间,优选介于10cp与10,000cp之间。
[0134]
在该方法包括包括液化步骤和糖化步骤的酶促水解的情况下,液化步骤中的纤维素材料的粘度介于10cp与4000cp之间、介于10cp与2000cp之间,优选介于10cp与1000cp之间,和/或糖化步骤中的纤维素材料的粘度优选介于10cp与1000cp之间。
[0135]
粘度可以用rheolab qc粘度计,使用rushton叶轮,在用于水解的温度和雷诺数《10下测定。
[0136]
在一个实施方式中,在酶促水解期间添加氧。在一个实施方式中,在酶促水解的至少一部分期间添加氧。可以在酶促水解期间连续或不连续地添加氧。在一个实施方式中,在酶促水解期间添加氧一次或多次。在一个实施方式中,可以在酶促水解之前、在将纤维素材料添加到用于酶促水解的水解反应器期间、在将酶添加到用于酶促水解的水解反应器期间、在酶促水解的一部分期间、在整个酶促水解期间或它们的任何组合中添加氧。向在酶促水解中使用的一个或多个水解反应器中添加氧。
[0137]
氧可以几种形式添加。例如,氧可以以氧气、富氧气体(例如富氧空气)或空气的形式添加。如何添加氧的示例包括但不限于借助于以下方式来添加氧:鼓泡、电解、氧的化学添加、从顶部填充在酶促水解中使用的一个或多个水解反应器(将水解产物投入罐中,由此将氧引入水解产物中),以及将氧添加到所述一个或多个水解反应器的顶部空间中。当将氧添加至水解反应器的顶部空间中时,可以供应水解反应所需的足够的氧。通常,可以控制和/或改变添加到水解反应器中的氧的量。通过仅在水解时间的部分期间在所述水解反应器中添加氧,可以限制所供应的氧。另一种选择是添加低浓度的氧,例如通过使用空气和循环空气(离开水解反应器的空气)的混合物,或者通过用惰性气体“稀释”空气。通过在较长的水解时间段期间加入氧、加入较高浓度的氧或加入更多空气,可以实现氧加入量的增加。控制氧浓度的另一种方法是加入氧消耗器和/或氧发生器。可以将氧引入(例如吹入)水解
反应器中存在的纤维素材料中。也可以将氧吹入水解反应器的顶部空间中。
[0138]
在一个实施方式中,在将纤维素材料添加到所述一个或多个水解反应器中之前和/或期间和/或之后,将氧添加到在酶促水解中使用的一个或多个水解反应器中。氧可以与进入水解反应器的纤维素材料一起引入。可以将氧引入将进入水解反应器的材料流中,或者与水解反应器内容物的经过水解反应器的外部回路的部分一起引入。
[0139]
在一个实施方式中,在酶促水解和/或发酵中使用的反应器具有至少1m3的体积。优选地,反应器具有至少1m3、至少2m3、至少3m3、至少4m3、至少5m3、至少6m3、至少7m3、至少8m3、至少9m3、至少10m3、至少15m3、至少20m3、至少25m3、至少30m3、至少35m3、至少40m3、至少45m3、至少50m3、至少60m3、至少70m3、至少75m3、至少80m3、至少90m3、至少100m3、至少200m3、至少300m3、至少400m3、至少500m3、至少600m3、至少700m3、至少800m3、至少900m3、至少1000m3、至少1500m3、至少2000m3、至少2500m3的体积。通常,反应器将小于3000m3或5000m3。在酶促水解中使用几个反应器的情况下,它们可以具有相同的体积,但也可以具有不同的体积。在酶促水解包括单独的液化步骤和糖化步骤的情况下,用于液化步骤的水解反应器和用于糖化步骤的水解反应器可以具有相同的体积,但也可以具有不同的体积。
[0140]
在一个实施方式中,酶促水解在40-90℃,优选45-80℃,更优选55-65℃的温度下进行。
[0141]
如本文所用的纤维素材料包括任何含纤维素的材料。优选地,如本文所用的纤维素材料包括木质纤维素材料和/或半纤维素材料。如本文所用的纤维素材料还可包含淀粉和/或蔗糖。适用于本文所述方法的纤维素材料包括生物质,例如原始生物质和/或非原始生物质,诸如农业生物质、商业有机物、构建和拆除碎片、城市固体废弃物、废纸和庭院废弃物。生物质的常见形式包括树木、灌木和草、小麦、黑麦、燕麦、小麦秸秆、甘蔗、甘蔗秸秆、甘蔗渣、柳枝稷、芒草、能源甘蔗、木薯、糖蜜、大麦、玉米、玉米秸秆、玉米纤维、玉米壳、玉米芯、芸苔茎、大豆茎、甜高粱、玉米粒(包括来自谷粒的纤维)、酒糟(ddgs)、来自谷物(例如玉米、小麦和大麦)的研磨(包括湿磨和干磨)的通常被称为“麸皮或纤维”的产物和副产物,以及城市固体废弃物、废纸和庭院废弃物。生物质也可以是但不限于草本材料、农业残余物、林业残余物、城市固体废物、废纸,以及制浆造纸厂残余物。“农业生物质”包括树枝、灌木、甘蔗、玉米和玉米壳、能源作物、森林、水果、花卉、谷物、草、草本作物、树叶、树皮、针叶、原木、根、树苗、短期轮种木本作物、灌木、柳枝稷、树木、蔬菜、果皮、蔓藤、甜菜糖、甜菜粕、小麦苗、燕麦壳,以及硬木和软木(不包括具有有害材料的木材)。另外,农业生物质包括从包括农业和林业活动在内的农业过程中产生的有机废物材料,特别地包括林业木材废物。农业生物质可以是单独的任何上述,或者是它们的任意组合或混合物。
[0142]
在一个实施方式中,纤维素材料在酶促水解之前和/或期间进行预处理。预处理方法是本领域中已知的,并且包括但不限于加热、机械、化学修饰、生物修饰,以及它们的任意组合。通常执行预处理是为了增强纤维素材料对酶促水解而言的可及性和/或水解半纤维素和/或溶解纤维素材料中的半纤维素和/或纤维素和/或木质素。在一个实施方式中,预处理包括用蒸汽爆破、热水处理或稀酸或稀碱处理来处理纤维素材料。预处理方法的示例包括但不限于蒸汽处理(例如,在100-260℃、7-45巴的压力、中性ph下处理1-10分钟)、稀酸处理(例如,在存在或不存在蒸汽的情况下在120-200℃、2-15巴的压力、酸性ph下用0.1-5%的h2so4和/或so2和/或hno3和/或hcl处理2-30分钟)、有机溶剂处理(例如,在有机溶剂和蒸
汽存在下在160-200℃、在7-30巴的压力、酸性ph下用1-1.5%的h2so4处理30-60分钟)、石灰处理(例如,在水/蒸汽存在下在60-160℃、1-10巴的压力、碱性ph下用0.1-2%的naoh/ca(oh)2处理60-4800分钟)、arp处理(在150-180℃、9-17巴的压力、碱性ph下用5-15%的nh3处理10-90分钟)、afex处理(例如,在60-140℃、8-20巴的压力、碱性ph下用》15%的nh3处理5-30分钟)。
[0143]
可以洗涤纤维素材料。在一个实施方式中,可以在预处理之后洗涤纤维素材料。洗涤步骤可用于去除可充当发酵和/或水解步骤的抑制剂的水溶性化合物。洗涤步骤可以以技术人员已知的方式进行。除了洗涤,还存在其他解毒方法。纤维素材料也可以通过这些方法中的任何一种(或任何组合)进行解毒,这些方法包括但不限于固/液分离、真空蒸发、萃取、吸附、中和、加灰过量(overliming)、添加还原剂、添加解毒酶(例如漆酶或过氧化物酶)、添加能够使水解产物解毒的微生物。
[0144]
在一个实施方式中,进行水解步骤,直至纤维素材料中70%或更多、80%或更多、85%或更多、90%或更多、92%或更多、95%或更多的可用糖被释放。
[0145]
在一个实施方式中,酶促水解中纤维素材料的干物质含量为10%-40%(w/w)、11%-35%(w/w)、12%-30%(w/w)、13%-29%(w/w)、14%-28%(w/w)、15%-27%(w/w)、16%-26%(w/w)、17%-25%(w/w)。
[0146]
在一个实施方式中,水解中添加的酶组合物的量(本文中也称为酶剂量或酶负载)较低。在一个实施方式中,酶组合物的量为10mg蛋白质/g干物质或更低、9mg蛋白质/g干物质或更低、8mg蛋白质/g干物质或更低、7mg蛋白质/g干物质或更低、6mg蛋白质/g干物质或更低、5mg蛋白质/g干物质或更低、4mg蛋白质/g干物质或更低、3mg蛋白质/g干物质或更低、2mg蛋白质/g干物质或更低、或1mg蛋白质/g干物质或更低(表示为以mg蛋白质/g干物质计的蛋白质)。在一个实施方式中,酶组合物的量为5mg酶/g干物质重量或更低、4mg酶/g干物质重量或更低、3mg酶/g干物质重量或更低、2mg酶/g干物质重量或更低、1mg酶/g干物质重量或更低、0.5mg酶/g干物质重量或更低、0.4mg酶/g干物质重量或更低、0.3mg酶/g干物质重量或更低、0.25mg酶/g干物质重量或更低、0.20mg酶/g干物质重量或更低、0.18mg酶/g干物质重量或更低、0.15mg酶/g干物质重量或更低、或0.10mg酶/g干物质重量或更低(表示为以mg酶/g干物质计的纤维素酶总量)。
[0147]
在一个实施方式中,在酶促水解中以纤维素材料中4.5mg蛋白质/克干物质重量至15mg蛋白质/克干物质重量的葡聚糖的量使用酶组合物。在一个实施方式中,在酶促水解中以纤维素材料中5mg蛋白质/克干物质重量至12mg蛋白质/克干物质重量的葡聚糖的量使用酶组合物。在一个实施方式中,在酶促水解中以纤维素材料中6mg蛋白质/克干物质重量至10mg蛋白质/克干物质重量的葡聚糖的量使用酶组合物。
[0148]
如上所述,本公开还涉及一种用于从纤维素材料生产发酵产物的方法,所述方法包括以下步骤:(a)用如本文所述的酶组合物水解纤维素材料以获得糖,(b)通过将所获得的糖与发酵微生物接触来发酵所述获得的糖,以生产发酵产物;以及(c)任选地,回收所述发酵产物。
[0149]
在一个实施方式中,在一个或多个发酵反应器中执行发酵(即步骤b)。在一个实施方式中,由产醇微生物进行发酵以产生醇。在一个实施方式中,由产有机酸微生物进行发酵以产生有机酸。由产醇微生物进行发酵以产生醇可以在执行酶促水解的同一发酵反应器中
进行。或者,由产醇微生物进行发酵以产生醇和由产有机酸微生物进行发酵以产生有机酸可以在一个或多个独立的发酵反应器中执行,但是也可以在一个或多个相同的发酵反应器中进行。
[0150]
在一个实施方式中,发酵由酵母进行。在一个实施方式中,产醇微生物和/或产有机酸微生物是酵母。在一个实施方式中,产醇微生物能够发酵至少c5糖和至少c6糖。在一个实施方式中,产有机酸微生物能够发酵至少一种c6糖。在一个实施方式中,产醇微生物和产有机酸微生物是不同的微生物。在另一个实施方式中,产醇微生物和产有机酸微生物是同一微生物,即产醇微生物还能够产生有机酸,例如琥珀酸。
[0151]
在另一方面中,本公开因此包括发酵过程,其中微生物用于发酵包含一种或多种糖(例如葡萄糖、l-阿拉伯糖和/或木糖)的碳源。碳源可包括任何碳水化合物寡聚体或聚合物,包括l-阿拉伯糖、木糖或葡萄糖单元,诸如木质纤维素、木聚糖、纤维素、淀粉、阿拉伯聚糖等。为了从此类碳水化合物中释放木糖或葡萄糖单元,可以将合适的糖酶(例如木聚糖酶、葡聚糖酶、淀粉酶等)添加到发酵培养基中,或者可以由经修饰的宿主细胞产生合适的糖酶。在后一种情况下,可以对经修饰的宿主细胞进行遗传工程改造以产生和分泌此类糖酶。使用葡萄糖的低聚或聚合源的附加优点在于,其例如通过使用限速量的糖化酶,使得能够在发酵期间保持(较)低的游离葡萄糖浓度。这继而将防止抑制非葡萄糖的糖(诸如木糖)的代谢和运输所需的系统。在一种优选的方法中,经修饰的宿主细胞发酵l-阿拉伯糖(任选地木糖)和葡萄糖两者,优选同时发酵,在这种情况下,优选使用对葡萄糖阻抑不敏感的经修饰的宿主细胞以防止二次生长。除了l-阿拉伯糖,任选地木糖(和葡萄糖)的源作为碳源之外,发酵培养基还将包含经修饰的宿主细胞生长所需的适当成分。用于微生物(诸如酵母或丝状真菌)生长的发酵培养基的组成在本领域中是众所周知的。
[0152]
发酵时间可以比相同条件下的常规发酵更短,其中酶促水解的一部分仍然必须在发酵期间进行。在一个实施方式中,对于具有50g/l葡萄糖和来自碳水化合物材料的对应其它糖(例如50g/l木糖、35g/l l-阿拉伯糖和10g/l半乳糖)的糖组合物,发酵时间为100小时或更短、90小时或更短、80小时或更短、70小时或更短、或60小时或更短。对于更稀的糖组合物,发酵时间可被对应地缩短。在一个实施方式中,乙醇生产步骤的发酵时间对于由c6糖制乙醇介于10小时与50小时之间,并且对于由c5糖制乙醇介于20小时与100小时之间。在一个实施方式中,琥珀酸生产步骤的发酵时间介于20小时与70小时之间。
[0153]
发酵方法可以是需氧或厌氧发酵方法。厌氧发酵方法在本文中定义为在不存在氧或基本上不消耗氧,优选消耗小于5mmol/l/h、2.5mmol/l/h或1mmol/l/h,更优选0mmol/l/h(即无法检测到氧消耗)的情况下进行的发酵方法,并且其中有机分子充当电子供体和电子受体两者。在没有氧的情况下,在糖酵解和生物质形成中产生的nadh不能被氧化磷酸化所氧化。为了解决该问题,许多微生物使用丙酮酸或其衍生物之一作为电子和氢受体,从而使nad
再生。因此,在优选的厌氧发酵过程中,丙酮酸被用作电子(和氢受体),并被还原为发酵产物,诸如乙醇、乳酸、3-羟基-丙酸、丙烯酸、乙酸、琥珀酸、柠檬酸、苹果酸、富马酸、氨基酸、1,3-丙-二醇、乙烯、甘油、丁醇、β-内酰胺抗生素和头孢菌素。在一个优选的实施方式中,发酵过程是厌氧的。厌氧过程是有优势的,因为它比需氧过程便宜:需要更少的专用设备。此外,厌氧过程有望比需氧过程提供更高的产物产率。通常在需氧条件下的生物质产率要高于在厌氧条件下的生物质产率。结果,通常在需氧条件下的预期产物产率低于在厌氧
条件下的预期产物产率。
[0154]
在另一个实施方式中,发酵过程是在限氧条件下进行的。更优选地,发酵过程是需要氧并且限氧条件下进行的。限氧发酵方法是氧消耗受到氧从气体到液体的转换限制的方法。限氧程度由进入气流的量和组成以及所用发酵设备的实际混合/质量传递特性确定。优选地,在限氧条件下的方法中,氧消耗速率为至少5.5mmol/l/h,更优选至少6mmol/l/h,并且甚至更优选至少7mmol/l/h。
[0155]
在一个实施方式中,醇发酵过程是厌氧的,而有机酸发酵过程是需氧的,但在限氧条件下进行。
[0156]
发酵过程优选在对所用微生物最佳的温度下进行。因此,对于大多数酵母或真菌细胞,发酵过程是在低于42℃,优选38℃或更低的温度下执行的。对于酵母或丝状真菌宿主细胞,发酵过程优选在低于35℃、33℃、30℃或28℃的温度和高于20℃、22℃或25℃的温度下执行。在一个实施方式中,醇发酵步骤和有机酸发酵步骤在介于25℃与35℃之间执行。
[0157]
在一个实施方式中,用发酵微生物进行发酵。在一个实施方式中,用c5发酵微生物进行c5糖的醇(例如乙醇)发酵。在一个实施方式中,用c5发酵微生物或商业c6发酵微生物进行c6糖的醇(例如乙醇)发酵。适用于乙醇生产的市售酵母包括但不限于bioferm
tm
aft和xr(nabc—north american bioproducts corporation,ga,usa)、ethanol red
tm
酵母(fermentis/lesaffre,usa)、fali
tm
(fleischmann's yeast,usa)、fermiol
tm
(dsm food specialties)、gert strand
tm
(gert strand ab,sweden)以及superstart
tm
和thermosacc
tm
新鲜酵母(ethanol technology,wi,usa)。
[0158]
在一个实施方式中,在一个或多个繁殖反应器中执行产醇微生物和/或产有机酸微生物的繁殖。在繁殖后,可以将产醇微生物和/或产有机酸微生物添加到一个或多个发酵反应器中。或者,将产醇微生物和/或产有机酸微生物的繁殖与由产乙醇微生物和/或产有机酸微生物进行的发酵进行组合,以分别产生醇和/或有机酸。
[0159]
在一个实施方式中,产醇微生物是能够发酵至少一种c5糖的微生物。优选地,它还能够发酵至少一种c6糖。在一个实施方式中,本公开还描述了一种用于从纤维素材料制备乙醇的方法,所述方法包括以下步骤:(a)执行如本文所述的从纤维素材料制备糖产物的方法,(b)发酵经酶促水解的纤维素材料以产生乙醇;以及(c)任选地,回收所述乙醇。可以用能够发酵至少一种c5糖的微生物进行发酵。
[0160]
在一个实施方式中,产有机酸微生物是能够发酵至少一种c6糖的微生物。在一个实施方式中,本公开描述了一种用于从纤维素材料制备琥珀酸的方法,所述方法包括以下步骤:(a)执行如本文所述的从纤维素材料制备糖产物的方法,(b)发酵经酶促水解的纤维素材料以产生琥珀酸;以及(c)任选地,回收所述琥珀酸。可以用能够发酵至少一种c6糖的微生物进行发酵。
[0161]
产醇微生物可以是原核或真核生物。在该方法中使用的微生物可以是经遗传工程改造的微生物。合适的产醇生物的示例是酵母,例如酵母属(saccharomyces),例如酿酒酵母(saccharomyces cerevisiae)、巴氏酵母(saccharomyces pastorianus)或葡萄汁酵母(saccharomyces uvarum);汉逊酵母属(hansenula);伊萨酵母属(issatchenkia),例如东方伊萨酵母(issatchenkia orientalis);毕赤酵母属(pichia),例如树干毕赤酵母(ichia stipites)或巴斯德毕赤酵母(pichia pastoris);克鲁维酵母属(kluyveromyces),例如脆
壁克鲁维酵母(kluyveromyces fagilis);念珠菌属(candida),例如伪热带念珠菌(candida pseudotropicalis)或酸性嗜热假丝酵母(candida acidothermophilum);管囊酵母属(pachysolen),例如嗜鞣管囊酵母(pachysolen tannophilus);或细菌,例如乳杆菌属(诸如乳酸乳杆菌(lactobacillus lactis))、芽孢杆菌属(geobacillus)、发酵单胞菌属(zymomonas)(诸如运动发酵单胞菌(zymomonas mobilis))、梭菌属(clostridium)(诸如clostridium phytofermentans)、埃希氏菌属(escherichia)(例如大肠杆菌(e.coli))、克雷伯氏菌属(klebsiella)(例如产酸克雷伯菌(klebsiella oxytoca))。在一个实施方式中,能够发酵至少一种c5糖的微生物是酵母。在一个实施方式中,酵母属于酵母属,优选地属于酿酒酵母物种。在如本文所述的方法中使用的酵母(例如,酿酒酵母)能够转换己糖(c6)和戊糖(c5)。在如本文所述的方法中使用的酵母(例如,酿酒酵母)可以厌氧发酵至少一种c6糖和至少一种c5糖。例如,除葡萄糖外,所述酵母还能够厌氧地使用l-阿拉伯糖和木糖。在一个实施方式中,酵母能够将l-阿拉伯糖转换为l-核糖和/或木酮糖5-磷酸和/或转换为期望的发酵产物,例如转换为乙醇。能够从l-阿拉伯糖产生乙醇的生物,例如酿酒酵母菌株,可以通过以下方式产生:修饰宿主酵母,以引入来自合适的源的araa(l-阿拉伯糖异构酶)、arab(l-核酮乙醛酸)和arad(l-核糖-5-p4-差向异构酶)基因。可以将此类基因引入宿主细胞中,以使所述宿主细胞能够使用阿拉伯糖。在wo2003/095627中描述了此类方法。来自植物乳杆菌(lactobacillus plantarum)的araa、arab和arad基因可以被使用,并在wo2008/041840中公开。来自枯草芽孢杆菌(bacillus subtilis)的araa基因和来自大肠杆菌的arab和arad基因可被使用并且在ep1499708中公开。在另一个实施方式中,araa、arab和arad基因可来源于棒形杆菌属(clavibacter)、节细菌属(arthrobacter)和/或革兰菌属(gramella)中的至少一种,特别是番茄细菌性溃疡病菌(clavibacter michiganensis)、金黄节杆菌(arthrobacter aurescens)和/或弗塞特革兰菌(gramella forsetii)中的一种,如在wo 2009011591中所公开的。在一个实施方式中,酵母还可以包含一个或多个拷贝的木糖异构酶基因,和/或一个或多个拷贝的木糖还原酶和/或木糖醇脱氢酶。
[0162]
酵母可包含一种或多种遗传修饰以允许所述酵母发酵木糖。遗传修饰的示例是引入一个或多个xyla-基因、xyl1基因和xyl2基因和/或xks1基因;使醛糖还原酶(gre3)基因缺失;过表达ppp基因tal1、tkl1、rpe1和rki1,以允许增大通过细胞中的戊糖磷酸途径的通量。经遗传工程改造的酵母的示例描述于ep1468093和/或wo2006/009434中。
[0163]
合适的商业酵母的示例是rn1016,所述rn1016是来自荷兰dsm的发酵木糖和葡萄糖的酿酒酵母菌株。
[0164]
在一个实施方式中,用于生产乙醇的发酵过程是厌氧的。厌氧已经在本文先前定义。在另一个优选的实施方式中,用于生产乙醇的发酵过程是需氧的。在另一个优选的实施方式中,用于生产乙醇的发酵过程是在限氧条件下,更优选地需氧且限氧的条件下进行的。限氧条件已经在本文先前定义。
[0165]
或者,对于上述发酵过程,可以使用至少两个不同的细胞,这意味着该过程是共发酵过程。如上所述的发酵过程的所有优选实施方式也是该共发酵过程的优选实施方式:发酵产物的识别、l-阿拉伯糖源和木糖源的识别、发酵条件(需氧或厌氧条件、限氧条件、执行过程的温度、乙醇生产率、乙醇产率)。
[0166]
产有机酸微生物可以是原核或真核生物。在该方法中使用的微生物可以是经遗传
工程改造的微生物。合适的产有机酸生物的示例是酵母,例如酵母属(saccharomyces),例如酿酒酵母(saccharomyces cerevisiae);真菌,例如曲霉属菌株,例如黑曲霉和烟曲霉菌、雪白丝衣霉(byssochlamys nivea)、虎皮香菇属(lentinus degener)、宛氏拟青霉(paecilomyces varioti)和葡萄酒青霉(penicillium viniferum);和细菌,例如产琥珀酸厌氧螺菌(anaerobiospirillum succiniciproducens)、产琥珀酸放线杆菌(actinobacillus succinogenes)、产琥珀酸曼氏杆菌(mannhei succiniciproducers)mbel 55e、大肠杆菌(escherichia coli)、丙酸杆菌属(propionibacterium)种属、梳状菌属种属(pectinatus sp.)、拟杆菌属(bacteroides sp.),例如嗜淀粉拟杆菌(bacteroides amylophilus)、生黄瘤胃球菌(ruminococcus flavefaciens)、栖瘤胃普雷沃氏菌(prevotella ruminicola)、溶淀粉琥珀酸单胞菌(succcinimonas amylolytica)、溶糊精琥珀酸弧菌(succinivibrio dextrinisolvens)、产琥珀酸沃林氏菌(wolinella succinogenes)和产琥珀酸噬纤维菌(cytophaga succinicans)。在一个实施方式中,能够发酵至少一种c6糖的产有机酸微生物是酵母。在一个实施方式中,酵母属于酵母属,优选地属于酿酒酵母物种。如本文所述的有机酸生产过程中使用的酵母,例如酿酒酵母,能够转换己糖(c6)糖。如本文所述的方法中使用的酵母,例如酿酒酵母,可以厌氧发酵至少一种c6糖。
[0167]
可以缩短总反应时间(或水解步骤和发酵步骤一起的反应时间)。在一个实施方式中,在90%葡萄糖产率下,总反应时间为300小时或更短、200小时或更短、150小时或更短、140小时或更短、130小时或更短、120小时或更短、110小时或更短、100小时或更短、90小时或更短、80小时或更短、75小时或更短、或约72小时。对应地,在较低的葡萄糖产率下可以达到较低的总反应时间。
[0168]
可通过如本文所述的方法生产的发酵产物可以是来源于发酵的任何物质。它们包括但不限于醇(例如阿拉伯糖醇、丁醇、乙醇、甘油、甲醇、1,3-丙二醇、山梨糖醇和木糖醇);有机酸(例如乙酸、醋酮酸、己二酸、抗坏血酸、丙烯酸、柠檬酸、2,5-二酮-d-葡糖酸、甲酸、富马酸、葡糖二酸、葡糖酸、葡糖醛酸、戊二酸、3-羟基丙酸、衣康酸、乳酸、马来酸、苹果酸、丙二酸、草酸、草酰乙酸、丙酸、琥珀酸和木糖酸);酮类(例如丙酮);氨基酸(例如天冬氨酸、谷氨酸、甘氨酸、赖氨酸、丝氨酸、色氨酸和苏氨酸);烷烃(例如戊烷、己烷、庚烷、辛烷、壬烷、癸烷、十一烷和十二烷);环烷烃(例如环戊烷、环己烷、环庚烷,以及环辛烷)、烯烃(例如戊烯、己烯、庚烯,以及辛烯);以及气体(诸如甲烷、氢气(h2)、二氧化碳(co2),以及一氧化碳(co))。发酵产物还可以是蛋白质、维生素、药物、动物饲料补充剂、特殊化学品、化学原料、塑料、溶剂、乙烯、酶(例如蛋白酶、纤维素酶、淀粉酶、葡聚糖酶、乳糖酶、脂肪酶、裂解酶、氧化还原酶、转移酶或木聚糖酶)。在一个优选实施方式中,在如本文所述的发酵过程中制备有机酸和/或醇。在一个优选实施方式中,在如本文所述的发酵过程中制备琥珀酸和/或乙醇。
[0169]
发现如本文所述的有益效应适用于几种纤维素材料,并且因此据信对于水解所有种类的纤维素材料都存在有益效应。发现了对几种酶的有益效应,因此据信本发明对所有种类的水解酶组合物都存在有益效应。
[0170]
实施例
[0171]
实施例1
[0172]
eg与cbh1的比率对纤维素材料的酶促水解期间的粘度降低的影响
[0173]
本实施例中显示了内切葡聚糖酶(eg)与纤维二糖水解酶1(cbh1)的比率对纤维素材料的酶促水解期间的粘度降低的影响。
[0174]
在工作体积为1l的经搅拌的、ph受控并且温度受控的反应器中进行水解实验。用最终干物质浓度为17%(w/w)的经酸预处理的玉米秸秆执行水解反应。材料的ph为4.5,并且水解温度为62℃。经酸预处理的玉米秸秆是通过将玉米秸秆在186℃下孵育6.7分钟制成的。在热处理之前,将玉米秸秆用h2so4浸渍10分钟,以将预处理期间的ph设置为2.3。
[0175]
在每个实验开始时,添加0.54mg eg/克干物质(dm)、0.41mg bg/克干物质和不同量的cbh1。eg和cbhi的氨基酸序列分别如序列2和序列4所示。bg的氨基酸序列如wo 2012/000890中的seq id no:2所示。此外,添加不同量的bsa(牛血清白蛋白),以保持所添加的蛋白质总量恒定。实验和所应用的酶剂量的概述如表1所示。
[0176]
使用tca-缩二脲法测定cbhi和eg的蛋白质浓度。简而言之,制备牛血清白蛋白(bsa)稀释液(0mg/ml、1mg/ml、2mg/ml、5mg/ml、8mg/ml和10mg/ml)以生成校准曲线。另外,用水制备eg/cbhi样本的稀释液。将270μl的各个经稀释的样本转移到容纳有830μl的12%(w/v)三氯乙酸的丙酮溶液的10ml试管中,并充分混合。随后,将试管在冰水上孵育一个小时,并在4℃和6000rpm下离心30分钟。弃去上清液,通过将试管倒置在组织上并在室温下静置30分钟来干燥沉淀。接下来,将3ml bioquant biuret试剂混合物添加到试管中的沉淀中,沉淀在混合时溶解,之后添加1ml水。将试管充分混合并在室温下孵育30分钟。在546nm处测量混合物的吸收,并且将水样本用作空白测量。将在校准线范围内在546nm处具有吸收值的eg/cbhi稀释液用于经由bsa校准线计算eg/cbhi样本的总蛋白浓度。
[0177]
使用缩二脲法测定bg的蛋白质浓度。将bg样本基于重量用水稀释,并以》14000
×
g离心5分钟。制备牛血清白蛋白(bsa)稀释液(0.5mg/ml、1mg/ml、2mg/ml、5mg/ml、10mg/ml和15mg/ml)以生成校准曲线。将每种稀释的蛋白质样本的200μl上清液转移到1.5ml反应管中。添加800μl的bioquant biuret试剂并充分混合。将来自相同的经稀释的蛋白质样本的500μl加入至装有10kd过滤器的反应管中。将200μl流出物转移到1.5ml反应管中,添加800μl的bioquant biuret试剂并充分混合。接下来,将所有混合物(在10kd过滤之前和之后的经稀释的蛋白质样本与bioquant混合的)在室温下孵育至少30分钟。在546nm处测量混合物的吸收,并且将水样本用作空白测量。将在校准线范围内在546nm处具有吸收值的bg稀释液用于经由bsa校准线计算混合物样本的总蛋白浓度。
[0178]
在水解3小时后,使用配备有rushton叶轮的anton paar rheolab qc粘度计,在用于水解的温度和《10的雷诺数下测量粘度。粘度结果如表2所示,并且被定义为在4.79l/s剪切速率下的cp。在4.79 1/s的剪切速率下,起始材料的粘度为8700cp。
[0179]
结果显示,与实验1和实验2相比,实验3至实验5,即其中r
eg
(比率eg/(eg cbh1))为0.30、0.20和0.10的实验具有更高的粘度降低。
[0180]
实施例2
[0181]
eg含量和eg与cbh1的比率对纤维素的酶促水解的影响
[0182]
本实施例中显示了酶组合物中eg与cbh1的比率以及蛋白质总量中eg的量对纤维素材料的酶促水解的影响。如实施例1所述测量bg的蛋白质浓度。如实施例1中对cbhi和eg所述,测量lpmo的蛋白质浓度。如实施例1中对bg所述,测量纤维素酶混合物的蛋白质浓度。
eg和cbhi的氨基酸序列分别如序列2和序列4所示。bg的氨基酸序列如wo 2012/000890中的seq id no:2所示。lpmo的氨基酸序列如wo 2012/000892中的seq id no:2所示。
[0183]
在55℃的恒定温度和150rpm的振荡速度下,在置于振荡培养箱中的2升瓶中进行水解实验。用最终干物质浓度为17%(w/w)的经酸预处理的玉米秸秆执行水解反应。材料的ph为ph 4.5,并且每次水解反应都用500g反应混合物/瓶进行。经酸预处理的玉米秸秆是通过将玉米秸秆在186℃下孵育6.7分钟制成的。在热处理之前,将玉米秸秆用h2so4浸渍10分钟,以将预处理期间的ph设置为2.3。
[0184]
在每个实验开始时,每克干物质添加2.75mg总蛋白质。纤维素酶混合物含有11%(w/w)的eg和49%(w/w)的cbh1。根据如wo 2011/000949中所述的方法生产纤维素酶混合物。纤维素酶混合物中eg和cbh1的量如下测定。将纤维素酶混合物的样本在20817rcf和4℃下离心10分钟,并将上清液稀释至终浓度为1mg/ml蛋白质(使用缩二脲测定(参见实施例1)测定蛋白质浓度)。将各个样本的100μg蛋白质转移到埃彭道夫管中,并将蛋白酶抑制剂混合物(蛋白酶抑制剂混合物,halt,thermo fisher)添加到样本中。将样本用tcep进行二硫键还原,随后用碘乙酰胺进行游离半胱氨酸的烷基化。使用冰冷的20%tca的丙酮溶液沉淀蛋白质。将蛋白质沉淀用胰蛋白酶消化,并在与qexactive plus质谱仪(thermo fisher scientific)联用的ultimate 3000(柱:waters acquity uplc csh c18,1.7μm,2.1mm
×
100mm)上进行分析。使用proteome discoverer 2.3,对照内部构建的踝节菌属埃默森蓝状菌蛋白质数据库搜索所获得的数据。使用过滤器过滤结果,以使错误发现率《1%。使用所谓的top3方法对鉴定出的蛋白质进行定量(silva jc等人,mol.&cell proteomics 5.1:第144-156页,2006)。实验和所应用的酶剂量的概述如表3所示。
[0185]
水解177小时后取样进行分析。将样本立即以4000
×
g离心8分钟。将上清液通过0.20μm尼龙过滤器过滤,并将滤液在4℃贮存,直到如下所述分析葡萄糖含量。
[0186]
根据2008年1月的nrel技术报告nrel/tp-510-42623,使用配备有aminex hpx-87h柱的hplc测量样本中的葡萄糖浓度。结果呈现于表4中。
[0187]
表4中的结果清楚地显示了实验2至实验5,即其中r
eg
为0.32至0.01并且eg以小于酶组合物中蛋白质总量的10%(w/w)的量存在的实验中的高葡萄糖浓度。
[0188]
表4中的结果还显示了实验1,即其中r
eg
为0.32至0.01但eg以大于酶组合物中蛋白质总量的10%(w/w)的量存在的实验中较低的(与实验2至实验5相比)葡萄糖浓度。
[0189]
此外,将实验1,即其中使用r
eg
为0.18并且eg以酶组合物中蛋白质总量的10.2%(w/w)的量存在的酶组合物的实验,与其中使用r
eg
为0.23并且eg以大于酶组合物中蛋白质总量的20.6%(w/w)的量存在的酶组合物的实验进行比较。后者给出的葡萄糖浓度比实验1中使用的组合物低约25%(数据未显示)。这表明另一种对照组合物比本发明的组合物表现更差,它甚至比实验1中使用的对照组合物表现更差。
[0190]
此外,将实验1,即其中使用r
eg
为0.18并且eg以酶组合物中蛋白质总量的10.2%(w/w)的量存在的酶组合物的实验,与其中使用r
eg
为0.53并且eg以酶组合物中蛋白质总量的40.5%(w/w)的量存在的酶组合物的实验进行比较。后者给出的葡萄糖浓度比实验1中使用的组合物低约17%(数据未显示)。这表明又一种对照组合物比本发明的组合物表现更差,它甚至比实验1中使用的对照组合物表现更差。
[0191]
实施例3
[0192]
eg含量和eg与cbh1的比率对纤维素的酶促水解的影响
[0193]
本实施例中显示了酶组合物中eg与cbh1的比率以及蛋白质总量中eg的量对纤维素材料的酶促水解的影响。如实施例1所述测量cbhi、eg和bg的蛋白质浓度。如针对bg所述(参见实施例1),测量纤维素酶混合物的蛋白质浓度。牛血清白蛋白(bsa)购自sigma(≥96%纯度)。eg和cbhi的氨基酸序列分别如序列2和序列4所示。bg的氨基酸序列如wo 2012/000890中的seq id no:2所示。
[0194]
在55℃的恒定温度和150rpm的振荡速度下,在置于振荡培养箱中的2升瓶中进行水解实验。用最终干物质浓度为17%(w/w)的经酸预处理的玉米秸秆执行水解反应。材料的ph为ph 4.5,并且每次水解反应都用500g反应混合物/瓶进行。经酸预处理的玉米秸秆是通过将玉米秸秆在186℃下孵育6.7分钟制成的。在热处理之前,将玉米秸秆用h2so4浸渍10分钟,以将预处理期间的ph设置为2.3。
[0195]
在每个实验开始时,每克干物质添加2.75mg总蛋白质。纤维素酶混合物含有11%(w/w)的eg和49%(w/w)的cbh1。根据如wo 2011/000949中所述的方法生产纤维素酶混合物。实验和所应用的酶剂量的概述如表5所示。
[0196]
水解177小时后取样进行分析。将样本立即以4000
×
g离心8分钟。将上清液通过0.20μm尼龙过滤器过滤,并将滤液在4℃贮存,直到如下所述分析葡萄糖含量。
[0197]
根据2008年1月的nrel技术报告nrel/tp-510-42623,使用配备有aminex hpx-87h柱的hplc测量样本中的葡萄糖浓度。结果呈现于表6中。
[0198]
表6中的结果清楚地显示了实验2和实验3,即其中r
eg
为0.32至0.01并且eg以小于酶组合物中蛋白质总量的10%(w/w)的量存在的实验中的高葡萄糖浓度。
[0199]
表6中的结果还显示了实验1,即其中r
eg
为0.32至0.01但eg以大于酶组合物中蛋白质总量的10%(w/w)的量存在的实验中较低的(与实验2和实验3相比)葡萄糖浓度。
[0200]
表1:实验和所应用的酶剂量的概述。
[0201][0202]
表2:3小时后的粘度结果。
[0203]
实验粘度(剪切速率为4.79l/s时的cp)11650
2150931094410635924
[0204]
表3:实验和所应用的酶剂量的概述。
[0205][0206][0207]
*eg和cbh1的量是纤维素酶混合物中存在的量
[0208]
表4:177小时后的水解结果。
[0209]
实验葡萄糖浓度(g/l)145.2248.7351.2449.4551.3
[0210]
表5:实验和所应用的酶剂量的概述。
[0211][0212][0213]
*eg和cbh1的量是纤维素酶混合物中存在的量
[0214]
表6:177小时后的水解结果。
[0215]
实验葡萄糖浓度(g/l)137.0239.2342.5
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。