一种基于peg-mal修饰的靶向her2阳性乳腺癌的二维黑磷杂化纳米药物
技术领域
1.本发明属于纳米药物领域,特别涉及一种基于peg-mal修饰的靶向her2阳性乳腺癌的二维黑磷杂化纳米药物与制备方法。
背景技术:
2.纳米医学已经成为现代医学领域的一个重要发展方向,fda已经批准了60多种含有纳米材料(如纳米粒子、纳米球、纳米胶囊和量子点)的药物申请,用于治疗应用的新兴二维材料已经被广泛研究,包括石墨烯(go)、黑磷(bp)、15种过渡金属二卤化物(tmd)、16种过渡金属碳化物和氮化物。其中二维黑磷作为一种新型的无金属二维纳米材料,具有较高的生物相容性和药物负载率,同时在紫外和近红外区都有光吸收,具有非常高的光热转化效率,可适用于生物医学领域。但是当二维黑磷暴露在空气或水时非常容易降解,wan等人制备了聚乙二醇(peg)化的bp nss,显著提高了bp nss的生物相容性和生理稳定性(j mater chem b,8,32,2020,7076-7120)。
3.癌症免疫疗法已经成为癌症治疗中一种强有力的新策略。目前癌症免疫疗法主要包括检查点抑制剂法(例如,anti-pd-1/pd-l1和anti-ctla-4法)、t细胞过继免疫疗法、疫苗法等,其在临床上已显示出良好的治疗效果。免疫治疗由于缺少特异性靶向治疗分析,免疫应答速率较低,并且单独的免疫治疗很难彻底消融局部肿瘤(nat rev cancer,12,4,2012,265-277)。马来酰亚胺(mal)修饰的ac-nps(antigen-capturing nanoparticles)可以通过形成稳定的硫醚键与蛋白质相结合,因此能够捕获肿瘤衍生蛋白抗原(tdpa)并将它们运送到抗原提呈细胞(apc),从而显著改善免疫治疗的治疗效果(nat nanotechnol,12,9,2017,877-882;adv.sci.2019,1802157)。
4.乳腺癌是一种高度异质性疾病,不同分子亚型乳腺癌具有不同的生物学行为和临床病理学特点,其治疗策略及预后也大不相同。目前乳腺癌一般根据雌激素受体(estrogen receptor,er)、孕激素受体(progestrone receptor,pr)、人表皮生长因子受体2(human epithermal growth factor receptor 2,her2)等情况分为四种分子亚型(nat rev clin oncol,13,11,2016,674-690)。her2的过度表达标志着肿瘤细胞增殖迅速,曲妥珠单抗(trastuzumab,缩写为tmab)是一种结合her2的人源化单克隆抗体,可以改善her2乳腺癌患者的预后。将tmab与化疗药物紫杉醇结合使用或化疗后使用,可以显著提高机体存活率并降低肿瘤复发的风险(n engl j med,372,2,2015)。
5.检索国内外有关杂化纳米药物方面的文献和专利结果表明:目前,还没有发现基于peg-mal修饰的靶向her2阳性乳腺癌的二维黑磷杂化纳米药物的制备等应用方面的报道。
技术实现要素:
6.本发明的目的在于,解决现有的光热治疗与免疫治疗的治疗效果不彻底,容易复
发,免疫抑制等问题。
7.为了解决上述技术问题,本发明采用如下技术方案:
8.一种基于peg-mal修饰的二维黑磷杂化纳米药物,包括用peg-mal和tmab修饰的bpqds。
9.用peg-mal(聚乙二醇-马来酰亚胺)和tmab(曲妥珠单抗)修饰bpqds(黑磷量子点),利用修饰了曲妥珠单抗的聚乙二醇化的二维黑磷纳米杂化药物靶向her2阳性的转移性乳腺癌,达到光热免疫治疗效果。研究发现,nh
2-peg-mal是一种含有马来酰亚胺和氨基的异双功能聚乙二醇,可以用来修饰蛋白质、多肽及其他含有巯基的材料或小分子,mal可以增强抗原提呈细胞对抗原的捕获能力,曲妥珠单抗可以有效靶向her2阳性的乳腺癌,二维黑磷作为一种有效的光热试剂。本发明利用二维黑磷作为载体,成功修饰上peg-mal和tmab,将光热治疗和免疫治疗有机结合,达到更好的治疗效果,在实现局部消融肿瘤的同时,激发机体免疫调节达到更彻底地消除肿瘤的目的。
10.一种上述基于peg-mal修饰的二维黑磷杂化纳米药物的制备方法,包括:
11.a、将块状黑磷晶体粉末溶于酰胺类有机溶剂,超声震荡破碎后离心并水洗,得到bpqds水溶液;
12.b、将所述bpqds水溶液与nh
2-peg-mal水溶液、tmab水溶液混合均匀获得混合溶液,然后先超声,再搅拌,离心得到所述基于peg-mal修饰的二维黑磷杂化纳米药物。
13.优选的,所述混合溶液中,bpqds、nh
2-peg-mal、tmab的摩尔比为1:5~10:2~6。
14.优选的,所述bpqds水溶液浓度为5~10mg/ml;所述nh
2-peg-mal水溶液中的nh
2-peg-mal分子量为2000。
15.优选的,所述bpqds水溶液中为3~7nm的二维黑磷量子点。
16.bpqds水溶液中为3~7nm的二维黑磷量子点,浓度为5~10mg/ml,体积用量约为500~1000μl。nh
2-peg-mal分子量为2000,质量用量约为15~60mg。tmab质量用量约为7.5~30mg。
17.优选的,所述块状黑磷晶体粉末与所述nmp的质量体积比为50~100mg:20~30ml。
18.优选的,包括:
19.a、将所述块状黑磷晶体粉末溶于所述nmp(1-甲基-2-吡咯烷酮),先探头超声震荡破碎再低温水浴超声震荡清洗,之后3500~4500rpm离心10~15min,去除大的块状沉淀,然后13000~14000rpm离心并用去离子水进行水洗,得到分散均匀的所述bpqds水溶液;
20.b、将所述bpqds水溶液与nh
2-peg-mal水溶液、tmab水溶液混合均匀获得所述混合溶液,然后先水浴超声20~30min,然后在室温下400~500rpm避光搅拌10~12h,在转速13000~14000rpm下离心10~15min,得到所述基于peg-mal修饰的二维黑磷杂化纳米药物。
21.步骤a中,黑磷晶体粉末可溶于酰胺类有机溶剂,类似于nmp的酰胺类有机溶剂都可以作为bp的分散剂,但bp在nmp中的分散稳定性最好,应认为是较优的选择。
22.优选的,步骤a中,先探头超声震荡破碎再低温水浴超声震荡清洗的具体操作为:先在功率为810w,超声频率为开2.0s关1.0s的循环的条件下用6号变幅杆的超声波细胞粉碎机冰浴超声破碎40~50min,重复3~5次,然后再在0~10℃中水浴超声清洗1~2h。
23.因为黑磷极不稳定,在温度较高的条件下极易分解,所以在超声破碎过程中要在冰浴的条件下进行,清洗过程也要保证低温,大概温度在0~10℃左右。通过先探头超声震
荡破碎再低温水浴超声震荡清洗,能获得3~7nm的分散均匀的二维黑磷量子点。
24.一种上述基于peg-mal修饰的二维黑磷杂化纳米药物的应用,在制备癌症光热免疫复合治疗靶向药物上的应用。
25.优选的,所述癌症为her2阳性乳腺癌。
26.本发明可以直接用于癌症的光热免疫复合治疗,或者制备相关药物,特别是关于her2阳性的转移性乳腺癌的光热免疫复合治疗。
27.实施本发明,具有如下有益效果:
28.(1)本发明制备方法简单、易于操作,利用探头超声和水浴超声相结合的液相剥离法得到分散均匀的二维黑磷量子点,利用正负电荷相互吸引的静电吸附作用成功修饰上peg-mal和tmab,制备得到的杂化纳米药物对her2阳性的乳腺癌具有良好的靶向性,同时将光热治疗与免疫治疗有机结合,具有良好的应用前景;
29.(2)本发明将peg-mal修饰到二维黑磷表面,可以有效增强抗原提呈细胞对抗原的捕获能力,大大增强机体的免疫能力,tmab作为一种已知的针对her2过表达的转移性乳腺癌的药物,可以有效靶向her2阳性的乳腺癌,制备得到的杂化纳米药物在进行光热治疗的同时,又能增强机体的免疫功能达到更彻底的消除肿瘤的效果,本发明为her2阳性乳腺癌的新型光热免疫联合疗法奠定了良好的基础。
30.(3)本发明选用可完全代谢的新型二维黑磷纳米材料作为无机纳米平台,具有较高的药物负载率和光热转化率。peg-mal的修饰不仅可以提高纳米药物的胶体稳定性和生物相容性,还可以有效增强抗原提呈细胞对抗原的捕获能力,激发机体免疫反应。tmab的修饰使纳米药物有效靶向her2阳性的乳腺癌,并进一步提高纳米药物的胶体稳定性。本发明首次将抗her2阳性的乳腺癌的药物tmab与二维黑磷有机结合,实现对her2阳性乳腺癌靶向光热免疫复合治疗,设计方法简单,反应条件温和,为乳腺癌的精准治疗提供了一种新的策略。
附图说明
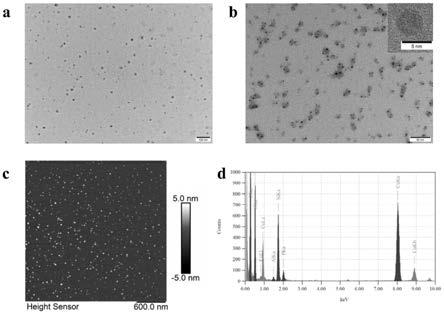
31.图1为制备的bpqds的分析图,其中:(a)为bpqds的tem图;(b)为bpqds的hrtem图;(c)为bpqds的afm图;(d)为bpqds的eds图。
32.图2为制备的bp-peg-mal-tmab的分析图,其中:(a)为bp-peg-mal-tmab的表面电势柱状图;(b)为bp-peg-mal-tmab的粒径大小柱状图。
33.图3为不同浓度的bp-peg-mal-tmab在808nm激光照射(1.0w/cm2)下的升温曲线图。
34.图4为50μg/ml的bp-peg-mal-tmab在1w/cm2的808nm激光辐照下的升温-降温曲线图。
35.图5为bpqds在第0、7、15天的450~900nm范围内的紫外吸收光谱图。
36.图6为bp-tmab在第0、7、15天的450~900nm范围内的紫外吸收光谱图。
37.图7为不同浓度的bp-peg-mal-tmab与mda-mb-231细胞孵育24h、48h、72h后的相对细胞存活率,即本发明对mda-mb-231细胞的暗毒性评价示意图。
38.图8为不同浓度的bp-peg-mal-tmab与skbr3细胞孵育24h、48h、72h后的相对细胞存活率,即本发明对skbr3细胞的暗毒性评价示意图。
39.图9为不同浓度的bp-peg-mal-tmab分别与mda-mb-231细胞和skbr3细胞共培养6h后经808nm激光照射10min(1w/cm2)后,再孵育2h后的相对细胞生存率,即本发明对不同细胞的靶向光毒性评价示意图。
40.图10为不同浓度的bp-peg-mal-tmab与mda-mb-231细胞共培养6h后经808nm激光照射10min(1w/cm2)后,再孵育2h后的活死细胞染色图,即本发明对mda-mb-231细胞的光毒性评价示意图。
41.图11为不同浓度的bp-peg-mal-tmab与skbr3细胞共培养6h后经808nm激光照射10min(1w/cm2)后,再孵育2h后的活死细胞染色图,即本发明对skbr3细胞的光毒性评价示意图。
具体实施方式
42.为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
43.实施例1
44.bpqds的制备,包括如下步骤:
45.(1)二维黑磷量子点的制备采用液相剥离法。详细来说就是将块状黑磷晶体粉末溶于1-甲基-2-吡咯烷酮,先用6号变幅杆的超声波细胞粉碎机冰浴超声破碎45min,重复3次,超声波细胞粉碎机的功率为810w,超声频率为开2.0s关1.0s的循环,然后再4℃低温水浴超声清洗1h;
46.(2)然后把混合物放入离心机,4000rpm离心12min,去除大的块状颗粒沉淀,然后再13000rpm离心12min,得到我们所要的二维黑磷量子点,接着加入去离子水再次13000rpm离心12min,去除残留的nmp,得到bpqds水溶液,用紫外-可见分光光度计对黑磷浓度进行定量后4℃保存备用。
47.bp-peg-mal-tmab nps的制备,包括如下步骤:
48.把bpqds水溶液、nh
2-peg-mal水溶液、tmab水溶液混合后水浴超声20min,然后室温下450rpm避光搅拌10h,离心(13000rpm,10min)除去未结合的过量的nh
2-peg-mal和tmab,并用去离子水洗涤,收集所有沉淀,即得到bp-peg-mal-tmab杂化纳米药物。
49.实施例2
50.bpqds的制备,包括如下步骤:
51.(1)二维黑磷量子点的制备采用液相剥离法。详细来说就是将块状黑磷晶体粉末溶于1-甲基-2-吡咯烷酮,先用6号变幅杆的超声波细胞粉碎机冰浴超声破碎40min,重复5次,超声波细胞粉碎机的功率为810w,超声频率为开2.0s关1.0s的循环,然后再0℃低温水浴超声清洗2h;
52.(2)然后把混合物放入离心机,4500rpm离心10min,去除大的块状颗粒沉淀,然后再14000rpm离心10min,得到我们所要的二维黑磷量子点,接着加入去离子水再次14000rpm离心10min,去除残留的nmp,得到bpqds水溶液,用紫外-可见分光光度计对黑磷浓度进行定量后0℃保存备用。
53.bp-peg-mal-tmab nps的制备,包括如下步骤:
54.把bpqds水溶液、nh
2-peg-mal水溶液、tmab水溶液混合后水浴超声30min,然后室
温下400rpm避光搅拌12h,离心(14000rpm,15min)除去未结合的过量的nh
2-peg-mal和tmab,并用去离子水洗涤,收集所有沉淀,即得到bp-peg-mal-tmab杂化纳米药物。
55.实施例3
56.bpqds的制备,包括如下步骤:
57.(1)二维黑磷量子点的制备采用液相剥离法。详细来说就是将块状黑磷晶体粉末溶于1-甲基-2-吡咯烷酮,先用6号变幅杆的超声波细胞粉碎机冰浴超声破碎50min,重复3次,超声波细胞粉碎机的功率为810w,超声频率为开2.0s关1.0s的循环,然后再10℃低温水浴超声清洗1h;
58.(2)然后把混合物放入离心机,3500rpm离心15min,去除大的块状颗粒沉淀,然后再13000rpm离心15min,得到我们所要的二维黑磷量子点,接着加入去离子水再次13000rpm离心15min,去除残留的nmp,得到bpqds水溶液,用紫外-可见分光光度计对黑磷浓度进行定量后2℃保存备用。
59.bp-peg-mal-tmab nps的制备,包括如下步骤:
60.把bpqds水溶液、nh
2-peg-mal水溶液、tmab水溶液混合后水浴超声20min,然后室温下500rpm避光搅拌10h,离心(13000rpm,10min)除去未结合的过量的nh
2-peg-mal和tmab,并用去离子水洗涤,收集所有沉淀,即得到bp-peg-mal-tmab杂化纳米药物。
61.效果例1
62.以实施例1为例,对所制备的bpqds进行观测,经过观测发现,2d bpqds分散均匀,大小在3-7nm左右(见图1a),hrtem图像显示了清晰的晶格条纹(见图1b),afm图显示了bpqds的高度大概在5nm左右(见图1c),eds图像进一步证实了磷元素的存在(见图1d)。动态光散射技术对bpqds、nh
2-peg-mal、tmab、bp-peg-mal、bp-tmab、bp-peg-mal-tmab的表面电势(见图2a)和水合粒径(见图2b)进行分析,通过与bpqds的电位以及粒径进行对比,可以看出我们所制备的最终材料bp-peg-mal-tmab成功负载上nh
2-peg-mal和tmab。不同浓度的bp-peg-mal-tmab在808nm激光照射10min(1w/cm2),可以快速将近红外光转化为热能(见图3)。例如,在100ppm浓度下,bp-peg-mal-tmab的温度达到了50℃左右,而在相同条件下,对照组的pbs的温度仅仅达到30℃。已知肿瘤细胞对温度非常敏感,当温度高于42℃对肿瘤细胞就具有杀伤能力。此外,经过5次激光开/关循环后,升温能力未见明显衰减,说明该杂化纳米药物显示出良好的光热稳定性(见图4)。
63.效果例2
64.按实施例1的条件,分别制备了bpqds和bp-tmab水溶液,将其放置于室温,然后用紫外可见光分光光度计分别测定了bpqds、bp-tmab在450~900nm范围内第0、7、15天的紫外吸收光谱(见图5和图6),与bpqds组相比,bp-tmab显著提高了bpqds的稳定性。表格1为在700nm处,bpqds和bp-tmab分别在第0、7、15天的吸光值以及第15天和第0天相比的衰减率值。以第15天为例(见表格1),bpqds组在700nm处吸光值与第0天相比减少了41.82%,而bp-tmab组的吸光值仅减少了6.34%,有效证明了修饰tmab后可以显著提高bp的稳定性,减少其氧化分解带来的损失。
65.表格1
[0066][0067]
效果例3
[0068]
以实施例1获得的bp-peg-mal-tmab杂化纳米药物为例,采用cck-8法评价了不同浓度的bp-peg-mal-tmab nps对mda-mb-231细胞(见图7)和skbr3细胞(见图8)的细胞毒性,以共培养24h为例,该纳米杂化药物对两种乳腺癌细胞均具有一定的毒性,skbr3细胞毒性略高于mda-mb-231细胞,这与该纳米杂化药物对her2阳性的乳腺癌细胞具有靶向性有关,随着共培养时间越长,细胞毒性也越高。活死细胞双染进一步证实以上结论(见图9、10、11),已知calcein-am染活细胞,pi染死细胞,以100ppm l( l表示给予激光照射,1w/cm2)为例,在激光照射10min后,mda-mb-231细胞活细胞比例占11%,而skbr3细胞活细胞仅仅只剩4%,再次证明该纳米杂化药物的靶向性与良好的光热转化能力。
[0069]
以上所阐述的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。