1.本发明属于医药技术领域,具体涉及一种草地风毛菊在制备防治由微生物感染引起的发热为特点的疾病的药物中的应用。
背景技术:
2.发热是临床常见的症状之一,是感染性或非感染性疾病引发的一种保守系统反应,也是感染、炎症和中毒等疾病早期的指征之一。发热作为多种疾病的重要病理过程和临床表现,也是疾病发生的重要信号,影响着中枢神经系统中内分泌、神经、免疫和行为学多个系统的一种复杂过程。
3.现代医学认为,发热是由各种微生物、病原体及其产物、炎性渗出物及无菌性坏死组织、抗原抗体复合物、某些类固醇物质等外源性致热原刺激机体免疫活性细胞(巨噬细胞、淋巴细胞、单核细胞、肥大细胞、粒细胞等)产生白介素-6(il-6)、白介素-1β(il-1β)、肿瘤坏死因子(tnf-α)、干扰素-γ(ifn-γ)等内源性致热原ep(endogenous pyrogen),这些细胞因子直接或通过血液循环与下丘脑视前区(poah)的终版血管器(ovlt)作用于体温调节中枢,产生前列腺素pge2、环磷酸腺苷camp、一氧化氮no、促肾上腺皮质激素释放激素crh、na
/ca
2
等中枢制热介质,这些介质可致使体温调节中枢的调定点升高,进而机体效应器散热增加,产热减少,同时体温升高幅度收到精氨酸血管加压素avp、黑素细胞刺激素msh、β-内啡肽、p物质、神经降压素nt等中枢负调介质的影响。因此,发热是体温调节中枢正、负两种调节机制共同作用的结果。pge2是能够引起体温调定点升高的主要物质,是多种致热源诱导体温升高的中枢共同通路,pge2作为cox-2的主要产物的同时,也影响着cox-2的高表达。在炎症状态下,nf-kb激活后可与多种炎症因子基因启动子中的特异性kb序列结合,参与il-6、il-1β、tnf-α、cox-2(环氧化酶-2)、nos(一氧化氮合酶)等转录,是信号通路中的重要因子。
4.发热属于蒙医温病范畴,其主要病因为血与希拉。蒙医温病学中按照温病病机发展变化的规律可分为未熟热、曾盛热、热病山滩界、空虚热、隐伏热、燥浊热、散播热、陈旧热等8个病期。8个病期即为8种不同证型。其中曾盛热为温病病理过程的第二个阶段,是未熟热期脱离巴达干赫依转变为单纯热,热力增盛达巅峰的时期。临床表现为39-40℃高热,头疼,口干舌燥,脉象、舌、尿呈现单纯希拉症。目前研究常用的干酵母致热与脂多糖(lipopolysaccharide,lps)致热模型的症状符合曾盛热证期标准的症状。二者都具有造模方法简便、实验条件简单、时间短、成功率高等特点。这两种模型也是中西药解热作用研究中的经典模型,因此蒙医中的发热/解热作用的机制可以用现代医学的研究手段与理论进行探索研究。
5.蒙药草地风毛菊(蒙名:哈拉特日嘎那,藏语名:鲁孜道)为菊科风毛菊属多年生草本植物草地风毛菊saussurea amara(l.)dc.的干燥全草,为蒙药洪古日朱勒(漏芦花)的代用品。蒙药漏芦花具有杀粘、止刺痛、清热、解毒、解表功效,用于肠刺痛、瘟热、发症、结喉、
麻疹、毒热、心热、讧热、炽热、血热、新陈热、伤热等,在蒙医临床中有较长的应用历史。蒙药漏芦花始载于《甘露四部》,因蒙药材多就地采集利用野生资源,导致出现地方习用品和替代品,历代蒙医古籍《金光注释集》、《晶珠本草》、《无误蒙药鉴》等和《蒙药学》一书中均记载蒙医所用洪古日朱勒为漏芦花,而草地风毛菊为其代用品。目前草地风毛菊已被收载于《中华人民共和国卫生部药品标准》。根据现代国内外相关文献报道可知,目前关于草地风毛菊的研究仅限于氨基酸成分检测、胆盐非依赖性促胆汁分泌相关有效成分研究等。
技术实现要素:
6.有鉴于此,本发明要解决的技术问题在于提供一种草地风毛菊在制备防治由微生物感染引起的发热为特点的疾病的药物中的应用,本发明的草地风毛菊药材及提取物能防治由微生物感染引起的发热为特点的疾病。
7.本发明提供了一种草地风毛菊在制备防治由微生物感染引起的发热为特点的疾病的药物中的应用。
8.优选的,所述草地风毛菊为草地风毛菊药材或提取物。
9.优选的,所述提取物选自草地风毛菊醇提物、草地风毛菊水提物、草地风毛菊石油醚提取物、草地风毛菊二氯甲烷提取物、草地风毛菊乙酸乙酯提取物和草地风毛菊正丁醇提取物中的一种或多种。
10.优选的,所述由微生物感染引起的发热为特点的疾病包括流感和/或肠炎。
11.优选的,所述微生物为干酵母。
12.优选的,所述药物选自草地风毛菊药材粉末、草地风毛菊水提物或草地风毛菊醇提物。
13.优选的,所述药物具有抗炎作用。
14.优选的,所述抗炎作用包括抑制no释放、降低细胞因子。
15.优选的,所述细胞因子包括il-6、il-1β、tnf-α中的一种或多种。
16.优选的,所述草地风毛菊选自草地风毛菊的乙酸乙酯提取物、石油醚提取物和正丁醇提取物
17.与现有技术相比,本发明提供了一种草地风毛菊在制备防治由微生物感染引起的发热为特点的疾病的药物中的应用。本发明发现草地风毛菊药材及提取物用于制备解热抗炎药物的新用途。草地风毛菊药材及提取物在细胞水平、分子水平和动物实验中都具有解热抗炎作用。
附图说明
18.图1为草地风毛菊药粉、草地风毛菊水提物、草地风毛菊醇提物对干酵母致热大鼠下丘脑中nf-kb信号通路相关蛋白表达的影响。
具体实施方式
19.本发明提供了一种草地风毛菊在制备防治由微生物感染引起的发热为特点的疾病的药物中的应用。
20.其中,所述草地风毛菊为草地风毛菊药材或提取物。
21.所述提取物选自草地风毛菊醇提物、草地风毛菊水提物、草地风毛菊石油醚提取物、草地风毛菊二氯甲烷提取物、草地风毛菊乙酸乙酯提取物和草地风毛菊正丁醇提取物中的一种或多种。
22.本发明对所述草地风毛菊提取物的制备方法并没有特殊限制,本领域技术人员公知的提取方法即可。
23.在本发明中,所述草地风毛菊药材粉末的制备方法包括:草地风毛菊药材干燥后,直接粉粹,过60目筛,即得;
24.所述草地风毛菊醇提物的制备方法包括:草地风毛菊和体积浓度分别为70%、95%乙醇水溶液或无水乙醇混合,浸泡,加热回流提取,过滤,即得。
25.其中,本发明草地风毛菊和乙醇水溶液或无水乙醇的的质量体积比例优选为1g:(9~10)ml;更优选为1g:10ml;所述浸泡的温度为室温条件,时间为4~6小时。所述加热回流提取的时间优选为2~6h;更优选为3~5h,最优选为4h。所述提取次数为2~3次。所述过滤优选为采用纱布过滤,更优选为采用4层纱布过滤。然后滤液优选采用减压蒸馏去除溶剂。
26.在本发明中,所述草地风毛菊水提物的制备方法包括:草地风毛菊和水混合,浸泡,加热回流提取,过滤,即得。
27.其中,本发明草地风毛菊和水的质量体积比例优选为1g:(9~10)ml;更优选为1g:10ml;所述浸泡的温度为室温条件,时间为4~6小时。所述加热回流提取的时间优选为4~6h;最优选为4h。所述提取次数为2~3次。所述过滤优选为采用纱布过滤,更优选为采用4层纱布过滤。然后滤液优选采用减压蒸馏去除溶剂。
28.在本发明中,草地风毛菊石油醚提取物的制备方法包括:将草地风毛菊醇提物与水混合得到混悬液,加入石油醚萃取,合并上层石油醚萃取液,干制,得到草地风毛菊石油醚提取物。
29.其中,所述草地风毛菊醇提物的制备方法如上文所述,在此不做赘述。
30.本发明所述草地风毛菊醇提物与水混合的质量体积比优选为1:(6~10)(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值;草地风毛菊醇提物与每次加入石油醚的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。本发明所述萃取的次数优选为25~30次。
31.在本发明中,所述草地风毛菊二氯甲烷提取物的制备方法包括:将草地风毛菊醇提物与水混合得到混悬液,加入石油醚萃取,取下层水萃取液加入二氯甲烷,合并下层二氯甲烷萃取液,干制,得到草地风毛菊二氯甲烷提取物。
32.其中,所述草地风毛菊醇提物的制备方法如上文所述,在此不做赘述。
33.本发明所述草地风毛菊醇提物与水混合的质量体积比优选为1:(6~10)(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值;草地风毛菊醇提物与每次加入石油醚的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
34.本发明所述草地风毛菊醇提物与每次加入二氯甲烷的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
35.每次萃取后静置10min以上。本发明所述萃取的次数优选为25~30次。
36.在本发明中,所述草地风毛菊乙酸乙酯提取物的制备方法包括:将草地风毛菊醇
提物与水混合得到混悬液,加入石油醚萃取,取下层水萃取液加入二氯甲烷,合并上层萃余液加入乙酸乙酯,分层后合并上层乙酸乙酯萃取液,干制即得。
37.其中,所述草地风毛菊醇提物的制备方法如上文所述,在此不做赘述。
38.本发明所述草地风毛菊醇提物与水混合的质量体积比优选为1:(6~10)(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值;草地风毛菊醇提物与每次加入石油醚的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
39.本发明所述草地风毛菊醇提物与每次加入二氯甲烷的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
40.本发明所述草地风毛菊醇提物与每次加入乙酸乙酯的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
41.每次萃取后静置10min以上。本发明所述萃取的次数优选为25~30次。
42.在本发明中,所述草地风毛菊正丁醇提取物的制备方法包括:草地风毛菊醇提物与水混合得到混悬液,加入石油醚萃取,取下层水萃取液加入二氯甲烷,合并上层萃余液加入乙酸乙酯,合并下层萃余液加入正丁醇,分层后合并上层正丁醇萃取液,干制,得到草地风毛菊正丁醇提取物。
43.其中,所述草地风毛菊醇提物的制备方法如上文所述,在此不做赘述。
44.本发明所述草地风毛菊醇提物与水混合的质量体积比优选为1:(6~10)(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值;草地风毛菊醇提物与每次加入石油醚的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
45.本发明所述草地风毛菊醇提物与每次加入二氯甲烷的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
46.本发明所述草地风毛菊醇提物与每次加入乙酸乙酯的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
47.本发明所述草地风毛菊醇提物与每次加入正丁醇的质量体积比为1:(6~10),(g/ml),优选为1:6、1:8、1:10,或1:(6~10)之间的任意值。
48.每次萃取后静置10min以上。本发明所述萃取的次数优选为25~30次。
49.本发明提供了一种预防或治疗由微生物感染引起的疾病的药物,由包括草地风毛菊和/或草地风毛菊提取物和药学上可接受的辅料。
50.本发明对于所述药物的剂型不进行限定,本领域技术人员熟知的粉剂、片剂、颗粒剂、注射剂等均可。
51.本发明对于所述药学上可接受的辅料不进行限定,本领域技术人员熟知的即可。
52.其中,所述由微生物感染引起的疾病包括流感和/或肠炎,微生物选自细菌、真菌、病毒,进一步为干酵母。
53.在本发明中,草地风毛菊药材及提取物对干酵母致热大鼠的体温有较好的降温作用,并且发现草地风毛菊药材粉末及各提取部位均降低发热模型大鼠血清中il-6、il-1β、tnf-α、crh、pge2、camp含量,western blot法对下丘脑组织中nf-kb信号通路相关蛋白nf-kb、ikbα、ikbβ蛋白表达,发现草地风毛菊药材及提取物下调nf-kb、ikbα、ikbβ蛋白表达。
54.在进行干酵母致热大鼠解热作用实验中,发现草地风毛菊药材及提取物能够通过中枢神经正调控介质降低发热大鼠体温。
55.进一步的,草地风毛菊药材粉末及草地风毛菊水提物、醇提物在干酵母致热大鼠解热作用过程中均有明显的降温作用。其中,与模型组相比,草地风毛菊醇提物组解热作用更为明显(p《0.01),草地风毛菊药材粉末和水提物也有解热效果(p《0.05)。
56.此外,草地风毛菊药材粉末及草地风毛菊水提物、醇提物在干酵母致热大鼠解热过程中降低大鼠血清中il-6、il-1β、tnf-α、crh、pge2、camp含量,降低下丘脑组织中nf-kb信号通路相关蛋白nf-kb、ikbα、ikbβ蛋白表达的作用。
57.因此草地风毛菊药材粉末及草地风毛菊水提物、醇提物可以成为解热抗炎候选药物,进而开发成为用于制备预防或治疗由微生物感染引起的以发热为特点的疾病的药物。
58.在本发明中,所述药物具有抗炎作用,所述抗炎作用包括抑制no释放、降低细胞因子。
59.所述细胞因子包括il-6、il-1β、tnf-α中的一种或多种。
60.所述草地风毛菊选自草地风毛菊的乙酸乙酯提取物、石油醚提取物和正丁醇提取物时,具有显著的抑制no释放和降低细胞因子的抗炎作用。
61.本发明提供了草地风毛菊药材及提取物用于制备预防或治疗受试者中的由微生物感染引起的以发热为特点的疾病的药物的新用途。草地风毛菊提取物在细胞水平、分子水平和动物实验中都具有解热抗炎的作用。
62.为了进一步理解本发明,下面结合实施例对本发明提供的草地风毛菊在制备防治由微生物感染引起的发热为特点的疾病的药物中的应用进行说明,本发明的保护范围不受以下实施例的限制。
63.本发明所检测草地风毛菊药材及提取物的均为混合物,除非另外说明,实施例中使用的各种仪器和试剂均为普通市售品,所述的sd大鼠购于湖南斯莱克景达实验动物有限公司、raw264.7细胞购于上海帅岳实业有限公司。
64.实施例1:草地风毛菊各级提取物的制备方法
65.(1)草地风毛菊醇提物
66.取草地风毛菊500g,加10倍量95%乙醇(5000ml)浸泡4-6小时,加热回流提取4小时,提取3次,合并提取液。使用4层纱布过滤后,将滤液用旋转蒸发仪减压回收溶剂,待95%乙醇回收完,晾干,即得草地风毛菊的95%乙醇提取物。
67.(2)草地风毛菊水提物
68.取草地风毛菊500g,加10倍量水(5000ml)浸泡4-6小时,加热回流提取4小时,提取3次,合并提取液。使用4层纱布过滤后,将滤液用旋转蒸发仪减压回收溶剂,待水回收完,晾干,即得草地风毛菊的水提取物。
69.(3)草地风毛菊石油醚提取物
70.取草地风毛菊500g,加10倍量95%乙醇(5000ml)浸泡4-6小时,加热回流提取4小时,共提取3次,合并提取液。使用4层纱布过滤后,将滤液用旋转蒸发仪减压回收溶剂,待95%乙醇回收完,晾干,即得草地风毛菊的95%乙醇提取物。
71.取草地风毛菊的95%乙醇提取物50g,加入500ml水,制成混悬液,放入分液漏斗,每次加400ml石油醚,放置10分钟以上,待分层后取上层石油醚层萃取液,反复萃取30次,合并所有石油醚萃取液并回收,晾干即得草地风毛菊石油醚萃取物。
72.(4)草地风毛菊二氯甲烷萃取物
73.取草地风毛菊500g,加10倍量95%乙醇(5000ml)浸泡4-6小时,加热回流提取4小时,共提取3次,合并提取液。使用4层纱布过滤后,将滤液用旋转蒸发仪减压回收溶剂,待95%乙醇回收完,晾干,即得草地风毛菊的95%乙醇提取物。
74.取草地风毛菊的95%乙醇提取物50g,加入500ml水,制成混悬液,放入分液漏斗,每次加400ml石油醚,放置10分钟以上,待分层后取石油醚层萃取液,反复萃取30次,合并所有石油醚萃取液并回收,晾干即得草地风毛菊石油醚萃取物。
75.石油醚萃取后的下层水混悬液继续加入二氯甲烷,每次加400ml二氯甲烷,放置10分钟以上,待分层后取下层二氯甲烷层萃取液,反复萃取30次,合并所有二氯甲烷萃取液并回收,晾干即得草地风毛菊二氯甲烷萃取物。
76.(5)草地风毛菊乙酸乙酯萃取物
77.取草地风毛菊500g,加10倍量95%乙醇(5000ml)浸泡4-6小时,加热回流提取4小时,共提取3次,合并提取液。使用4层纱布过滤后,将滤液用旋转蒸发仪减压回收溶剂,待95%乙醇回收完,晾干,即得草地风毛菊的95%乙醇提取物。
78.取草地风毛菊的95%乙醇提取物50g,加入500ml水,制成混悬液,放入分液漏斗,每次加400ml石油醚,放置10分钟以上,待分层后取石油醚层萃取液,反复萃取30次,合并所有石油醚萃取液并回收,晾干即得草地风毛菊石油醚萃取物。
79.石油醚萃取后的下层水混悬液继续加入二氯甲烷,每次加400ml二氯甲烷,放置10分钟以上,待分层后取下层二氯甲烷层萃取液,反复萃取30次,合并所有二氯甲烷萃取液并回收,晾干即得草地风毛菊二氯甲烷萃取物。
80.二氯甲烷萃取后的上层水混悬液继续加入乙酸乙酯,每次加400ml乙酸乙酯,放置10分钟以上,待分层后取上层乙酸乙酯萃取液,反复萃取30次,合并所有乙酸乙酯萃取液并回收,晾干即得草地风毛菊乙酸乙酯萃取物。
81.(6)草地风毛菊正丁醇萃取物
82.取草地风毛菊500g,加10倍量95%乙醇(5000ml)浸泡4-6小时,加热回流提取4小时,共提取3次,合并提取液。使用4层纱布过滤后,将滤液用旋转蒸发仪减压回收溶剂,待95%乙醇回收完,晾干,即得草地风毛菊的95%乙醇提取物。
83.取草地风毛菊的95%乙醇提取物50g,加入500ml水,制成混悬液,放入分液漏斗,每次加400ml石油醚,放置10分钟以上,待分层后取石油醚层萃取液,反复萃取30次,合并所有石油醚萃取液并回收,晾干即得草地风毛菊石油醚萃取物。
84.石油醚萃取后的下层水混悬液继续加入二氯甲烷,每次加400ml二氯甲烷,放置10分钟以上,待分层后取下层二氯甲烷层萃取液,反复萃取30次,合并所有二氯甲烷萃取液并回收,晾干即得草地风毛菊二氯甲烷萃取物。
85.二氯甲烷萃取后的上层水混悬液继续加入乙酸乙酯,每次加400ml乙酸乙酯,放置10分钟以上,待分层后取上层乙酸乙酯萃取液,反复萃取30次,合并所有乙酸乙酯萃取液并回收,晾干即得草地风毛菊乙酸乙酯萃取物。
86.乙酸乙酯萃取后的下层水混悬液继续加入正丁醇,每次加400ml正丁醇,放置10分钟以上,待分层后取上层正丁醇萃取液,反复萃取30次,合并所有正丁醇萃取液并回收,晾干即得草地风毛菊正丁醇萃取物。
87.实施例2:草地风毛菊药材粉末、草地风毛菊水提物、草地风毛菊醇提物对干酵母
致热大鼠的解热作用及机制
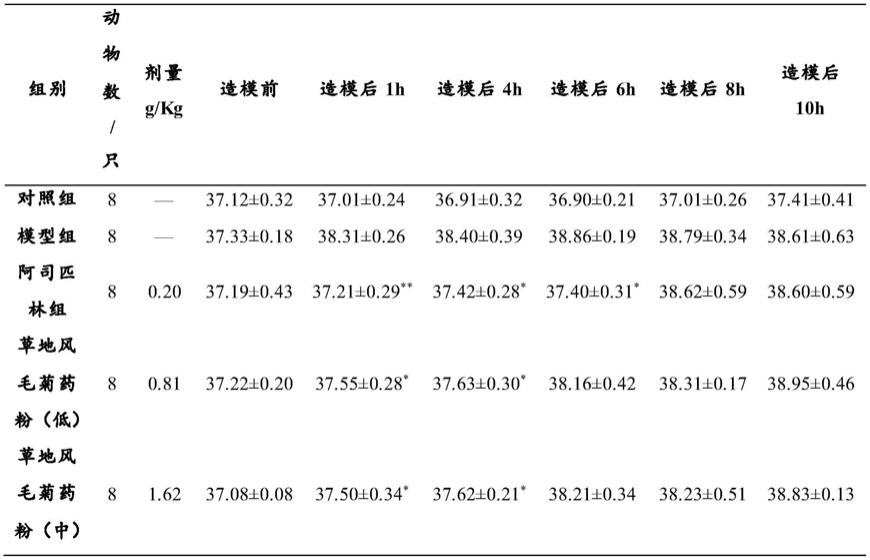
88.选用体重约220~240g的sd大鼠,实验前3天,每天用体温计间隔1h测量肛温2次,使其适应后续实验的肛温测定操作,减少后续实验体温波动对实验结果的影响。剔除前3天间隔2次测量肛温超过38℃或者2次测量值相差大于0.5℃的大鼠。将剩余大鼠随机分空白对照组、模型对照组、阿司匹林组(阳性)、草地风毛菊药材粉末组、草地风毛菊提取物高、中、低剂量组,共12组。
89.草地风毛菊提前灌胃(粉末低、中、高剂量分别为0.81、1.62、3.24g/kg;水提物低、中、高剂量分别为0.2、0.4、0.8g/kg;醇提物低、中、高剂量分别为0.08、0.16、0.32g/kg)给药7天,其他组灌胃给cm-cna(第七天阳性对照灌胃阿司匹林0.1g/kg)。致热实验前测量大鼠肛温3次,以3次平均体温作为致热前基础体温。空白对照组背部皮下注射无菌生理盐水10ml/kg;其他组大鼠背部均皮下注射15%干酵母混悬液10ml/kg。检测各组大鼠分别于给药后1、4、6、8、10h内体温。
90.检测草地风毛菊药材粉末/水提物/醇提物对干酵母致热大鼠血清中致热因子的影响时,检测完10h后体温后将实验动物进行麻醉,腹主动脉取血,4℃、3000g、15min离心分离血清,-80℃保存备用。按照试剂盒说明书操作,采用酶标仪测定450nm处吸光度,检测大鼠血清中il-6、il-1β、tnf-α、crh、pge2、camp含量,il-6、tnf-α、il-1β、crh水平。
91.测定草地风毛菊药材粉末/水提物/醇提物对干酵母致热大鼠下丘脑中nf-kb信号通路相关蛋白表达的影响时,将下丘脑组织室温解冻,每组随机抽取样本(0.1g组织),加入pbs溶液,重复浸洗3次。将组织转移到ep管中,加入1ml提取液用分散研磨机研磨15s,超声破碎20s,冰水浴30s,重复两次。冰水浴静止10min。4℃、4000r/min、离心10min后收集上清液,4℃、12000r/min再次离心30min,取上清液,-80℃保存备用。制备蛋白样品,进行sds-page电泳、转膜、封闭、置于一抗、二抗溶液中孵育、化学发光、拍照、使用graphpad prism5软件分析。计算出蛋白的相对定量值。结果见图1,图1为草地风毛菊药粉、草地风毛菊水提物、草地风毛菊醇提物对干酵母致热大鼠下丘脑中nf-kb信号通路相关蛋白表达的影响。
92.表1草地风毛菊药粉对干酵母致热大鼠体温的影响
[0093][0094][0095]
*
与模型组相比,p《0.05,
**
与模型组相比,p《0.01。
[0096]
表2草地风毛菊水提物对干酵母致热大鼠体温的影响
[0097][0098]
*
与模型组相比,p《0.05,
**
与模型组相比,p《0.01。
[0099]
表3草地风毛菊醇提物对干酵母致热大鼠体温的影响
[0100]
[0101][0102]
*
与模型组相比,p《0.05,
**
与模型组相比,p《0.01。
[0103]
表4草地风毛菊药粉、醇提物和水提物对干酵母致热大鼠血清中il-6、il-1β、tnf-α、chr、camp、pge2的影响
[0104][0105]
*
与模型组相比,p《0.05,
**
与模型组相比,p《0.01。
[0106]
通过以上结果可以得到如下结论,草地风毛菊药材粉末及草地风毛菊水提物、醇提物在干酵母致热大鼠解热作用过程中均有明显的降温作用。其中,与模型组相比,草地风毛菊醇提物组解热作用更为明显(p《0.01),草地风毛菊药材粉末和水提物也有解热效果(p《0.05)。草地风毛菊药材粉末、草地风毛菊水提物、草地风毛菊醇提物均对干酵母发热大鼠
有较好的降温作用。草地风毛菊药材粉末、草地风毛菊水提物、草地风毛菊醇提物均能够显著降低干酵母致热大鼠血清中il-6、il-1β、tnf-α、chr、camp、pge2的水平;草地风毛菊药粉、草地风毛菊水提物、草地风毛菊醇提物均下调干酵母致热大鼠下丘脑中nf-kb通路相关蛋白的表达。以上结果表明,草地风毛菊药材粉末、草地风毛菊水提物、草地风毛菊醇提物均对干酵母致热大鼠有较好的解热作用,解热作用机制与降低血清和脑脊液中致热因子和体温调节介质的含量有一定的关系,并且可能与nf-kb信号通路的调节有关。草地风毛菊醇提物的解热效果较粉末、水提物好一些。
[0107]
实施例3:草地风毛菊石油醚提取物、二氯甲烷提取物、乙酸乙酯提取物、正丁醇提取物对raw264.7细胞毒性和对脂多糖(lipopolysaccharide,lps)诱导raw264.7细胞增殖的影响、释放no的影响、分泌il-6、il-1β、tnf-α的影响。
[0108]
细胞培养:取巨噬细胞raw264.7细胞株在含有10%胎牛血清、1%双抗(100u/ml青霉素、100ug/ml链霉素溶液)的dmem高糖培养液中,在37℃、5%co2的培养箱中培养至约80%-90%时进行传代。fbs(胎牛血清)和dmem高糖培养基均购自美国sigma公司。
[0109]
在mtt法检测草地风毛菊石油醚提取物/二氯甲烷提取物/乙酸乙酯提取物/正丁醇提取物的细胞毒性时,将对数生长期细胞以每孔1x105个接种于96孔板中,培养过夜;各组加入不同浓度草地风毛菊提取物,使其药物浓度为15.63、31.25、62.5、125、250、500、1000、2000μg/ml,空白对照组仅加入培养基;孵育24h后,每孔加入50μl的mtt(5mg/ml)溶液,37℃孵育4h;吸弃孔内的培养液,每孔加入150μl的dmso震荡至板底的紫色结晶完全溶解,酶标仪450nm波长处测定吸光度od值。细胞存活率(%)=(实验组od-空白空od)/(空白对照组od-空白组od)x100%
[0110]
在检测草地风毛菊石油醚提取物/二氯甲烷提取物/乙酸乙酯提取物/正丁醇提取物对lps诱导巨噬细胞raw264.7分泌no的影响时,将对数生长期的raw264.7细胞,用0.25%胰酶消化液消化,离心(800r/min,5min)调整细胞密度为6
×
104个/孔,并接种于96孔细胞培养板,每孔定容100μl,分为6组:空白对照组(dmem完全培养液常规培养)、模型对照组(0.1mg/llps刺激)、阳性地塞米松组(0.1mg/llps 0.05mg/l地塞米松)、草地风毛菊石油醚提取物/二氯甲烷提取物/乙酸乙酯提取物/正丁醇提取物(0.1mg/llps 25μg/ml、0.1mg/l lps 50μg/ml、0.1mg/l lps 100μg/ml、0.1mg/l lps 250μg/ml)。每一浓度设3个复孔,于37℃、5%co2培养箱孵育24h后收集上清液,按照试剂盒说明书操作。用griess法检测no
2-含量。
[0111]
在检测草地风毛菊石油醚提取物/二氯甲烷提取物/乙酸乙酯提取物/正丁醇提取物对lps诱导巨噬细胞raw264.7分泌细胞因子的影响时,将对数生长期的raw264.7细胞以2
×
105/孔接种于24孔培养板中,细胞处理按上面所述用elisa法检测il-6、il-1β、tnf-α、chr、camp、pge2的含量,操作步骤按照试剂盒说明书进行。
[0112]
独立实验重复两次,结果取两次平均值。
[0113]
实验结果如下:
[0114]
表5草地风毛菊石油醚提取物、二氯甲烷提取物、乙酸乙酯提取物、正丁醇提取物对巨噬细胞raw264.7的影响
[0115][0116][0117]
通过体外抗炎实验发现,草地风毛菊的石油醚、二氯甲烷、乙酸乙酯、正丁醇提取物的浓度在250μg/ml及以下时,对raw264.7细胞增殖无影响。
[0118]
表6草地风毛菊石油醚提取物、二氯甲烷提取物、乙酸乙酯提取物、正丁醇提取物
对lps诱导的raw264.7细胞no释放的抑制率
[0119][0120][0121]
*
与模型组相比,p《0.05,
**
与模型组相比,p《0.01。
[0122]
草地风毛菊的乙酸乙酯提取物在31.25-250μg/mg均可以抑制no释放(p《0.05,p《0.01),石油醚提取物和正丁醇提取物在125-250μg/mg时可以抑制no释放(p《0.05),而其二氯甲烷提取物只有在最高安全浓度250μg/mg时对no的释放具有抑制作用(p《0.05)。
[0123]
表7草地风毛菊石油醚提取物、二氯甲烷提取物、乙酸乙酯提取物、正丁醇提取物对lps诱导raw26.47细胞il-6、il-1β、tnf-α的影响
[0124][0125]
*
与模型组相比,p《0.05,
**
与模型组相比,p《0.01。
[0126]
草地风毛菊的乙酸乙酯提取物在31.25-250μg/mg均可以降低细胞因子il-6、il-1β、tnf-α的水平(p《0.05,p《0.01);石油醚提取物和正丁醇提取物在125-250μg/mg时可以抑制il-6、il-1β的水平(p《0.05),对tnf-α的水平无影响(p》0.05);二氯甲烷提取物对il-6、il-1β、tnf-α的水平均无影响(p》0.05)。
[0127]
通过以上结果可以得到如下结论,草地风毛菊乙酸乙酯提取物能抑制lps诱导raw264.7细胞分泌il-6、il-1β、tnf-α,且程剂量依赖性;草地风毛菊石油醚提取物和正丁醇提取物可以抑制il-6、il-1β的水平。草地风毛菊的抗炎作用,机制可能与抑制il-6、il-1β、tnf-α等细胞因子的分泌有关。
[0128]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。