脱环氧埃坡霉素衍生物制剂、制备及其治疗肿瘤的应用
1.本技术是申请号为201780010021.3、申请日为2017年2月6日、发明名称为“脱环氧埃坡霉素衍生物制剂、制备及其治疗肿瘤的应用”的专利申请的分案申请。
技术领域
2.本技术涉及一种脱环氧埃坡霉素衍生物药物制剂的制备方法及药物制剂在治疗癌症中的应用,尤其涉及该类化合物药物制剂的制备方法、单独用药或与其它肿瘤药物进行联合使用治疗癌症,特别是晚期乳腺癌的临床应用。
背景技术:
3.全球每年新诊断的癌症患者为1400多万,癌症已成为对人类的危害非常严重的常见病、多发病。由于癌症的早期诊断和治疗还没有达到令人满意的程度,大多数癌症患者经过手术或放疗后,仍会复发或转移到全身,需要接受全身治疗。目前,用于全身治疗、特别是治疗中晚期癌症患者的主要手段仍以化学药物治疗为主,对于既往接受过大剂量蒽环类抗生素和紫杉类治疗的晚期乳腺癌患者而言,目前除已批准的卡培他滨和吉西他滨外,可以选择的治疗药物很少,且吉西他滨在二线或三线背景下的应用不明确。其它药物包括长春瑞滨、贝伐单抗 紫杉醇、顺铂、卡铂、依托泊甙、长春碱以及很少应用的氟尿嘧啶注射液,但几乎未有证据提示其产生了显著疗效。因此开发安全和有效的小分子抗癌药物仍是各国积极寻找的癌症治疗方法和途径。
4.埃坡霉素a(epoa)和埃坡霉素b(epob)为聚酮化合物衍生的16元大环内酯新型化合物,最初从土壤细菌sorangiumcellulosum菌株so ce90中分离出来,其结构式如下所示。它们为最先被分离,合成并确证的埃坡霉素,(hofle et al.,1996,angew.chem.int.ed.engl.35(13/14):1567-1569;gerth et al.,1996.j.antibiotics 49(6):560-563)。聚酮化合物在自然界存在于多种生物体中,由聚酮化合物合成酶pks(polyketide synthase)合成。
5.埃坡霉素对治疗癌症有巨大的潜能。虽然在结构上不相似,但埃坡霉素的作用机理和主流化疗药物紫杉醇(paclitaxel)极为相似,即诱导微管蛋白聚合、稳定微管组装。这些化合物表现出对不同癌细胞系的强大细胞杀伤力。特别是,它们对具有多药耐药性(mdr)的肿瘤细胞系,尤其是对耐紫杉的肿瘤细胞系,显示出引人注目的效果(altmann et al.,2000.biochem.biophys.acta.1470(3):m79-91;bollag et al.,cancer res.55(11):2325-2333)。
6.虽然埃坡霉素化合物具有显著的治疗学性质,但由于某些性质方面的原因,他们在药物配制和临床应用方面对技术人员而言还存在一些困难,本技术式i化合物可以安全的进行调剂并可以通过注射进行给药。许多抗癌药具有与毒性有关的作用,由于毒性,许多有效的抗癌药的治疗受到局限,因此本领域致力于通过合适的制剂配方、给药方法或给药剂量以减少或避免与抗癌药物相关的毒性,从而获得可临床使用的有效抗癌药物。
技术实现要素:
7.本技术包含了一种用于治疗肿瘤的脱环氧埃坡霉素非肠道用药的药物制剂和应用。
8.本技术的方法和制剂描述了一种用于包含了脱环氧埃坡霉素式i的制剂及其制备方法。
9.脱环氧埃坡霉素衍生物在水性介质中具有非常低的溶解度,并在与水性介质接触后会迅速析出或降解,难于进行制备。本技术的药物制剂解决了这个问题。
10.根据一个方面,本技术提供了一种药物制剂,其包含作为脱环氧埃坡霉素衍生物的式i化合物的晶体和赋形剂,所述赋形剂由醇(如乙醇)和至少一种(例如一至三种)增溶剂分别以一定比例混溶,其中醇(如乙醇)20-50%(v/v),每种增溶剂可分别为5-50%(v/v):
[0011][0012]
式i
[0013]
式i中,r2=ch3或h。
[0014]
根据本技术的一些实施方式,所述增溶剂可选自:聚氧乙烯蓖麻油(cremorphore el或elp),丙二醇,peg(如polyethylene glycol 300-500),solutol-hs15,captisol或hydroxypropyl-β-cyclodextrin(hp-β-cd)等。当使用一种以上增溶剂时,其中每种增溶剂的含量可以为5-50%(v/v)。
[0015]
根据一些实施方式,所述赋形剂优选是由无水乙醇、聚氧乙烯蓖麻油(cremorphore el或elp)和丙二醇组成。更优选地,赋形剂是由无水乙醇:聚氧乙烯蓖麻油:丙二醇(体积比)=5:2:3组成。
[0016]
根据一些实施方式,本技术的药物制剂为可施用于胃肠道外的溶液形式。
[0017]
根据一些实施方式,本技术的药物制剂中的式i化合物选自其中r2=ch3的化合物。
[0018]
根据一些实施方式,本技术的药物制剂中式i化合物的浓度为5-20mg/ml,优选为10mg/ml。该药物制剂可被装在独立的玻璃小瓶中为3ml或5ml。
[0019]
根据本技术的另一方面,本技术涉及上述药物制剂在制备抗肿瘤药物中的应用。
[0020]
根据本技术的再一方面,本技术提供了一种治疗患者肿瘤的方法,该方法包括含将本技术所述的药物制剂施用于患者体内。
[0021]
根据本技术的又一方面,本技术提供了上述药物制剂,其用于抗肿瘤或治疗肿瘤患者。
[0022]
根据本技术的一些实施方式,所述抗肿瘤药物为抗实体瘤药物。具体地,所述实体瘤可选自乳腺癌、肺部肿瘤、淋巴肿瘤、结肠癌、前列腺癌、神经系统肿瘤(脑癌)、卵巢癌、肝癌、头颈肿瘤、胃癌和肾癌。优选乳腺癌、肺癌、肝癌、结直肠癌和胃癌。
[0023]
根据本技术的一些实施方式,所述抗肿瘤药物用于治疗之前没有接受过对实体癌
治疗的患者或之前已接受过实体癌治疗的患者。
[0024]
根据本技术的一些实施方式,所述抗肿瘤药物用于治疗紫衫烷类抗肿瘤药物治疗抗药或复发的肿瘤或难以治疗的肿瘤。
[0025]
根据本技术的一些实施方式,本技术的药物制剂在一定数量适宜的非肠道的稀释剂进行稀释,从而使得其中所说衍生物的浓度为0.05mg/ml至0.5mg/ml。所用的稀释剂是注射用5%葡萄糖注射液、乳酸钠林格氏注射液、无菌注射用水或无菌注射用生理盐水,例如为无菌注射用生理盐水。
[0026]
根据一些实施方式,在本技术的药物制剂中,所包含的增溶剂是captisol(β-cyclodextrinsulfobutyl ether),形成5-20%的captisol溶液(含或不含乙醇和丙二醇)作为药物制剂,优选8%captisol,该含captisol药物制剂可被缓冲溶液稀释成含式i化合物0.5mg/ml至1.0mg/ml的稀释后药物制剂,供临床使用。所述缓冲溶液例如为磷酸盐缓冲剂。或者,可将captisol制剂冷冻干燥(lyophilization)。或在使用时,再用一定数量适宜的常用的稀释剂(含或不含乙醇和丙二醇)进行稀释(reconstitution),从而使得其中式i化合物的最终浓度为0.5mg/ml至1.0mg/ml。
[0027]
根据本技术的一个方面,所述的抗肿瘤药物治疗患者的方法包含给所述患者静脉内或口服施用治疗有效剂量的式i所示的化合物。在每次静脉输注或口服、或同时输注和口服时,用于人的剂量的实例为10mg/m2/天至175mg/m2/天,其可以以一个单剂量来进行给药,或者可以以各个分割剂量的形式给药。根据本技术的一些实施方式,所述药物制剂为静脉内给药。例如,在第1至第5天静脉给药,每天给药一次,连续给药5天,每3周一个治疗周期,以静脉输注的形式给药。所述式i化合物的给药剂量是约10mg/m2/天至50mg/m2/天,例如约40mg/m2/天的剂量进行静脉内给药。
[0028]
当口服给药时,式i化合物优选与可药用的酸中和缓冲剂一起,如碳酸盐或磷酸盐,所述的含式i的溶液包含磷酸盐缓冲剂(ph约为8,浓度为1m),该缓冲剂可中和患者胃中的酸从而降低式i化合物的降解速度。可以固体口服剂型(如片剂或粉剂,包肠衣的丸剂或胶囊剂)或液体口服剂,进行口服给药。
[0029]
根据本技术的一些实施方式,其中所述式i化合物是在约30分钟至约3小时的时间内静脉给药,例如在约1.5小时的时间内给药。
[0030]
根据本技术的一些实施方式,所述药物制剂可与至少一种其它抗癌药物联合使用。
[0031]
根据本技术的一些实施方式,所述其它抗癌药物选自化疗药物5-氟尿嘧啶类如卡培他滨(capecitabine)、健泽(gemcitabine),或者选自烷化剂如卡铂(carboplatin)和顺铂(cisplatin),或者选自靶向药物如iressa、gleevec、凯美纳、lapatinib或单克隆抗体药物如曲妥珠单抗(herceptin,trastuzumab)、贝伐珠单抗(avastin,bevacizumab)、帕妥珠单抗(perjeta,pertuzumab)或肿瘤免疫治疗药物anti-pd-1/pd-l1和anti-ctla-4等,或者选自激素类内分泌治疗药物诺雷德、来曲唑。
[0032]
根据本技术的一些实施方式,所述化合物采用每3周一个治疗周期的给药,其中所述式i化合物在第1至第5天,每天给药一次,连续给药5天,以静脉输注的形式进行给药;当其它抗癌药物选自卡培他滨,即与卡培他滨联合使用时,卡培他滨在第1天至第14天,连续给药14天,每天给药2次,口服。例如,式i的化合物是以约10mg/m2/day至50mg/m2/day的剂量
进行静脉内给药的;其中卡培他滨是以约1000mg/m2/day至2500mg/m2/day的剂量进行口服给药。再例如,式i的化合物是以约30mg/m2/day的剂量进行静脉内给药的,卡培他滨是以约2000mg/m2/day的剂量进行口服给药。
[0033]
本技术还涉及一种治疗肿瘤的方法,其包含将式i化合物施用于有此需求的患者。
[0034]
本技术还涉及一种制备本技术的式i化合物的晶体的方法,其包括以下步骤:将式i化合物加入醇(如乙醇)后与水40%-60%v/v,优选50%(醇:水),加入量为20-50ml/g混合后,在不高于室温的条件下,使式1化合物结晶析出,获得的晶体通过真空干燥或冷冻干燥,在24小时至98小时,优选48小时,干燥后得到化合物的晶体。
[0035]
本技术的药物制剂独特,药物稳定性好,临床给药方法科学有效,充分体现了脱环氧埃坡霉素衍生物的疗效以及具有较低不良反应,特别是基本没有骨髓抑制毒性方面的优势。
[0036]
本技术的方案:
[0037]
1.一种药物制剂,其包含式i化合物的晶体和赋形剂,所述赋形剂由乙醇和至少一种增溶剂(或含水)以一定的比例混溶组成,其中基于赋形剂总体积,乙醇为20-50%(v/v)
[0038][0039]
式i中,r2=ch3或h。
[0040]
2.根据方案1所述的药物制剂,其中所述的药物制剂为施用于胃肠道外或口服的溶液形式。
[0041]
3.根据方案1至2中任一项所述的药物制剂,其中所述的增溶剂为聚氧乙烯蓖麻油和丙二醇二者的组合;具体地,赋形剂由无水乙醇:聚氧乙烯蓖麻油:丙二醇=5:2:3(v/v)组成。
[0042]
4.根据方案1至3中任一项所述的药物制剂,其中所述的药物制剂中的式i化合物的浓度为5-20mg/ml,优选10mg/ml。
[0043]
5.根据方案1至4所述的应用或方法,其中所述药物制剂用于非肠道给药时,被稀释剂稀释后,使其中所述式i化合物的浓度为0.05mg/ml至0.5mg/ml;优选地,所用的稀释剂选自注射用5%葡萄糖注射液、无菌注射用水或无菌注射用生理盐水。
[0044]
6.根据方案1至5中任一项所述的药物制剂,其中所述的增溶剂为captisol,制得的药物制剂为5-20%(wt)的captisol溶液(含或不含乙醇和丙二醇),或将captisol溶液冷冻干燥,或制成固体口服剂型。
[0045]
7根据方案6所述的药物制剂,其中所述药物制剂captisol溶液在使用时以缓冲溶液(优选磷酸盐缓冲剂)稀释成式i化合物的浓度为0.5-1.0mg/ml的药物溶液;或将冷冻干燥物再溶解(含或不含乙醇和丙二醇的稀释液),形成式i化合物的浓度为0.5-1.0mg/ml的
药物溶液。
[0046]
8.方案1-7中任一项所述的药物制剂在制备抗肿瘤药物中的应用或一种治疗肿瘤患者的方法,该方法包括将方案1-7所述的药物制剂施用于肿瘤患者。
[0047]
9.根据方案8所述的应用或方法,其中所述化合物对肿瘤患者的给药剂量是约10mg/m2/天至50mg/m2/天。
[0048]
10.根据方案8或9所述的应用或方法,其中所述化合物是在约30分钟至约3小时的时间内静脉输注给药。
[0049]
11.根据方案8至10中任意一项所述的应用或方法,当用于肠道用药时,其中所述化合物对肿瘤患者的给药剂量是约50mg/m2/天至200mg/m2/天,每天给药1-3次,连续给药多天。
[0050]
12.根据方案8至11所述的应用或方法,其中所述肿瘤为实体瘤。
[0051]
13.根据方案12所述的应用或方法,其中所述实体瘤选自乳腺癌、肺部肿瘤、淋巴肿瘤、结肠癌、前列腺癌、脑癌、卵巢癌、肝癌、肺癌、胃癌、头颈肿瘤、肾癌和神经系统肿瘤。
[0052]
14.根据方案13所述的应用或方法,其中所述药物制剂用于治疗紫杉烷类抗肿瘤药物治疗无效或复发的肿瘤或难治疗的肿瘤或对使用微管稳定剂治疗有效的肿瘤。
[0053]
15.根据方案13或14所述的应用或方法,其中所述药物制剂用于之前对癌症没有进行过治疗或已经对癌症进行过治疗的癌症,所述癌症尤其是人上皮细胞生长因子受体2(her2)阴性的乳腺癌,优选her2阴性和激素受体阳性的乳腺癌。
[0054]
16.根据方案8-15中任一项所述的应用或方法,其中所述化合物采用每18-24天为一个治疗周期给药;在第1至第5天,每天给药一次,连续给药3天或5天,以静脉输注的形式进行给药。
[0055]
17.根据方案8至16中任一项所述的应用或方法,其中所述药物制剂可与至少一种其它抗癌药物联合使用。
[0056]
18.根据方案17所述的应用或方法,其中所述其它抗癌药物选自化疗药物5-氟尿嘧啶类如卡培他滨(capecitabine)、健泽(gemcitabine),或者选自烷化剂如卡铂(carboplatin)和顺铂(cisplatin),或者选自靶向药物如iressa、gleevec、凯美纳、lapatinib或单克隆抗体药物如曲妥珠单抗(herceptin,trastuzumab)、贝伐珠单抗(avastin,bevacizumab)、帕妥珠单抗(perjeta,pertuzumab)或肿瘤免疫治疗药物anti-pd-1/pd-l1和anti-ctla-4,或者选自激素类内分泌治疗药物诺雷德、来曲唑。
[0057]
19.根据方案18所述的应用或方法,其中,所述式i化合物当与其它抗癌药物联合使用,其它抗癌药物是卡培他滨时,式i化合物采用每3周一个治疗周期给药,其中在第1至第5天,每天给药一次,连续给药5天,以静脉输注的形式进行给药;卡培他滨第1天至第14天,连续给药14天,每天口服给药2次。
[0058]
20.根据方案19所述的应用或方法,其中式i的化合物是以约10mg/m2/天至50mg/m2/天的剂量进行静脉内给药的;卡培他滨是以约1000mg/m2/天至2500mg/m2/天的剂量进行口服给药。
[0059]
21.根据方案8-20中任一项所述的应用或方法,其中式i的化合物单独应用时是以约40mg/m2/天的初始剂量静脉内给药,当与卡培他滨联合时,式i的化合物是以约30mg/m2/天的初始剂量静脉内给药,卡培他滨是以约2000mg/m2/天的剂量口服给药。
[0060]
22.一种制备方案1至7中任一项的式i化合物的晶体的方法,其包括以下步骤:化合物i在醇(如乙醇)与水40%-60%v/v,优选50%v/v混合后,以20-50ml/g,在低温-室温的条件下,使结晶析出,获得的晶体通过真空干燥,在24小时至98小时,优选48小时,干燥后得到化合物的晶体。
[0061]
发明详述
[0062]
本技术的药物制剂可采用如下方法制得。将式i化合物通过一种醇如乙醇与水40%-60%v/v,优选50%,加入量为20-50ml/g,进行结晶析出,获得的晶体通过真空或冷冻干燥,在24小时至98小时,优选48小时,可制得保存和制备制剂的原料药,可除去产品中的残余溶剂和水,以及减少药品中有害的内毒性。为了将制剂溶液中聚氧乙烯蓖麻油的数量降到最低,干燥的式i化合物用50%v/v无水乙醇(usp),30%v/v丙二醇(usp)和20%v/v其他增溶剂的混合物为溶剂的赋形剂来进行制备制剂,其中所述的其他增溶剂优选的是聚氧乙烯蓖麻油(cremophor el或elp),提供足够数量的赋形剂以形成一种具有约5mg/ml至约20mg/ml的式i化合物的溶液,优选约10mg/ml,可使式i化合物的初始制剂和稀释后临床配伍制剂表现出更好的稳定性。同时因使用丙二醇增溶剂,将蓖麻油的浓度降到最小的需要量,减少了该溶剂引发的过敏变态反应。用本技术制剂所观测到的变态反应水平显著低于某些其他抗肿瘤制剂(含50%蓖麻油)。
[0063]
本技术提供的药物制剂中的式i化合物可以多种光学异构体、立体异构体的形式存在,也可与各种有机酸和无机酸形成盐。
[0064]
本技术所制备的制剂可通过罐装机组进行无菌罐装至玻璃小管或小瓶,优选5ml西林瓶,可装含约0.5ml至约5ml的制剂,加盖药用镀聚四氟乙烯类膜丁基橡胶塞后密封可在至少2-8℃的温度下保存超过24个月。
[0065]
对本技术制剂中的化合物在临床使用时的最终稀释可以用适宜的稀释剂来完成,如可以用5%葡萄糖注射液、无菌注射用水或无菌注射用生理盐水和乳酸盐林格氏注射液,制得可注射液的体积约为50ml至300ml,优选约为100ml至250ml。稀释后的溶液在进行给药之前可以在室温下存放不低于约24小时,从而使得其中所说式i化合物的最终给药浓度优选包含约为0.05mg/ml至0.5mg/ml的式i化合物。
[0066]
式i的化合物可以与一种或多种其他物质一起进行给药以便预防恶心、过敏或胃肠道反应,其中所说的其他物质如止吐药或h1,h2抗组胺药。
[0067]
本技术所制备的制剂通过上述方法稀释后可用于静脉滴注,静脉滴注时间为30分钟-3小时,优选1.5小时,每天给药1次,连续5天给药,每21天为一治疗周期,可联合口服卡培他滨1000mg/m2/次,每天2次,持续1~14天,21天为一治疗周期。所述式i化合物采用每3周一个治疗周期的给药;在第一至第五天,每天给药一次,连续给药5天,以静脉输注的形式进行给药,所述的静脉输注是在约45分钟至约3小时的时间内进行给药的,优选在约1.5小时的时间内进行给药。
[0068]
其他可使用的增溶剂有为peg,captisol,solutol-hs 15,也可与乙醇和/或丙二醇混合使用。
[0069]
本技术还涉及治疗癌症患者的方法,该方法包括给患者施用一种或多种治疗有效量的由式i所示的化合物或其制剂,优选进行静脉给药的方法。在一些实施案中,描述了一种用于包含了脱环氧埃坡霉素式i的给药方案和给药剂量,采用各个分割剂量的形式来进
行给药,特定的患者其给药剂量和给药频率是可变的,取决许多因素,如药物的代谢、患者的一般情况以及癌症疾病的严重程度和对药物的不良反应的不同等。优选将本技术的药物制剂每天给药一次,连续为给药5天,约3-4周(18-28天,优选3周,18-24天)为一个治疗周期,每周期静脉输注的药物剂量范围约5mg/m2/day至50mg/m2/day,并且更优选为20mg/m2/day至40mg/m2/day。一般给药至患者出现了药物相关的不良反应时需终止给药或降低剂量,或延迟给药。减低剂量按照起始剂量的20%-30%,优选20%继续给药。
[0070]
本技术进一步提供了具有式i所示的脱环氧埃坡霉素衍生物在抗肿瘤中的应用。在治疗时,包括给癌症患者非肠道给药有效治疗量的本技术药物制剂,如果必要的话,可以重复给药,以防止癌扩散或者是根治癌症。另一方面,本技术的药物制剂可以单独使用,也可以与其它抗癌药物或疗法共同使用。例如,可以和本技术的化合物一起用于联合治疗的其它化疗药可选自抗代谢物,如5-氟尿嘧啶和健泽(gemcitabine),或者选自烷化剂如卡铂(carboplatin)和顺铂(cisplatin),或者选自靶向药物如iressa、gleevec、凯美纳、lapatinib或单克隆抗体药物如曲妥珠单抗(herceptin,trastuzumab)、贝伐珠单抗(avastin,bevacizumab)、帕妥珠单抗(perjeta,pertuzumab)或肿瘤免疫治疗药物anti-pd-1/pd-l1和anti-ctla-4等,或者选自激素类内分泌治疗药物诺雷德,来曲唑。联合疗法可以采用顺次给药的方式,即先后分别给予本技术的药物制剂和其它化疗药,也可以采用同时给药的方式。
[0071]
本技术的药物制剂可用于治疗和/或预防转移性肿瘤以及原发瘤。本技术也包含以前单独或同时接受了实体瘤的放疗和化疗的患者的治疗,也可用于天然对紫衫类药物不敏感或后来变得对其不敏感的肿瘤。
[0072]
在一些实施案中,本技术的药物制剂的给药剂量包含每天给药一次,连续为给药5天,约三周为一个治疗周期,每天静脉输注的剂量范围约5mg/m2/天至50mg/m2/天,并且更有选为20mg/m2/天至40mg/m2/天。
[0073]
本技术的式i化合物可与其它的抗癌药物联合给药,其它的抗癌药物包括烷化剂、抗代谢类、抗生素类、激素类、植物产品、单克隆抗体药物或肿瘤免疫治疗药物。
[0074]
本技术还包含了含式i化合物的药物制剂,单独使用或与卡培他滨联合使用用于治疗晚期乳腺癌的用途,尤其是人上皮细胞生长因子受体2(her2)阴性(human epidermal growth factor receptor 2-negative)乳腺癌,优选her2阴性和激素受体阳性(hormone receptor(er or/and pr)-positive)乳腺癌。
[0075]
本技术还提供了式i化合物(或称为“脱环氧埃坡霉素衍生物”)与免疫治疗药物联合使用用于治疗实体瘤,包括晚期乳腺癌或肺癌的用途。
[0076]
本技术提供了一种治疗肿瘤患者的方法,该方法包括含将本技术所述的药物制剂对患者进行胃肠外给药或口服给药。
[0077]
根据一些实施方式,其中所述的药物制剂是在21天或多于21天的周期内进行用药,静脉内给药或口服给药,一个周期内可单次给药也可多次给药,优选多次给药。
[0078]
本技术的脱环氧埃坡霉素衍生物与卡培他滨联合用于治疗晚期转移性乳腺癌时,治疗有效量的脱环氧埃坡霉素衍生物与一定剂量(2000-2500mg/m2/day)卡培他滨联合使用。
具体实施方式
[0079]
以下实施例仅为示例目的,不应构成对本技术的限定。
[0080]
制备实施例
[0081]
实施例1.制剂的制备
[0082]
制剂制备工艺包括:结晶体的制备、制剂配制、过滤、装填、加塞、密封等步骤
[0083]
1)、将干燥的式i化合物(其中r2=ch3的75克干燥物用100%乙醇20ml/g浓度溶解后,采用0.2um膜无菌过滤,滤液在搅拌下,缓慢加入40%水后,加入少量晶种后继续搅拌30分钟。然后将其余的水加入到溶液中至乙醇浓度为50%。在搅拌过程中,利用冷却水浴,使结晶溶液温度至4℃,继续搅拌2-12小时。将晶体真空抽滤,随后迅速用4℃的冷却30%乙醇水溶液进行洗涤。将晶体放在真空干燥箱中干燥48小时。获得产品60g,可置于清洁干燥的玻璃瓶中保存。
[0084]
2)由步骤1)获得的产品,每克化合物用20g无水乙醇(药典级)溶解形成一种溶液,在搅拌条件下,加入21.0g的聚氧乙烯蓖麻油(药典级),搅拌混匀10-15min,然后将31.1g的丙二醇(药典)加入到混合溶液中继续搅拌10-15min,最后加入19.45g的无水乙醇(药典级),继续搅拌直至溶液澄清(5~10min),制得10mg/ml含式i化合物的制剂溶液,其中赋形剂无水乙醇:聚氧乙烯蓖麻油:丙二醇的体积比为5:2:3。
[0085]
3)由步骤2)所得的制剂通过0.2um的过滤器(millipore)过滤除菌,除菌后将制剂灌装到5ml的西林瓶中,每个西林瓶罐装3ml 0.25ml或5ml 0.3ml,之后加塞、密封,于2~8℃下保存备用。保存时间大于24个月。在这些过程中没有观察到药物降解或析出的现象,药物溶解度好并稳定,利于保存。
[0086]
4)本药物制剂可通过1:20或1:50的生理盐水的稀释,在室温24小时内,其外观色泽、ph值、可见异物、含量、有关物质均没有发生显著变化,说明式i化合物与常用的溶液稀释无配伍禁忌。在室温下保存可以稳定至少24小时以上。
[0087]
实施例2制剂的制备:
[0088]
本实施方案的主要目的是使用captisol增加式i化合物的溶解度,减少或不用聚氧乙烯蓖麻油,从而到达降低患者的超过敏的不良反应的目的。
[0089]
1.取100克captisol溶解在200ml的水(wfi)中,制备为50%的captisol的浓溶液;
[0090]
2.取400mg式1化合物,加入10ml乙醇溶解,制得40mg/ml的乙醇样品溶液。
[0091]
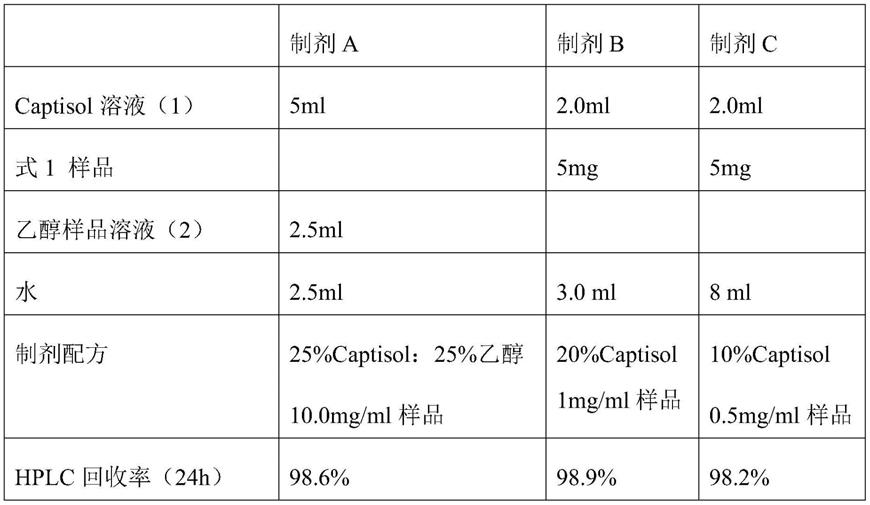
3.按照下表中配置含captisol的样品溶液:
[0092][0093]
4.制剂a、b、c配制后完全溶解,室温放置0h和24后h分别取样1ml,12000rpm高速离心10分钟后,取上清,加入乙氰溶剂稀释后进行hplc分析,回收率》98%。
[0094]
5.在室温24小时后,式i化合物在制剂a、b、c溶液中全部溶解,且在24h内没有发生析出现象,说明药物溶解度好并稳定,利于保存。制剂a稀释后,captisol为2.5%或1.25%,在24h内无析出。
[0095]
6.制剂a制备为规格为5ml的浓溶液保存。临床使用时可选用稀释剂如无菌注射用水或无菌注射用生理盐水,或磷酸盐缓冲液稀释,制成含式1化合物0.5mg/ml-1.0mg/ml溶液,稀释液在室温12h内没有发生显著变化。
[0096]
7.取10ml制剂b进行冷冻干燥48h,形成白色粉沫。hplc分析样品没有检测出降解。说明该制剂进行冷冻干燥,稳定性好,利于保存。
[0097]
8.通过步骤7干燥的样品,加入10ml或20ml一种稀释液,如无菌注射用水,无菌生理盐水或磷酸盐缓冲剂(含或不含1%丙二醇和10%乙醇),制成含式1化合物0.5mg/ml-1.0mg/ml溶液。稀释液在室温12h内没有发生显著变化。
[0098]
生物活性实验
[0099]
以下的生物活性实验使用的本技术的药物制剂均为实施例1所制备的制剂。
[0100]
实施例3.口服给药的生物利用度
[0101]
式i的药物制剂(赋形剂无水乙醇:聚氧乙烯蓖麻油:丙二醇的体积比为5:2:3)用磷酸盐缓冲液稀释为1.0mg/ml分别采用静脉滴注(时间1小时)或口管灌食比格犬后,在不同时间(给药开始起至24小时)进行血样采集,分析血液浓度,计算比格犬在血浆中的auc和生物利用度。
[0102]
剂量(mg/kg)比格犬id=201比格犬id=202生物利用度3.6(mg/kg)auc(静脉滴注)auc(口服)f(%)血药浓度(ng
·
ml-1
)16258923256.8
[0103]
本实施证明了式i化合物(尤其是r=ch3)在比格犬中通过口服给药有很好的生物利用度(》50%),可用于口服制剂的制备和给药。
[0104]
实施例4.本技术的药物制剂在体内采用静脉推注给药对人体肿瘤细胞异种移值模型的抗肿瘤实验
[0105]
1)动物数:试验组及阳性对照组每组6只裸小鼠,体重:20-21克,阴性对照各为两组。
[0106]
2)剂量设置及给药方案:根据约定剂量进行(见实验结果中的描述)。注射体积0.2ml/鼠。
[0107]
3)试验对照:阴性对照为相应的溶媒,阳性对照为临床广泛应用的抗肿瘤药物紫杉醇。
[0108]
4)试验主要步骤:
[0109]
无菌条件下取生长旺盛的瘤源,以匀浆法制备成约1-3
×
107/ml细胞悬液,于相应宿主腋皮下接种0.2ml/每鼠,待种瘤触及后开始给药,按实验设计方案给药,三至四周左右处死各组动物,剖取肿瘤称重,按下列公式计算肿瘤抑制率:
[0110]
肿瘤抑制率%=[(阴性对照组平均瘤重一给药组平均瘤重)/阴性对照组平均瘤重)
×
100%
[0111]
5)试验结果:
[0112]
将本技术的制剂以2.5、1.0、0.4mg/kg/d,iv
×
10bid方案给药,对人体肿瘤肠癌hct-15异种移植于腋皮下实体瘤模型的抑瘤率分别为:87.74%、77.42%、60.19%,紫杉醇对照组10mg/kg/次iv
×
7qd给药方案的疗效抑瘤率52.2%
[0113]
式i化合物按将本技术的制剂以剂量2.5、1.0、0.4mg/kg/次iv
×
10bid方案给药,对人体肿瘤肝癌hep-g2异种移植于腋皮下实体瘤模型的抑瘤率分别为:81.26%、69.41%、58.67%,紫杉醇对照组10mg/kg/次iv
×
7qd给药方案的疗效抑瘤率52.2%。
[0114]
式i化合物按将本技术的制剂以剂量2.5、1.0、0.4mg/kg/次iv
×
10bid方案给药,对人体肿瘤前列腺癌pc-3异种移植于腋皮下实体瘤模型的抑瘤率分别为:70.00%、61.15%、49.08%,紫杉醇对照组10mg/kg/次iv
×
7qd给药方案的疗效抑瘤率41.31%。
[0115]
本实施例充分说明式i化合物可以用于制备治疗肠癌、肝癌、前列腺癌等实体瘤的药物,疗效较对照组优。
[0116]
实施例5.式i化合物与其它化疗药物联合使用对人体肿瘤异种移植于腋皮下实体瘤模型肠癌的疗效
[0117]
试验方法同实施例2,式i化合物以0.4mg/kg/d,iv
×
10bid剂量、或该式i化合物以该剂量方案合并吉西他滨(gemcitabine)ed50剂量50mg/kg/d,iv
×
3,q3d、或单独吉西他滨50mg/kg/d,iv
×
3,q3d分别给药,对人体肿瘤肺癌a549异种移植于腋皮下实体瘤模型的抑瘤率分别为:51.28%、82.18%、39.23%。
[0118]
式i化合物以0.4mg/kg/d,iv
×
10bid,或该式i化合物以该剂量方案合并顺铂(ddp)ed50剂量1mg/kg/d,iv
×
7,qd及单独ddp 1mg/kg/d,iv
×
7,qd分别给药,对人体肿瘤肝癌hep-g2异种移植于腋皮下实体瘤模型两次实验结果的抑瘤率分别为:58.67%、85.33%、45.33%。
[0119]
式i化合物以0.4iv
×
10bid方案给药,或该式i化合物以该剂量方案合并5fu ed50剂量15mg/kg/d,iv
×
7qd,或单独5fu 15mg/kg/d,iv
×
7qd分别给药,对人体肿瘤肠癌hct-15异种移植于腋皮下实体瘤模型的抑瘤率分别为:60.19%;73.68%;42.71%。
[0120]
体内低剂量合并几种常用的抗肿瘤化疗药(ed50的剂量)显示协同或增效的效果:合并gemcitabine对肺癌a549、合并ddp对肝癌hepg2均显示有协同效果;式1化合物合并5fu对肠癌hct-15也显示增效的趋势。
[0121]
实施例6化合物的静脉给药
[0122]
符合入选标准的21例转移性晚期实体瘤患者接受了6个剂量组(25
–
225mg/m2)的式i化合物的治疗,从而对mtd(最大耐受剂量),dlt(限制性毒性)、药代动力学和药效学进行了抗肿瘤药物的评估,
[0123]
受试者中男性患者5名,女性患者16名,年龄为25-64岁,其中乳腺癌患者10名,非小细胞肺癌患者4名,恶性黑色素瘤患者2名,乙状结肠癌、口底颌下腺癌、肩胛小细胞恶性肿瘤及叶状囊肉瘤患者各1名,其中19例患者既往接受过其他化疗药物的治疗。
[0124]
将按照实施例1制备的式i化合物制剂,保存在单个的小西林瓶中,规格为50mg:5ml,按照患者体表面积取适当的制剂,用100ml注射用生理盐水稀释后,用定量输液泵匀速静脉点滴,在3小时滴完。采用每3周第一天给药一次,3周为一个治疗疗程的给药方法。在治疗期间对患者进行dlt的监测。结果表明式i化合物可以以已高至170mg/m2的剂量每3周给药而不会出现严重的毒性,也未发生过敏变态反应。
[0125]
在第2个研究中,符合入选标准的15名晚期实体瘤患者接受了3个剂量组(35,40,45mg/m2/d)式i化合物的治疗,男性患者3名,女性患者12名,其中乳腺癌患者8名,直肠癌患者2名,非小细胞肺癌、胃癌、左肩胛恶性肿瘤各1名,全部患者都既往接受过其他化疗药物的治疗。采用每天静脉滴注1.5小时,连续注射5天,每3周为1个治疗疗程。结果表明式i化合物可以以高至40mg/m2/day的剂量(mtd)每天给药,连续给药5天,每3周一个治疗,至少可用药6个治疗周期以上,而不会出现严重的毒性,安全可控。尤其是没有其他常规化疗药物和其他给药方式所发生的严重骨髓抑制的不良反应。受试者中13位患者完成两个治疗周期以上可疗效评价,其中最佳疗效有3名pr,3名pd,7位患者sd,疗效确切。该研究进一步表明既然接受过化疗治疗的乳腺癌和结肠癌、肺癌等对于式i化合物的治疗有反应。
[0126]
实施例7式i化合物联合卡培他滨治疗晚期乳腺癌患者的静脉给药
[0127]
符合入选标准的33例转移性乳腺癌患者(年龄在28-71岁)接受了3个剂量组(25,30,35mg/m2/d)式i化合物,每天静脉滴注1.5小时,连续给药1-5天,分别与卡培他滨(2000mg/m2/d,每天2次,持续14天)联合治疗,每3周一个治疗周期。全部受试患者均接受过其它化疗药物的治疗,有30例患者既往接受过转移性化疗方案的治疗,27例既往接受过紫杉烷类和蒽环类用于转移性化疗的治疗,接受过紫杉类、蒽环类和卡培他滨3种以上药物治疗的有11例。结果表明,32位受试者可以疗效评价,其中1名cr,13名pr,15名sd,3例pd,客观缓解率orr(完全缓解cr和部分缓解pr)为43.8%。缓解的中位出现时间为6周。中位治疗周期数为6(也是方案要求的试验终止治疗周期数)。中位缓解持续时间为7.8个月。中位pfs为7.9个月,治疗期间没有发生患者死亡,也未发生sae,手足麻木疼痛(pn)和掌足红肿疼痛(手足综合症)为较常见的不良事件,也没有发生严重的骨髓抑制。采用本技术的联合用药方案没有增加卡培他滨的相关毒副作用,尤其是手足综合症。由此证明采用本技术的制剂和给药方案式i化合物的疗效显著,毒性可控较低。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。