1.本发明属于医疗技术领域,具体涉及一种止血材料,用于患者(特别是凝血障碍患者)的止血,尤其适用于患者不可压迫部位如腔体和/或深度伤口的止血等临床治疗。
背景技术:
2.典型的创伤如创伤事故、武器或简易爆炸装置的射弹,这些装置经常造成小入口的伤口,对不可压迫的空洞内出血部位的能见度有限或不可见。常规止血敷料和传统止血带存在止血不完全,操作复杂,压力难控制,易引起周围组织缺血坏死等缺点。大量失血的同时容易引起凝血障碍,增加出血控制难度。
3.凝血障碍患者的止血一直未能有效解决。超过30%平时创伤患者和38%战创伤都有不同程度的创伤性凝血障碍。目前,临床止血效果最佳的材料为含纤维蛋白的材料。然而,含纤维蛋白的材料对凝血病效果不佳。其他材料也没有表现出对凝血病患者的有效疗效。因此,需要“独立于血液状况”的有效止血,以减少与凝血病性出血相关的术后并发症的发生。
4.虽然一些吸水膨胀的海绵如涂布壳聚糖的纤维海绵、聚乙烯醇海绵等开始用于部分体表不可压迫部位出血的止血。但是,该类产品无法体内降解,故需要二次手术取出。更重要的是,对凝血障碍患者效果欠佳。因此,迫切需要一种能够适用于凝血障碍患者的止血材料,特别是针对无法压迫部位的止血材料。
技术实现要素:
5.本发明提供了一种止血材料的设计、制备及其应用。
6.根据本发明的一种止血材料,用于不可压迫部位或者腔道的止血,或者用于缓释药物,特别是适用于凝血障碍患者的止血,其中,该止血材料可在体内生物降解;该材料的主体基质为壳聚糖,并同时含有交联组分、氨基官能团、多羟基苯基官能团三部分,还可选地进一步含有如止血剂、麻醉剂、抗菌剂的药物。
7.该材料的基本制备方法包括三部分:1)在离子强度辅助下可控交联,交联主体基质壳聚糖的部分氨基官能团;2)接枝含有多羟基苯基官能团的化合物到壳聚糖的部分氨基官能团;3)冰干、压缩,得到可与血液膨胀止血材料。通过步骤1)和2)的控制以后,交联主体基质壳聚糖的仍能保留活性(即未接枝和未交联)的氨基官能团。
8.该材料的特征是既可以用于不可压迫部位或者腔道的止血,也可以用于缓释药物治疗疾病,特别是适用于凝血障碍患者的止血。该止血材料可在体内生物降解,无需二次手术取出。该材料还可以进一步负载止血剂和其它药物等,增强止血效果和发挥治疗作用。
9.本发明的止血材料的制备方法采用以下技术方案。
10.技术方案一:
11.1)成型:配置壳聚糖的酸溶液,注入模具中冰干,得到冰干成型物。
12.2)交联:一定浓度盐溶液的辅助下,利用交联剂交联该冰干成型物。具体而已,将
冰干物浸入一定浓度盐溶液中,然后取出并浸入到交联剂溶液进行交联,交联后去离子水洗除盐和未反应交联剂,得到交联的壳聚糖;或者,将步骤1)的冰干物直接浸入盐和交联剂的混合液中,交联后去离子水洗除盐和未反应交联剂,得到交联的壳聚糖;所述盐溶液包括但不限于氯化钠、氯化钾、氯化钙中的一种或者几种的混合物;一定浓度是指盐溶液的离子浓度的下限可以维持冰干物的微观和宏观结构不发生变化所需的浓度,同时离子浓度的上限又能保证一部分氨基被交联;所述交联剂是常规壳聚糖交联剂,包括但不限于三聚磷酸钠、戊二醛、环氧氯丙烷、缩水甘油醚、磷酸甘油酯中的一种或者多种的混合物。
13.3)在反应助剂的作用下,将含有多羟基苯基基团的化合物接枝到交联的壳聚糖上;去离子水洗除未反应物质,得到交联接枝的壳聚糖。所述反应助剂包括1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)、n-羟基琥珀酰亚胺(nhs);所述含有多羟基苯基基团的化合物优选为含有邻二羟基苯环的化合物,包括但不限于二羟基苯丙氨酸、二羟基苯甲酸、二羟基苯乙酸、三羟基苯甲酸。
14.4)可选地负载:可进一步加入软化并增快吸水速率的物质和其它负载物,得到负载的交联接枝的壳聚糖;
15.5)压缩:将改性后壳聚糖继续冰干,并压缩到原高度的0.1~1倍,得到止血材料。
16.技术方案二:
17.1)配置壳聚糖的酸溶液,在反应助剂的作用下,将含有多羟基苯基基团的化合物接枝到壳聚糖,去离子水洗除未反应物质,得到接枝的壳聚糖。所述反应助剂是指edc/nhs等。所述含有多羟基苯基基团的化合物优选含有邻二羟基苯环的化合物,包括但不限于二羟基苯丙氨酸、二羟基苯甲酸、二羟基苯乙酸、三羟基苯甲酸等。
18.2)另配置壳聚糖的酸溶液,并进一步加入步骤1)所得的接枝的壳聚糖,可选地加入胶原、明胶、甘油、聚乙二醇等用于软化并增快吸水速率的物质或者用于止血或抗菌的药物等,注入模具中冰干成型,得到冰干物。
19.3)一定浓度盐溶液的辅助下,利用交联剂将步骤2)所得的冰干物进行交联,得到交联接枝的壳聚糖。具体而言,将冰干物浸入一定浓度盐溶液中后,取出并浸入到交联剂溶液进行交联,得到交联接枝的壳聚糖;或者,将冰干物浸入到一定浓度的盐溶液和交联剂的混合溶液中进行交联,得到交联接枝的壳聚糖。
20.4)可选地,将交联接枝的壳聚糖浸入负载物如止血剂、麻醉剂、抗菌剂等溶液中,得到负载的交联接枝的壳聚糖。
21.5)将交联接枝壳聚糖或者负载的交联接枝壳聚糖冰干、压缩,得到止血材料。
22.技术方案三:
23.1)成型:配置壳聚糖的酸溶液,可选地还加入用于软化并增快吸水速率的物质或者止血或抗菌药物,注入模具中冰干,得到冰干成型物;
24.2)交联:在一定浓度盐溶液的辅助下,利用交联剂将步骤1)所得的冰干成型物进行交联;交联后去离子水洗除盐和未反应交联剂,得到交联的壳聚糖;
25.3)接枝:配置壳聚糖的酸溶液,在反应助剂的作用下,将羟基苯酸类化合物接枝到壳聚糖,去离子水洗除未反应物质,得到接枝的壳聚糖,溶于水中得到接枝的壳聚糖的溶液。
26.4)将步骤2)所得的交联的壳聚糖浸入步骤3)所得的接枝的壳聚糖的溶液,得到交
联接枝的壳聚糖;
27.5)可选地负载:在接枝的壳聚糖溶液中或者交联接枝的壳聚糖中进一步加入负载物,得到负载的交联接枝的壳聚糖;
28.6)压缩:将交联接枝壳聚糖或者负载的交联接枝壳聚糖冰干、压缩,得到可膨胀止血材料。
29.优点和积极效果
30.本发明的止血材料注射到深度创伤,比如说刀伤或者枪伤以后,与血液接触后,快速吸血膨胀,浓缩血液中的红细胞、血小板等激活凝血机制。此外,膨胀后的材料还可以封堵出血部位,实施物理压迫式止血。对于抗凝血患者,其血小板的止血功能基本丧失。针对这一点,本发明在壳聚糖上引入了部分多羟基苯基官能团,该基团和壳聚糖的氨基官能团协同作用,激活血液中的蛋白组分,最终促进在伤口腔内形成阻止血流的凝结物。压迫、物理、化学凝血的多手段耦合促进止血,特别是对凝血障碍患者有效。此外,该材料具有可体内自行降解,无需二次手术取出等优点。
附图说明
31.图1示出了相机拍摄的止血材料遇血膨胀的照片。
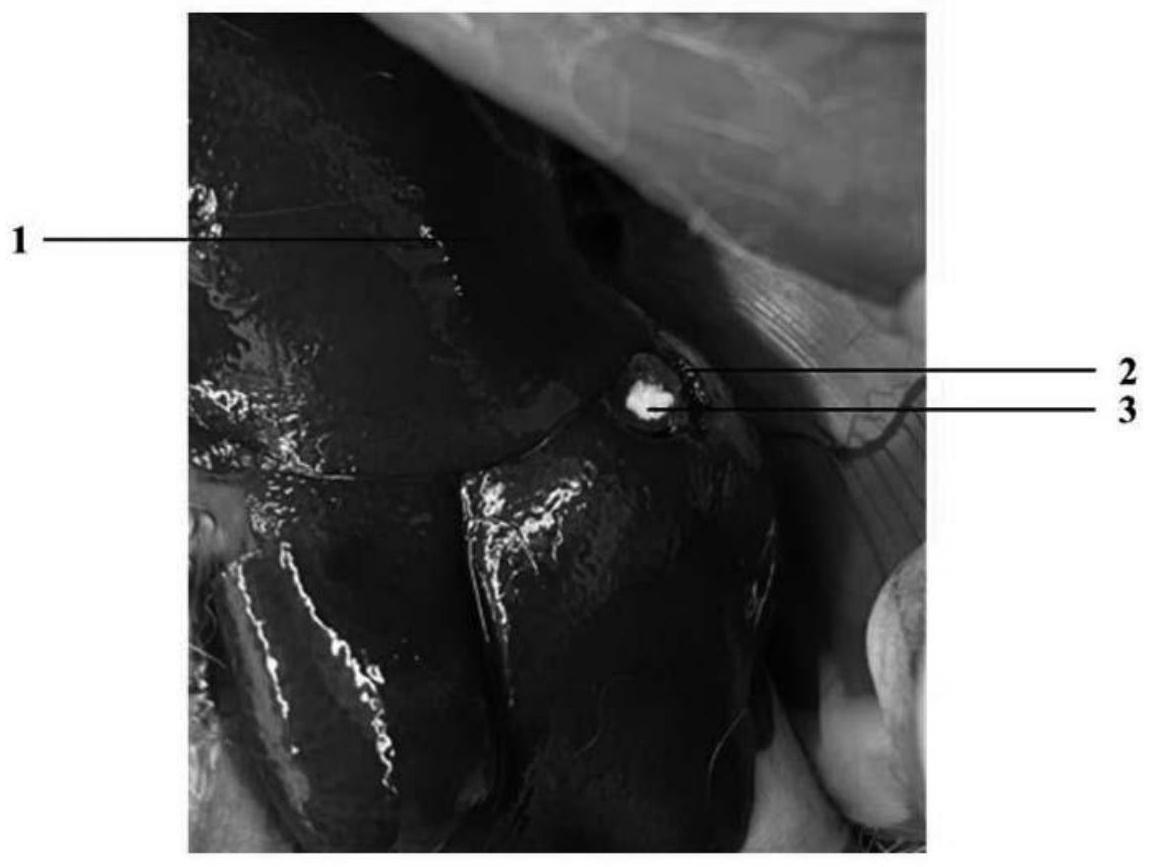
32.图2是实施例的肝脏出血模型中的肝部贯穿伤止血图。
33.附图标记:1:肝脏;2:贯穿伤口;3:止血材料。
具体实施方式
34.下面是本发明的非限定性实例,这些实例的给出仅仅是为了说明目的,并不能理解为对本发明的限定,因为在不脱离本发明的精神和范围的基础上,可以对本发明进行许多改变。
35.对比实施例1
36.利用1%的乙酸溶液配置20mg/ml的壳聚糖(分子量400cp)溶液。加入成型模具中,-20℃冷冻成型后冰干。将冰干物直接浸入0.5m氢氧化钠溶液交联5min,产生约30%收缩变形。取出,水洗干净后,进一步冰干。
37.对比实施例2
38.利用1%的乙酸溶液配置30mg/ml壳聚糖(分子量128cp)和5mg/ml甘油的溶液。加入成型模具中,-80℃冷冻成型后冰干。将冰干物直接浸入2%三聚磷酸钠溶液中交联15min,产生约35%收缩变形。取出,水洗干净后,冰干。
39.对比实施例1和对比实施例2制备得到的样品无法保持微观和宏观结构的稳定,压缩后,在水中也无法膨胀到压缩前状态,所以没有测量它们的诸如吸水率、膨胀时间、止血特性等性能参数。发明人发现,一定浓度的盐溶液是维持止血材料微观和宏观结构稳定性的关键所在,也是本发明的创新点之一。
40.对比实施例3
41.利用1%的乙酸溶液配置20mg/ml的壳聚糖(分子量128cp)溶液。加入成型模具中,-20℃冷冻成型后冰干。首先浸入到10%氯化钠溶液中,然后转移到1%三聚磷酸钠溶液交联30min,去离子水洗涤,冰干后1.0mpa压缩,辐照灭菌,备用。
42.实施例1
43.利用1%的乙酸溶液配置20mg/ml的壳聚糖(分子量128cp)溶液。加入成型模具中,-20℃冷冻成型后冰干。首先浸入到10%氯化钠溶液中,然后转移到1%三聚磷酸钠溶液交联30min。去离子水洗除未反应物质,得到交联的壳聚糖。
44.0.5g交联的壳聚糖放入50ml ph=5.0的乙酸溶液中。0.6g二羟苯丙酸和0.6g edc分别溶于15ml水中,加入20ml乙醇,混合。缓慢滴入交联的壳聚糖的乙酸溶液,反应6h以后去离子水洗除未反应的物质,冰干。1.0mpa压缩,辐照灭菌,得到止血材料。
45.实施例2
46.利用2%的乙酸溶液配置15mg/ml的壳聚糖(分子量400cp)溶液。加入成型模具中,-80℃冷冻成型后冰干。首先浸入到25%氯化钠溶液中,然后转移到1%戊二醛溶液中交联20min。去离子水洗除未反应物质,得到交联的壳聚糖。
47.1.0g交联的壳聚糖放入80ml ph=5.0的盐酸溶液中。1.0g二羟苯乙酸溶于30ml水中,0.8g edc和0.8g nhs溶于30ml水中,加入40ml乙醇,混合。缓慢滴入交联的壳聚糖的乙酸溶液,反应3h以后去离子水洗除未反应的物质,冰干。1.5mpa压缩,辐照灭菌,得到止血材料。
48.实施例3
49.利用1%的盐酸溶液配置40mg/ml壳聚糖(分子量200cp)和5mg/ml甘油的溶液。加入成型模具中,-80℃冷冻成型后冰干。浸入到15%氯化钾和2%磷酸甘油酯的混合溶液中交联30min,去离子水洗除未反应物质,得到交联的壳聚糖。
50.2.0g交联的壳聚糖放入80ml ph=5.5的盐酸溶液中。2.6g三羟基苯甲酸溶于50ml水中,3.0g edc和3.0g nhs溶于50ml水中,加入50ml乙醇,混合。缓慢滴入交联的壳聚糖的盐酸溶液,反应5h以后去离子水洗除未反应的物质,冰干。2.0mpa压缩,辐照灭菌,得到止血材料。
51.实施例4
52.利用1%的盐酸溶液配置30mg/ml壳聚糖(分子量200cp)。2.3g二羟基苯甲酸溶于60ml水中,2.5g edc和2.5g nhs溶于50ml水中,加入50ml乙醇,混合。缓慢滴入,滴完后继续反应12h。ph=5.0的hcl溶液透析除去未反应的物质。冰干,得到接枝壳聚糖。
53.利用1%的盐酸溶液配置20mg/ml壳聚糖(分子量200cp),进一步溶入5mg/ml接枝壳聚糖。加入成型模具中,-80℃冷冻成型后冰干。浸入到15%氯化钠和2%三聚磷酸钠的混合溶液中交联30min,去离子水洗除未反应物质,冰干。1.0mpa压缩,辐照灭菌,得到止血材料。
54.实施例5
55.实施例1中,冰干后压缩前,先浸入10mg/ml氨甲环酸溶液中,取出,然后冰干并0.5mpa压缩,辐照灭菌,得到止血材料。
56.实施例6
57.实施例4中,冰干后压缩前,先浸入5mg/ml氨甲环酸和5mg/ml利多卡因的混合溶液中,取出,然后冰干并0.8mpa压缩,辐照灭菌,得到止血材料。
58.实施例7
59.利用1%的乙酸溶液配置20mg/ml的壳聚糖(分子量128cp)溶液。加入成型模具
中,-20℃冷冻成型后冰干。首先浸入到10%氯化钠溶液中,然后转移到1%三聚磷酸钠溶液交联30min。去离子水洗除未反应物质,得到交联的壳聚糖,冰干。
60.利用1%的盐酸溶液配置30mg/ml壳聚糖(分子量200cp)。2.3g二羟基苯甲酸溶于60ml水中,2.5g edc和2.5g nhs溶于50ml水中,加入50ml乙醇,混合。缓慢滴入,滴完后继续反应12h。ph=5.0的hcl溶液透析除去未反应的物质。冰干,得到接枝壳聚糖。利用去离子水配置5mg/ml的接枝壳聚糖溶液。
61.将冰干后交联的壳聚糖浸入接枝壳聚糖溶液中,取出,然后冰干并1.0mpa压缩,辐照灭菌,得到止血材料。
62.实施例8
63.利用1%的乙酸溶液配置20mg/ml的壳聚糖(分子量128cp)溶液。加入成型模具中,-20℃冷冻成型后冰干。首先浸入到7.5%氯化钠溶液中,然后转移到2%三聚磷酸钠溶液交联30min。去离子水洗除未反应物质,得到交联的壳聚糖,冰干。
64.利用1%的盐酸溶液配置30mg/ml壳聚糖(分子量200cp)。2.3g二羟基苯甲酸溶于60ml水中,2.5g edc和2.5g nhs溶于50ml水中,加入50ml乙醇,混合。缓慢滴入,滴完后继续反应12h。ph=5.0的hcl溶液透析除去未反应的物质。冰干,得到接枝壳聚糖。
65.利用去离子水配置5mg/ml的接枝壳聚糖溶液、10mg/ml氨甲环酸和10mg/ml利多卡因的混合溶液。
66.将冰干后交联的壳聚糖浸入混合溶液中,取出,然后冰干并2.0mpa压缩,辐照灭菌,得到止血材料。
67.实施例9
68.物理机械性能评价
69.吸水率:称量样品初始质量m0,浸入生理盐水中,记录吸水膨胀到最终状态所需膨胀时间(t);取出后,称量质量m1。吸水率=(m
1-m0)/m0×
100%。
70.测量吸水膨胀前(h0)后(h1)高度变化率,即膨胀倍数=(h
1-h0)/h0。
71.表1:止血材料的物理机械性能和生物相容性
72.为了实现物理压迫式止血,本发明的止血材料具有合适的吸血/吸水膨胀的基本性能,如吸水率、膨胀时间、膨胀倍数、弹性模量等。
73.实施例10
74.生物相容性表征
75.生物相容性是医用材料的基本要求。按照国家标准gb16886测试止血材料的细胞
毒性、致敏和溶血性能。本发明的止血材料无毒、不致敏、溶血率为0.3%~2.0%。
76.实施例11
77.构建非抗凝血动物体内肝脏出血模型,模拟贯穿伤的止血性能评价。具体实验过程如下:
78.选择健康新西兰兔30只,兔龄5-6周,体重2.5-3.0kg,雌雄不限。随机分为6组,每组5只。
79.实验组1:实施例1的止血材料样品(压缩前尺寸φ8
×
15mm);
80.实验组2:实施例4的止血材料样品(压缩前尺寸φ8
×
15mm);
81.实验组3:实施例7的止血材料样品(压缩前尺寸φ8
×
15mm);
82.对照组1:对比实施例3的止血材料样品(压缩前尺寸φ8
×
15mm);
83.对照组2:胶原海绵(尺寸φ8
×
15mm,无锡贝迪生物工程有限公司,压缩后无法回弹,故不压缩,直接使用);
84.空白组:医用止血纱布(河南驼人医疗器械集团有限公司,裁剪并卷成约φ8
×
15mm)。
85.新西兰兔实验前禁食3h,经耳缘静脉注射3%戊巴比妥钠溶液麻醉后,经腹部切口暴露肝脏,仔细清除肝脏周围的浆液性液体;用打孔器形成一个φ8mm的柱状贯穿肝缺损(如图2所示);自由出血5s,擦拭纱布(医用止血纱布,河南驼人医疗器械集团有限公司)收集并称重。各个实验组和对照组1将样品垂直放入以保证回弹后可以充满整个贯穿伤口,对照组2和空白组直接填塞。每组表面均用擦拭纱布覆盖。记录开始止血到止血结束的止血时间和出血量。
86.覆盖纱布,1min后拿开纱布,如果没有继续流血,则止血时间记为1min;如果继续流血,马上放回纱布,每15s轻轻揭开擦拭纱布一角,观察止血情况。记录止血时间。
87.出血量=(止血材料 擦拭纱布)湿重-(止血材料 擦拭纱布)干重;
88.使用spss软件进行统计分析。数据表示为独立实验值的平均值
±
标准偏差,anova分析,p《0.05时表示具有统计学显著性差异。
89.表2:非抗凝血动物模型的模拟贯穿伤的止血性能
90.如表2所示,空白组的出血量和止血时间显著性高于各个实验组和各个对照组(p《0.05),增加了失血性休克致死的风险。实验组1/2/3和对照组1都显著性优于对照组2(p《0.05),止血材料塞入伤口后快速吸血,在3s内回弹到初始状态。实验组的组间统计学分析表明,没有显著性差异(p>0.05)。
91.实施例12
92.构建凝血障碍动物体内肝脏出血模型,具体实验过程如下:
93.新西兰兔实验前禁食3h,经耳缘静脉注射肝素钠(200iu/kg)并等待5分钟,测试凝血指数如下:正常新西兰兔活化部分凝血活酶时间(aptt)为24.92
±
1.36s,凝血酶原时间(pt)16.41
±
0.12s,肝素钠新西兰兔的aptt为77.56
±
5.09s,pt为14.92
±
0.11s。
94.其余操作同实施例11。
95.表3:抗凝血动物模型的模拟贯穿伤的止血性能
96.与表2相比较,抗凝血动物的止血难度极大提高。空白组在30min内无法有效止血,失血量超过40g。实验组和对照组的出血量和止血时间也明显变大。
97.如表3所示,实验组1/2/3和对照组1都显著性优于对照组2(p《0.05),止血材料塞入伤口后快速吸血,在2~5s内回弹到初始状态。实验组1/2/3显著性优于对照组1(p《0.05)。实验组1/2/3的统计学分析表明,组间没有显著性差异(p>0.05)。
98.综上所述,无论是正常动物还是抗凝血动物,实验组都可以有效止血。
99.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。