长效人生长激素缀合物的制剂
1.本技术为分案申请,原申请的申请日是2014年9月26日、申请号是201480064028.x、发明名称为“长效人生长激素缀合物的制剂”。
技术领域
2.本发明涉及长效人生长激素缀合物的制剂,其包括长效人生长激素(hgh)缀合物——其中作为生理活性肽的人生长激素连接至免疫球蛋白fc区域、缓冲液、非离子表面活性剂和糖醇,具体地涉及长效人生长激素缀合物的冻干制剂和液体制剂,用于制备冻干制剂的方法,用于重构冻干制剂的方法和包括冻干制剂和重构溶液的试剂盒。
背景技术:
3.人生长激素(下文称为“hgh”)是由垂体前叶腺分泌的由具有约22,000的分子量的191个氨基酸组成的多肽激素。人生长激素已经主要用于儿科垂体性侏儒症的治疗。传统地,已经使用从人垂体腺提取的hgh,但是由于其有限的供应,仅治疗了非常有限数量的人。而且,自从报导了在用从垂体腺提取的hgh治疗的一些患者中发现的克-雅二氏病——退行性神经障碍,禁止了从垂体腺提取的hgh的使用。目前,基因工程技术的发展已经能够生产大肠杆菌和酵母菌中的hgh,和自1985年以来由此生产的生物合成的hgh药物已经在数个国家被批准,并且在经过毒理学和临床试验后成为商业上可获得的。
4.一般而言,多肽比如hgh具有低稳定性并且因此容易变性。而且,它们容易被血清蛋白酶降解和通过肾或肝去除。因此,包含多肽作为药物成分的蛋白质类药物必须被频繁地施用至患者以维持其血液浓度和效价(titer)。然而,因为蛋白质类药物通常以注射的形式被施用,为维持活性多肽的最佳血液浓度的蛋白质类药物的频繁注射引起患者的大量疼痛。为了解决这些问题,已经存在许多尝试以增加血液中蛋白质类药物的稳定性和维持其血液浓度在长时间段内为高水平以使药物的疗效最大化。
5.最近,韩国专利号10-0567902(具有改进的体内耐久性的生理活性多肽缀合物)和韩国专利号10-0725315(使用免疫球蛋白片段的蛋白质复合物和制备其的方法)公开了通过将生理活性多肽与免疫球蛋白fc区域和非肽基聚合物连接制备的缀合物,作为蛋白质类药物的长效制剂,能够获得蛋白质活性的最小降低和蛋白质稳定性的增加二者。根据这些方法,hgh可用作生理活性多肽以制备长效hgh缀合物。为了使包含长效hgh缀合物的药物商业化,防止由于在储存和运输过程期间通过光、热或添加剂中的杂质诱导的降解的物理化学改变,比如变性、聚集、吸附或水解,同时保留hgh的体内活性是必要的。因为与hgh多肽相比,长效hgh缀合物具有较大的尺寸和增加的分子量,因此难以使缀合物稳定。
6.冻干法(冷冻-干燥法)通常用于通过从感兴趣的蛋白质制剂中去除水以保存蛋白质。冻干法是通过其首先冷冻待干燥的材料并且然后通过升华去除冰或冷冻溶剂的过程。赋形剂可包括在预冻干制剂中以维持或增强在冻干过程期间的蛋白质稳定性或改进在储存期间冻干产品的稳定性。然而,由于待保存的蛋白质的性质的不同,适用于一种蛋白质的冻干制剂的组合物通常不适用于其他蛋白质。具体而言,由于其不同的化学性质,不同蛋白
质在储存、冻干和重构过程期间的不同条件下可能是灭活的。也就是说,由用于稳定性的材料提供的稳定性的增强对于不同蛋白质不相同,并且因此用于在储存、冻干和重构过程期间提供稳定性的稳定剂的合适的比率、浓度和种类不同,这取决于蛋白质的物理化学性质。当不同的稳定剂组合使用时,由于其竞争或不良反应可产生有害负面作用,并且由于在冻干或储存过程期间蛋白质的性质或浓度的改变,可能出现非期望的作用。因此,蛋白质稳定性需要许多努力和防范。
7.具体而言,因为具有改进的体内耐久性和稳定性的长效hgh缀合物具有其中作为生理活性肽的人生长激素连接至免疫球蛋白fc区域的形式,其分子量和体积与人生长激素的分子量和体积有很大不同。因此,需要特定组合物用于稳定蛋白质。而且,因为每种生理活性肽hgh和免疫球蛋白fc区域具有不同的物理化学性质,所以它们应被同时稳定。然而,如上所述,由于其物理化学性质的不同,不同的肽或蛋白质可在不同的比率和条件下逐渐灭活。而且,当同时使用适于每种肽或蛋白质的稳定剂时,由于它们之间的竞争性相互作用和副作用,它们可引起不良结果。此外,由于储存的蛋白质的性质和浓度在其储存期间可能变化,稳定剂可能展现非期望的副作用。因此,对于长效hgh缀合物,难以找到适于能够同时稳定生理活性肽hgh和免疫球蛋白fc区域二者的稳定剂的组合物。另外,对于冻干制剂,应该以各种方式控制冻干和重构的方法以维持在重构时的蛋白质稳定性和活性。这些方法也可根据制剂的组合物和其使用的蛋白质变化。
8.另外,当冻干制剂包括高浓度的蛋白质时,由于高浓度,蛋白质可在冻干期间聚集,并且其处理也变得困难。因此,高浓度的蛋白质常规地已经通过制备包括低浓度的蛋白质的冻干制剂并且然后重构其具有小体积获得,而不是在重构高浓度蛋白质之后进行冻干。然而,如果蛋白质重构为具有小体积,对于待直接适用于患者的制剂,不仅蛋白质而且包括在其中的其他成分变得过于浓缩和过于高渗。因此,存在开发使得高浓度蛋白质保持原样冻干的制剂的需要。
9.最近,研发了为患者方便可重复使用的蛋白质和肽的制剂。然而,这些多用途制剂应包含防腐剂以防止在重复施用之后和处理之前微生物污染。包含防腐剂的多用途制剂相对于单一用途制剂具有一些优势。例如,对于单一用途制剂,可能浪费大量的药物,取决于剂量,当使用多用途制剂时其可降低。此外,多用途制剂可以被使用若干次而不用考虑在给定时间段期间的微生物生长,并且因为其可以在单个容器中提供,所以包装可以最小化,产生经济益处。然而,防腐剂的使用可能影响蛋白质稳定性。与防腐剂的使用相关的最熟知的问题是沉淀物的形成。当施用至身体时,蛋白质的沉淀可降低药物的疗效并且诱导非期望的免疫应答。因此,选择维持微生物污染而不影响蛋白质稳定性的能力的适当类型和浓度的防腐剂是关键的。
10.一般而言,溶液状态的制剂以注射器形式形成。最常用的类型是预装注射器,并且还频繁使用更方便的自动注射器。另外,允许需要的剂量自动注射至患者的笔式注射器主要用于生长激素、胰岛素等。虽然这些注射设备对溶液状态的制剂的施用是方便的,但是它们不能用于因为低稳定性必须被冻干的药物。
11.一般而言,冻干制剂与用于溶解的溶剂分开地在强化玻璃小瓶中制备。在使用注射器注射之前立即混合二者以溶解冻干制剂。最近的趋势是从冻干小瓶(例如,强化玻璃小瓶)朝向为方便患者的单一用途或多用途注射器。实例包括vetter(德国)的双腔式药筒。
技术实现要素:
12.技术问题
13.在此背景下,本发明的发明人已经努力开发了在冻干过程期间能够保持长效人生长激素缀合物的稳定性并且能够储存其持续长时间段的冻干制剂,和能够稳定储存长效人生长激素缀合物的液体制剂。结果,他们已经发现当使用包括缓冲液、糖醇和非离子表面活性剂的稳定剂时,在冻干和储存期间长效hgh缀合物的稳定性增加,并且因此可制备有成本效益的和稳定的液体制剂。而且,证实了当长效hgh缀合物的浓度为10-58.5mg/ml时,可提供具有优异稳定性的无氯化钠的液体制剂。此外,证实了本发明的冻干制剂不仅在储存和运输期间稳定而且当重构时对于皮下注射也具有适当的渗透压和稳定性。另外,证实了冻干制剂可用作多用途制剂,因为即使当包括防腐剂时其也保持稳定性。
14.技术方案
15.本发明涉及提供长效人生长激素缀合物的制剂,其包括长效人生长激素(hgh)缀合物——其中人生长激素(hgh)作为生理活性肽连接至免疫球蛋白fc区域、缓冲液、非离子表面活性剂和糖醇。
16.本发明还涉及提供长效hgh缀合物的冻干制剂,该冻干制剂包括水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效人生长激素缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括缓冲液、非离子表面活性剂和糖醇。
17.本发明还涉及提供长效hgh缀合物的液体制剂,该液体制剂包括药学上有效量的长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域——和无白蛋白稳定剂,其中稳定剂包括缓冲液、非离子表面活性剂和糖醇。
18.本发明还涉及提供用于制备该制剂的方法。
19.本发明还涉及提供用于重构冻干制剂的方法,包括添加重构溶液至水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效人生长激素缀合物——其中人生长激素作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括缓冲液、非离子表面活性剂和糖醇。
20.本发明还涉及提供包括长效hgh缀合物的冻干制剂的试剂盒。
21.有益效果
22.因为本发明的长效hgh缀合物的制剂不包括人血清白蛋白或任何潜在有害的因素,所以不存在病毒污染的担心。另外,该制剂允许通过连接hgh多肽至免疫球蛋白fc区域制备的长效hgh缀合物的高稳定性,因此相比于野生型具有较大的分子量和增加的体内耐久性。具体而言,冻干制剂不仅在冻干期间而且在重构之后提供优异的稳定性,并且即使当其包含防腐剂时也保持稳定性,因此可用作用于多次施用的制剂。
附图说明
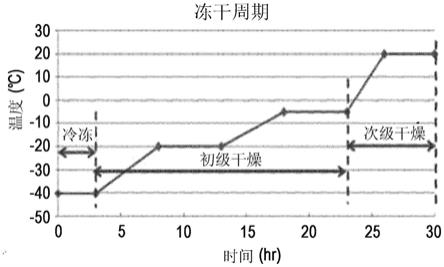
23.图1显示用于本发明的冻干过程的温度梯度。
24.图2显示用于本发明的冻干过程的温度梯度,其中初级干燥被划分为两个阶段。
25.图3a显示用于本发明的强化玻璃小瓶。
26.图3b显示vetter的双腔式药筒。
具体实施方式
27.最佳模式
28.在一方面,本发明提供长效人生长激素缀合物的制剂,其包括长效人生长激素(hgh)缀合物——其中人生长激素(hgh)作为生理活性肽连接至免疫球蛋白fc区域、缓冲液、非离子表面活性剂和糖醇。
29.在另一方面,本发明提供长效人生长激素缀合物的冻干制剂,其包括水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括缓冲液、非离子表面活性剂和糖醇。
30.在示例性实施方式中,缓冲液是醋酸盐缓冲液、组氨酸缓冲液或柠檬酸盐缓冲液。
31.在另一示例性实施方式中,缓冲液是醋酸盐缓冲液。
32.在另一示例性实施方式中,醋酸盐是醋酸钠,并且柠檬酸盐是柠檬酸钠。
33.在另一示例性实施方式中,缓冲液的ph范围是5.0至6.0。
34.在另一示例性实施方式中,糖醇是甘露醇或山梨醇。
35.在另一示例性实施方式中,包括的糖醇的浓度范围是水性溶液的总体积的1%(w/v)至10%(w/v)。
36.在另一示例性实施方式中,包括的糖醇的浓度范围是2.5%(w/v)至5%(w/v)。
37.在另一示例性实施方式中,非离子表面活性剂是聚山梨醇酯80。
38.在另一示例性实施方式中,非离子表面活性剂的浓度范围是水性溶液的总体积的0.001%(w/v)至0.05%(w/v)。
39.在另一示例性实施方式中,无白蛋白溶液进一步包括选自糖、多元醇和氨基酸的至少一种。
40.在另一示例性实施方式中,氨基酸是组氨酸或甘氨酸。
41.在另一示例性实施方式中,组氨酸的浓度范围是1至10mm。
42.在另一示例性实施方式中,长效hgh缀合物的浓度范围是10至100mg/ml。
43.在另一示例性实施方式中,无白蛋白溶液进一步包括等渗剂。
44.在另一示例性实施方式中,等渗剂是氯化钠。
45.在另一示例性实施方式中,氯化钠的浓度范围是0至200mm。
46.在另一示例性实施方式中,冻干制剂的容器是小瓶、双腔式药筒或双腔式注射器。
47.在另一方面中,本发明提供长效hgh缀合物的液体制剂,其包括药学上有效量的长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,和无白蛋白稳定剂,其中稳定剂包括缓冲液、非离子表面活性剂和糖醇。
48.在示例性实施方式中,液体制剂不包括等渗剂。
49.在另一示例性实施方式中,缓冲液是柠檬酸盐缓冲液、醋酸盐缓冲液或组氨酸缓冲液。
50.在另一示例性实施方式中,糖醇是甘露醇或山梨醇。
51.在另一示例性实施方式中,包括的糖醇的浓度范围是2%(w/v)至4.5%(w/v)。
52.在另一示例性实施方式中,包括的糖醇的浓度是4%(w/v)。
53.在另一示例性实施方式中,缓冲液的ph范围是5.0至6.0。
54.在另一示例性实施方式中,缓冲液的ph是5.2。
55.在另一示例性实施方式中,非离子表面活性剂是聚山梨醇酯80。
56.在另一示例性实施方式中,非离子表面活性剂的浓度范围是制剂总体积的0.001%(w/v)至0.05%(w/v)。
57.在另一示例性实施方式中,制剂中包括的长效hgh缀合物的浓度范围是5.0mg/ml至60.0mg/ml。
58.在另一示例性实施方式中,hgh具有与野生型hgh相同的氨基酸序列。
59.在另一示例性实施方式中,免疫球蛋白fc区域是源自igg、iga、igd、ige或igm的fc区域。
60.在另一示例性实施方式中,免疫球蛋白fc区域的每个结构域是具有不同来源的结构域的杂种(hybrid),该不同来源源自选自igg、iga、igd、ige和igm的免疫球蛋白。
61.在另一示例性实施方式中,免疫球蛋白fc区域是由单链免疫球蛋白组成的二聚体或多聚体,所述单链免疫球蛋白由具有相同来源的结构域组成。
62.在另一示例性实施方式中,免疫球蛋白fc区域是igg4 fc区域。
63.在另一示例性实施方式中,免疫球蛋白fc区域是无糖基化的(aglycosylated)人igg4 fc区域。
64.在另一示例性实施方式中,缀合物是这样的形式——hgh经非肽基聚合物作为连接体或经遗传重组连接至免疫球蛋白fc。
65.在另一示例性实施方式中,非肽基聚合物选自生物可降解的聚合物,比如聚乙二醇、聚丙二醇、乙二醇和丙二醇的共聚物、聚氧乙烯化多元醇、聚乙烯醇、多糖、葡聚糖、聚乙烯基乙醚、聚乳酸(pla)和聚乳酸-乙醇酸(plga)、脂质聚合物、壳多糖、透明质酸和其组合。
66.在另一示例性实施方式中,非肽基聚合物是聚乙二醇。
67.在另一示例性实施方式中,制剂用于垂体性侏儒症、生长激素缺乏、普-韦二氏综合征或特发性身材矮小症的治疗。
68.在另一方面中,本发明提供长效hgh缀合物的冻干制剂,其包括水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括醋酸盐缓冲液、聚山梨醇酯80和甘露醇。
69.在另一方面中,本发明提供长效hgh缀合物的液体制剂,其包括药学上有效量的长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,和包括柠檬酸盐缓冲液、聚山梨醇酯80和甘露醇的无白蛋白稳定剂,该稳定剂不包括等渗剂。
70.在另一方面中,本发明提供用于制备冻干制剂的方法,其包括冻干长效hgh缀合物——其中人生长激素作为生理活性肽连接至免疫球蛋白fc区域,和包括缓冲液、非离子表面活性剂和糖醇的无白蛋白溶液。
71.在另一方面中,本发明提供用于重构冻干制剂的方法,其包括添加重构溶液至水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效hgh缀合物——其中人生长激素(hgh)作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括在冻干制剂中包括的缓冲液、非离子表面活性剂和糖醇。
72.在示例性实施方式中,重构溶液是注射用水。
73.在另一示例性实施方式中,重构溶液进一步包括防腐剂。
74.在另一示例性实施方式中,防腐剂是苯甲醇、间甲酚或苯酚。
75.在另一示例性实施方式中,通过该方法重构的制剂包括的长效hgh缀合物的浓度范围是10至100mg/ml。
76.在另一方面中,本发明提供包括长效hgh缀合物的冻干制剂的试剂盒。
77.发明模式
78.在一方面,本发明提供长效人生长激素缀合物的制剂,其包括长效人生长激素(hgh)缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域、缓冲液、非离子表面活性剂和糖醇。
79.如本文所使用,术语“长效人生长激素(hgh)缀合物”指其中生理活性肽人生长激素连接至免疫球蛋白fc区域,并且其生理学活性与野生型hgh相比具有增加的体内耐久性的缀合物。如本文使用的术语“长效”意思是生理学活性具有比野生型hgh更长的耐久性。如本文所使用,术语“缀合物”指其中人生长激素连接至免疫球蛋白fc区域的形式。
80.具体而言,制剂可以是长效hgh缀合物的冻干制剂,其包括水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括缓冲液、非离子表面活性剂和糖醇。
81.如本文所使用,术语“长效hgh缀合物的冻干制剂”指包括长效hgh缀合物的冻干制剂。它包括包含通过冻干长效hgh缀合物和稳定长效hgh缀合物的物质比如赋形剂获得的以固体状态存在的材料的制剂。在本发明中,冻干制剂包括冻干物质本身。冻干物质也可称为冻干饼(lyophilized cake)。
82.冻干制剂通过从准备制剂(preparatory formulation)升华水的冻干过程制备,该准备制剂包括长效hgh缀合物和用于稳定长效hgh缀合物的赋形剂。在本发明中,长效hgh缀合物的冻干制剂可包括治疗有效量的长效hgh缀合物,并且治疗有效量的hgh可以包含在单一用途容器或多用途容器中,尽管不限于此。
83.冻干制剂可以包含在小瓶(例如,强化玻璃小瓶)、双腔式药筒或双腔式注射器中,尽管不限于此。
84.本发明的冻干制剂具有在冻干过程期间能够稳定长效hgh缀合物并且当储存后重构时能够保持制剂的稳定性的组合物。具体而言,即使当包括范围为10mg/ml至100mg/ml的高浓度的长效hgh缀合物时,本发明的冻干制剂也能够提供稳定性。
85.长效hgh缀合物的冻干制剂可以储存在容器中并且当需要施用至受试者时重构。
86.如本文所使用,术语“重构”意思是固体状态的冻干物质液化以允许hgh缀合物的施用。当重构时,包括在本发明的冻干制剂中的长效hgh缀合物的浓度范围是1mg/ml至150mg/ml,特别地10mg/ml至120mg/ml,更特别地10mg/ml至100mg/ml,尽管不限于此。
87.可通过溶解冻干物质进行重构,通过添加溶剂至包含冻干物质的小瓶或通过添加溶剂至包含在单一用途注射器或多用途注射器中的冻干物质溶解冻干物质,但是不具体限于此。
88.本发明的长效hgh缀合物的冻干制剂相对于现存液体制剂的优势在于hgh缀合物可以被稳定储存并且缀合物的有效浓度可以被控制。重构之后的浓度可以与冻干过程期间预冻干制剂的浓度相同或不同。
89.本发明的冻干制剂包括水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效hgh缀合物,该无白蛋白溶液包括缓冲液、非离子表面活性剂和糖醇。
90.如本文所使用,术语“无白蛋白溶液”指能够使长效hgh缀合物稳定储存并且在冻干和重构过程期间维持其稳定性的物质。具体而言,无白蛋白溶液指包括长效hgh缀合物和稳定长效hgh缀合物的赋形剂的水性溶液,并且因此提供在冻干过程期间长效hgh缀合物的稳定性并且使得冻干制剂的制备具有储存稳定性。具体而言,水性溶液包括缓冲液、糖醇和非离子表面活性剂。此外,可包括等渗剂用于渗透压的调整。对于蛋白质比如长效hgh缀合物,储存稳定性不仅对于确保精确施用剂量而且对于抑制针对长效hgh缀合物的抗原物质的潜在形成是重要的。在本发明中,术语无白蛋白溶液可与“预制剂(preformulation)”互换使用。
91.因为可通过调整添加至冻干制剂的重构溶液的体积控制长效hgh缀合物的浓度,所以无白蛋白溶液中的长效hgh缀合物的浓度不被具体限制。然而,本发明的制剂是有利的,其在于包括甚至10-100mg/ml或更高的高浓度的长效hgh缀合物的无白蛋白溶液可被稳定冻干,制备的冻干制剂可以在3分钟内快速溶解并且在重构的溶液中可维持长效hgh缀合物的稳定性。
92.水性溶液不包含人血清白蛋白。因为可用作蛋白质稳定剂的人血清白蛋白由人血清产生,所以存在被源自人的病原性病毒污染的风险。另外,明胶或牛血清白蛋白在一些患者中可引起疾病或可诱导过敏反应。因为本发明蛋白质的无白蛋白溶液不包含异源性蛋白比如源自人或动物的血清白蛋白或纯化明胶,所以不存在病毒感染的风险。
93.如本文所使用,术语“缓冲液”指包括在本发明的无白蛋白溶液中并且用来维持冻干或重构过程之后制剂稳定的ph水平从而防止制剂ph的急剧改变以使长效hgh缀合物的活性保持稳定的溶液。缓冲液可包括碱盐(例如,磷酸钠或磷酸钾或其一元碱盐或二元碱盐)、柠檬酸盐(例如,柠檬酸钠或柠檬酸)、醋酸盐(例如,醋酸钠或醋酸)、组氨酸、本领域已知的任何其他药学上可接受的ph缓冲剂、或其组合。缓冲液可以具体地是醋酸盐缓冲液、组氨酸缓冲液或柠檬酸盐缓冲液,更具体地是醋酸盐缓冲液或柠檬酸盐缓冲液,尽管不限于此。
94.构成缓冲液的柠檬酸盐或醋酸盐的浓度具体地在5至100mm的范围内,更具体地在10至50mm的范围内,尽管不限于此。缓冲液的ph具体地在4.0至7.0的范围内,更具体地在5.0至6.0的范围内,进一步更具体地在5.2至6.0的范围内,尽管不限于此。
95.如本文所使用,术语“糖醇”指包括在本发明的冻干制剂中并且在冻干过程期间用来保护长效hgh缀合物的蛋白质和在重构之后改进长效hgh缀合物的稳定性的氢化的碳水化合物。用于本发明的糖醇的浓度范围可以是制剂总体积的1至10%(w/v),尽管不限于此。具体而言,糖醇的浓度可以在2.5至5%(w/v)的范围内。当糖醇的浓度在该范围内时,使用与预制剂相同体积的重构溶液通过重构获得的重构制剂可具有与等渗溶液相应的渗透压,尽管不限于此。
96.用于本发明的糖醇可以是选自甘露醇和山梨醇的至少一种,具体地甘露醇,但是不具体限于此。包括在本发明的制剂中的糖醇比如甘露醇可用来调节渗透压。具体而言,通过重构本发明的冻干制剂获得的制剂可以是等渗的。然而,高渗或低渗制剂也适于本发明。
97.如本文所使用,术语“非离子表面活性剂”指降低蛋白质溶液的表面张力以防止蛋白质被吸附在疏水表面上或在重构之后蛋白质聚集的物质。可用于本发明的非离子表面活性剂的具体实例包括聚山梨醇酯型非离子表面活性剂、泊洛沙姆型非离子表面活性剂和其组合。更具体而言,可使用聚山梨醇酯型非离子表面活性剂。聚山梨醇酯型非离子表面活性
剂的实例包括聚山梨醇酯20、聚山梨醇酯40、聚山梨醇酯60和聚山梨醇酯80,并且其中聚山梨醇酯80是优选的,尽管不限于此。添加高浓度的非离子表面活性剂至制剂可能是不合适的,因为当通过分析方法比如uv-光谱测定方法或等电聚焦(ief)分析蛋白质以确定蛋白质浓度或稳定性时高浓度的非离子表面活性剂可能引起干扰效果,并且因此难以精确地确定蛋白质稳定性。因此,本发明的冻干制剂可包括具体地为0.1%(w/v)或更低,更具体地在0.001至0.1%(w/v)的范围内,和进一步更具体地在0.001至0.05%(w/v)的范围内的低浓度的非离子表面活性剂,尽管不限于此。
98.具体而言,无白蛋白溶液可进一步包括选自糖、多元醇和氨基酸的至少一种。本发明的发明人证实的是,当组氨酸作为氨基酸被进一步添加时,可改进溶解速率和实现重构而不起泡。
99.可被进一步包括以增加长效hgh缀合物的储存稳定性的糖的具体实例包括单糖比如甘露糖、葡萄糖、岩藻糖和木糖,以及多糖比如乳糖、麦芽糖、蔗糖、棉子糖和葡聚糖。多元醇的具体实例包括丙二醇、低分子量聚乙二醇、甘油、低分子量聚丙二醇和其组合。氨基酸的实例包括组氨酸或甘氨酸,尽管不限于此。组氨酸等可以以范围从1至10mm的浓度存在于水性溶液中,尽管不限于此。
100.无白蛋白溶液可进一步包括用于控制渗透压的等渗剂。
101.如本文所使用,术语“等渗剂”指当重构之后将长效hgh缀合物施用至身体时保持适当的渗透压的试剂。等渗剂可具有进一步稳定溶液中的长效hgh缀合物的作用。例如,等渗剂可以是水溶性无机盐,具体地氯化钠,尽管不限于此。用于本发明的氯化钠的浓度具体地在0至200mm的范围内,尽管不限于此。而且,取决于包括在制剂中的物质的类型和量,可调节包括的等渗剂的量使得包括所有成分的溶液制剂变得等渗。
102.在稀释1/2倍、1/4倍或更多之后无白蛋白溶液可被冻干。本发明的发明人证实的是,当稀释1/2倍或1/4倍之后无白蛋白溶液被冻干时溶解时间可降低(测试实施例1-(5))。
103.包括冻干混合物的本发明的冻干制剂展现优异的溶解时间。溶解时间是冻干物质的重要性质之一。如果溶解时间长,蛋白质必须长时间暴露于浓缩的溶液中,在此期间它可能变性。而且,因为不能施用不完全溶解产品,所以短的溶解时间可为患者和医师二者均提供方便。然而,随着蛋白质浓度增加,溶解时间不可避免地会增加。因此,具有短的溶解时间的制剂的开发对高浓度冻干制剂可能是重要的问题。
104.本发明的发明人证实的是,本发明的冻干制剂在短至10秒内溶解,并且即使当它包括10mg/ml或更高的高浓度的长效hgh缀合物时长至3分钟内溶解。
105.通过冻干具有期望浓度的目标蛋白并且然后用一定体积的预制剂重构目标蛋白可实现冻干产品期望的剂量,尽管不具体限于此。可选地,预制剂可以通过稀释用增加的体积被冻干并且然后使用较小体积的重构溶液重构。然而,如果过度稀释预制剂,冻干周期(具体而言,初级干燥时间)可能被延长并且因此生产成本可能增加。因此,本发明的制剂就成本而言也是有利的,因为即使高浓度长效hgh缀合物可以被冻干而不用过分稀释。
106.另外,本发明的冻干制剂可进一步包括除了上述缓冲液、等渗剂、糖醇、非离子表面活性剂和包括在重构溶液中的防腐剂之外的本领域已知的其他成分或材料,只要它们不减弱本发明的效果。
107.本发明的发明人制备了作为预制剂的冻干制剂,该冻干制剂包括长效hgh缀合物
和包括缓冲液、糖醇和表面活性剂的无白蛋白溶液并且评估其稳定性和溶解速率。具体而言,使用包括20mm ph 5.2或ph 5.6的柠檬酸盐缓冲液、150mm氯化钠、5%甘露醇和0.005%聚山梨醇酯80的预冻干制剂将长效hgh缀合物冻干为具有19.5mg/ml或78.0mg/ml的浓度,并且然后使用蒸馏水重构。优异的稳定性在以上浓度下是优异的。具体而言,在78.0mg/ml的更高浓度下稳定性更好。而且,在ph 5.2和5.6二者下均能实现良好的稳定性(测试实施例1-(1))。另外,当长效hgh缀合物溶解在包括ph 5.2或ph 5.6的20mm醋酸盐缓冲液、150mm nacl、5%甘露醇和0.005%聚山梨醇酯80的预冻干制剂中并且然后使用包括间甲酚、苯甲醇或苯酚作为防腐剂的重构溶液重构时,稳定性被维持。该结果证实了,通过用包括防腐剂的重构溶液重构冻干物质可制备具有保存活性的重构的制剂。具体而言,当使用水性醋酸盐溶液时,即使当使用包括防腐剂的重构溶液进行重构时,可以实现优异的稳定性而没有沉淀(测试实施例1-(2))。此外,证实了随着缀合物的浓度从19.5mg/ml增加至39.0mg/ml、至58.5mg/ml和至70.0mg/ml,制备的冻干制剂的溶解时间增加(测试实施例1-(3))。另外,即使当无白蛋白溶液不包含盐时实现了优异的溶解时间和稳定性,并且通过增加甘露醇的浓度溶解速率可增加。并且,当添加组氨酸时,可能降低溶解时间而不增加甘露醇的浓度(测试实施例1-(4))。此外,发明人发现,当稀释预制剂以降低密度时溶解速率被进一步改进(测试实施例1-(5)),并且发明人确定了冻干物质可完全干燥的最佳干燥条件(测试实施例1-(6))。还证明了甘露醇的存在极大地影响溶解时间(测试实施例1-(7)),并且即使对于58.5mg/ml的高浓度长效hgh缀合物而言当甘露醇浓度为4-4.5%时,30秒或更短的溶解时间可实现等渗渗透压(测试实施例1-(8))。另外,即使在将制备的冻干制剂在4℃或25℃下储存6个月之后,稳定性被维持为几乎恒定。而且,即使在重构之后将冻干制剂在25℃下储存2周之后,稳定性被维持(测试实施例1-(9))。
108.具体而言,制剂可以是长效hgh缀合物的液体制剂,其包括长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,和无白蛋白稳定剂,其中稳定剂包括缓冲液、非离子表面活性剂和糖醇。
109.长效hgh缀合物与如上所述的相同。
110.如本文所使用,术语“长效hgh缀合物的液体制剂”指包括长效hgh缀合物的液体制剂。液体制剂包括用于内部和外部应用二者的液体制剂。在本发明中,长效hgh缀合物的液体制剂可包括药学上有效量的长效hgh缀合物。一般而言,药学上有效量的hgh对应于单一用途小瓶中的约1至3mg,但不限于此。
111.并且,包括在本发明的液体制剂中的长效hgh缀合物的浓度范围具体地为5.0至60.0mg/ml,尽管不限于此。
112.长效hgh缀合物的液体制剂包括药学上有效量的长效hgh缀合物和无白蛋白稳定剂。
113.如本文所使用,术语“稳定剂”指使长效hgh缀合物稳定储存的物质。具体而言,稳定剂包括缓冲液、糖醇和非离子表面活性剂。针对蛋白质比如长效hgh缀合物,储存稳定性对于确保剂量精确性和抑制针对长效hgh缀合物的潜在抗原的形成是重要的。
114.如本文所使用,术语“缓冲液”指包括在本发明的稳定剂中并且用来维持制剂的稳定ph水平,从而防止ph的急剧改变以维持长效hgh缀合物的活性稳定的溶液。以上针对冻干制剂陈述的缓冲液的描述也应用于此。
115.缓冲液可以是柠檬酸盐缓冲液、醋酸盐缓冲液或组氨酸缓冲液,具体地是柠檬酸盐缓冲液,尽管不限于此。构成缓冲液的盐的浓度具体地在5至100mm的范围内,更具体地在10至50mm的范围内,尽管不限于此。缓冲液的ph在4.0至7.0的范围内,更具体地在5.0至6.0的范围内,进一步更具体地在5.2至6.0的范围内,最具体地为5.2,尽管不限于此。
116.如本文所使用,术语“糖醇”指包括在本发明的液体制剂中并且用来改进长效hgh缀合物的稳定性的氢化的碳水化合物。用于本发明的糖醇的浓度具体地在制剂总体积的1至10%(w/v)的范围内,并且更具体地在2%(w/v)至4.5%(w/v)的范围内,进一步更具体地为4%(w/v),尽管不限于此。用于本发明的糖醇可以是选自甘露醇和山梨醇的至少一种,具体地为甘露醇,尽管不具体限于此。
117.如本文所使用,术语“非离子表面活性剂”指降低蛋白质溶液的表面张力以防止蛋白质吸附在疏水的表面上或聚集的物质。可用于本发明的非离子表面活性剂的具体实例与如上所述的相同。
118.本发明的制剂可以是不包含等渗剂的一种。
119.等渗剂与如上所述的相同。
120.本发明的发明人发现,包括作为缓冲液的ph 5.2的水性醋酸盐或柠檬酸酯溶液并且包括4%(w/v)甘露醇但不包括等渗剂的制剂展现优异的稳定性。具体而言,包括作为缓冲液的ph 5.2的水性柠檬酸盐溶液并且包括4%(w/v)甘露醇但不包括等渗剂的制剂在10.0mg/ml的长效hgh缀合物浓度下展现最高的稳定性。
121.可进一步包括以增加长效hgh缀合物的储存稳定性的糖的具体实例与如上所述的相同。另外,本发明的液体制剂可进一步包括除上述缓冲液、糖醇和非离子表面活性剂以外的本领域已知的其他成分或材料,只要它们不减弱本发明的效果。
122.具体而言,本发明的液体制剂可进一步包括防腐剂。
123.发现的是,当其包括4%甘露醇(w/v)时,不包含等渗剂的长效hgh缀合物的制剂在ph 5.2的缓冲液中展现长效hgh缀合物的最佳稳定性。具体而言,当使用醋酸盐缓冲液时,在10.0mg/ml的长效hgh缀合物浓度下实现最佳稳定性(测试实施例2)。
124.本发明的制剂可用于垂体性侏儒症、生长激素缺乏、普-韦二氏综合征或特发性身材矮小症的治疗并且可在重构之后注射以治疗疾病。
125.在下文中,详细描述长效hgh缀合物。
126.如本文所使用,术语“人生长激素(hgh)”指刺激人生长、细胞增殖和再生的肽激素。hgh的序列上的信息可获得自公用数据库比如ncbi genbank。另外,本发明中hgh的范围包括具有与野生型hgh的氨基酸序列具有70%或更高、具体地80%或更高、更具体地90%或更高、甚至更具体地95%或更高、和最具体地98%或更高的序列同源性的氨基酸序列的蛋白质,只要它具有hgh活性。而且,只要其生物活性不显著改变,通过氨基酸残基的置换、缺失或插入的源自野生型hgh的任何突变体可用于本发明。
127.用于本发明的hgh可具有野生型hgh、其变体、其衍生物或其片段的氨基酸序列。
128.如本文所使用,术语“hgh变体”指具有不同于野生型hgh的氨基酸序列的至少一种氨基酸序列同时展示hgh活性的肽。可通过野生型hgh的一些氨基酸的置换、添加、缺失或修饰或其组合制备hgh变体。
129.如本文所使用,术语“hgh衍生物”指与野生型hgh具有至少80%氨基酸序列同源性
并且展现hgh活性的肽,其中氨基酸残基的一些基团被化学置换(例如,α-甲基化,α-羟基化)、缺失(例如,脱氨基)或修饰(例如,n-甲基化)。
130.如本文所使用,术语“hgh片段”指其中在hgh的n-端或c-端添加或缺失至少一种氨基酸同时保留hgh活性的肽。添加的氨基酸是非天然存在的氨基酸的一种(例如,d-氨基酸)。
131.另外,用于本发明的hgh可以获得自天然或重组蛋白质。具体而言,其为通过使用大肠杆菌作为宿主细胞制备的重组体hgh,尽管不限于此。
132.如本文所使用,术语“免疫球蛋白fc区域”指排除重链和轻链的可变区的免疫球蛋白部分——免疫球蛋白的重链恒定区1(ch1)和轻链恒定区1(c
l
1)。免疫球蛋白fc区域可以是免疫球蛋白的重链恒定区2(ch2)和重链恒定区3(ch3),并且可进一步包括重链恒定区的铰链区,尽管不限于此。而且,本发明的免疫球蛋白fc区域可以是包括除免疫球蛋白的重链和轻链的可变区以外的重链恒定区1(ch1)和/或轻链恒定区1(c
l
1)的部分或全部的扩展fc区域,只要其具有与野生型蛋白质相比基本上相同或改进的效果。而且,免疫球蛋白fc区域可以是其中对应于ch2和/或ch3的氨基酸序列的相当长的部分缺失的片段。也就是说,本发明的免疫球蛋白fc区域可包括1)ch1结构域、ch2结构域、ch3结构域和ch4结构域,2)ch1结构域和ch2结构域,3)ch1结构域和ch3结构域,4)ch2结构域和ch3结构域,5)至少一种结构域和免疫球蛋白铰链区(或部分铰链区)的组合,和6)重链恒定区和轻链恒定区的结构域的二聚体,尽管不限于此。
133.本发明的免疫球蛋白fc区域包括天然氨基酸序列和其氨基酸序列衍生物(突变体)。氨基酸序列衍生物指通过缺失、插入、非保守或保守置换天然氨基酸序列的至少一种氨基酸残基或其组合具有与天然序列不同序列的序列。例如,在igg fc中,已知对于蛋白质结合重要的214至238位、297至299位、318至322位或327至331位的氨基酸残基可以是用于修饰的适合的目标。
134.而且,可使用其他类型的衍生物,包括以下衍生物:其中缺失能够形成二硫键的区域,天然fc的n-端的氨基酸残基几乎没有被消除,或甲硫氨酸残基被添加在天然fc的n-端。此外,为了消除效应器(effector)的功能,可以缺失补体-结合位点,例如c1q-结合位点或抗体依赖性细胞毒作用(adcc)位点。在wo 97/34631和wo 96/32478中公开了用于制备免疫球蛋白fc区域的这种序列衍生物的技术。
135.不改变整体蛋白质活性的蛋白质和肽中的氨基酸的置换在本领域是已知的(h.neurath,r.l.hill,the proteins,academic press,new york,1979)。最经常发生的交换是两个方向的ala/ser、val/ile、asp/glu、thr/ser、ala/gly、ala/thr、ser/asn、ala/val、ser/gly、thy/phe、ala/pro、lys/arg、asp/asn、leu/ile、leu/val、ala/glu和asp/gly。在一些情况下,fc区域可以通过磷酸化、硫酸化、丙烯酰化、糖基化、甲基化、法呢酰化、乙酰化、酰胺化等修饰。上述fc衍生物展现与本发明的fc区域相同的生物活性,并且它们具有针对热、ph等的增强的结构稳定性。
136.另外,这些fc区域可以获得自与人或包括奶牛、山羊、猪、小鼠、兔子、仓鼠、大鼠和豚鼠的其他动物分离的天然蛋白质,或可以是获得自转化动物细胞或微生物或其衍生物的重组体。这里,由天然免疫球蛋白获得fc区域的方法可包括从人体或动物体分离整个免疫球蛋白,并且用蛋白酶处理它们。当木瓜蛋白酶用于消化免疫球蛋白时,它们被分裂成fab
和fc区域,并且当使用胃蛋白酶时,免疫球蛋白被分裂成pf'c和f(ab)2。这些片段可以通过尺寸排阻色谱分离以分离fc或pf'c。具体而言,源自人的fc区域是获得自微生物的重组免疫球蛋白fc区域。
137.另外,本发明的免疫球蛋白fc区域可以是天然糖链的形式、比天然形式长的糖链、比天然形式短的糖链或去糖基化形式。通过使用本领域常用方法——包括化学方法、酶方法和使用微生物的基因工程化方法——可进行免疫球蛋白fc糖链的延长或去除。糖链从免疫球蛋白fc区域的去除导致其与第一补体组分c1的c1q的结合亲和力急剧降低,并且因此抗体依赖性细胞毒作用或依赖补体的细胞毒性降低或去除,并且可以避免体内不需要的免疫应答的发生。在这点上,去糖基化或无糖基化免疫球蛋白fc区域作为用于本发明的对象的药物载体是更优选的形式。
138.另外,免疫球蛋白fc区域可以是源自igg、iga、igd、ige和igm的一种,或通过其组合或杂种制备的那些。具体而言,其源自igg或igm,其为人血液中最丰富蛋白质,和最具体地源自igg,已知其增强配体-结合蛋白质的半衰期。免疫球蛋白fc可通过用某些蛋白酶处理天然igg或通过使用遗传重组技术转化细胞产生。具体而言,免疫球蛋白fc是在大肠杆菌中产生的重组人免疫球蛋白fc。
139.同时,如本文所使用,术语“组合”指当形成二聚体或多聚体时编码相同来源的单链免疫球蛋白fc区域的多肽和不同来源的单链多肽之间的缀合。也就是说,二聚体或多聚体可由选自igg fc、iga fc、igm fc、igd fc和ige fc片段的两个或更多个片段形成。
140.如本文所使用,术语“杂种”指在单链免疫球蛋白fc区域中存在对应于不同来源的免疫球蛋白fc片段的至少两个序列。在本发明中,可以使用各种类型的杂种。也就是说,结构域的杂种可以由选自igg fc、igm fc、iga fc、ige fc和igd fc的ch1、ch2、ch3和ch4的一个至四个结构域组成,并且可包括铰链区。
141.同时,igg也可被分为子类,igg1、igg2、igg3和igg4,并且其组合或杂种在本发明中也是可能的,具体地igg2和igg4子类,和最具体地缺少效应器功能——比如依赖补体的细胞毒性——的igg4的fc区域。换句话说,本发明中缀合物的最优选的免疫球蛋白fc区域是源自人igg4的非糖基化的fc区域。源自人的fc区域优选的是非人源的fc区域,其可充当人体中的抗原并引起非期望的免疫应答比如针对该抗原的新抗体的产生。
142.本发明的长效hgh缀合物可以通过组合hgh和免疫球蛋白fc区域制备,该hgh通过任何方法由天然或重组形式制备,该免疫球蛋白fc区域通过用某些蛋白酶处理野生型igg制备或通过使用重组技术由转化细胞产生。
143.作为用于该目的的组合方法,缀合物可通过使用非肽基聚合物交联hgh和免疫球蛋白fc区域制备,或可作为融合蛋白产生,其中hgh和免疫球蛋白fc区域使用重组技术连接。也就是说,缀合物可以以其中hgh和免疫球蛋白fc经非肽基连接体连接的形式,或以hgh和免疫球蛋白fc的融合蛋白的形式产生。融合蛋白包括其中hgh和免疫球蛋白fc经肽基连接体组合的形式,尽管不限于此。
144.如本文所使用,术语“非肽基聚合物”指其中两个或更多个重复单元被组合并且重复单元通过除肽键以外的任何共价键连接至彼此的生物相容性聚合物。在本发明中,术语非肽基聚合物可与术语非肽基连接体互换使用。
145.用于交联的非肽基聚合物可选自生物可降解的聚合物,其包括聚乙二醇、聚丙二
醇、乙二醇-丙二醇共聚物、聚氧乙烯化多元醇、聚乙烯醇、多糖、葡聚糖、聚乙烯基乙醚、聚乳酸(pla)或聚乳酸-乙醇酸(plga)、脂质聚合物、壳多糖、透明质酸和其组合。具体而言,可使用聚乙二醇(peg),尽管不限于此。另外,本领域已知的其衍生物和可通过本领域已知的方法容易制备的衍生物可包括在本发明的范围内。
146.为了制备本发明的长效hgh缀合物,参考文献比如韩国专利号0725315在本发明中作为引用的参考文献公开。本领域技术人员通过查阅参考文献可生产本发明的长效hgh缀合物,尽管不限于此。
147.在另一方面中,本发明提供长效hgh缀合物的冻干制剂,其包括水性溶液和无白蛋白溶液的冻干混合物,该水性溶液包括长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,该无白蛋白溶液包括醋酸盐缓冲液、聚山梨醇酯80和甘露醇。
148.hgh、免疫球蛋白fc区域、长效hgh缀合物、无白蛋白溶液、冻干和冻干制剂与以上描述的相同。
149.在另一方面中,本发明提供长效hgh缀合物的液体制剂,其包括药学上有效量的长效hgh缀合物——其中hgh作为生理活性肽连接至免疫球蛋白fc区域,和包括柠檬酸盐缓冲液、聚山梨醇酯80和甘露醇的无白蛋白稳定剂,稳定剂不包括等渗剂。
150.hgh、免疫球蛋白fc区域、长效hgh缀合物、无白蛋白稳定剂和液体制剂与以上描述的相同。
151.在另一方面中,本发明提供用于制备冻干制剂的方法,包括冻干长效hgh缀合物和包括缓冲液、非离子表面活性剂和糖醇的无白蛋白溶液。
152.长效hgh缀合物、缓冲液、非离子表面活性剂、糖醇、无白蛋白溶液、冻干和冻干制剂与以上描述的相同。
153.在另一方面中,本发明提供用于重构冻干制剂的方法,其包括添加重构溶液至冻干制剂。
154.冻干制剂和重构与以上描述的相同。
155.如本文所使用,术语“重构溶液”指添加至固体状态的冻干物质以重构该冻干物质的溶液。重构溶液可以是注射用水,例如无菌蒸馏水,但是不具体限于此。
156.而且,重构溶液可进一步包括防腐剂。
157.如本文所使用,术语“防腐剂”指大幅度降低制剂中的细菌或真菌污染的物质。尤其,其包括在制剂中以促进生产用于多次给药的制剂。防腐剂的实例包括十八烷基二甲基苄基氯化铵、六甲氯铵、苯扎氯铵(具有长烷基链的烷基苄基二甲基氯化铵的混合物)和苄索氯铵。其他类型的防腐剂包括:芳族醇类比如苯酚、丁醇和苯甲醇;烷基对羟基苯甲酸酯比如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;和间甲酚,但不限于此。本发明的液体制剂中的防腐剂具体地为苯甲醇、间甲酚或苯酚,更具体地为苯甲醇,尽管不限于此。防腐剂的浓度具体地在0.001至0.9%(w/v)的范围内,更具体地在0.1至0.9%(w/v)的范围内,尽管不限于此。
158.如上所述重构的本发明的制剂可包含的长效hgh缀合物的浓度范围是10至100mg/ml,尽管不限于此。
159.在另一方面中,本发明提供包括冻干制剂和重构溶液的试剂盒。
160.冻干制剂与如上所述的相同。
161.试剂盒包括冻干制剂和重构溶液,并且可进一步包括由至少一种适于重构的其他成分组成的组合物、溶液或装置。
162.在下文中,将参考实施例更详细描述本发明。然而,这些实施例仅用于说明性目的,并且本发明不旨在被这些实施例限制。
163.制备实施例:长效人生长激素(hgh)缀合物的制备
164.ald-peg-ald——其为在两个端处具有醛基的分子量约3.4kda的聚乙二醇——与人生长激素(hgh,分子量:22kda)缀合,并且然后连接至源自人igg4的无糖基化fc区域(约50kda)的n-端。通过此,制备和纯化最终产物hgh-peg-fc缀合物(在下文中,称为“长效hgh缀合物”),其为本发明的代表性长效hgh缀合物。
165.测试实施例1:长效hgh缀合物的冻干制剂的评估
166.(1)分析长效hgh缀合物的冻干制剂根据浓度和缓冲液的稳定性
167.在制备包括表1中描述的浓度的长效hgh缀合物的冻干制剂之后,在重构之后分析稳定性。还分析了缓冲液和ph对长效hgh缀合物的稳定性的作用。
168.如表1中所描述,使用包括缓冲液、氯化钠(nacl)、甘露醇和聚山梨醇酯80的预冻干制剂将长效hgh缀合物冻干为具有给定浓度,其然后使用蒸馏水重构。冻干由初级干燥和次级干燥步骤组成。冻干的温度梯度被设定为冷冻,随后是初级干燥(4℃)和次级干燥(20℃),如在图1中所显示。通过用与冻干前的制剂相同体积的蒸馏水溶解冻干制剂进行重构。将重构的液体制剂在40℃下储存4周,并且通过离子交换色谱(ie-hplc)分析稳定性。结果显示在表2中。在表2中,ie-hplc(%)指示在给定时间长效hgh缀合物的纯度。
169.表1
[0170][0171][0172]
表2
[0173][0174]
由表2可见,在40℃下储存4周之后,长效hgh缀合物的液体制剂显示根据浓度的稳定性没有差别。因此,证实了甚至可向高浓度的长效hgh提供稳定性。而且,证实了当缓冲液和ph改变时稳定性被维持(比较实施例2和3)。
[0175]
(2)分析长效人生长激素(hgh)缀合物的冻干制剂根据防腐剂的稳定性和溶解度
[0176]
使用测试实施例1-(1)的实施例2的制剂(20mm柠檬酸钠,ph 5.2,150mm氯化钠,5%甘露醇,0.005%聚山梨醇酯80)和实施例3的制剂(20mm醋酸钠,ph 5.6,150mm氯化钠,5%甘露醇,0.005%聚山梨醇酯80)和由实施例3的制剂(20mm醋酸钠,ph 5.6,4%甘露醇,0.005%聚山梨醇酯80)制备的等渗制剂,将长效hgh缀合物混合为表3中描述的68.25mg/ml和58.5mg/ml的浓度,其然后被冻干。在使用包括表3中描述的防腐剂的重构溶液重构之后,测量溶解时间和稳定性。用肉眼比较产品状态。用与测试实施例1-(1)描述的相同方式进行冻干和重构。重构的液体制剂在25℃下储存4周并且然后通过离子交换色谱(ie-hplc)和目测评估稳定性。结果显示在表4中。在表4中,ie-hplc(%)指示在给定时间长效hgh缀合物的纯度。
[0177]
表3
[0178][0179]
表4
[0180][0181]
由表4可见,在实施例6和7中长效hgh缀合物的稳定性比在实施例4和5中维持的好。然而,由实施例6-9的结果可见,根据防腐剂的种类,长效hgh缀合物的稳定性没有差别。但是,当使用包含间甲酚的重构溶液时,所得的液体制剂在溶解期间是有薄雾的。
[0182]
(3)分析长效hgh缀合物的冻干制剂根据缀合物浓度的溶解度
[0183]
制备包括不同浓度的长效hgh缀合物的冻干制剂并且评估当重构时其产品状态和溶解度。使用测试实施例1-(1)的实施例1的制剂(20mm柠檬酸钠,ph 5.2,150mm氯化钠,5%甘露醇,0.005%聚山梨醇酯80),将长效hgh缀合物混合为表5中描述的不同浓度,其然后被冻干。在使用蒸馏水重构之后,测量溶解时间。以与测试实施例1-(1)描述的相同方式进行冻干和重构。用肉眼比较产品状态。使用设定为60
°
和30rpm的自动振动器进行重构。在表6中给出了完全溶解需要的时间。
[0184]
表5
[0185]
[0186][0187]
表6
[0188] 实施例1实施例10实施例11实施例12溶解时间(秒)103090150
[0189]
虽然无论浓度如何冻干物质的产品状态是稳定的,但是在较高的浓度下可观察到更刚性的饼。由表6可见,溶解时间随着浓度增加。
[0190]
(4)分析长效人生长激素(hgh)缀合物的冻干制剂根据稳定剂的稳定性和溶解度
[0191]
使用不同的稳定剂制备长效hgh缀合物的冻干制剂并且评估其溶解时间、溶解状态和长效hgh缀合物稳定性。用表7中描述的组合物制备预制剂,其然后被用于冷冻干燥78.0mg/ml的长效hgh缀合物。在使用蒸馏水重构之后测量溶解时间。以与测试实施例1-(1)中描述的相同方式进行冻干和重构。用肉眼比较产品状态。使用设定为60
°
和30rpm的自动振动器进行重构。在表8中给出了完全溶解需要的时间。
[0192]
而且,重构的液体制剂在40℃下储存4周之后,通过离子交换色谱(ie-hplc)评估稳定性。在表9中,ie-hplc(%)指示在给定时间长效hgh缀合物相对于初始值的残留率。
[0193]
表7
[0194][0195]
[0196]
表8
[0197][0198]
表9
[0199][0200]
由表8可见,当甘露醇的浓度高时获得高的溶解速率。还证实了添加5mm组氨酸导致改进的溶解速率。实施例15和17的制剂显示在重构期间相比于实施例19的制剂严重起泡。由表9可见,每种制剂溶解之后的稳定性相似。但是,当包括氯化钠作为稳定剂时,长效hgh缀合物的稳定性略高。
[0201]
(5)分析冻干制剂根据冻干物质的密度和长效hgh缀合物的浓度的溶解度
[0202]
使用测试实施例1-(4)的实施例19的制剂(20mm柠檬酸钠,ph 5.2,5%(w/v)甘露醇,5mm组氨酸,0.005%(w/v)聚山梨醇酯80),分析冻干物质根据长效hgh缀合物浓度的溶解度。用表10中描述的组合物制备预制剂并且然后冻干。在冻干期间,使用蒸馏水将预制剂稀释1倍、1/2倍和1/4倍。冻干由初级干燥和次级干燥步骤组成。冻干的温度梯度显示在图1中。通过用与冻干前的制剂相同体积的蒸馏水溶解冻干制剂进行重构。使用设定为60
°
和30rpm的自动振动器进行重构。在表11中给出了完全溶解需要的时间。
[0203]
表10
[0204][0205]
表11
[0206][0207]
由表11可见,证实了当通过稀释降低冻干物质的密度时溶解速率被改进。而且,当制剂(20mm柠檬酸钠,5%甘露醇,5mm组氨酸,0.005%聚山梨醇酯80)中长效hgh缀合物的浓度由39.0mg/ml增加至48.8mg/ml和至58.5mg/ml时溶解速率同样增加。
[0208]
(6)设定冻干过程的温度梯度
[0209]
通过使初级干燥时间由10小时增加至20小时和将初级干燥步骤(4℃)的温度细分为-20℃和-5℃的两个阶段(图2)改变测试实施例1-(1)中的温度梯度(图1)。在前者温度梯度中,出现冻干物质的破坏是因为3-5%的水保留在冻干物质中。当温度梯度变化为如图2所显示时,即使具有较大的体积(~5ml)可实现完全的冻干。
[0210]
(7)分析考虑渗透压的长效hgh缀合物的冻干制剂的溶解度
[0211]
使用测试实施例1-(1)和(2)中的制剂(20mm醋酸钠,ph 5.6,5%(w/v)甘露醇,150mm氯化钠,0.005%(w/v)聚山梨醇酯80),考虑渗透压设定稳定剂的浓度并且分析冻干物质的溶解度。如表12中所描述制备预制剂并且然后冻干。
[0212]
在冻干期间,使用蒸馏水将预制剂稀释1/2倍。冻干由初级干燥和次级干燥步骤组成。冻干的温度梯度被设定为如图2所显示。使用包含0.9%苯甲醇的蒸馏水进行重构,其具有与稀释前的制剂相同的体积。
[0213]
使用设定为60
°
和30rpm的自动振动器进行重构。表13显示了重构之后完全溶解所需要的时间和测量的渗透压。
[0214]
表12
[0215][0216][0217]
表13
[0218] 实施例23实施例24实施例25实施例26溶解时间(秒)301801560渗透压(mosm/kg)662338365355
[0219]
由表13可见,当去除甘露醇时溶解时间大大增加。当甘露醇的浓度为5%(w/v)时,渗透压高于280-320mosm/kg的等渗范围。
[0220]
(8)分析长效hgh缀合物的冻干制剂根据甘露醇浓度的溶解度和渗透压
[0221]
使用测试实施例1-(7)的制剂(20mm醋酸钠,ph 5.6,5%(w/v)甘露醇,0.005%(w/v)聚山梨醇酯80),分析冻干物质根据甘露醇浓度的溶解度和渗透压。
[0222]
如表14中描述制备预制剂并且然后冻干。冻干和重构的方法和条件与测试实施例1-(7)中描述的相同。表15显示了重构之后完全溶解所需要的时间和测量的渗透压。
[0223]
表14
[0224][0225][0226]
表15
[0227] 实施例23实施例25实施例27实施例28实施例29溶解时间(秒)3020222527渗透压(mosm/kg)632350318291258
[0228]
由表15可见,当甘露醇的浓度在4至4.5%的范围内时观察到等渗渗透压。虽然随着甘露醇浓度越低,溶解时间越长,但是与包括氯化钠时相比,该变化较小。
[0229]
(9)分析在4℃和25℃下长效hgh缀合物的冻干制剂的储存稳定性
[0230]
使用测试实施例1-(8)的制剂(20mm醋酸钠,ph 5.6,4%(w/v)甘露醇,0.005%(w/v)聚山梨醇酯80),分析在4℃和25℃下冻干物质的储存稳定性。在4℃和25℃下储存冻干制
剂6个月以后,重构之后通过离子交换色谱(ie-hplc)评估稳定性。初始重构溶液在25℃下以液体状态储存4周,并且然后在重构之后通过离子交换色谱(ie-hplc)评估。在表16中,ie-hplc(%)指示在给定时间冻干物质中长效hgh缀合物的纯度。在表17中,ie-hplc(%)指示重构的液体制剂中长效hgh缀合物的纯度。
[0231]
表16
[0232][0233]
表17
[0234][0235]
由表16可见,冻干物质的稳定性甚至在4℃和25℃下储存6个月之后被维持。而且,重构制剂的稳定性甚至在25℃储存2周之后被维持。
[0236]
测试实施例2:评估长效hgh缀合物的液体制剂
[0237]
(1)分析长效hgh缀合物的液体制剂根据ph、缓冲液、等渗剂和糖醇浓度的稳定性
[0238]
测试了缓冲液、等渗剂和糖醇浓度对长效hgh缀合物的稳定性的影响。将如表18中描述制备的制剂在25℃下储存0-4周并且然后通过离子交换色谱和尺寸排阻色谱分析。在表19和20中,ie-hplc(%)和se-hplc(%)分别指示长效hgh缀合物相对于初始值的残留率(面积%/初始面积%)。
[0239]
表18
[0240][0241]
表19
[0242]
[0243][0244]
表20
[0245][0246]
ie-hplc结果显示,长效hgh缀合物在20mm醋酸钠(ph 5.2)的条件下显示良好的稳定性。并且,se-hplc结果显示长效hgh缀合物在20mm醋酸钠(ph 5.2)和4%(w/v)甘露醇的条件下最稳定。
[0247]
(2)分析长效hgh缀合物的液体制剂根据缓冲液的稳定性
[0248]
测试作为稳定剂的缓冲液对长效hgh缀合物的稳定性的影响。使用测试实施例2-(1)的制剂(ph 5.2,4%甘露醇,0.005%聚山梨醇酯80),如表21中描述制备制剂。在25℃下储存0-4周之后,通过ie-hplc和se-hplc分析稳定性。在表22和23中,ie-hplc(%)和se-hplc(%)分别指示长效hgh缀合物相对于初始值的残留率(面积%/初始面积%)。
[0249]
表21
[0250][0251]
表22
[0252]
[0253][0254]
表23
[0255][0256]
ie-hplc结果显示,在柠檬酸钠的条件下10.0mg/ml长效hgh缀合物最稳定。并且,se-hplc结果显示,10.0mg/ml长效hgh缀合物在组氨酸和柠檬酸钠的组中显示良好的稳定性。
[0257]
ie-hplc结果显示,58.5mg/ml长效hgh缀合物在醋酸钠和柠檬酸钠的组中显示良好的稳定性。并且,se-hplc结果显示,58.5mg/ml长效hgh缀合物在组氨酸和柠檬酸钠的组中显示良好的稳定性。
[0258]
当长效hgh缀合物的浓度在10mg/ml至58.5mg/ml的范围内时,在20mm柠檬酸钠(ph 5.2)、4%甘露醇和0.005%聚山梨醇酯80的条件下观察到最佳稳定性。
[0259]
对本领域技术人员将显而易见的是,可以做出各种改变和变化而不背离本发明的范围和精神。因此,应理解,以上实施方式不是限制性的,而是在所有方面说明性的。本发明的范围由所附权利要求书而不是由在其之前的说明书限定,并且因此所有变化和改变落在
权利要求书的界限内,或这种界限的等价物旨在包含在权利要求书中。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
