100~150iu/ml、β-连环素20~35iu/ml、pdgf 10~18iu/ml、pi3k 100~150iu/ml、热休克蛋白2.0~8.0ng/ml、壳聚糖0.5~1.0μg/ml、糖胺多糖2.0~3.0μg/ml、冷凝集素1.0~1.8μg/ml、整合素β1 2.0~6.0μg/ml和凝血酶2.0~4.0μg/ml。
9.优选的,所述间充质干细胞包括:脐带间充质干细胞、脂肪间充质干细胞、胎盘间充质干细胞和牙髓间充质干细胞。
10.本发明还提供了上述赋能型间充质干细胞添加剂在保持间充质干细胞增殖能力中的应用。
11.本发明还提供了上述赋能型间充质干细胞添加剂在保持间充质干细胞多向分化潜能中的应用。
12.优选的,所述赋能型间充质干细胞添加剂与间充质干细胞无血清基础培养基的体积比例为1:50。
13.本发明提供了一种赋能型间充质干细胞添加剂,该赋能型间充质干细胞添加剂中的wnt3a蛋白、wnt3b蛋白和wnt8c蛋白为wnt信号通路上的蛋白,与形态发生蛋白bmp一同起到了维持间充质干细胞的自我更新能力的作用;雷帕霉素和pluripotin蛋白则能够显著提高间充质干细胞自噬与增殖能力;tgf-β1、fgf-2、β-连环素、pdgf和pi3k能够在不改变间充质干细胞分化的潜能的基础上,增加间充质干细胞增殖速度和寿命;热休克蛋白对细胞损伤具有保护作用,提高间充质干细胞适应体外培养的耐受程度;壳聚糖、糖胺多糖、冷凝集素、整合素β1和凝血酶则借助其吸附作用,促进间充质干细胞的贴壁生长。本发明提供的赋能型间充质干细胞添加剂不仅有效促进间充质干细胞体外增殖培养,还克服了传统间充质干细胞体外培养传代多次后出现细胞衰老的缺点,使间充质干细胞一直保持强大的增殖能力和多向分化潜能。该添加剂使用的各组分为优质级细胞因子和医疗级重组蛋白或试剂,没有引入外源性的动物源蛋白,成分明确,便于开展后续相关研究工作,利于研究人员使用该添加剂培养间充质干细胞用于细胞治疗。
14.实施例结果表明,本发明提供的赋能型间充质干细胞添加剂中多种成分协同作用,提高间充质干细胞体外扩增的数量;传代至20代的脐带间充质干细胞仍具有分化为成骨、脂肪、软骨的潜力,能够有效保持多向分化潜能。
附图说明
15.图1为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd90);
16.图2为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd73);
17.图3为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd45);
18.图4为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd44);
19.图5为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd34);
20.图6为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干
细胞的流式分析图(检测表面抗原为cd19);
21.图7为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd11b);
22.图8为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为hla-dr);
23.图9为实施例3中使用本发明提供的赋能型间充质干细胞添加剂的脐带间充质干细胞的流式分析图(检测表面抗原为cd105);
24.图10为实施例4使用本发明提供的赋能型间充质干细胞添加剂培养脐带间充质干细胞传代20代后诱导成脂肪图片;
25.图11为实施例4使用本发明提供的赋能型间充质干细胞添加剂培养脐带间充质干细胞传代20代后诱导成骨图片;
26.图12为实施例4使用本发明提供的赋能型间充质干细胞添加剂培养脐带间充质干细胞传代20代后诱导成软骨图片。
具体实施方式
27.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法;所用的实验材料,如无特殊说明,均为自常规化试剂厂商购买得到的。尤其是下列添加剂中涉及到的各组分,均为常规市售产品。
28.本发明需要提示说明的实验环境、实验材料和仪器设备如下:
29.1、实验环境:gmp环境下实验室内的超净工作台中操作。
30.2、试剂:msc-t4&msc-t4 phenolred(-)基础培养基、磷酸盐缓冲液pbs(珠海贝索生物技术有限公司)、r-te重组胰酶、s-ti胰酶中止剂(株式会社细胞科学研究所csti);fbs(gibco);
31.3、仪器与设备:离心机(thermo,美国)、t75培养瓶(tc处理)、co2培养箱(三洋,中国)、超净工作台(智净,中国)、倒置显微镜。
32.实施例1
33.(1)准备添加剂
34.赋能型间充质干细胞添加剂由以下浓度的组分组成:wnt3a 100ng/ml、wnt3b 50pg/ml、wnt8c 50pg/ml、bmp蛋白10pg/ml、雷帕霉素10nmol/l、pluripotin 5nmol/l、tgf-β1 50iu/ml、fgf-2 100iu/ml、β-连环素20iu/ml、pdgf 10iu/ml、pi3k 100iu/ml、热休克蛋白2ng/ml、壳聚糖0.5μg/ml、糖胺多糖2μg/ml、冷凝集素1μg/ml、整合素β1 2μg/ml和凝血酶2μg/ml,配置完成后按1:50的比例加入到msc-t4培养基中;
35.对照组添加等比例的质量百分浓度为10%的fbs。
36.(2)干细胞复苏
37.1、将恒温自动加热仪预热到37℃;
38.2、准备一支50ml离心管,按冻存细胞液:干细胞完全培养基=1:9的比例取干细胞完全培养基,并预热到37℃;
39.3、从液氮罐中取出冻存的干细胞,快速置于恒温自动加热仪中,直到冰块完全溶解,整个溶解过程不能超过2min;
40.4、将溶解的干细胞用枪头转移到预先准备好装有干细胞完全培养基的离心管中,于常温下,250
×
g离心6min,弃上清,剩余干细胞;
41.5、取干细胞完全培养基回悬干细胞得到细胞悬液,取50μl细胞悬液,用50μl质量百分浓度为0.4%的台盼蓝染色液混匀染色,进行细胞活性检测和细胞计数,按5000~10000个/cm2的密度进行接种;
42.6、在t75培养瓶中加入15ml干细胞进行培养,实验组和对照组按照步骤(1)的描述分别使用本发明提供的赋能型间充质干细胞添加剂和fbs,按5000~10000个/cm2的密度接种干细胞,使干细胞其均匀的铺在培养瓶底部,37℃,5%co2培养箱中培养;
43.7、待干细胞复苏后第2天进行换液,吸弃瓶内旧培养基,再加入25ml干细胞完全培养基,继续放入37℃,5%co2培养箱中培养;
44.8、每隔两至三天进行镜下观察再进行换液,当干细胞达到90%以上融合时,镜下观察细胞形态,利用重组胰酶消化干细胞并进行离心处理进行细胞收集计数,统计结果见表1。
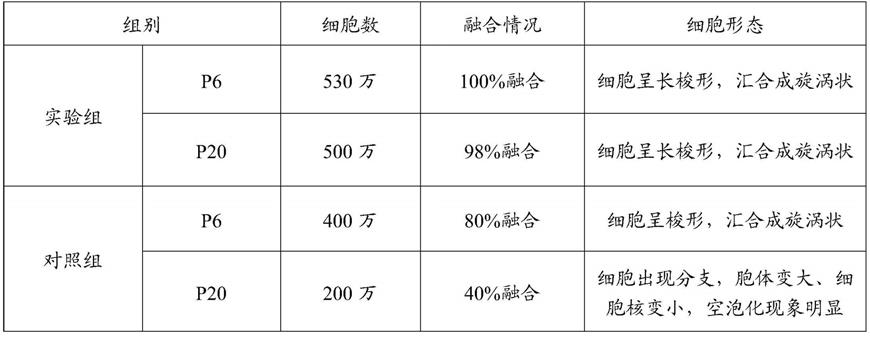
45.表1实验组和对照组的p6代与p20代细胞数、融合情况和细胞形态的对比
[0046][0047]
由表1可知,实验组中各组细胞的数量均显著高于对照组的,融合情况也高于对照组的,并且细胞形态也更为理想,表明本发明提供的赋能型间充质干细胞添加剂能够提高干细胞复苏过程中的细胞数和融合情况。
[0048]
实施例2
[0049]
(1)准备添加剂
[0050]
1、赋能型间充质干细胞添加剂由以下浓度的组分组成:wnt3a 70ng/ml、wnt3b 80pg/ml、wnt8c 60pg/ml、bmp蛋白17pg/ml、雷帕霉素10nmol/l、pluripotin 3nmol/l、tgf-β1 80iu/ml、fgf-2 150iu/ml、β-连环素30iu/ml、pdgf 18iu/ml、pi3k 120iu/ml、热休克蛋白8ng/ml、壳聚糖0.6μg/ml、糖胺多糖2μg/ml、冷凝集素1.8μg/ml、整合素β1 5μg/ml和凝血酶3μg/ml,配置完成后按1:50的比例加入到msc-t4培养基中;
[0051]
2、对比例1:与实施例2的区别在于添加剂的成分不同,去除添加剂中的wnt3a、wnt3b、wnt8c和bmp蛋白,其余均与实施例2相同;
[0052]
3、对比例2:与实施例2的区别在于添加剂的成分不同,去除添加剂中的雷帕霉素和pluripotin,其余均与实施例2相同;
80pg/ml、wnt8c 55pg/ml、bmp蛋白15pg/ml、雷帕霉素15nmol/l、pluripotin 4nmol/l、tgf-β1 65iu/ml、fgf-2 120iu/ml、β-连环素35iu/ml、pdgf16 iu/ml、pi3k 150iu/ml、热休克蛋白5ng/ml、壳聚糖1μg/ml、糖胺多糖3μg/ml、冷凝集素1.5μg/ml、整合素β1 6μg/ml和凝血酶4μg/ml,配置完成后按1:50的比例加入到msc-t4培养基中。
[0088]
(2)干细胞传代
[0089]
以175cm2培养瓶为例,当细胞达到80%~90%融合时进行传代;
[0090]
1、吸弃瓶内旧培养基,使用无菌10ml pbs(-)洗涤培养瓶;
[0091]
2、加入5ml r-te覆盖瓶底细胞,室温下放置2~3min,定期在显微镜下观察细胞是否脱离瓶底;
[0092]
3、继续消化至大约90%的细胞变为圆形,轻拍培养瓶,使大部分细胞从底部脱离;
[0093]
4、细胞悬浮后,用5ml s-ti终止消化反应;
[0094]
5、将细胞快速转至50ml的无菌离心管,用10ml pbs(-)冲洗培养瓶收集余下的细胞,一并移入离心管内;
[0095]
6、显微镜下观察培养瓶内的细胞是否收集成功,未收集的细胞应小于5%;
[0096]
7、室温下250
×
g,离心6min,弃上清;
[0097]
8、用少量的回温的t4完全培养基重悬细胞,进行细胞计数;
[0098]
9、在t175cm2培养瓶中加入25ml细胞培养基,按5000~10000个/cm2的密度接种干细胞,使干细胞其均匀的铺在培养瓶底部,37℃,5%co2培养箱中培养;
[0099]
10、隔两至三天进行镜下观察后进行换液,当细胞达到90%以上融合时,镜下观察细胞形态,使用重组胰酶消化离心细胞,再继续进行传代。
[0100]
(3)人脐带间充质干细胞的成脂诱导分化
[0101]
选择生长状态良好的第20代脐带间充质干细胞,按8.0
×
103/cm2接种于6孔培养板中,当细胞贴壁生长达到60%融合时,加入成脂诱导剂地塞米松1μmol/l、ibmx 0.5mmol/l、吲哚美辛100μmol/l,置于37℃、5%co2培养箱;间隔3天换液1次。第14天时使用2%的油红o染色鉴定细胞。染色结果如图10所示。
[0102]
(4)人脐带间充质干细胞的成骨导分化
[0103]
取生长状态良好的第20代脐带间充质干细胞,按7.0
×
103/cm2接种于6孔培养板中,当细胞贴壁生长达到60%融合时,加入成骨诱导剂地塞米松10-7
mol/l、β-甘油磷酸钠10mmol/l、抗坏血酸50μg/ml;置于37℃、5%co2培养箱,间隔3天换液1次。成骨诱导至14d时,4%多聚甲醛固定细胞,冯库萨染色鉴定成骨细胞。染色结果如图11所示。
[0104]
(5)人脐带间充质干细胞的成软骨诱导分化
[0105]
取扩增好的第20代脐带间充质干细胞,以2.0
×
105细胞总数接种15ml离心管中,1500r/min离心10min,使细胞沉淀于培养管底部,加入软骨诱导培养基,dmem/ham's f12培养基中加入地塞米松10-7
mol/l、抗坏血酸50μg/ml、牛血清白蛋白1.25μg/ml、转铁蛋白6.25μg/ml、丙酮酸钠1mmol/l、亚油酸5.35μg/ml;置于37℃、5%co2培养箱,间隔3天半量换液1次。培养至第21天时,使用4%多聚甲醛固定软骨细胞团,行冰冻切片,阿尔法蓝染色鉴定细胞。染色结果如图12所示。
[0106]
(6)实验结果
[0107]
由图10~图12可知,传代至20代的脐带间充质干细胞仍具有分化为成骨、脂肪、软
骨的潜力。
[0108]
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可以做各种改动和修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。