1.本发明涉及一种在容器内的溶剂中产生二氧化氯气体的二氧化氯产生装置及二氧化氯产生方法。
背景技术:
2.一直以来,已知有使亚氯酸盐的溶液与酸性物质进行反应而产生二氧化氯气体的设备及装置(例如专利文献1)。现有技术文献专利文献
3.专利文献1:日本特开2007-145654号公报。
技术实现要素:
发明想要解决的课题
4.在专利文献1中记载的产生二氧化氯气体的方法中,在例如反应的初期产生大量高浓度的二氧化氯气体,经过一定时间之后产生低浓度的二氧化氯气体。例如想要在人所处的环境下,用二氧化氯气体对房间、室内或其它相同的空间进行除菌的情况下,需要从反应的初期起长时间稳定地产生一定程度低浓度的二氧化氯气体。
5.因此,本发明的目的在于提供一种能够从反应的初期起稳定地控制并产生二氧化氯气体的二氧化氯产生装置及二氧化氯产生方法。用于解决课题的手段
6.用于实现上述目的的本发明的二氧化氯产生装置的特征组成在于,在容器内的溶剂中,将亚氯酸盐、与该亚氯酸盐反应而产生二氧化氯气体的酸性物质、及作为对该酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质混合而产生二氧化氯气体。
7.在本发明的二氧化氯产生装置中,亚氯酸盐和酸性物质在容器内的溶剂中反应而产生二氧化氯气体。此时,由于溶剂中存在作为对酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质,因此,亚氯酸盐和酸性物质进行反应而生成了二氧化氯时,能够使溶剂的ph不易变动(大致固定)。故而,能够从亚氯酸盐和酸性物质的反应的初期起稳定地控制并产生二氧化氯气体。
8.在下述的实施例1等中,在向亚氯酸盐和酸性物质的反应系统中添加了缓冲作用物质的情况下,得到如下结果:在反应的初期产生低浓度的二氧化氯气体,随后,二氧化氯气体的产生量长期大致保持反应初期的低浓度。另一方面,在未向亚氯酸盐和酸性物质的反应系统中添加缓冲作用物质的情况下,得到如下结果:在反应的初期快速大量产生高浓度的二氧化氯气体,随后二氧化氯气体的产生量快速减少。
9.因此,在如本发明的二氧化氯产生装置那样向亚氯酸盐和酸性物质的反应系统中添加了缓冲作用物质的情况下,与未添加缓冲作用物质的情况相比,能够抑制二氧化氯气体在反应初期的浓度,因此,能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞
跃性地延长产生时段。
10.本发明的二氧化氯产生装置的进一步特征组成在于,使所述亚氯酸盐为亚氯酸钠或亚氯酸钾,使所述酸性物质为无机酸、有机酸及两亲物质中的任意一种。
11.根据本组成,作为亚氯酸盐的亚氯酸钠或亚氯酸钾容易获得,因此容易实现本发明。另外,如果酸性物质为无机酸、有机酸及两亲物质中的任意一种,则能够与作为亚氯酸盐的亚氯酸钠或亚氯酸钾进行反应而产生二氧化氯。
12.本发明的二氧化氯产生装置的进一步特征组成在于,使所述酸性物质为磷酸化合物。
13.根据本组成,如果酸性物质为磷酸化合物,则容易获得,因此容易实施本发明。
14.本发明的二氧化氯产生装置的进一步特征组成在于,使所述酸性物质为磷酸二氢钠或磷酸二氢钾。
15.根据本组成,作为酸性物质的磷酸二氢钠或磷酸二氢钾储存稳定性优异,不会产生腐蚀性气体,操作性优异,因此容易实施本发明。
16.本发明的二氧化氯产生装置的进一步特征组成在于,使所述缓冲作用物质为磷酸盐。
17.根据本组成,如果使缓冲作用物质为磷酸盐,则在容器内的溶剂中,能够对作为酸性物质的磷酸化合物(磷酸二氢钠或磷酸二氢钾)可靠地起到缓冲作用。
18.本发明的二氧化氯产生装置的进一步特征组成在于,所述缓冲作用物质包含磷酸三钾、磷酸三钠、磷酸氢二钾及磷酸氢二钠中的至少任意一种。
19.根据本组成,作为缓冲作用物质的磷酸三钾、磷酸三钠、磷酸氢二钾及磷酸氢二钠容易获得,因此,容易实施本发明。
20.本发明的二氧化氯产生装置的进一步特征组成在于,使所述酸性物质为醋酸。
21.根据本组成,如果酸性物质为醋酸,则容易获得,储存稳定性优异,不会产生腐蚀性气体,操作性优异,因此,容易实施本发明。
22.本发明的二氧化氯产生装置的进一步特征组成在于,使所述缓冲作用物质为醋酸盐。
23.根据本组成,如果使缓冲作用物质为醋酸盐,则在容器内的溶剂中,能够对作为酸性物质的醋酸可靠地起到缓冲作用。
24.本发明的二氧化氯产生装置的进一步特征组成在于,所述缓冲作用物质包含醋酸钾及醋酸钠中的至少任意一种。
25.根据本组成,作为缓冲作用物质的醋酸钾及醋酸钠容易获得,因此,容易实施本发明。
26.本发明的二氧化氯产生装置的进一步特征组成在于,使所述酸性物质为柠檬酸。
27.根据本组成,如果酸性物质为柠檬酸,则容易获得,储存稳定性优异,不产生腐蚀性气体,操作性优异,因此,容易实施本发明。
28.本发明的二氧化氯产生装置的进一步特征组成在于,使所述缓冲作用物质为柠檬酸盐。
29.根据本组成,如果使缓冲作用物质为柠檬酸盐,则在容器内的溶剂中,能够对作为酸性物质的柠檬酸可靠地起到缓冲作用。
30.本发明的二氧化氯产生装置的进一步特征组成在于,所述缓冲作用物质包含柠檬酸钾及柠檬酸钠中的至少任意一种。
31.根据本组成,作为缓冲作用物质的柠檬酸钾及柠檬酸钠容易获得,因此,容易实施本发明。
32.本发明的二氧化氯产生装置的进一步特征组成在于,使所述溶剂的ph为5~7。
33.根据本组成,通过使溶剂的ph为5~7,能够从反应的初期起更加稳定地控制并产生低浓度的二氧化氯气体(参见下述的实施例5)。
34.本发明的二氧化氯产生装置的进一步特征组成在于,所述亚氯酸盐为亚氯酸盐水溶液的形式,使所述亚氯酸盐的浓度为3~25重量%。
35.在下述的实施例2中,观察对亚氯酸盐水溶液的浓度进行各种变更(3~25重量%)时二氧化氯气体的产生量,结果得到如下结果:能够抑制二氧化氯气体在反应初期的浓度,能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段。因此,在考虑了安全性、稳定性、二氧化氯气体的产生效率等的情况下,可以使亚氯酸盐的浓度为3~25重量%。
36.本发明的二氧化氯产生装置的进一步特征组成在于,向所述容器内的溶剂中添加了凝胶化剂。
37.根据本组成,通过添加凝胶化剂,能够将容器内的溶剂凝胶化。故而,即使倾斜容器,凝胶化后的所述溶剂也不易从容器中洒出,从而能够容易地操作二氧化氯产生装置。
38.本发明的二氧化氯产生方法的特征组成在于,在容器内的溶剂中,将亚氯酸盐、与该亚氯酸盐反应而产生二氧化氯气体的酸性物质、及作为对该酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质混合而产生二氧化氯气体。
39.在本发明的二氧化氯产生方法中,亚氯酸盐和酸性物质在容器内的溶剂中反应而产生二氧化氯气体。此时,由于溶剂中存在作为对酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质,因此,亚氯酸盐和酸性物质产生反应而生成了二氧化氯时,能够使溶剂的ph不易变动(大致固定)。故而,能够从亚氯酸盐和酸性物质的反应的初期起稳定地控制并产生二氧化氯气体。
40.因此,在如本发明的二氧化氯产生方法那样向亚氯酸盐和酸性物质的反应系统中添加了缓冲作用物质的情况下,与未添加缓冲作用物质的情况相比,能够抑制二氧化氯气体在反应初期的浓度,因此能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段。
41.本发明的二氧化氯产生方法的进一步特征组成在于,在使所述缓冲作用物质溶解于亚氯酸盐水溶液的状态下混合所述酸性物质。
42.根据本组成,通过使缓冲作用物质溶解于亚氯酸盐水溶液,能够在亚氯酸盐水溶液中将缓冲作用物质制成均匀的状态,若在该状态下混合酸性物质,则亚氯酸盐和酸性物质产生反应而生成了二氧化氯时,溶剂的ph更不易产生变动。故而,能够可靠地抑制反应初期的浓度,从而能够在保持反应初期的二氧化氯气体的产生浓度的状态下进一步延长产生时段。
43.本发明的二氧化氯产生方法的进一步特征组成在于,在使所述缓冲作用物质溶解
于亚氯酸盐水溶液的状态下混合所述酸性物质及凝胶化剂。
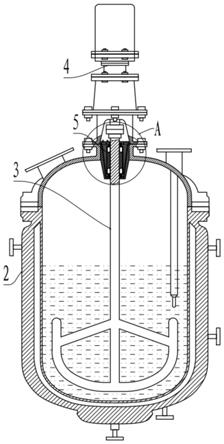
44.根据本组成,通过添加凝胶化剂,能够将容器内的溶剂凝胶化。故而,即使倾斜容器,凝胶化后的所述溶剂也不易从容器洒出,能够容易地进行二氧化氯产生方法。
附图说明
45.图1为示出实施方式的二氧化氯产生装置的示意图。图2为示出所产生的二氧化氯气体的量与时间的关系的图表(实施例1)。图3为示出所产生的二氧化氯气体的量与时间的关系的图表(实施例2)。图4为示出所产生的二氧化氯气体的量与时间的关系的图表(实施例3)。图5为示出所产生的二氧化氯气体的量与时间的关系的图表(实施例4)。图6为示出在对缓冲作用物质的添加量进行各种变更以改变反应系统的ph的情况下,对二氧化氯气体的产生量如何变化进行调查而得到的结果的图表(实施例5)。图7为示出在使添加缓冲作用物质的形式不同的情况下,对二氧化氯气体的产生量如何变化进行调查而得到的结果的图表(实施例6)。图8为另一实施方式的二氧化氯产生装置(袋状)的示意图。图9为示出对在将容器制成袋状的情况下何产生二氧化氯气体进行调查而得到的结果的图表(实施例7)。图10为示出对在添加了凝胶化剂的情况下如何产生二氧化氯气体进行调查而得到的结果的图表(实施例8)。
具体实施方式
46.以下,基于附图对本发明的实施方式进行说明。本发明的二氧化氯产生装置在容器内的溶剂中,将亚氯酸盐、与该亚氯酸盐反应而产生二氧化氯气体的酸性物质、及作为对该酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质混合而产生二氧化氯气体。另外,本发明的二氧化氯产生方法在容器内的溶剂中,将亚氯酸盐、与该亚氯酸盐反应而产生二氧化氯气体的酸性物质、及作为对该酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质混合而产生二氧化氯气体。
47.亚氯酸盐和酸性物质的反应在容器内的溶剂中进行。该溶剂可以为水溶液。此时,可以将亚氯酸盐及酸性物质中的至少任意一种制成水溶液的状态并将两者在容器内混合以使其反应。在本实施方式中,对将亚氯酸盐制成亚氯酸盐水溶液的情况进行说明。在该情况下,酸性物质只要使用粉体状、固体状及液体状的任意一种即可。在本实施方式中,对使用粉体状的酸性物质的情况进行说明。
48.图1中示出二氧化氯产生装置x,其中,向一端具有开口的容器1内的溶剂(亚氯酸盐水溶液a)中添加酸性物质b,将两者在容器1内混合并使其反应而产生二氧化氯气体。本实施方式的容器1只要采用可以收容亚氯酸盐水溶液a容器(亚氯酸盐收容部12)即可。酸性物质b预先收容于容器1的外部的容器(酸性物质收容部13)等,在使用二氧化氯产生装置x时,将酸性物质b添加于容器1内即可。容器1的开口形成可以释放气体的气体释放部11。
49.作为对酸性物质b具有缓冲作用的其的盐或共轭碱的缓冲作用物质c可以使用固
体状及液体状中的任意一种。该缓冲作用物质c可以在混合亚氯酸盐水溶液a和酸性物质b之前预先溶解或者混合于亚氯酸盐水溶液a或者酸性物质b(粉体状、固体状及液体状)。在本实施方式中,对在使缓冲作用物质c溶解于亚氯酸盐水溶液a的状态下与酸性物质b混合的情况进行说明。
50.作为容器1的形状,示例了瓶状、管状(试管状)、棒状、袋状(袋状)、箱状等,但并不限定于此。在本实施方式中,对将容器1制成瓶状情况进行说明。另外,关于容器1的材质,只要为具有耐热性及耐化学性的材质,则不受特别限定。特别优选玻璃类、不锈钢等金属类、耐热性及耐化学性优异的聚丙烯、聚乙烯、tritan(注册商标,eastman公司制)等树脂类。
51.气体释放部11虽然可以为开放体系,但也可以设置具备具有通气性的结构的盖体、具有通气性的非透水部件。这些部件可以在将酸性物质b添加至容器1内之后安装于容器1的开口。作为该非透水部件,能够使用例如使气体、空气及湿气通过但不会通过液体的透湿防水性片材(或者通气防水片材)。该透湿防水性片材可以单独使用微多孔膜(具有很多非常小的孔的素材的膜),或者也可以多片重叠贴合而成的素材、或无孔但可以使气体、空气、湿气(水蒸气)移动的素材、对高密度纺织物施加了高效拒水处理的涂布类型的素材等。作为上市的材料,可列举例如:gore-tex(注册商标)、exepol(注册商标、三菱树脂公司制)、polum(注册商标、tokuyama公司制)、entrante(注册商标、东丽公司制)、tyvek(注册商标、杜邦公司制)、melfit(注册商标,unisel公司制)等。需要指出,为了使非透水部件便于安装于容器1,优选其具有热封性(热融合性)。
52.(亚氯酸盐)作为本发明中使用的亚氯酸盐,可列举例如:亚氯酸碱金属盐、亚氯酸碱土金属盐。作为亚氯酸碱金属盐,可列举例如:亚氯酸钠、亚氯酸钾、亚氯酸锂,作为亚氯酸碱土金属盐,亚氯酸钙、亚氯酸镁、亚氯酸钡。其中,从容易获得方面出发,优选亚氯酸钠、亚氯酸钾,最优选亚氯酸钠。以上亚氯酸盐可以单独使用一种,也可以并用两种以上。
53.亚氯酸盐在亚氯酸盐水溶液中的比例优选为0.1~30重量%。在低于0.1重量%的情况下,在产生二氧化氯气体时可能导致亚氯酸盐不足的问题,在超过30重量%的情况下,可能导致亚氯酸盐饱和而容易析出结晶的问题。在考虑到安全性、稳定性、二氧化氯气体的产生效率等的情况下,优选3~25重量%,进一步优选的范围为3重量%~15重量%。
54.(酸性物质)作为本发明中可使用的酸性物质,其为与亚氯酸盐反应的酸,优选地,只要为无机酸或有机酸及两亲物质中的任意一种,则不受特别限定。作为该酸性物质,例如,无机酸可列举:磷酸化合物(磷酸二氢钠或磷酸二氢钾)、醋酸、硫酸等;有机酸可列举:柠檬酸、苹果酸、乳酸等;两亲物质可列举:3-吗啉丙磺酸、2-吗啉乙磺酸、4-(2-羟乙基)-1-哌嗪乙磺酸等。其中,由于储存稳定性优异、不产生腐蚀性气体、存储时也不会产生浓度变化等理由,优选使用磷酸化合物(磷酸二氢钠或磷酸二氢钾)、醋酸及柠檬酸。酸性物质可以单独使用一种,也可以并用两种以上。另外,酸性物质还可以为酸酐及水合物中的任意一种形式。
55.酸性物质也可以制成包含于多孔性物质的形式。该多孔性物质能够使用例如多孔材料或者煅烧骨料,但并不限定于此。作为多孔材料,可列举例如:多孔二氧化硅、海泡石、蒙脱石、硅藻土、滑石、沸石、
活性粘土、分子筛、活性氧化铝等。其中,在容易获得,多孔性优异(多孔空间广),容易包含酸性物质或者亚氯酸盐这些方面,优选使用多孔二氧化硅。这些多孔二氧化硅等的比表面积没有特别限定。作为煅烧骨料,能够使用将例如动物(包括哺乳类、鱼类、鸟类)的骨头、贝壳及珊瑚煅烧并制成破碎片状、粒子状或者粉状后的物质。
56.在包含于这样的多孔性物质的状态下,作为酸性物质的浓度,可以使最终浓度为30重量%以下。
57.(缓冲作用物质)作为本发明中可使用的缓冲作用物质,只要其为对酸性物质具有缓冲作用的其的盐或共轭碱,则不受特别限定。符合对“酸性物质具有缓冲作用的其的盐或共轭碱”的物质为“酸性物质的盐”或“酸性物质的共轭碱”。缓冲作用物质可以单独使用一种,也可以并用两种以上。
58.在使用作为无机酸的磷酸化合物(磷酸二氢钠或磷酸二氢钾)来作为酸性物质的情况下,缓冲作用物质只要包含磷酸三钾、磷酸三钠、磷酸氢二钾及磷酸氢二钠中的至少任意一种磷酸盐即可。另外,在使用作为无机酸的醋酸来作为酸性物质的情况下,缓冲作用物质只要包含醋酸钾及醋酸钠中的至少任意一种醋酸盐即可。另外,在使用作为有机酸的柠檬酸来作为酸性物质的情况下,缓冲作用物质只要包含柠檬酸钾及柠檬酸钠中的至少任意一种柠檬酸盐即可。另外,缓冲作用物质可以为酸酐及水合物中的任意一种形式。
59.通过使缓冲作用物质c溶解于亚氯酸盐水溶液a,能够在亚氯酸盐水溶液a中将缓冲作用物质c制成均匀的状态,若在该状态下混合酸性物质b,则亚氯酸盐与酸性物质产生反应而生成二氧化氯时,溶剂的ph更不易变动。
60.在本实施方式中,虽然采用了在使缓冲作用物质c溶解于亚氯酸盐水溶液a的状态下混合酸性物质b的方案,但也可以与该酸性物质b一同添加并混合凝胶化剂。
61.该凝胶化剂只要使用吸水性的凝胶化剂即可,例如吸水性树脂,并不限定于这样的形式。作为该吸水性树脂,可列举例如:aqualic(注册商标、日本触媒公司制)、sunflesh(注册商标、三洋化成工业公司制)、aquakeep(注册商标、住友精化公司制)、ki凝胶(注册商标、可乐丽公司制)等,但并不限定于此。
62.将凝胶化剂添加于容器1的定时不限定于上述的方案,也可以在使缓冲作用物质c溶解于亚氯酸盐水溶液a的状态下混合酸性物质b之后再添加凝胶化剂。
63.通过添加凝胶化剂,能够使容器1内的溶剂凝胶化,因此,即使倾斜容器1,凝胶化后的所述溶剂也不易从容器1洒出,从而能够容易滴操作二氧化氯产生装置x。
64.在本发明的二氧化氯产生装置x中,亚氯酸盐和酸性物质在容器内的溶剂中反应而产生二氧化氯气体。此时,由于溶剂中存在作为对酸性物质具有缓冲作用的其的盐或共轭碱的缓冲作用物质,因此,能够减少亚氯酸盐和酸性物质反应而生成了二氧化氯时溶剂的ph的变动(大致固定)。故而,能够从亚氯酸盐和酸性物质的反应的初期起稳定地控制并产生二氧化氯气体。
65.因此,在如本发明的二氧化氯产生装置x那样向亚氯酸盐和酸性物质的反应系统中添加了缓冲作用物质的情况下,与未添加缓冲作用物质的情况相比,能够抑制二氧化氯气体在反应初期的浓度,因此,能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段。
66.所述溶剂的ph可以采用5~7。此时,溶剂的ph为在亚氯酸钠水溶液a、酸性物质b及缓冲作用物质c混合状态下的ph值,能够通过缓冲作用物质c的添加量来调节。如果ph在该范围,则能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体。优选地,如果将溶剂的ph调节为5.5~7,则更加能够抑制二氧化氯气体在反应初期的产生量,更优选地,如果将溶剂的ph调节为6~7,则能够进一步控制二氧化氯气体在反应初期的产生量。
67.使用本发明的二氧化氯产生装置x的场所没有特别限定,能够在各种情景中使用,例如一般家庭(客厅、玄关、浴室及厨房等)、以及工业用途(工厂用途)、或者医院及诊所、疗养院等医疗领域、学校、车站大楼及公共厕所等公共设施等。另外,不仅可以用于人可以居住的室内空间这些较为宽广的空间,还可以在冰箱、鞋架、车内(车、公交车、火车)等狭小的空间中使用。如此一来,可应用本发明的产生装置的空间的宽广性不受特别限制。
68.〔其它实施方式1〕也可以为使用固体(粉末)的亚氯酸盐,并将酸性物质制成液体状的方案,并不限定于上述的实施方式。在该情况下,可以在容器1中使缓冲作用物质c溶解于酸性物质b的水溶液的状态下与亚氯酸盐混合。
69.可以在本方式中使用的酸性物质能够使用上述的酸性物质。酸性物质的水溶液的浓度可以采用30重量%以下。实施例
70.〔实施例1〕作为本发明的二氧化氯产生装置x,制作如下装置:向容器1(瓶状,容积100ml)中收容23.5重量%的亚氯酸钠水溶液a(43ml)并溶解7.7g磷酸三钾(缓冲作用物质c),将酸性物质b收容于容器1的外部的容器(酸性物质收容部13)。作为酸性物质b,使用8.5g磷酸二氢钠(粉体)。
71.将磷酸二氢钠添加在容器1内,并使亚氯酸盐水溶液a及磷酸二氢钠接触。经由气体释放部11将混合亚氯酸盐水溶液a及磷酸二氢钠之后随即产生的二氧化氯气体释放至容器1的外部,在熏蒸室内对被处理物实施二氧化氯处理一定时间。图2是示出所产生的二氧化氯气体的量与时间的关系的图表。作为比较例1,示出了未添加缓冲作用物质c时二氧化氯气体的产生量。
72.其结果,在比较例1中,在反应的初期(约100小时之前)快速大量产生高浓度的二氧化氯气体(最大达每小时约3.5mg),在经过了约720小时(约1个月)的时刻产生低浓度的二氧化氯气体(每小时0.5mg以下),然后,每小时的二氧化氯气体的产生量逐渐减少,直至经过约6个月。
73.另一方面,在本发明例1中,在反应的初期产生低浓度的二氧化氯气体(每小时0.3mg以下),然后,二氧化氯气体的产生量长期(7200小时、约10个月)大致保持反应初期的低浓度。另外,在从反应起经过了约2500小时(约3.5个月)的时刻,二氧化氯气体每小时的产生量超过比较例1中的每小时的产生量。故而,可知,在本发明例1中,能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体。另外,还可知,在本发明例1中,由于能够控制二氧化氯气体在反应初期的浓度,因此,能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段,进而能够延长二氧化氯产生装置x的寿命。
74.〔实施例2〕
在实施例1中使用的二氧化氯产生装置x中,调查了对亚氯酸盐水溶液a的浓度进行各种变更(3~25重量%)的情况下如何产生二氧化氯气体(本发明例2-1~2-4)。将结果示于图3。作为比较例2-1~2-4,示出了未添加缓冲作用物质c时二氧化氯气体的产生量。
75.其结果可知,分别与比较例2-1~2-4相比,本发明例2-1~2-4均能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体。因此,如果亚氯酸盐水溶液a的浓度为3~25重量%,则能够抑制二氧化氯气体在反应初期的浓度,从而能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段。
76.〔实施例3〕在实施例1中使用的二氧化氯产生装置x中,关于使酸性物质b为磷酸二氢钾(9.6g),使缓冲作用物质c为磷酸三钾(7.7g)的方案(本发明例3-1)、及使酸性物质b为磷酸二氢钠(16.5g),使缓冲作用物质c为磷酸氢二钠(8.4g)的方案(本发明例3-2),调查如何产生二氧化氯气体。将结果示于图4。作为比较例3-1~3-2,示出了未添加缓冲作用物质c时二氧化氯气体的产生量。
77.其结果可知,分别与比较例3-1~3-2相比,本发明例3-1~3-2均能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体。因此可知,如果如本实施例那样至少将酸性物质b及缓冲作用物质c组合后使用,则能够抑制二氧化氯气体在反应初期的浓度,从而能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段。
78.〔实施例4〕在实施例1中使用的二氧化氯产生装置x中,关于使酸性物质b为醋酸(2.0ml),使缓冲作用物质c为醋酸钠(25.4g)的方案(本发明例4-1)、及使酸性物质b为柠檬酸(6.8g),使缓冲作用物质c为柠檬酸三钠二水合物(41.6g)的方案(本发明例4-2),调查如何产生二氧化氯气体。将结果示于图5。作为比较例4-1~4-2,示出了未添加缓冲作用物质c时二氧化氯气体的产生量。
79.其结果可知,分别与比较例4-1~4-2相比,本发明例4-1~4-2均能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体。因此可知,如果如本实施例那样至少将酸性物质b及缓冲作用物质c组合后使用,则能够抑制二氧化氯气体在反应初期的浓度,从而能够在保持反应初期的二氧化氯气体的产生浓度的状态下飞跃性地延长产生时段。
80.〔实施例5〕在使酸性物质b为磷酸二氢钾,使缓冲作用物质c为磷酸三钾的二氧化氯产生装置x的方案(本发明例3-1)中,调查在将作为缓冲作用物质c的磷酸三钾的添加量进行各种变更以改变反应系统的ph的情况下,二氧化氯气体的产生量如何变化。将结果示于图6。作为比较例5,示出了未添加缓冲作用物质c时二氧化氯气体的产生量。
81.比较例5的反应系统的ph为4.5。另外,作为缓冲作用物质c的磷酸三钾的添加量为0.5g时反应系统的ph为5.0(本发明例5-1),磷酸三钾的添加量为1.7g时反应系统的ph为5.5(本发明例5-2),磷酸三钾的添加量为3.5g时反应系统的ph为6.0(本发明例5-3),磷酸三钾的添加量为7.9g时反应系统的ph为6.7~7.0(本发明例5-4)。
82.其结果可知,如果添加作为缓冲作用物质c的磷酸三钾,则二氧化氯气体的产生量为每小时3mg以下,与比较例5相比,本发明例5-1~5-4均能够从反应的初期起稳定地控制
并产生低浓度的二氧化氯气体。另外判断,随着反应系统的ph从5.0升高至6.7(约7.0),抑制二氧化氯气体的产生量。故而可知,如果调节缓冲作用物质c的添加量以调节反应系统的ph,则能够控制二氧化氯气体的产生量。特别是如果将反应系统的ph调节为5.5~7.0,则二氧化氯气体的产生量变为每小时2mg以下,如果将反应系统的ph调节为6.0~7.0,则二氧化氯气体的产生量变为每小时1mg以下,从而能够从反应的初期起更稳定地控制并产生低浓度的二氧化氯气体。
83.需要指出,在本实施例中,虽然针对使酸性物质为磷酸化合物、使缓冲作用物质为磷酸盐的情况示出了结果,但即使在使酸性物质为醋酸、使缓冲作用物质为醋酸盐的情况下、及使酸性物质为柠檬酸、并使缓冲作用物质为柠檬酸盐的情况下,也得到了相同的结果(未示出结果)。
84.〔实施例6〕在实施例1中使用的二氧化氯产生装置x中,作为缓冲作用物质c的磷酸三钾溶解于亚氯酸钠水溶液a之后添加酸性物质b。与此相对,关于在使缓冲作用物质c溶解于酸性物质b的水溶液之后与亚氯酸钠水溶液a混合的情况(本发明例6-1)、与固体的酸性物质b混合之后与亚氯酸钠水溶液a混合的情况(本发明例6-2),调查了如何产生二氧化氯气体。将结果示于图7。
85.其结果可知,在本发明例6-1~6-2中,产生二氧化氯气体的行为均与本发明例1相同,能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体。
86.〔实施例7〕虽然实施例1的二氧化氯产生装置x中使用了瓶状的容器1,但也调查了将容器1制成袋状(袋状)时(本发明例7)如何产生二氧化氯气体。
87.作为袋状的容器1,使用加工为上面视时为矩形状的袋子(120mm
×
200mm)的容器(图8)。袋状的容器1中以重叠状态收容有第一收容容器10(100mm
×
150mm)和第二收容容器20(80mm
×
100mm),第一收容容器10收容有亚氯酸钠水溶液a及缓冲作用物质c(磷酸三钾),由易破坏性的分层型膜10a构成;第二收容容器20收容有酸性物质b(磷酸二氢钠、粉体),由水溶性pva膜构成。容器1将正面和表面中的至少任意一面制成气体释放部11,该气体释放部11具有透气性及不透液性。
88.从该容器1的外侧用手指按压来施加外力以使其变形。此时,赋予容器1的外力传递至易破坏性的第一收容容器10而使该第一收容容器10变形,通过其内压升高而剥离分层型膜10a中所需的层,从而能够容易地破坏第一收容容器10。通过破坏第一收容容器10使释放至容器1的内部的亚氯酸钠水溶液a立刻与第二收容容器20接触,水溶性的第二收容容器20部分溶解。接着左右晃动容器1数次,以使水溶性的第二收容容器20的大部分溶解。由此,形成亚氯酸钠水溶液、磷酸三钾及磷酸二氢钠混合的状态,产生二氧化氯气体。
89.将结果示于图9。作为比较例7,示出了未添加缓冲作用物质c时二氧化氯气体的产生量。
90.其结果可知,与实施例1的二氧化氯产生装置x的情况相同地,与比较例7相比,在本发明例7中,也能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体(每小时3mg以下),从而能够在保持反应初期的二氧化氯气体的产生浓度状态下飞跃性地延长产生时段。
91.需要指出,虽然在本实施例中,针对使酸性物质为磷酸化合物、使缓冲作用物质为磷酸盐的情况示出了结果,但即使在使酸性物质为柠檬酸、使缓冲作用物质为柠檬酸盐的情况下,也得到了相同的结果(未示出结果)。
92.〔实施例8〕调查在实施例1的二氧化氯产生装置x中,与酸性物质b一同添加了凝胶化剂(吸水性树脂:aqualic(日本触媒公司制))的情况下,如此产生二氧化氯气体(本发明例8)。将结果示于图10。作为比较例8,示出了为添加缓冲作用物质c时二氧化氯气体的产生量。
93.其结果可知,与本发明例1的二氧化氯产生装置x的情况相同地,与比较例8相比,在本发明例8中,也能够从反应的初期起稳定地控制并产生低浓度的二氧化氯气体(每小时0.5mg以下)。工业适用性
94.本发明能够用于在容器内的溶剂中产生二氧化氯气体的二氧化氯产生装置及二氧化氯产生方法。符号说明
95.x 二氧化氯产生装置a 亚氯酸盐水溶液b 酸性物质c 缓冲作用物质1 容器。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。