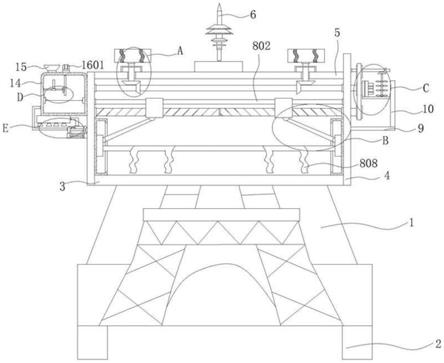
1.本发明涉及一种诱导糖用甜菜胚性愈伤组织的方法,属于愈伤组织诱导技术领域。
技术背景
2.甜菜是世界上重要的糖料作物之一,也是我国第二大糖料作物,在中国东北、西北以及华北地区有较大面积的种植,是中国北方重要的经济作物和糖料作物。不同类型的甜菜也具有不同的价值,糖用甜菜是甜菜属中与人类生产及生活关系最密切的一个栽培甜菜品种群。主要用作生产蔗糖,是制糖厂的原料。甜菜制糖后还有许多副产品具有较高经济价值和广泛用途。例如,糖蜜经过发酵或通过化学方法可生产甲醇、乙醇、丁醇、甘油、味精、丙酮等产品。制糖后的滤泥含丰富的钙质及其他营养物质,可作肥料,改良酸性土壤,通过工艺加工还可制造水泥。制糖废丝(颗粒粕)是牲畜的优良饲料,目前我国甜菜糖厂加工后的废丝还大量出口,畅销日本等国。糖用甜菜来源于在进化过程中叶用甜菜与具有较大贮藏根的饲用甜菜之间的杂交,经过长期的人工选择而形成。选育糖用甜菜新品种主要为了提高根内蔗糖含量,改善可提取物品质。然而,由于甜菜的栽培驯化时间较短,遗传背景狭窄,资源贫乏,自交高度不亲和性,往往使得优良单株基因型很容易丢失,给优良品种选育材料的繁殖和保存带来了不少的困难。且随着分子生物学和植物转基因技术的快速发展,当前利用基因工程技术提高作物品质,培育新品种是作物育种研究的热点之一,而基因工程技术又需要依托组织培养技术的支持,通过诱导植物胚性愈伤组织,将带有目的基因的质粒导入胚性愈伤组织中,利用胚性愈伤组织的再分化能力分化形成完整植株,建立完整的再生体系,形成转基因植株。因此,甜菜胚性愈伤组织的培养及其再生体系的建立就为甜菜基因工程以及培育新的优良品种提供了新途径。
3.根据组织学观察、外观特征及其再生性、再生方式等,可将愈伤组织分成两大类:胚性愈伤组织和非胚性愈伤组织。一般胚性愈伤组织质地较坚实,颜色有乳白色或黄色,表面具球形颗粒,其生长缓慢;从细胞学角度来看,胚性愈伤组织由等直径细胞组成,细胞较小,原生质浓厚,无液泡,常富含淀粉粒,核大,分裂活性强,内容物丰富,具有鱼雷胚、心型胚的典型特征,而分化能力差的非胚性愈伤则相反,组织结构疏松,细胞相对巨大,内含一大液泡,几乎无细胞器,呈水浸褐化状。为了获得分化能力更强的愈伤组织,应选择诱导胚性愈伤组织。然而,目前国内对糖用甜菜愈伤组织的研究有以甜菜品种“甘糖7号”叶柄为外植体,通过诱导愈伤组织、愈伤组织分化不定芽、芽生根和移栽等步骤建立一套甜菜组织培养与植株再生体系([1]伍国强,刘海龙,李智强.甜菜组织培养与植株再生体系的建立[j].中国糖料,2018,40(06):14-18.doi:10.13570/j.cnki.scc.2018.06.005.)。但其只是对甜菜再生体系的建立进行了一整套的研究,并没有深入的进行愈伤组织的细胞学观察。国外方面我们并不能仅凭提供的品种名称确定其所使用的的资源类型。因此,亟需寻求一种糖用甜菜胚性愈伤组织的诱导方法。
技术实现要素:
[0004]
本发明为了获得糖用甜菜胚性愈伤组织并建立其再生体系,提供了一种诱导糖用甜菜胚性愈伤组织的方法,其特征在于,包括如下步骤:
[0005]
s1、种子处理及无菌苗的获得:挑取饱满的糖用甜菜种子,去壳,消毒,用蒸馏水反复冲洗后接种于ms基础培养基上使种子萌发,18~22天后获得糖用甜菜无菌苗,采集糖用甜菜无菌苗外植体;
[0006]
s2、愈伤组织的诱导:向ms基础培养基中添加0.75mg/l 6-ba和0.1mg/lnaa,作为愈伤组织的诱导培养基,将s1所述无菌苗外植体接种于愈伤组织培养基,培养时间为7~8周。
[0007]
进一步地限定,所述糖用甜菜的品种为糖用甜菜资源92005-1。
[0008]
进一步地限定,s1所述消毒为先用75%的酒精消毒2min,再用12%的次氯酸钠消毒5min。
[0009]
进一步地限定,s1和s2所述的ms基础培养基的组成为3%蔗糖,0.8%琼脂,余量为水。
[0010]
进一步地限定,s1所述外植体取自无菌苗的叶片、叶柄或生长点。
[0011]
进一步地限定,s1所述外植体取自无菌苗的生长点。
[0012]
进一步地限定,s2所述培养温度为22-24℃。
[0013]
本发明的有益效果:
[0014]
本发明分别以糖用甜菜资源94002-1、92005-1和92011/1-6/1-1的无菌苗为基础材料,分别以其叶片、叶柄和生长点为外植体,选用不同种类和浓度的植物细胞分裂素生成体细胞胚,结果发现,糖用甜菜资源92005-1经种子处理及萌发后获得无菌苗,采集生长点作为外植体,接种于含有0.75mg/l 6-ba和0.1mg/lnaa的愈伤组织培养基,培养7~8周后可获得胚性愈伤组织,胚性愈伤组织可以再分化诱导出原胚团,原配团能增殖或发育形成早期体细胞胚,从而进一步发育为成熟体细胞胚,进而得到完整植株。
[0015]
本发明通过对诱导出的愈伤组织进行石蜡切片的制作,观察不同类型、外观形态、资源的愈伤组织,在细胞形态上对其进行胚性和非胚性的区分,寻找再生能力好的胚性愈伤组织,研究分析糖用甜菜愈伤组织的再生能力与细胞形态的关系,为建立糖用甜菜植株再生体系提供细胞学理论基础,也为更好的利用基因工程手段提供高质高产的新品种奠定基础。另外,甜菜愈伤组织再分化一直是制约甜菜再生体系建立的瓶颈,从组织结构、细胞学形态上分析其器官发生的变化规律,可以更加直观的发现问题,针对各个阶段的结构变化,采取合适的措施促进愈伤组织的分化。
附图说明:
[0016]
图1为不同浓度激素诱导出的愈伤组织图,其中,图1中的a为糖用甜菜资源94002-1叶片在ms 0.75mg/l 6-ba上愈伤组织生长情况;图1中的b为糖用甜菜资源92005-1叶柄在ms 0.75mg/l 6-ba上愈伤组织生长情况;图1中的c为糖用甜菜资源92005-1叶柄在ms 0.25mg/l 6-ba上愈伤组织生产情况;图1中的d为糖用甜菜资源92005-1生长点在ms 0.75mg/l 6-ba 0.1mg/lnaa上愈伤组织生长情况。
[0017]
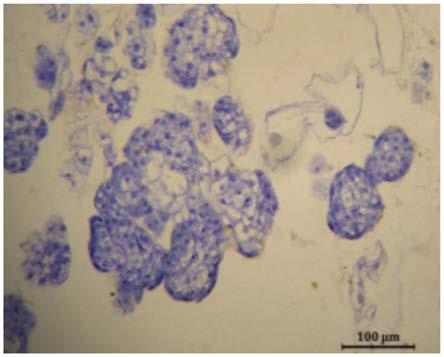
图2为甜菜胚性细胞与非胚性细胞间的差异图,其中,图2中的a为糖用甜菜资源
92005-1生长点在ms 0.75mg/l 6-ba 0.1mg/lnaa上愈伤组织情况,该愈伤组织中分布胚性细胞和非胚性细胞(白色箭头代表第二类胚性细胞,蓝色箭头代表第一类胚性细胞;黄色箭头代表第一类非胚性细胞,黑色箭头代表第二类非胚性细胞),图2中的b为红甜菜资源357叶柄在ms 0.5mg/l 6-ba上愈伤组织情况,该愈伤组织为非胚性细胞(白色箭头代表第一类非胚性细胞,黑色箭头代表第二类非胚性细胞);
[0018]
图3为糖用甜菜资源92005-1生长点在ms 0.75mg/l 6-ba 0.1mg/lnaa上愈伤组织的细胞学形态观察图;
[0019]
图4为甜菜体细胞胚发生的组织细胞学观察图,其中,图4中的a为92005-1糖用甜菜生长点在ms 0.75mg/l 6-ba 0.1mg/l naa上愈伤组织石蜡切片,se,somatic embryo体细胞胚(胚状体);图4中的b为92005-1糖用甜菜生长点在ms 0.75mg/l 6-ba 0.1mg/lnaa上愈伤组织石蜡切片,me,multicellular embryos,多细胞原胚团z,ma,mature embryo,成熟胚。
具体实施方式:
[0020]
以下具体实施方式中所述ms基础培养基的组成为蔗糖3%,琼脂0.8%,余量为水。
[0021]
以下具体实施方式中所述的糖用甜菜资源94002-1、糖用甜菜资源92005-1和糖用甜菜资源92011/1-6/1-1均来源于国家甜菜种质中期库。
[0022]
本发明采用传统石蜡切片法对获得的愈伤组织进行石蜡切片的制作,具体包括对材料进行固定、染色、脱水、透明、浸蜡、包埋、切片、贴片、展片、脱蜡、封片观察。主要步骤如下:各组织材料用faa固定液固定后置于70%酒精中4℃保存;将固定好的组织材料在爱氏苏木精染液中浸泡染色,时间一般为7~15d。染色之后对材料进行流水冲洗,并在冲洗过程中用显微镜对染色程度进行观察;冲洗完毕后经不同浓度梯度酒精逐渐脱去组织中的水分(一般经过70%酒精、85%酒精、95%酒精脱水后再用100%酒精脱水2次),每级每次间隔1~2h;后经1/2二甲苯 1/2纯酒精混合液1次;在纯二甲苯中透明两次,每次2h,最后浸蜡、包埋、切片,切片厚度为8μm。
[0023]
实施例1:糖用甜菜资源92005-1愈伤组织的诱导
[0024]
(1)种子处理及无菌苗的获得
[0025]
挑选饱满的糖用甜菜资源92005-1种子,用研钵磨去外壳,先用75%的酒精消毒2min,再用12%的次氯酸钠消毒5min,之后用蒸馏水反复冲洗4~5次后接种于ms基础培养基上使其萌发,约20d后获得糖用甜菜无菌苗,分别采集糖用甜菜无菌苗的叶柄,叶片和生长点用于愈伤组织的诱导。
[0026]
(2)愈伤组织的诱导
[0027]
以ms基础培养基分别添加
①
0.25mg/l 6-ba;
②
0.5mg/l 6-ba;
③
0.75mg/l 6-ba;
④
0.25mg/l 6-ba 0.1mg/lnaa;
⑤
0.5mg/l 6-ba 0.1mg/lnaa;
⑥
0.75mg/l 6-ba 0.1mg/lnaa作为愈伤组织的诱导培养基,分别对步骤(1)获得的糖用甜菜外植体进行诱导,24℃培养8周后统计愈伤组织诱导率,愈伤组织诱导率=(形成愈伤组织外植体数/接种外植体数)
×
100%。
[0028]
实施例2:糖用甜菜资源94002-1愈伤组织的诱导
[0029]
(1)种子处理及无菌苗的获得
[0030]
挑选饱满的糖用甜菜资源94002-1种子,用研钵磨去外壳,先用75%的酒精消毒2min,再用12%的次氯酸钠消毒5min,之后用蒸馏水反复冲洗4~5次后接种于ms基础培养基上使其萌发,约20d后获得糖用甜菜无菌苗,分别采集糖用甜菜无菌苗的叶柄,叶片和生长点用于愈伤组织的诱导。
[0031]
(2)愈伤组织的诱导
[0032]
以ms基础培养基分别添加
①
0.25mg/l 6-ba;
②
0.5mg/l 6-ba;
③
0.75mg/l 6-ba;
④
0.25mg/l 6-ba 0.1mg/lnaa;
⑤
0.5mg/l 6-ba 0.1mg/lnaa;
⑥
0.75mg/l 6-ba 0.1mg/lnaa作为愈伤组织的诱导培养基,分别对步骤(1)获得的糖用甜菜外植体进行诱导,24℃培养8周后统计愈伤组织诱导率,愈伤组织诱导率=(形成愈伤组织外植体数/接种外植体数)
×
100%。
[0033]
实施例3:糖用甜菜资源92011/1-6/1-1愈伤组织的诱导
[0034]
(1)种子处理及无菌苗的获得
[0035]
挑选饱满的糖用甜菜资源92011/1-6/1-1种子,用研钵磨去外壳,先用75%的酒精消毒2min,再用12%的次氯酸钠消毒5min,之后用蒸馏水反复冲洗4~5次后接种于ms基础培养基上使其萌发,约20d后获得糖用甜菜无菌苗,分别采集糖用甜菜无菌苗的叶柄,叶片和生长点用于愈伤组织的诱导。
[0036]
(2)愈伤组织的诱导
[0037]
以ms基础培养基分别添加
①
0.25mg/l 6-ba;
②
0.5mg/l 6-ba;
③
0.75mg/l 6-ba;
④
0.25mg/l 6-ba 0.1mg/lnaa;
⑤
0.5mg/l 6-ba 0.1mg/lnaa;
⑥
0.75mg/l 6-ba 0.1mg/lnaa作为愈伤组织的诱导培养基,分别对步骤(1)获得的糖用甜菜外植体进行诱导,24℃培养8周后统计愈伤组织诱导率,愈伤组织诱导率=(形成愈伤组织外植体数/接种外植体数)
×
100%。
[0038]
对实施例1-3获得的愈伤组织进行评价:
[0039]
(1)对实施例1-3中各处理方法的愈伤组织诱导率、颜色和质地进行统计,结果如表1和图1所示,表中未展示的处理方法则为诱导失败的处理方法。
[0040]
表1不同诱导方法对糖用甜菜愈伤组织诱导的影响
[0041][0042]
从表1结果可以看出,糖用甜菜资源92005-1的生长点外植体在含有0.75mg/l 6-ba 0.1mg/lnaa或含有0.25mg/l 6-ba的ms培养基上诱导率较高,达到50%,且获得的愈伤组织的颜色较好,而糖用甜菜92011/1-6/1-1没有得到诱导出的愈伤组织或外植体逐渐褐化死亡,究其原因可能是与培养基的激素浓度以及甜菜的资源品种有关。
[0043]
(2)观察甜菜胚性细胞与非胚性细胞的差异与形成过程
[0044]
通过石蜡切片可以观察到只有糖用甜菜资源92005-1的生长点外植体在含有0.75mg/l 6-ba 0.1mg/lnaa的ms培养基上培养获得的愈伤组织为胚性愈伤组织,该愈伤组织中含有四种不同类型的细胞形态(如图2中的a),第一类胚性细胞,细胞质浓厚,细胞核位于中间,淀粉粒含量较多,位于分化中心的边缘。第二类胚性细胞,细胞质浓厚,易被染色,细胞核位于边缘且淀粉粒含量较少,一般靠近分化中心,推测已经完成初步分化。第一类非胚性细胞,具有中央大液泡,淀粉粒含量少,几乎不含有细胞器,细胞核位于中央。第二类非胚性细胞,分布在第一类非胚性细胞外围,其内只含有少数细胞质,没有任何其他可供分化的细胞器存在,呈现空泡状。图2中的b为红甜菜资源357叶柄在ms 0.5mg/l 6-ba上愈伤组织情况,该愈伤组织为非胚性细胞,以此愈伤组织进行对比。
[0045]
(3)观察不同资源在不同植物生长调节剂物质处理下甜菜愈伤组织的细胞学形态
[0046]
图3为糖用甜菜92005-1生长点在ms 0.75mg/l 6-ba 0.1mg/lnaa上愈伤组织的细胞学形态观察图,由该图可知,愈伤组织含有第一、二类胚性细胞,这种细胞体积较小(直径约15~25μm),细胞排列及形状较规则且细胞质丰富,细胞质染色深,细胞核较大,具有旺盛的细胞分裂能力。
[0047]
(4)糖用甜菜细胞胚的体发育过程及起源方式
[0048]
经切片观察发现,如图4中a中se推测为内起源的胚性细胞逐步分化形成的胚状体,在后期会逐步分化形成其他胚状结构,进而发育形成完整植株。图4中的b中观察到三个体细胞原胚团聚集在一起推测是为成熟胚的形成输送营养物质。不同植物品种,不同发生途径的体细胞胚起源方式也存在差异。单从本次对糖用甜菜愈伤组织的细胞学观察来看,体细胞胚的起源方式包括外起源和内起源两种,但出现的时间、数量均不同。这些差异可能与糖用甜菜体细胞胚发生途径及诱导率相关,具体原因及相关分子机制需要进一步探讨。但不论其体细胞胚的起源方式如何,其最终目的都是发展成为胚状体从而进一步获得再生的器官。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。