一种合成乳链菌肽nisin的异源表达体系及其应用
技术领域
1.本发明涉及一种合成乳链菌肽nisin的异源表达体系及其应用,属于生物工程技术领域。
背景技术:
2.nisin为i类羊毛硫肽,是最经典研究最为透彻的羊毛硫肽。它是一种由乳酸乳球菌(l.lactis)产生的细菌素,已被食品管理局批准作为食品添加剂使用,分子量为3353da,具有形成二聚体或四聚体的能力。nisin能抑制孢子的萌发,对李斯特菌、梭状芽孢杆菌、葡萄球菌和芽孢杆菌都有抗菌活性。
3.乳酸链球菌素(nisin)由几种革兰氏阳性细菌乳酸乳球菌产生,作为天然防腐剂应用于食品工业,由核糖体合成途径(ripp)合成,即前体由核糖体翻译合成后经脱水和环化修饰后分泌至胞外,经前导肽酶切割前导肽后成熟。其中,前体编码基因为nisa,脱水酶编码基因为nisb,环化酶编码基因为nisc,前导肽切割酶编码基因为nisp。本发明中使用胰蛋白酶替代前导肽切割酶,用于nisin最终成熟。
4.以往的合成策略均在乳酸菌宿主中开展,不可避免地受宿主代谢和基因表达的双重调节,并且这些调节处于非常复杂的网络中,难以对其基因合成和调控系统进行有效改造,由于生产菌株生产nisin的产量低,生产成本较高,这成为限制大规模制备nisin的瓶颈问题。
技术实现要素:
5.针对现有的技术难点及存在的问题,本发明通过在e.coli bl21(de3)中构建nisin异源表达系统,以期能获得具有活性的nisin并提高其产量。
6.本发明提供了一种重组大肠杆菌,所述重组大肠杆菌采用prsfduet-1载体过表达了乳酸链球菌素前体肽nisa和修饰蛋白nisb,同时采用pacycduet-1载体过表达了修饰蛋白nisc。
7.在本发明的一种实施方式中,编码所述乳酸链球菌素前体肽nisa的核苷酸序列如seq id no.1所示,编码所述修饰蛋白nisb的核苷酸序列如seq id no.2所示,编码所述修饰蛋白nisb的核苷酸序列如seq id no.3所示。
8.在本发明的一种实施方式中,以e.coli bl21(de3)为表达宿主。
9.本发明还提供了一种制备上述重组大肠杆菌的方法,所述方法为:
10.(1)以乳酸乳球菌基因组为模板,分别克隆得到核苷酸序列如seq id no.1所示的nisa基因,核苷酸序列如seq id no.2所示的nisb基因和核苷酸序列如seq id no.3的所示nisc基因;
11.(2)将nisa和nisb连接至载体prsfduet-1上,制备得到重组载体prsfduet-1-nisa-nisb,同时,将nisc连接至载体pacycduet-1上,制备得到重组载体pacycduet-1-nisc;
12.(3)分别将重组质粒prsfduet-1-nisa-nisb和重组载体pacycduet-1-nisc转化进入大肠杆菌中,制备得到重组大肠杆菌。
13.在本发明的一种实施方式中,所述重组大肠杆菌以e.coli bl21(de3)为表达宿主
14.本发明还提供了一种乳链菌肽nisin的制备方法,所述方法包括以下步骤:
15.(1)将上述重组大肠杆菌的种子液接种至发酵培养基中进行培养后,收集菌体;
16.(2)将制备得到的菌体重悬之后,超声破碎取上清液,从上清液中提取制备得到乳链菌肽nisin。
17.在本发明的一种实施方式中,步骤(1)为:将重组大肠杆菌种子液按照1%(v/v)的接种量,接种至发酵培养基中,在37℃的条件下培养2~3h,至od600=0.8~1.2,加入终浓度0.4mm的iptg,18℃诱导表达20~24h,制备得到培养液,离心后收集菌体。
18.在本发明的一种实施方式中,所述发酵培养基为2yt培养基:nacl 5g/l,yeast extract 10g/l,tryptone 16g/l。
19.在本发明的一种实施方式中,步骤(1)具体为:
20.将所述重组大肠杆菌接种至5ml含有100μg/ml的卡纳抗生素和34μg/ml的氯霉素的lb液体培养基中,在37℃,200rpm条件下进行培养,待该种子液生长至od
600
为1.5~2.0时,得到一级种子液;
21.将制备得到的一级种子液按1%(v/v)的比例转接至具有双抗(100μg/ml的卡纳抗生素和34μg/ml的氯霉素)的50ml 2yt培养基中,37℃200rpm摇瓶培养,待该种子液生长至od
600
为3.0~4.0时,得到二级种子液;
22.将制备得到的二级种子液按1%(v/v)的比例转接至具有双抗(100μg/ml的卡纳抗生素和34μg/ml的氯霉素)的500ml 2yt培养基中,37℃200rpm摇瓶培养,培养至od
600
为0.9~1.0时,加入终浓度为0.3mm的iptg进行诱导表达,18℃,120rpm培养24h后,制备得到发酵液;
23.将制备得到的发酵液在4℃,12000rpm条件下离心5min,弃上清,收集菌体;
24.将收集得到的菌体用start buffer(20mm tris,500mm nacl,10%甘油,ph 8.0)重悬后,在4℃,12000rpm条件下离心5min,取菌体重复上述实验三次,制备得到菌体。
25.在本发明的一种实施方式中,步骤(2)具体为:
26.向步骤(1)收集好的菌体中加入20ml start buffer重悬,于4℃,12000rpm条件下离心30min,超声破碎后,去除细胞碎片,取上清液;
27.将上述上清液用乳酸调ph至3.0后,于4℃,12000rpm条件下离心30min,去沉淀,取上清液;
28.将上清液用20%(w/v)tca(10%三氯醋酸)进行沉淀,4℃静置8~12h后,在4℃,12000rpm条件下离心30min,弃上清,取沉淀;
29.向上述沉淀中加入体积分数为10%的丙酮,在4℃,12000rpm条件下离心3min;重复三次,以去除残留的tca,将离心管开口放置于室温下3-5h,使丙酮挥发后,制备得到含有乳链菌肽nisin的溶液。
30.本发明还提供了上述重组大肠杆菌,或上述构建方法,或上述制备含有乳链菌肽nisin的产品中的应用。
31.在本发明的一种实施方式中,所述产品为药品或保健品。
32.本发明还提供了一种不以疾病的诊断和治疗为目的的抑制致病菌的方法,所述方法为,采用上述重组大肠杆菌进行抑制。
33.本发明还提供了一种nisin的定性检测方法,即利用抑菌圈初步判断产物nisin是否具有抑菌活性。
34.本发明还提供了一种nisin的定量检测方法,即利用alamarblue检测指示菌细胞活力,从而评价nisin产量。
35.本发明还提供了上述重组大肠杆菌在抑制致病菌中的应用,所述应用不以疾病的诊断和治疗为目的,所述应用为,采用所述重组大肠杆菌的发酵产物进行抑制。
36.有益效果
37.(1)本发明提供了一种nisin在大肠杆菌异源表达的方法,该方法利用大肠杆菌自身对nisin的抗性,实现了nisin的组成型表达,从而脱离了宿主代谢和基因表达的双重调节,降低了后期的改在难度,有潜力提高nisin的产量并降低生产成本,为开发新型nisin高水平合成系统提供了可行方案。
38.(2)采用本发明的方法,利用alamarblue对产物进行定量检测,与nisin标准品(apexbio)相比,单位细胞量(od
600
)的产量为0.625mg。
附图说明
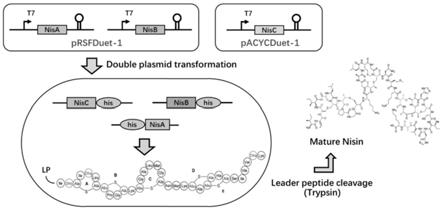
39.图1:nisin异源合成策略示意图。
40.图2:nisin表达的tris-tricine电泳图,其中,bl21为:空白对照破碎上清液;habc为:含有乳链菌肽nisin的溶液。
41.图3:nisin的抑菌圈定性检测结果。
42.图4:nisin的alamarblue定量检测结果。
43.图5:nisin表达的western blot图谱。
44.图6:以标准品浓度为横坐标对抑菌率建立的标准曲线。
具体实施方式
45.下述实施例中所涉及的指示菌b.subtilis 168和b.licheniformis均购自中国工业微生物菌种管理保藏中心。
46.下述实施例中所涉及的培养基如下:
47.lb液体培养基(1l):nacl 10g,yeast extract 5g,tryptone 10g。
48.2yt培养基(1l):nacl 5g,yeast extract 10g,tryptone 16g。
49.1%(v/v)tween的0.75%琼脂培养基(100ml):100ml lb培养基中加入0.75g琼脂粉。
50.实施例1:含有nisin异源合成途径的重组质粒的构建
51.具体步骤如下:
52.(1)通过ncbi数据库检索,确定nisin合成基因簇,以乳酸乳球菌基因组(genebank登录号为:cp069378.1)为模板,分别克隆得到前体及修饰酶基因nisa(核苷酸序列如seq id no.1所示),nisb(核苷酸序列如seq id no.2所示)和nisc(核苷酸序列如seq id no.3所示);
53.(2)分别将上述获得的基因利用gibson组装方法连接至载体中,制备得到重组载体;其中nisa连接至载体prsfduet-1的第一个启动子后,nisb连接至载体prsfduet-1的第二个启动子后,nisc连接至载体pacycduet-1的第一个启动子后,其中同源臂设计在引物5’端,加粗表示,列于表1;
54.上述步骤所涉及的引物序列如表1所示,扩增体系如表2所示,pcr扩增反应条件为98℃预变性3min,98℃变性30s,55℃退火30s,72℃延伸1.5min(其中前体nisa延伸20s),72℃延伸5min,共30个循环。
55.表1引物序列
[0056][0057][0058]
表2 pcr扩增体系
[0059][0060]
(3)将扩增好的dna片段进行琼脂糖凝胶电泳鉴定并切胶回收,然后使用2
×
genrec重组试剂盒进行重组反应。将重组反应后的产物转化e.coli dh5α,阳性转化子的基因序列由天霖生物科技(无锡)有限公司进行测序验证。
[0061]
制备得到重组质粒prs-nisa-nisb(prsfduet-1-nisa-nisb)和pac-nisc(pacycduet-1-nisc);重组质粒的基因结构如图1所示。
[0062]
实施例2:nisin诱导表达及tris-trince检测
[0063]
具体步骤如下:
[0064]
1、重组大肠杆菌的构建
[0065]
将实施例1构建好的重组质粒prs-nisa-nisb和pac-nisc转化至同一个e.coli bl21(de3)中,构建双质粒表达系统,制备得到重组大肠杆菌e.coli bl21(de3)/prs-nisa-nisb/pac-nisc。
[0066]
2、乳链菌肽nisin的制备表达
[0067]
(1)将所述重组大肠杆菌e.coli bl21(de3)/prs-nisa-nisb/pac-nisc接种至5ml含有100μg/ml的卡纳抗生素和34μg/ml的氯霉素lb液体培养基中,在37℃,200rpm条件下进行培养,待该种子液生长至od
600
为1.5~2.0时,得到一级种子液;
[0068]
(2)将制备得到的一级种子液按1%(v/v)的比例转接至具有100μg/ml的卡纳抗生素和34μg/ml的氯霉素的50ml 2yt培养基中,37℃200rpm摇瓶培养,待该种子液生长至od
600
为3.0~4.0时,得到二级种子液;
[0069]
(3)将制备得到的二级种子液按1%(v/v)的比例转接至具有100μg/ml的卡纳抗生素和34μg/ml的氯霉素的500ml 2yt培养基中,37℃200rpm摇瓶培养,培养至od
600
为0.9~1.0时,加入终浓度为0.3mm的iptg进行诱导表达,18℃,120rpm培养24h后,制备得到发酵液;
[0070]
(4)将制备得到的发酵液在4℃,12000rpm条件下离心5min,弃上清,收集菌体;
[0071]
(5)将收集得到的菌体用start buffer(20mm tris,500mm nacl,10%甘油,ph 8.0)重悬后,在4℃,12000rpm条件下离心5min,取菌体重复上述实验三次,制备得到菌体。
[0072]
(6)向步骤(5)收集好的菌体中加入20ml start buffer重悬,于4℃,12000rpm条件下离心30min,超声破碎后,去除细胞碎片,取上清液;
[0073]
(7)将上述上清液用乳酸调ph至3.0后,于4℃,12000rpm条件下离心30min,去沉淀,取上清液;
[0074]
(8)将步骤(7)制备得到的上清液用20%(w/v)tca(10%三氯醋酸)进行沉淀,4℃静置8~12h后,在4℃,12000rpm条件下离心30min,弃上清,取沉淀;
[0075]
(9)向步骤(8)制备得到的沉淀中加入10%的丙酮,在4℃12000rpm条件下离心3min;重复三次,以去除残留的tca,将离心管开口放置于室温下3-5h,使丙酮挥发后,制备得到含有乳链菌肽nisin的溶液。
[0076]
按照上述方法分别将空载质粒prsfduet-1,pacycduet-1导入e.coli bl21(de3)中,作为对照,制备得到空白对照破碎上清液。
[0077]
3、乳链菌肽nisin的检测
[0078]
分别将步骤2得到的含有乳链菌肽nisin的溶液、空白对照破碎上清液,采用超纯水重悬溶解,用于tris-tricine检测,结果如图2所示;其中,bl21为:空白对照破碎上清液;habc为:含有乳链菌肽nisin的溶液。
[0079]
结果显示:利用该体系成功表达带有前导肽的产物前体,分子量为6.8kda。
[0080]
4、采用western blot对步骤2制备得到的含有乳链菌肽nisin的溶液进行检测,结果如图5所示,结果显示:利用该表达体系可以成功合成nisin前体。
[0081]
实施例3:抑菌圈检测nisin活性
[0082]
具体步骤如下:
[0083]
(1)配制胰蛋白酶溶液:0.25%(w/v)胰蛋白酶,0.02%(v/v)edta,0.01m pbs,ph 8.0。
[0084]
(2)向按照实施例2的方法制备得到的nisin溶液中,按体积比为3:1的比例加入步骤(1)配制好的胰蛋白酶溶液,37℃,200rpm震荡反应1h,切割前导肽,使nisin完全成熟,反应好后过0.22μm的滤膜除菌,用于活性检测。
[0085]
(3)将过夜培养好的指示菌b.subtilis 168和b.licheniformis用无菌水调节至
od
600
为1.7,按1%(v/v)的接种量接种至含有1%(v/v)tween的0.75%琼脂培养基中,混匀后倒平板,厚度为4mm,待琼脂凝固后打孔。
[0086]
(4)将步骤(2)得到的过膜除菌的80~100μl nisin成熟产物加入孔中,直至加满,置于4℃预扩散12h,然后于30℃正置培养12~16h,观察抑菌圈,结果如图3所示,结果显示,本发明制备得到的nisin具有抑菌效果,对指示菌b.subtilis 168和b.licheniformis的抑菌直径分别为:9mm、8mm。
[0087]
实施例4:alamarblue定量检测nisin活性
[0088]
具体步骤如下:
[0089]
1、将实施例3步骤(3)制备好的指示菌按体积比为1:20的比例,接种至含有10%(v/v)的alamarblue的lb液体培养基中;
[0090]
同时按体积比为1:20的比例向上述培养基中添加实施例3的步骤(2)得到的成熟nisin,在37℃,200rpm条件下培养3~6h,检测荧光,其中激发光波长为560nm,发射光波长为590nm。
[0091]
公式为:
[0092]
还原度变化百分比(%)=实验组fi/阴性对照组fi
[0093]
抑制率(%)=1-还原度变化百分比(%)
[0094]
结果如图4所示,结果显示:本发明制备得到的nisin具有抑菌效果,对指示菌b.subtilis168和b.licheniformis的抑菌率分别为19%和48%。
[0095]
2、将实施例3步骤(3)制备好的指示菌按体积比为1:20的比例,接种至含有10%(v/v)的alamarblue的lb液体培养基中;同时按体积比为1:20的比例向上述培养基中添加实施例3的步骤(2)得到的成熟nisin及不同浓度的标准品,在37℃,200rpm条件下培养3~6h;其中,标准品分浓度为:0.2mg/ml,0.25mg/ml,0.3mg/ml,0.35mg/ml,0.4mg/ml,以标准品浓度为横坐标对抑菌率建立标准曲线(如图6所示),然后按照标准曲线计算产物浓度(mg/ml)。
[0096]
结果显示:利用alamarblue对产物进行定量检测,与nisin标准品(apexbio)相比,单位细胞量(od
600
)的产量为0.62mg。
[0097]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
