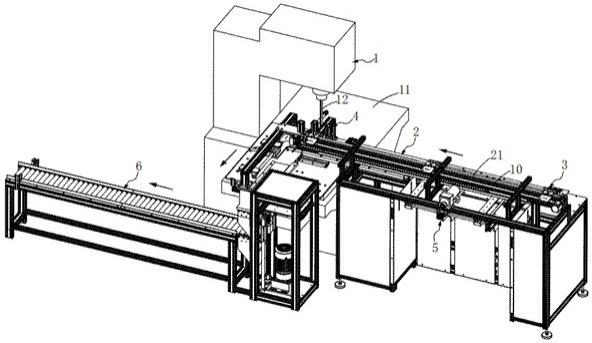
1.本发明属于植物组织培养技术领域,尤其涉及一种基于全基因组诱变创制苹果无融合异源多倍体砧木的方法。
背景技术:
2.无融合生殖是指不经过精子与卵细胞的受精结合而直接产生无性胚和无性种子的一种特殊的无性繁殖,其子代在遗传上是其母本的克隆,保留着母本的基因型,其后代不产生分离现象,从而表现出高度的整齐一致性及其他的优良性状,并在繁殖过程中能够保留下来。与现行苹果栽培应用的有性种子作基砧和无性系矮砧相比,无融合生殖砧木具有许多优点:通过无性种子繁殖,后代整齐一致;繁殖系数高,与扦插、压条等繁殖方式相比,繁殖效率高,根系壮,立地性好,适应性强;不带病毒,适应现代果树无毒栽培的发展趋势。
3.无融合生殖实生砧木首先要具备无融合生殖特征,并且一别以往的无性繁殖方法,而采用种子播种进行实生繁殖。大多数果树的遗传物质都是高度杂合的,实生繁殖将产生大幅度的分离,而使后代参差不齐。为防止这种现象的发生,实生砧木必须具有无融合生殖特征。
4.但目前对于具有无融合生殖特性的实生砧木存在创制困难的问题,制约了无融合生殖在育种程序和无性种子生产中的应用。尤其是苹果砧木选育上,存在童期长、植株占空间大、筛选周期长,高度的无融合生殖性状不能通过有性杂交传递给后代的问题。
技术实现要素:
5.本发明提供了一种基于全基因组诱变创制苹果无融合异源多倍体砧木的方法。本发明克服了苹果无融合生殖砧木的增殖特征,实现其快速高目的性增殖,节省了极大的时间与空间,可以大规模快速获得新型异源多倍体砧木并进行诱变基因功能鉴定。
6.为了实现上述发明目的,本发明提供以下技术方案:本发明提供了一种基于全基因组诱变创制苹果无融合异源多倍体砧木的方法,包括以下步骤:(1)对苹果无融合生殖砧木进行全基因组测序;(2)在苹果无融合生殖砧木开花时期,去除柱头采收种子;(3)采收的种子低温冷藏层积后,进行诱变处理、消毒,然后再次低温冷藏层积,进行播种,待得到的萌发幼苗长出根系移栽水培;(4)鉴定水培幼苗的根系表型;(5)选取根系表型有差异的幼苗扦插生根,再次鉴定根系表型;(6)选取扦插生根的根系表型有差异的幼苗进行组织培养,诱导生根后鉴定根系表型,得到差异诱变砧木;(7)将差异诱变砧木进行全基因组测序和转录组测序,与步骤(1)全基因组测序结
果进行比较获得诱变基因;(8)对诱变基因进行功能验证。
7.进一步的,所述步骤(1)中采用pacbio hifi测序、oxford nanopore technology 测序和illumina 二代测序平台对苹果无融合生殖砧木进行全基因组测序;然后利用canu hifi 软件对得到的原始测序数据进行组装,组装结果用nextpolish 软件和二代illumina 数据进行校正并组装高质量基因组,利用已知苹果基因组序列和hi-c数据,采用allhic软件进行contig的分相和挂载,得到挂载到全部染色体的苹果无融合生殖砧木基因组序列,对挂载到染色体的基因组利用necat校正的ont测序数据进行gap closing, 然后利用pacbio hifi 数据进行gap closing,得到最终的染色体水平的分相的苹果无融合生殖砧木基因组。
8.进一步的,所述步骤(3)低温冷藏层积的步骤为:将采收的种子与潮湿沙土混匀置于4℃冰箱中层积25-50天。
9.进一步的,所述诱变处理为化学诱变,所述化学诱变的试剂包括ems、秋水仙素、5-溴尿嘧啶。
10.进一步的,所述步骤(5)中根系表型的差异包括侧根数量增多。
11.进一步的,所述步骤(7)中采用solexa平台和solid平台对差异诱变砧木进行全基因组测序和转录组测序,通过比较基因组学和转录组wgcna分析,获得诱变基因的核苷酸序列。
12.进一步的,所述步骤(8)中利用诱变基因来构建目的基因超表达载体,转入发根农杆菌后,侵染野生型组培苗茎尖1.0 cm,经共培养和筛选培养后获得转基因根系,进行功能验证。
13.本发明还提供了利用所述的方法获得的诱变基因,所述诱变基因的核苷酸序列如seq id no.1所示。
14.进一步的,所述诱变基因编码的蛋白质的氨基酸序列如seq id no.2所示。
15.本发明还提供了所述的诱变基因在用于鉴定无融合诱变系苹果砧木中的应用。
16.本发明与现有技术相比,具有以下优点和有益效果:本发明对平邑甜茶进行全基因组测序;后代无融合种子用化学试剂诱变;将诱变后的种子继续层积萌发并播种;收集后代种子进行层积萌发;利用根系水培扫描系统分析根系表型;根系构型显著差异材料进行组织培养培养繁殖;组培苗生根验证表型;差异材料进行全基因组重测序和转录组测序并寻找差异基因;利用快速的发根农杆菌转化体系对突变基因进行基因功能验证。本发明基于异源三倍体分相全基因组解析,利用苹果无融合生殖特性、根系表型分析及转录组高通量快速筛选鉴定新型无融合砧木,极大的节省了筛选的时间与空间,使优秀无融合生殖苹果砧木的繁殖成为现实。本发明所述方法所需流程简单、操作技术容易掌握,且能够适用于所有的苹果无融合生殖砧木品种,具有广适性,并实现了优秀无融合砧木的快速大量的增殖,因此具有广阔的应用前景。
附图说明
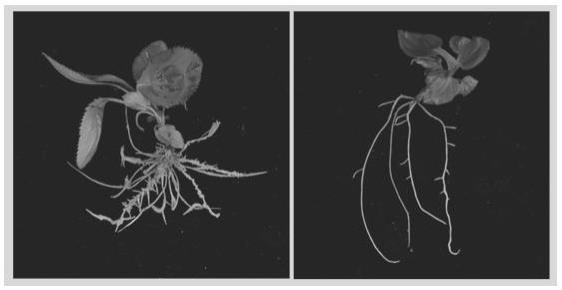
17.图1为实施例2中平邑甜茶去除柱头前的花;图2为实施例2中平邑甜茶经ems诱变后的种子;
图3为实施例2中水培获得的平邑甜茶差异幼苗根系;图4为实施例2中继代组织培养得到的平邑甜茶组培苗;图5为实施例2中生根诱导得到的诱变平邑甜茶幼苗(左)和对照组(右)平邑甜茶幼苗;图6为实施例2中侧根数量差异显著性分析;图7为实施例2中基因超表达(左)和对照组(右)平邑甜茶幼苗。
具体实施方式
18.结合以下具体实例对本发明的技术方案作进一步详细的说明。
19.下述实施例中,如无特殊说明,所使用的实验方法均为常规方法,所用材料、试剂等均可从生物或化学试剂公司购买。
20.实施例1本发明的一种基于全基因组诱变创制苹果无融合异源多倍体砧木的方法,包括以下步骤:(1)苹果无融合生殖砧木全基因组测序:对苹果无融合生殖目的材料采用但不限于pacbio hifi测序、oxford nanopore technology 测序和illumina 二代测序平台等综合手段进行全基因组测序,利用canu hifi 软件对得到的原始数据进行组装,组装结果用nextpolish 软件和二代illumina 数据进行校正并组装高质量基因组,利用已发表的苹果基因组序列如寒富、金冠等和hi-c数据,采用allhic软件进行contig的分相和挂载,最终得到挂载到全部染色体的无融合生殖目的材料基因组序列,对挂载到染色体的基因组利用necat校正的ont测序数据进行gap closing, 然后再次利用pacbio hifi 数据进行gap closing,得到最终的染色体水平的分相的苹果无融合生殖目的材料基因组;(2)测序木本材料后代种子进行诱变:在无融合生殖目的材料开花时期,去除柱头,成熟后收集种子;将种子与潮湿沙土混匀(沙土潮湿程度为手握成团不滴水),置于4℃冰箱中层积,25-50天后获得即将萌发的种子(不同目的材料可根据自身特点适当调整);清水冲洗出种子,0.5% ems诱变溶液避光处理种子16小时(可根据不同的实验要求调整ems浓度和诱变时间),0.1m硫代硫酸钠溶液消毒处理,继续4℃层积20天,进行大田播种;其中,诱变溶液可以选用秋水仙素、5-溴尿嘧啶等。
21.(3)水培苗观察根系表型:收集诱变株系后代种子,消毒处理后,置于潮湿沙土中,于22-24℃,培养至幼苗长出根系即可移栽水培,2周后观察确定差异根系;(4)根系构型有差异的幼苗进行扦插生根:根系构型有差异的幼苗进行土壤移栽,2个月后进行扦插,待长出足够的根后统计生根率及表型;(5)组培苗进行根系构型表型及分析:扦插生根有差异的株系取幼嫩的组织进行组织培养,然后转移到继代培养基(每升ms培养基中含0.5mg 6-ba 0.05mg iba,30g蔗糖,7.5g琼脂,ph为5.8-5.85)中,于22-24℃,进行扩增繁殖获得更多幼苗;2个月后选取继代培养基中长势良好的幼苗转移至生根培养基(每升1/2ms培养基中含0.5 mg iba,25 g/l蔗糖,7.5g琼脂,ph为5.8-5.85)诱导生根,再次确定表型;(6)诱变材料进行全基因组重测序及转录组测序寻找差异基因:采用solexa平台和solid平台对差异诱变材料进行全基因组测序和转录组测序,通过比较基因组学和转录
组wgcna分析,获得差异基因的核苷酸序列及其编码的氨基酸序列;(7)进行转基因根系验证:构建目的基因超表达载体并转入发根农杆菌k599, 侵染野生型组培苗茎尖1.0 cm,经共培养和筛选培养后获得转基因根系。
22.本发明是基于苹果无融合生殖砧木的特性,并利用化学诱变与组织培养技术而进行的高通量高规模快速筛选和鉴定无融合砧木。上述所述的方法能够适用于所有的无融合生殖砧木品种,具有广适性,并实现了优秀无融合砧木的快速大量的增殖。
23.实施例2现以平邑甜茶为例,对本发明所述的基于全基因组诱变创制苹果无融合异源多倍体砧木的方法,进行详细介绍,该方法包括以下步骤:(1)对单株沂蒙山区野生百年
‘
平邑甜茶’老树幼嫩树叶采样后用液氮迅速冷冻,送往北京百迈客生物科技有限公司测序,基因组提取由百迈客公司完成;(2)采用pacbio hifi测序、oxford nanopore technology 测序和illumina 二代测序平台进行全基因组测序,并利用canu hifi 软件对 pacbio hifi数据进行组装,组装结果用nextpolish 软件和二代illumina 数据进行校正,利用寒富的基因组序列和hi-c数据,采用allhic软件进行contig的分相和挂载,最终得到挂载到51条染色体的平邑甜茶基因组序列,染色体挂载率为94.33%,对挂载到染色体的基因组利用necat校正的ont测序数据进行gap closing, 然后再次利用pacbio hifi 数据进行gap closing,得到最终的染色体水平的分相的平邑甜茶基因组共1.88gb;(3)在平邑甜茶开花时期(图1),去除柱头,成熟后收集种子;(4)将种子与潮湿沙土混匀(沙土潮湿程度为手握成团不滴水),置于4℃冰箱中层积,30天后获得即将萌发的种子;(5)清水冲洗出种子,0.5% ems诱变溶液(每100ml诱变溶液中含有ems 0.5ml,10m 磷酸二氢钠溶液9.2 ml,1m磷酸氢二钠溶液0.8ml,dmso溶液5ml,去离子水84.5ml)避光处理种子16小时,0.1m硫代硫酸钠溶液消毒处理(图2),继续4℃层积20天,进行大田播种;(6)收集诱变株系后代种子,采用步骤(4)方法层积种子40天,获得萌发幼苗;(7)将萌发的幼苗转移到hoagland营养液中,2周后使用扫描仪(epson perfection v850 pro)扫描幼苗根系,winrhizo软件对根系进行侧根数量统计,graphpad prism软件对数据进行差异显著性分析(图6 a);(8)选择侧根数量明显增多的幼苗(图3),取幼嫩的组织在超净工作台中用75%的酒精处理30 s进行表面消毒,再用无菌水冲洗3次;然后将外植体放进0.1%升汞溶液中浸泡9 min进行最后一步消毒,再用无菌水冲洗3次;最后,将消毒好的外植体接种到生芽培养基(每升ms培养基中含3mg tdz,0.5mg naa,30g蔗糖,7.5g琼脂,ph为5.8-5.85)中暗培养14天,光培养30天;(9)将组培苗转移到继代培养基(每升ms培养基中含0.5mg 6-ba 0.05mg iba,30g蔗糖,7.5g琼脂,ph为5.8-5.85)中,于22-24℃条件下进行扩增繁殖获得更多组培苗(图4);(10)选取继代培养基中长势良好的幼苗切取茎尖1.5cm转移至生根培养基(每升1/2ms培养基中含0.5 mg iba,25 g/l蔗糖,7.5g琼脂,ph为5.8-5.85)中于22-24℃生根培养1个月,得到平邑甜茶幼苗(图5),使用步骤(7)中方法再次鉴定材料侧根明显增多(图
6b);(11)将步骤(10)中变异材料送至北京百迈客生物科技有限公司进行全基因组重测序,基因组提取由公司完成;(12)将步骤(10)中变异材料送至武汉贝纳科技服务有限公司,将步骤(2)获得的全基因组作为参考进行有参转录组测序,rna提取由公司完成;利用双端测序技术对mrna进行测序,原始 fastq数据经过fastp过滤得到剩余的有效数据如reads和碱基数等(表1);通过star将过滤后的转录组序列与参考基因比对,并进行统计,获得测序数据经过滤后单端的 clean reads 总数和参考序列上有唯一比对位置的 reads 所占比例等(表2);利用表达定量得到的基因在各个样品中的表达量 reads count 数据,进行差异表达分析,差异表达分析的软件为 deseq2,筛选阈值为 padj 《 0.05 且 |log2foldchange| 》 1,如若显著差异基因数目过少时筛选阈值为 p value 《 0.05 且 |log2foldchange| 》 1,本次分析使用的是fdr值进行显著差异过滤,获得经鉴定的差异表达基因数目(表3);表1:测序数据量信息统计
samplerawreadsrawbasescleanreadscleanbasesq20rateq30rategccontentck147369523718625480047074423706962067898.152�.523F.325%ck241852790652736910041592057642142880398.437�.635G.258%line145706349681049330045421610669995785097.583�.986G.947%line239479586587046960039233638577519089298.428�.471F.956%
注:sample 为样本名称;raw reads 为原始未过滤数据的 reads 数;raw bases 为原始未过滤数据的碱基数; clean reads 为过滤后剩余的 reads 数;clean bases 过滤后剩余的碱基数; q20_rate 为过滤后,总序列中质量值大于 20(错误率小于1%)的碱基数的比例,该值越大说明测序质量越好; q30_rate 为过滤后,总序列中质量值大于 30(错误率小于0.1%)的碱基数的比例,该值越大说明测序质量越好;gc_content 为过滤后数据gc含量。
24.表2:数据比对结果统计
sampletotal_reads(bp)unique_mapped(%)multiple_mapped(%)unmapped(%)ck12132878635.6254.1910.19ck22280251235.5953.4710.63line12065488033.3752.0314.60line219.80172232.5851.2616.16
注:上表中 sample 为样品名称,total_reads 为测序数据经过滤后单端的 clean reads 总数,unique_mapped 为参考序列上有唯一比对位置的 reads 所占比例,multiple_mapped 为在参考序列上有多个比对位置的 reads 所占比例,unmapped 为未比对上的 reads 所占比例。
25.表3:差异表达基因数目comparisonsignificant_diff_numberupdownck1_vs_line11061247885383ck2_vs_line21153353515840注:上表为每个比较组显著差异基因数目,以及上调和下调基因数目。
26.(13)通过kegg和go等手段进行转录本功能注释,共得到涉及34个主要通路的2764
个突变功能基因,预测其包含参与调控主根、侧根和根毛的基因;选择其中一个调控侧根数量的主要通路中的主效基因进行功能验证,即选择核苷酸序列如seq id no.1(ma01:mh04g130085)所示的差异基因,其编码得到的氨基酸序列如seq id no.2(ma01:mh04g130085)所示;(14)为了验证定向改造该砧木的可行性,对选择的诱变基因进行基因功能验证。首先构建目的基因过表达载体,载体选择购自biovector ntcc典型培养物保藏中心的prok2,酶切位点选择bamh1和kpn1,使用苏州新赛美生物科技有限公司的easyfusion assembly master mix定向同源重组克隆试剂盒连接目的基因,连接条件为50℃、30min;大肠杆菌为实验室保存的感受态top10,卡那霉素抗性;将连接好的质粒转化进感受态top10(冰水浴30 min,37℃热激90s,冰水浴5 min)中,涂板后37℃过夜培养,挑取单菌落,经菌液pcr和载体酶切鉴定后送生工生物工程有限公司测序,测序结果与步骤(2)获得的全基因组中序列比对结果相同,表示载体构建成功;表4:目的基因扩增所用引物序列引物名称引物序列ma01-facgggggactctagaggatccatggagaaagaaaaagaaagagccma01-rgcccttgctcaccatggtaccttatttgcatgagagagtagcaataaat(15)转入发根农杆菌k599。感受态k599购买自上海唯地生物技术有限公司,利福平抗性;将构建好的载体转化后涂布固体yep抗性板(每升yep含100μl利福平,50μl卡那霉素,7.5g琼脂),28℃培养48h后挑取单菌落于液体yep抗性培养基(每升yep含100μl利福平,50μl卡那霉素)中,振荡培养6h后进行菌液pcr,选取转化成功的保存菌种。
27.(16)取少量菌种于液体yep抗性培养基中过夜活化,第二天早上用移液枪吸取100μl菌液加入到20ml液体yep抗性培养基中28℃振荡培养4-6小时,用分光光度计测量农杆菌菌液浓度,选取od值为0.4-0.6的菌液离心(5000 rpm,5 min)收集菌体,无菌水清洗后离心倒掉上清,取少量菌在20ml侵染液(1/2 ms 15 g/l蔗糖,ph为5.20)中重悬;切取野生型组培苗茎尖1.0 cm,蘸取侵染液后于共培养培养基(1/2 ms 15 g/l蔗糖,8.5 g/l琼脂,ph为5.20)中22℃暗培养3天,转移到筛选培养基(1/2 ms 15 g/l蔗糖,6.0 g/l琼脂,ph为5.90,特美汀500 mg/l),每10天更换一次筛选培养基;诱变基因过表达的平邑甜茶(左)和对照组的平邑甜茶(右)如图7所示,相较于对照组来说,过表达的材料侧根数量多(图6c)且密度大,单体长度稍短,主根增长;主根长度增加可以更好的固定植株、分生侧枝,吸收深层土壤中的水分及微量元素,侧根密度大扩大了根系的分布范围、增加了根系吸收土壤养分的面积,增强了综合吸收水分与养分的能力,可更有效地实现早期丰产优质的目标。
28.通过上述实验,可以看出,利用本发明所述的方法能够快速筛选诱变获得的无融合砧木,相对于现有技术显著的缩短了筛选时间,缩小了筛选空间,使无融合苹果的增殖成为可能。
29.以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。