1.本技术属于精子保存技术领域,尤其涉及花色苷在冷冻保存精子中的应用、精子冷冻保存液。
背景技术:
2.精子冷冻保存早在半个世纪前就开始了,并在发现甘油作为补充物后发展起来。在过去的几十年里,精子冷冻保存已经发展成为辅助生殖技术治疗的常规做法。重要的是,低温保存过程会导致精子损伤,包括过度脱水、质膜解体、顶体渗漏、线粒体损伤和dna碎裂。
3.在人类精子冷冻损伤中,温度的快速变化对精子在冷冻-解冻过程中产生化学和物理压力,并改变精子膜脂质成分,这被认为是多因素的。此外,精子低温保存过程中受到的氧化应激可引起dna损伤。精子活性氧(ros)的生理水平是正常精子功能所必需的,而过量的ros会使有害物质积累,导致精子损伤。因此,降低精子氧化应激对防止超低温保存造成的额外损伤具有重要作用。
技术实现要素:
4.有鉴于此,本技术提供了花色苷在冷冻保存精子中的应用、精子冷冻保存液,有效解决现有的冷冻精子在解冻过程中容易发生氧化应激而引起dna碎裂以及活力降低的技术问题。
5.本技术第一方面提供了花色苷在体外冷冻保存精子中的应用。
6.另一实施例中,所述体外冷冻保存精子包括:将精子与精子冷冻培养基混合,然后按照精子冷冻保存法进行冷冻保存;其中,所述精子冷冻培养基包括花色苷和精子冷冻培养可接受物质。
7.另一实施例中,所述花色苷为矢车菊素-3-o-葡萄糖苷(cyanidin-3-o-glucoside,以下简称c3g)、飞燕草素-3-o-葡萄糖苷、天竺葵素-3-o-葡萄糖苷、锦葵素-3-o-葡萄糖苷、芍药素-3-o-葡萄糖苷和牵牛色素-3-o-葡萄糖苷中的一种或多种。
8.另一实施例中,所述花色苷在所述精子冷冻培养基中的浓度为50μm/l~200μm/l。
9.另一实施例中,所述矢车菊素-3-o-葡萄糖苷在所述精子冷冻培养基中的浓度为50μm/l~200μm/l。
10.另一实施例中,所述花色苷在所述精子冷冻培养基中的浓度为50μm/l~100μm/l。
11.另一实施例中,所述矢车菊素-3-o-葡萄糖苷在所述精子冷冻培养基中的浓度为50μm/l~100μm/l。
12.另一实施例中,所述矢车菊素-3-o-葡萄糖苷在所述精子冷冻培养基中的浓度为50μm/l。
13.另一实施例中,所述精子冷冻培养可接受物质包括人血白蛋白、重组人胰岛素和抗生素中的一种或多种。
14.具体的,所述人血白蛋白、所述重组人胰岛素和所述抗生素的用量为现有常规用量。
15.另一实施例中,所述应用包括所述花色苷在提高精子存活率和活力中的应用。
16.另一实施例中,所述应用包括所述花色苷在降低精子ros水平、精子dna碎片率dfi和精子核完整性hds中的应用。
17.本技术第二方面提供了一种精子冷冻培养基,包括花色苷和精子冷冻培养可接受物质;
18.所述花色苷选自矢车菊素-3-o-葡萄糖苷、飞燕草素-3-o-葡萄糖苷、天竺葵素-3-o-葡萄糖苷、锦葵素-3-o-葡萄糖苷、芍药素-3-o-葡萄糖苷和牵牛色素-3-o-葡萄糖苷中的一种或多种。
19.另一实施例中,所述花色苷在所述精子冷冻培养基中的浓度为50μm/l~200μm/l。
20.另一实施例中,所述矢车菊素-3-o-葡萄糖苷在所述精子冷冻培养基中的浓度为50μm/l~200μm/l。
21.由于精子的冷冻保存过程,包括冰晶的形成、冷冻保护介质的毒性和精子渗透压的变化,由于精子膜的破坏、线粒体氧化磷酸化的减少和ros的过量产生,对精子质量产生了负面影响。ros的释放和抗氧化酶活性的降低了精子活力,诱导精子dna损伤。本技术针对现有技术中冷冻和解冻过程降低了精子的活力,增加了精子ros的产生和dna碎片的缺陷,发现了花色苷,尤其是c3g在冷冻保存精子中的新应用,以及c3g可作为精子冷冻保存液中的抗氧化剂,本技术发现在精子冷冻培养基中加入c3g,在精子解冻后能有效提高精子存活和前向运动比例,降低精子ros水平、精子dna碎片率dfi和精子核完整性hds的产生,本技术发现了c3g是一种有效的精子低温保护剂,可改善人类精子低温保存过程中的氧化应激。
附图说明
22.为了更清楚地说明本技术实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
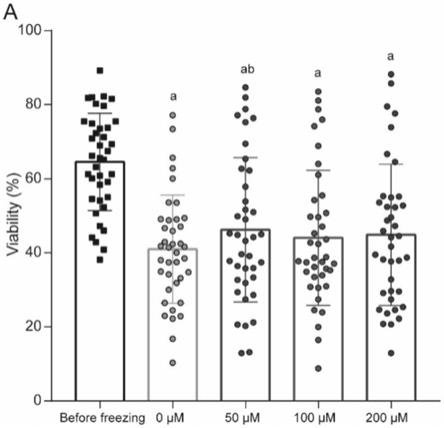
23.图1为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后存活率比较;其中,ap《0.05;bp《0.05与对照组(0μm/l c3g)相比;
24.图2为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后活动率比较;其中,ap《0.05;bp《0.05与对照组(0μm/l c3g)相比;
25.图3为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后精子ros比较;其中,ap《0.05,bp《0.05与对照组(0μm/l c3g);cp与添加c3g(50μm/l c3g)相比,p《0.05;
26.图4为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后精子dfi比较;其中,ap《0.05,bp《0.05与对照组(0μm/l c3g);cp与添加c3g(50μm/l c3g)相比,p《0.05;
27.图5为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后精子hds比较;其中,ap《0.05,bp《0.05与对照组(0μm/l c3g);cp与添加c3g(50μm/l c3g)相比,p《0.05。
具体实施方式
28.本技术提供了花色苷在冷冻保存精子中的应用、精子冷冻保存液,用于解决现有的冷冻精子在解冻过程中容易发生氧化应激而引起dna碎裂以及活力降低的技术缺陷。
29.下面将对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本技术保护的范围。
30.其中,以下实施例所用原料或试剂均为市售或自制。
31.以下实施例中精液来源于39名在生殖中心寻求生育诊断的男性,这些男性的临床特征及精子质量见表1。试验前3个月服用任何药物或补充抗氧化剂的男性被排除在外。以下实施例的试验获得中国科学技术大学第一附属医院伦理委员会批准(2021-ky-040)。
32.表1
33.特征平均数
±
标准差年龄(年)31.2
±
5.5性禁欲(天)5.2
±
4.9精液体积(毫升)3.4
±
1.1精子浓度(106ml-1
)94.1
±
57.9存活率(%)70.4
±
8.5前向运动(%)44.6
±
8.3正常形态(%)6.3
±
2.1精子ros(%)2.6
±
2.8精子dna碎片(dfi)(%)7.8
±
6.2精子核完整性(hds)(%)7.7
±
2.6
34.以下实施例中c3g是根据jiang et al.的文献方法从黑豆皮中提取的。采用液相色谱-质谱联用(lc-ms)对其结构和纯度进行鉴定。
35.以下实施例中精子ros水平由ros检测试剂盒(beyotime biotechnology,shanghai,china)根据制造商说明进行检测。采用流式细胞仪(cytopoc,gaugene,beijing,china)检测样品。
36.以下实施例中精子dna片段评估采用流式细胞仪(becton dickinson,franklin lakes,usa)对精子染色质结构分析评估精子dna片段,每个样本至少收集5000个精子,并使用bdaccuri软件(becton dickinson,franklin lakes,usa)收集和分析数据。
37.实施例1
38.本技术实施例提供了精液的分析试验,具体包括:
39.精液来源于39名在生殖中心寻求生育诊断的男性,在禁欲后2~7天通过手淫收集精液样本,在37℃液化至少30分钟后进行评估。精液分析按照who第五指南(世界卫生组织:世界卫生组织人类精液检验和处理实验室手册,第五版,日内瓦:世界卫生组织;2010)进行。使用计算机辅助精液分析(casa)在显微镜下(cx43,olympus,tokyo,japan)与sas
‑ⅱ
系统(sas medical,beijing,china)进行精子浓度和活力分析。采用伊红-苯胺黑染色法(ankebio,hefei,china)测定精子存活率。在光学显微镜(ub100i,uop,chongqing,china)下,采用dff-quick染色(ankebio,hefei,china)在100倍放大下分析每个样品200个精子的形态。
40.在测量和记录新鲜精液参数,结果如表1。39名研究对象的平均年龄为31.2
±
5.5
岁。根据who 2010指南评估精液样本为正常精子症(精液体积≥1.5ml,前向运动≥32%,精子浓度≥1500万/ml,精子活率≥59%)。精子ros、dfi和hdi平均水平分别为2.6
±
2.8%、7.8
±
6.2%和7.7
±
2.6%。
41.然后按照仪器的说明书(pureception,cooper surgical,trumbull,united states),通过密度梯度离心从精浆中分离精子。2.0ml的80%梯度溶液(pureceptionwith 80%gradient)转移到锥形离心管中。另取2.0ml40%梯度溶液(pureceptionwith40%gradient),用移液管缓慢放置在下相液体上。然后,将2.5ml新鲜精液小心地置于上相,以400g离心20分钟。精子在spermrinse(vitrolife,san diego,usa)中洗涤并重悬。
42.实施例2
43.本技术实施例测定矢车菊素-3-o-葡萄糖苷(c3g)对低温保存精子的影响,具体方法包括:
44.在冷冻培养基中添加c3g,将含有c3g的冷冻培养基分为4组,每组加入等量相同浓度的精子悬液,冷冻培养基中c3g的浓度分别为0μm/l(对照)、50μm/l、100μm/l和200μm/l。将这些精子标本在室温平衡后装入吸管,将吸管置于液氮蒸气上方10cm处悬浮冷冻30min,然后放入液氮中浸泡2周。解冻后的样品在温水(37℃)中浸泡10min,并测定精子在低温冷冻前与冷冻后相关参数(包括精子存活率、精子活动率、精子ros、精子dna碎片率dfi和精子核完整性hds),同时分析精子ros、精子dna碎片率dfi的相关性分析。测定的结果采用spss 23.0统计软件(spss inc.,chicago,il,usa)进行统计分析。本实施例中所有数据均以均值
±
sd表示。数据的正态性通过shapiro-wilk检验进行分析。采用单因素方差分析、tukey检验和kruskal-wallis检验比较不同组间的参数。两组比较采用配对t检验。采用spearman相关检验分析c3g添加浓度与冷冻后精子ros、dfi水平的相关性。p《0.05为差异有统计学意义。
45.其中,冷冻培养基购自origio公司(denmark)的精子冻存液sperm freezingmedium,产品编号为1067,其成分含有人血白蛋白、重组人胰岛素、硫酸庆大霉素等。
46.上述精子存活率、精子活动率、精子ros、精子dna碎片率dfi和精子核完整性hds的结果如图1~图5所示,精子ros与精子dna碎片率dfi的相关性分析如表2所述。图1为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后存活率比较,图2为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后活动率比较,图3为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后精子ros比较,图4为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后精子dfi比较,图5为本技术实施例提供的体外下不同浓度c3g对低温保存精子解冻后精子hds比较。
47.图1和图2中的before freezing分别为精子低温冷冻前的存活率和活动率,0μm、50μm、100μm和200μm分别为精子低温冷冻后的0μm/l、50μm/l、100μm/l和200μm/l的c3g对精子的存活率和活动率。从图1和图2数据可知,冷冻后精子活力和进行性运动下降,特别是对照组(0μm/l)。在低温保存培养基中添加低浓度c3g(50μm/l)可提高精子活力和进行性运动。此外,添加100或200μm/l c3g组的精子活力和生存能力均高于对照组。
48.图3~图5中的before freezing分别为精子低温冷冻前的精子ros、精子dfi和精子hds,0μm、50μm、100μm和200μm分别为精子低温冷冻后的0μm/l、50μm/l、100μm/l和200μm/
l的c3g对精子的精子ros、精子dfi和精子hds。从图3~图5中数据可知,与新鲜精子相比,解冻后精子ros水平显著升高(图3)。而添加较低浓度的c3g(50μm/l~100μm/l)降低了精子ros水平的升高,这是由于低温保存。冷冻保存后,c3g添加组的精子dfi和hds较对照组低。
49.从表2数据的相关分析表明,冷冻后精子ros水平是与较低的补充c3g(50μm/l)具有相关性(r=-0.2,p=0.03)。
50.表2
[0051][0052]
现有技术中精子的冷冻保存过程,包括冰晶的形成、冷冻保护介质的毒性和精子渗透压的变化,由于精子膜的破坏、线粒体氧化磷酸化的减少和ros的过量产生,对精子质量产生了负面影响。ros的释放和抗氧化酶活性的降低了精子活力,诱导精子dna损伤。上述实施例数据可知:在冷冻培养基中添加c3g,特别是在低浓度c3g时,可通过控制细胞内ros水平提高了精子质量。即在低温培养基中添加抗氧化剂c3g,精子冷冻之后解冻过程中,c3g可以通过控制ros的产生来保护精子免受冻融损伤。
[0053]
上述试验数据证实了在冷冻培养基中加入c3g,以浓度依赖的方式降低了细胞内ros的产生。在冷冻培养基中补充c3g提高了解冻后精子的活力和活力。冷冻培养基中添加低浓度的c3g比添加高浓度c3g,更有效降低精子解冻后ros水平。即在冻融过程中,添加50μm/l的c3g可能比添加另外两种高剂量的c3g(100和200μm/l)更有效地诱导精子活力和活力下降的保护。表明c3g在低剂量下的抗氧化能力足以克服低温损伤。
[0054]
综上所述,与对照组(无添加c3g)相比,低剂量(50μm/l或100μm/l)c3g可提高精子活力和活力,降低精子活性氧(ros),冷冻后的dna碎片指数(dfi)和精子核完整性hds均高于c3g添加组。在冷冻培养基中补充低浓度c3g(50μm/l)与精子ros水平呈负相关(r=-0.2,p=0.03)。低剂量补充c3g可通过降低精子解冻后ros水平,提高精子活力,减少dna损伤。因此c3g是一种有效的精液低温保护剂,可改善人类精子低温保存过程中的氧化应激。
[0055]
以上所述仅是本技术的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本技术原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本技术的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。