1.本发明涉及黄色系化合物、含有该化合物的着色组合物、含有该着色组合物的滤色器用着色剂及使用了该着色组合物的滤色器。
背景技术:
2.目前为止,开发出了喹酞酮颜料、偶氮颜料、二酮基吡咯并吡咯颜料等多种颜料(专利文献1~4)。将这些颜料用于液晶、场致发光(el)显示装置的滤色器的着色剂。就滤色器而言,通过在玻璃等透光性基板上通过染色法、颜料分散法、印刷法、电沉积法等使着色层层叠而制造。喹酞酮颜料为通过喹哪啶与邻苯二甲酸酐的缩合而合成的黄色系化合物,由于其鲜明性,作为滤色器用着色剂来使用(专利文献1、2、5、6、非专利文献1)。但是,随着显示器的高画质化,滤色器所要求的性能提高,需要进一步提高着色力、明度及对比度。
3.颜料一般不溶于溶剂,因此在包含树脂等的滤色器中以微粒状存在。因此,已知:就使用了颜料的滤色器而言,由于在颜料粒子表面透射光进行反射
·
散射,因此对透明性、色纯度产生影响,另外,由于由反射引起的消偏作用,因此彩色液晶显示装置的对比度降低。
4.为了改善对比度降低的问题,提出了只使用染料作为着色剂的方法或者将染料和颜料并用的方法等。由于染料可溶于溶剂,因此,就使用了染料的滤色器而言,与只使用颜料作为着色剂的情况相比,消偏作用得到抑制,分光特性优异,期待对比度、亮度等的提高。
5.现有技术文献
6.专利文献
7.专利文献1:日本特公昭47-3476号公报
8.专利文献2:日本特开2012-193318号公报
9.专利文献3:日本特开2012-12498号公报
10.专利文献4:日本特开2001-220520号公报
11.专利文献5:日本特开2019-104897号公报
12.专利文献6:日本特开2019-123856号公报
13.非专利文献
14.非专利文献1:市村国宏主编、《最先进滤色器的工艺技术和化学》、株式会社cmc出版、2006年、第80页
技术实现要素:
15.发明要解决的课题
16.本发明为了解决上述课题而完成,目的在于提供:使黄色系化合物在有机溶剂(丙二醇单甲基醚乙酸酯(pgmea)等)中的溶解性及耐热性提高、含有该化合物、着色力、鲜明性、色相等色彩特性优异的着色组合物、含有该着色组合物的滤色器用着色剂及使用了该
着色剂的滤色器。
17.用于解决课题的手段
18.本发明是为了上述目的而深入研究、结果得到的,以下为其要点。
19.1.由下述通式(1)表示的化合物。
20.【化1】
[0021][0022]
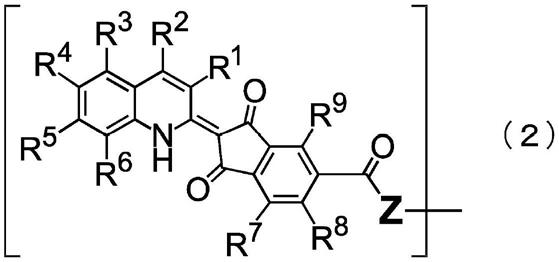
[式(1)中,q分别独立地为由下述通式(2)表示的基团,
[0023]
n表示2~10的整数,
[0024]
l表示2~10价的基团。]
[0025]
【化2】
[0026][0027]
[式(2)中,r1~r9分别独立地表示
[0028]
氢原子(-h)、羟基(-oh)、卤素原子、氰基(-cn)、硝基(-no2)、
[0029]
可具有取代基的碳原子数0~25的氨基、
[0030]
可具有取代基的碳原子数0~25的磺酰基、
[0031]
可具有取代基的碳原子数1~25的直链状、分支状或环状的烷基、
[0032]
可具有取代基的碳原子数2~25的直链状、分支状或环状的烯基、
[0033]
可具有取代基的碳原子数1~25的直链状、分支状或环状的烷氧基、
[0034]
可具有取代基的碳原子数1~25的酰基、
[0035]
可具有取代基的碳原子数0~25的醚基、
[0036]
可具有取代基的碳原子数6~25的芳香族烃基、或者
[0037]
可具有取代基的成环原子数5~25的杂环基,
[0038]
r1~r9可在相邻的基团之间相互键合而形成环。
[0039]
z分别独立地为2价基团或者3价基团,表示
[0040]
可具有取代基的碳原子数0~25的氨基、
[0041]
可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基、
[0042]
包含醚基或者单键中的1种或2种以上的基团,
[0043]
有多个的q经由l或者z相互键合。]
[0044]
2.化合物,其中,在上述通式(1)中,l为
[0045]
可具有取代基的碳原子数0~25的氨基、
[0046]
可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基、
[0047]
可具有取代基的碳原子数0~25的醚基、
[0048]
可具有取代基的碳原子数6~25的芳香族烃基、或者
[0049]
可具有取代基的成环原子数5~25的杂环基。
[0050]
3.化合物,其中,在上述通式(2)中,z为可具有取代基的碳原子数1~20的氨基。
[0051]
4.化合物,其中,在上述通式(2)中,z为可具有取代基的碳原子数1~20的直链状、分支状或环状的亚烷基、或者、包含醚基的基团。
[0052]
5.化合物,其中,在上述通式(2)中,r2或者r6为可具有取代基的碳原子数1~20的氨基。
[0053]
6.化合物,其中,在上述通式(2)中,r2或者r6为可具有取代基的碳原子数1~20的醚基。
[0054]
7.着色组合物,其含有上述化合物。
[0055]
8.滤色器用着色剂,其含有上述着色组合物。
[0056]
9.滤色器,其使用有上述滤色器用着色剂。
[0057]
发明的效果
[0058]
就本发明涉及的化合物而言,与现有的黄色系化合物相比,在pgmea等有机溶剂中的溶解性优异,且制膜时的耐热性优异,因此含有本发明涉及的化合物的着色组合物可用作滤色器用着色剂。
具体实施方式
[0059]
以下,对于本发明的实施方式详细地说明。应予说明,本发明并不限定于以下的实施方式,在其主旨的范围内能够进行各种变形来实施。首先,对由上述通式(1)表示的化合物进行说明。
[0060]
本发明的化合物由下述通式(1)或[q]
n-l表示。在通式(1)中,q分别独立地为由下述通式(2)表示的基团,n表示2~10的整数,l表示2~10价的基团。有多个的q可彼此相同也可不同。
[0061]
【化3】
[0062][0063]
【化4】
[0064][0065]
因此,通式(1)能够使用通式(2)如下述通式(1-2)那样来表示。
[0066]
【化5】
[0067][0068]
其中,在通式(1)中,n为2时,将有多个的q分别表示为q1及q2的情况下,如下述式(1-3),q1和q2经由l如“q
1-l-q
2”那样键合。
[0069]
【化6】
[0070]q1-l-q2ꢀꢀꢀ
(1-3)
[0071]
进而,在通式(1)中,n为3时,将有多个的q分别表示为q1、q2和q3的情况下,如下述式(1-4)那样,q1~q3可经由l键合,q1~q3的各个可相互地直接键合,也可相互地替代。在n为4以上的情况下也同样地,如下述式(1-4)那样,多个q能够经由l相互键合。
[0072]
【化7】
[0073][0074]
这样,通式(1)中n表示2~10的整数,即使在存在q1~q
10
作为多个q的情况下,q1~q
10
的各个可经由l键合,q1~q
10
的各个也可相互直接键合,也可相互地替代。因此,l与n对应地表示2~10的价数的基团。n优选为2~6,更优选为2~4。
[0075]
作为通式(2)中的r1~r9表示的“卤素原子”,可列举出氟原子、氯原子、溴原子、碘原子等。作为“卤素原子”,优选氟原子或者氯原子。
[0076]
通式(2)中,就由r1~r9表示的“可具有取代基的碳原子数0~25的氨基”而言,可具有取代基也可不具有取代基,在具有取代基的情况下包含表示为
“‑
nr
10r11”的“具有取代基r
10
及r
11
的氨基”,可列举出未取代氨基(-nh2)、一取代氨基、二取代氨基等。就一取代氨基或者二取代氨基中的碳原子数而言,例如,为1~25,可为1~20,也可为2~10。就“可具有取代基的碳原子数0~25的氨基”而言,可以是经由-nh-、-n<或者-n=ch-键合了后述的“碳原子数1~25的直链状、分支状或环状的烷基”、“碳原子数6~25的芳香族烃基”、“碳原子数0~25的酰基”、“成环原子数5~25的杂环基”的基团。作为一取代氨基,可列举出乙基氨基、丁基氨基、乙酰基氨基、苯基氨基等。作为二取代氨基,可列举出二甲基氨基、二乙基氨基、二丙基氨基、二丁基氨基、二己基氨基等碳原子数2~25的二烷基氨基;二烯丙基氨基等碳原子数4~25的二烯基氨基;二苯基氨基、n-乙酰基-n-苯基氨基、(正丁基)-n-苯基氨基等。
[0077]
通式(2)中,由r1~r9表示的“可具有取代基的碳原子数0~25的磺酰基”意指表示为
“‑
so
2-r
100”(或者
“‑
s(=o)
2-r
100”)的具有取代基r
100
的磺酰基。
“‑
so
2-r
100”可以是不含碳
原子的基团,例如可为
“‑
so3h”或者包含碱金属原子“m”的
“‑
so3m”。就本发明中的碱金属原子“m”而言,可列举出锂原子(li)、钠原子(na)、钾原子(k)或者铯原子(cs)等,优选li、na或者k,更优选li或者na,特别优选na。r
100
的碳原子数为0~25,可为1~20,也可为1~10。作为碳原子数0~25的可具有取代基的磺酰基,除了上述的-so3h、-so3m以外,还可列举出磺酰胺基(-s(=o)
2-nh2)、甲磺酰基、甲苯磺酰基等。
[0078]
通式(2)中,作为由r1~r9表示的“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷基”中的“碳原子数1~25的直链状、分支状或环状的烷基”,具体地,可列举出甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基等直链状的烷基;异丙基、异丁基、仲丁基、叔丁基、异辛基、2-乙基己基等分支状的烷基;环丙基、环戊基、环己基、环庚基、环辛基、环壬基、环癸基等环状的烷基(环烷基)、1-金刚烷基、2-金刚烷基等。
[0079]
通式(2)中,作为由r1~r9表示的“可具有取代基的碳原子数2~25的直链状、分支状或环状的烯基”中的“碳原子数2~25的直链状、分支状或环状的烯基”,具体地,可列举出乙烯基、1-丙烯基、烯丙基、1-丁烯基、2-丁烯基、1-戊烯基、1-己烯基、异丙烯基、异丁烯基等直链状或分支状的烯基;环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基等环状的烯基(环烯基)、或者这些直链状、分支状或环状的烯基多个键合而成的基团。
[0080]
通式(2)中,作为由r1~r9表示的“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷氧基”中的“碳原子数1~25的直链状、分支状或环状的烷氧基”,具体地,可列举出甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、庚氧基、辛氧基、壬氧基、癸氧基等直链状的烷氧基;异丙氧基、异丁氧基、仲丁氧基、叔丁氧基、异辛氧基等分支状的烷氧基;环丙氧基、环丁氧基、环戊氧基、环己氧基、环庚氧基、环辛氧基、环壬氧基、环癸氧基等环状的烷氧基(环烷氧基);1-金刚烷氧基、2-金刚烷氧基等。
[0081]
通式(2)中,由r1~r9表示的“可具有取代基的碳原子数1~25的酰基”意指由
“‑
(c=o)-r
101”表示的具有取代基r
101
的基团。取代基r
101
可以是包含碳原子的基团,也可以是不含碳原子的基团。在取代基r
101
为包含碳原子的基团的情况下,取代基r
101
的碳原子数例如可为1~25,可为1~20。作为取代基r
101
,例如可列举出-h、-ch3、-ch2ch2ch3、-ch=ch2、-c6h5(苯基)等。作为“可具有取代基的碳原子数1~25的酰基”中的“碳原子数1~25的酰基”,具体地,可列举出甲酰基、乙酰基、丙酰基、丙烯酰基、苯甲酰基等。
[0082]
通式(2)中,由r1~r9表示的“可具有取代基的碳原子数0~25的醚基”意指由
“‑
o-r
102”表示的具有取代基r
102
的醚基。取代基r
102
可以是包含碳原子的基团,也可以是不含碳原子的基团。作为“可具有取代基的碳原子数0~25的醚基”中的“碳原子数0~25的醚基”,具体地可列举出氨氧基、由
“‑
o-(c=o)-r”表示的酯基(r为任意的烷基或者芳香族烃基等)、磷酸基、磷酸酯基等。
[0083]
通式(2)中,作为由r1~r9表示的“可具有取代基的碳原子数6~25的芳香族烃基”中的“碳原子数6~25的芳香族烃基”,具体地,可列举出苯基、联苯基、三联苯基、萘基、蒽基(
アントリル
基)、菲基、芴基、茚基、芘基、苝基、荧蒽基、苯并[9,10]菲基等芳香族烃基(本发明中的“芳香族烃基”也包含芳基或者稠合多环芳香族基团)。
[0084]
通式(2)中,作为由r1~r9表示的“可具有取代基的成环原子数5~25的杂环基”中的“成环原子数5~25的杂环基”,具体地,可列举出吡啶基、嘧啶基、三嗪基、咪唑基、吡唑基、三唑基、噻吩基、呋喃基(
フラニル
基)、吡咯基、喹啉基、异喹啉基、萘啶基、吲哚基、吖啶
基、菲咯啉基、苯并呋喃基、苯并噻吩基、吲哚基、咔唑基、噁唑基、苯并噁唑基、噻唑基、苯并噻唑基、喹喔啉基、苯并咪唑基、吡唑基、二苯并呋喃基、二苯并噻吩基、咔啉基等杂环基(或者杂芳香族烃基)。
[0085]
通式(2)中,作为由r1~r9表示的
[0086]“具有取代基的碳原子数0~25的氨基”、
[0087]“具有取代基的碳原子数0~25的磺酰基”、
[0088]“具有取代基的碳原子数1~25的直链状、分支状或环状的烷基”、
[0089]“具有取代基的碳原子数2~25的直链状、分支状或环状的烯基”、
[0090]“具有取代基的碳原子数1~25的直链状、分支状或环状的烷氧基”、
[0091]“具有取代基的碳原子数1~25的酰基”、
[0092]“具有取代基的碳原子数0~25的醚基”、
[0093]“具有取代基的碳原子数6~25的芳香族烃基”、或者、
[0094]“具有取代基的成环原子数5~25的杂环基”中的“取代基”,
[0095]
具体地,可列举出重氢原子、羟基、硫醇基、氰基、硝基;
[0096]
氟原子、氯原子、溴原子、碘原子等卤素原子;
[0097]
碳原子数0~20的氨基;
[0098]
碳原子数0~20的磺酰基;
[0099]
碳原子数1~20的直链状、分支状或环状的烷基;
[0100]
碳原子数2~20的直链状、分支状或环状的烯基;
[0101]
碳原子数1~20的直链状、分支状或环状的烷氧基;
[0102]
碳原子数1~20的酰基;
[0103]
碳原子数1~20的醚基;
[0104]
碳原子数6~20的芳香族烃基或稠合多环芳香族基团;
[0105]
成环原子数5~20的杂环基等。应予说明,在“取代基”包含碳原子的情况下,不将其碳原子算入上述的“碳原子数0~25”、“碳原子数1~25”、“碳原子数2~25”、“碳原子数6~25”、“成环原子数5~25”。就这些“取代基”而言,可只包含一个,也可包含多个,在包含多个的情况下可彼此相同也可不同。另外,这些“取代基”可进一步具有上述例示的取代基。另外,这些取代基之间可经由单键、取代或未取代的亚甲基、氧原子(-o-)或者硫原子(-s-)相互键合而形成环。不过,由上述的r1~r9表示的各基团中的“取代基”的数最大为10个,各基团中的最大的碳原子数为100。
[0106]
予以说明,作为在通式(2)中由r1~r9表示的具有“取代基”的上述的各基团中作为“取代基”所列举的、
[0107]“碳原子数0~20的氨基”、
[0108]“碳原子数0~20的磺酰基”、
[0109]“碳原子数1~20的直链状、分支状或环状的烷基”、
[0110]“碳原子数2~20的直链状、分支状或环状的烯基”、
[0111]“碳原子数1~20的直链状、分支状或环状的烷氧基”、
[0112]“碳原子数1~20的酰基”、
[0113]“碳原子数1~20的醚基”、
[0114]“碳原子数6~20的芳香族烃基或稠合多环芳香族基团”、或者
[0115]“成环原子数5~20的杂环基”,具体地可列举出
[0116]
氨基;甲基氨基、二甲基氨基、二乙基氨基、乙基甲基氨基、二丙基氨基、二叔丁基氨基、二苯基氨基等具有碳原子数1~20的直链状或碳原子数3~20的分支状的烷基、或者、碳原子数6~20的芳香族烃基的一取代或二取代氨基;
[0117]
磺酰胺(-s(=o)
2-nh2)基、甲磺酰基、甲苯磺酰基等碳原子数0~20的具有磺酰基(-s(=o)
2-)的基团;-so
3-、-so3h、-so3m(m为碱金属原子);
[0118]
甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、正己基、2-乙基己基、庚基、辛基、异辛基、壬基、癸基等碳原子数1~20的直链状或碳原子数3~20的分支状的烷基;环丙基、环戊基、环己基、环辛基、环壬基、环癸基等碳原子数3~20的环状的烷基(环烷基);1-金刚烷基、2-金刚烷基;
[0119]
乙烯基、1-丙烯基、烯丙基、1-丁烯基、2-丁烯基、1-戊烯基、1-己烯基、异丙烯基、异丁烯基、或者这些烯基多个键合的碳原子数2~20的直链状或碳原子数3~20的分支状的烯基;环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基等碳原子数3~20的环状的烯基(环烯基);
[0120]
甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基、庚氧基、辛氧基、壬氧基、癸氧基、异丙氧基、异丁氧基、仲丁氧基、叔丁氧基、异辛氧基等碳原子数1~20的直链状或碳原子数3~20的分支状的烷氧基;环丙氧基、环丁氧基、环戊氧基、环己氧基、环壬氧基、环癸氧基等碳原子数3~20的环状的烷氧基(环烷氧基);1-金刚烷氧基、2-金刚烷氧基;
[0121]
甲酰基、乙酰基、丙酰基、丙烯酰基、苯甲酰基等碳原子数1~20的酰基;
[0122]
醚基(-o-)、氨氧基、由
“‑
o-(c=o)-r”表示的酯基(r为任意的烷基或者芳香族烃基等)、磷酸基、磷酸酯基等碳原子数0~20的含有醚基(-o-)的基团;
[0123]
苯基、联苯基、三联苯基、萘基、蒽基(
アントリル
基)、菲基、芴基、茚基、芘基、苝基、荧蒽基、苯并[9,10]菲基等碳原子数6~20的芳香族烃基或稠合多环芳香族基团;
[0124]
吡啶基、嘧啶基、三嗪基、噻吩基、呋喃基(
フラニル
基)、吡咯基、咪唑基、吡唑基、三唑基、喹啉基、异喹啉基、萘啶基、吖啶基、菲咯啉基、苯并呋喃基、苯并噻吩基、噁唑基、吲哚基、咔唑基、苯并噁唑基、噻唑基、苯并噻唑基、喹喔啉基、苯并咪唑基、吡唑基、二苯并呋喃基、二苯并噻吩基、咔啉基等成环原子数5~20的杂环基;
[0125]
苯氧基、甲苯氧基、联苯氧基、萘氧基、蒽氧基、菲氧基等碳原子数6~19的芳氧基等。
[0126]
在通式(2)中,r1~r9在相邻的基团之间可经由单键、取代或未取代的亚甲基、氧原子或者硫原子相互键合而形成环。
[0127]
在通式(2)中,作为r1~r9,优选
[0128]
氢原子、羟基、卤素原子、硝基、氰基、
[0129]
可具有取代基的碳原子数1~20的氨基、
[0130]
可具有取代基的碳原子数1~20的直链状或碳原子数3~20的分支状的烷基、
[0131]
可具有取代基的碳原子数2~20的直链状或碳原子数3~20的分支状的烯基、
[0132]
可具有取代基的碳原子数2~20的直链状或碳原子数3~20的分支状的烷氧基、
[0133]
可具有取代基的碳原子数1~20的酰基、
[0134]
可具有取代基的碳原子数1~20的醚基、或者
[0135]
可具有取代基的碳原子数6~20的芳香族烃基,
[0136]
更优选氢原子、可具有取代基的碳原子数1~20的氨基、或者、可具有取代基的碳原子数1~20的醚基。进一步优选r2或者r6为可具有取代基的碳原子数1~20的氨基、或者、可具有取代基的碳原子数1~20的醚基。
[0137]
在通式(1)中,包含n个由通式(2)表示的q。在通式(2)中存在多个(n个)的z分别独立地可相同也可不同,为2价基团或者3价基团。
[0138]
在通式(1)中,有多个的q经由l或者z相互键合。在z为2价基团的情况下,例如,在上述的通式(1)如“q
1-l-q
2”那样表示的情况下,如下述式(2-1)那样表示。此时,有多个的r1~r9分别独立地可相同也可不同。另外,在如下述式(2-1)那样表示的情况下,有多个的z中的任一个或者多个可为3价基团,z可为适当的基团,例如具有r
12
的3价基团,具体地,可如下述式(2-2)那样表示。有多个的r
12
分别独立地可相同也可不同。
[0139]
【化8】
[0140][0141]
【化9】
[0142][0143]
通式(1)中,在多个q经由z键合的情况下,例如如下述式(2-3)那样,各个q能够经由由z表示的2价基团或者3价基团而相互键合。
[0144]
【化10】
[0145][0146]
在通式(1)中,由“l”表示的基团表示2~10价的基团,作为l的具体例,可列举出使用下述的任意的基团而形成的2~10价基团。另外,l及多个q能够在下述的基团的任意的取代基的部位相互键合。
[0147]
作为这些基团,可列举出
[0148]“可具有取代基的碳原子数0~25的氨基”(或亚氨基)、
[0149]“可具有取代基的碳原子数0~25的磺酰基”、
[0150]“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷基”、
[0151]“可具有取代基的碳原子数2~25的直链状、分支状或环状的烯基”、
[0152]“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷氧基”、
[0153]“可具有取代基的碳原子数1~25的酰基”、
[0154]“可具有取代基的碳原子数0~25的醚基”、
[0155]“可具有取代基的碳原子数6~25的芳香族烃基”、或者
[0156]“可具有取代基的成环原子数5~25的杂环基”。
[0157]
就这些基团而言,具体地,可列举出与作为通式(2)中的r1~r9所列举出的基团同样的基团。对于这些“基团”可具有的“取代基”,也可列举出与由r1~r9表示的基团可具有的“取代基”同样的基团。
[0158]
就由这些基团表示的l而言,通过q的数(n)、或者、与任意的可具有取代基的部位的多个q的键合,能够成为2~10的任意的价数的基团。例如“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷基”可为“可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基”,取代基可键合于这些“亚烷基”中的一部分基团而成为3价以上的基团。可只包含1个这些“基团”或者“取代基”,也可包含多个,在包含多个的情况下,可彼此相同也可不同。另外,这些“基团”或者“取代基”可进一步具有上述例示的基团或者取代基。另外,这些“基团”或者“取代基”之间可经由单键、取代或未取代的亚甲基、氧原子或者硫原子相互键合而形成环。不过,l中所含的上述的“基团”或者“取代基”的数最大为10个,各基团中的最大的碳原子数为100。
[0159]
在通式(1)中,l优选
[0160]
可具有取代基的碳原子数0~25的氨基、
[0161]
可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基、
[0162]
可具有取代基的碳原子数0~25的醚基、
[0163]
可具有取代基的碳原子数6~25的芳香族烃基、或者
[0164]
可具有取代基的成环原子数5~25的杂环基,
[0165]
更优选可具有取代基的碳原子数1~25的直链状或分支状的亚烷基。
[0166]
在通式(2)中,由z表示的2价基团或者3价基团表示
[0167]
可具有取代基的碳原子数0~25的氨基、
[0168]
可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基、
[0169]
包含醚基、或者单键中的1种或2种以上的基团,包含在适当的部位将这些基团替换为2价基团或者3价基团的基团。就这些氨基、亚烷基或者醚基而言,也可包含多个相同或者不同的基团。
[0170]
在通式(2)中的z中,作为“可具有取代基的碳原子数0~25的氨基”中的“碳原子数0~25的氨基”,可列举出将与-n<、-n=ch-、或者、通式(2)中由r1~r9表示的“可具有取代基的碳原子数0~25的氨基”同样的基团在任一个取代基的部位替换为2价基团或者3价基团的基团,通过取代基r
12
,能够表示为-nr
12-、>n-r
12-、-r
12-nr
12-r
12-、-r
12-nh-nr
12-r
12-等。就取代基r
12
而言,可列举出与由r1~r9表示的“可具有取代基的碳原子数0~25的氨基”中的“取代基”同样的基团。多个r
12
可相同也可不同。予以说明,在通式(2)中z包含多个“可具有取代基的碳原子数0~25的氨基”的情况下,各个q能够经由z而与彼此不同的q键合。
[0171]
通式(2)中,作为由z表示的“可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基”,可列举出从具有与由r1~r9表示的“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷基”相同的结构的1价基团中在任意的位置的取代基处替换为2价基团的基团。作为“可具有取代基的碳原子数1~25的直链状、分支状或环状的亚烷基”中的“取代基”,可列举出与由r1~r9表示的“可具有取代基的碳原子数1~25的直链状、分支状或环状的烷基”中的“取代基”同样的基团。这些亚烷基可进行分支而形成3价基团。
[0172]
在通式(2)中,z为2价基团或者3价基团,优选为可具有取代基的碳原子数1~20的氨基、可具有取代基的碳原子数1~20的直链状、分支状或环状的亚烷基、或者、包含醚基的基团。
[0173]
予以说明,在上述中,
[0174]“碳原子数1~25的直链状、分支状或环状的烷基”优选为“碳原子数1~25的直链状、或碳原子数3~25的分支状或环状的烷基”。
[0175]“碳原子数2~25的直链状、分支状或环状的烯基”优选为“碳原子数2~25的直链状、或碳原子数3~25的分支状或环状的烯基”。
[0176]“碳原子数1~25的直链状、分支状或环状的烷氧基”优选为“碳原子数1~25的直链状、或碳原子数3~25的分支状或环状的烷氧基”。
[0177]“碳原子数1~25的直链状、分支状或环状的亚烷基”优选为“碳原子数1~25的直链状、或碳原子数3~25的分支状或环状的亚烷基”。
[0178]
本发明的化合物由
[0179]
1个2~10价的基团l[与通式(1)中的l同义。]、
[0180]
n个相同或不同、由下述通式(3)表示的1价的基团r0、
[0181]
n个相同或不同的1价的基团r
12
[与通式(2)中的取代基同义或者为氢原子。]、及
[0182]
n个相同或不同的2价或者3价的基团z[与通式(2)中的z同义。]构成,或者包含上述的基团,
[0183]
n表示2~10的整数,
[0184]
l只与z键合,
[0185]
r0只与z键合,
[0186]r12
只与z键合,
[0187]
z与r0键合,且与选自l、r
12
及其它的z中的1个或2个键合。
[0188]
【化11】
[0189][0190]
[式(3)中,r1~r9与上述同义。]
[0191]
由通式(1)表示的化合物(以下简称为化合物(1))包含可生成的全部的立体异构体、互变异构体。在以下示出化合物(1)的具体例,但本发明并不限定于这些。应予说明,下述结构式中,将一部分氢原子省略。
[0192]
【化12】
[0193][0194]
【化13】
[0195][0196]
【化14】
[0197][0198]
【化15】
[0199][0200]
【化16】
[0201][0202]
【化17】
[0203][0204]
【化18】
[0205][0206]
【化19】
[0207][0208]
【化20】
[0209]
[0210]
【化21】
[0211][0212]
【化22】
[0213][0214]
【化23】
[0215][0216]
【化24】
[0217][0218]
【化25】
[0219][0220]
【化26】
[0221][0222]
【化27】
[0223][0224]
【化28】
[0225][0226]
【化29】
[0227][0228]
【化30】
[0229][0230]
【化31】
[0231]
[0232]
【化32】
[0233][0234]
【化33】
[0235][0236]
【化34】
[0237][0238]
就由通式(1)表示的化合物而言,能够用以下的方法来合成。在以下,示出在通式(1)中n为2、r6为任意的-nr
10r11
、z由具有的任意的取代基r
12
的氨基所表示的情况的合成例。
[0239]
通过使具有相当的取代基的8-氨基-2-甲基喹啉衍生物与偏苯三酸酐通过适合的溶剂、温度进行脱水缩合反应,得到具有相当的取代基的下述中间体(x-1)。
[0240]
【化35】
[0241][0242]
进而,通过使得到的中间体(x-1)与具有相当的取代基的二胺通过适合的溶剂、温度采用脱水缩合剂,能够得到由通式(1)表示的本发明的化合物。
[0243]
在本发明中,作为将生成物进行精制的方法,可列举出利用柱色谱的精制;利用硅胶、活性炭、活性白土等的吸附精制;利用溶剂的重结晶、晶析法等公知的方法。另外,在这
些化合物的鉴定、分析中,能够进行核磁共振分析(nmr)、利用分光光度计的吸光度测定、紫外可见吸收光谱(uv-vis)测定、热重测定-差示热分析(tg-dta)等。这些分析方法也能够用于得到的化合物的溶解性、色彩评价、耐热性评价。
[0244]
本发明的化合物的溶解性用溶解度表示,溶解度表示物质能够在特定的溶剂中溶解的最大量的比例,例如用“质量%(溶剂名,温度)”等单位表示。就溶解度而言,例如,将试样在特定的溶剂中混合、在一定温度下将溶剂搅拌一定时间、对制备的饱和溶液的浓度进行测定,由此而得到,也通过利用溶解部的液相色谱(lc)、吸光度测定等的浓度测定而得到。
[0245]
通过进行本发明的化合物的热重测定-差示热分析(tg-dta),能够分析热分解温度,能够作为耐热性的指标。在着色组合物中,色素部分的化合物的热分解温度优选为250℃以上。在应用于滤色器的情况下,热分解温度越高越优选。
[0246]
通过将本发明的化合物与各种树脂溶液混合、在玻璃基板上涂布,能够制作涂膜。对于得到的涂膜,使用分光测色计来测色,得到涂膜的色彩值,由此能够进行色彩特性的评价。色彩值一般使用cie l
*a*b*
表色系等。具体地,测定膜试样的色彩值l
*
、a
*
、b
*
,根据适当的温度下的加热前后的色彩值的色差(δe
*ab
),能够判断耐热性。在应用于滤色器的情况下,能够使用230℃左右的温度下的色差作为耐热性的指标。就δe
*ab
而言,其值比比较对象越小,意味着热分解引起的颜色的变色越小,因此优选,更优选3以下。越为热分解引起的颜色的变色小的色素化合物,越能够得到着色力、鲜明性、色相等色彩特性优异的着色组合物、滤色器用着色剂。
[0247]
就滤色器用着色剂中所含有的着色组合物而言,由于色素化合物需要在树脂及有机溶剂中良好地溶解或者分散,因此这些着色组合物中所含有的化合物优选对于有机溶剂的溶解度高。作为有机溶剂,具体地,可列举出醋酸乙酯、醋酸正丁酯等酯类;二乙醚、丙二醇单甲基醚(pgme)等醚类;丙二醇单甲基醚乙酸酯(pgmea)等醚酯类;丙酮、环己酮等酮类;甲醇、乙醇等醇类;二丙酮醇(daa)等;苯、甲苯、二甲苯等芳香族烃类;n,n-二甲基甲酰胺(dmf)、n-甲基吡咯烷酮(nmp)等酰胺类;二甲基亚砜(dmso)等。这些溶剂可单独地使用,也可将2种以上混合使用。这些中,就本发明涉及的化合物而言,在pgme、pgmea中的溶解性优异,例如,室温25
±
2℃的温度范围(23~27℃之间的任一个温度)下的对于pgmea的溶解度(质量%)(溶剂pgmea,25
±
2℃)优选0.1质量%以上,更优选1质量%以上,特别优选2质量%以上。
[0248]
由通式(1)表示的化合物优选在溶液中的可见光区域例如350~700nm的范围的最大吸收波长在400~500nm的范围。
[0249]
本发明的着色组合物含有由通式(1)表示的本发明的化合物,可含有1种结构的化合物,也可含有2种以上的结构的化合物。在本发明中,化合物的结构优选为1种。
[0250]
就本发明的着色组合物而言,为了提高作为滤色器用着色剂的性能,作为化合物以外的成分,能够添加表面活性剂、分散剂、消泡剂、流平剂、其他滤色器用着色剂的制造时混合的添加剂等。不过,着色组合物中的这些添加剂的含有率优选为适量,优选为不使着色组合物的溶解性降低、或者不过度地使其提高、对滤色器制造不产生影响的范围的含有率。这些添加物能够以着色组合物的制备的任意的时机投入。
[0251]
本发明的滤色器用着色剂包含:含有由通式(1)表示的化合物的着色组合物、和在
滤色器的制造时一般使用的成分。就一般的滤色器而言,例如,在利用了光刻工序的方法的情况下,在玻璃、树脂等的基板上涂布将染料、颜料等色素与树脂成分(包含单体、低聚物、粘结剂成分、抗蚀剂成分)、溶剂混合而制备的液体,使用光掩模而使其光聚合,制作在溶剂中可溶/不溶的色素-树脂复合膜的着色图案,清洗后加热,由此得到。就本发明的化合物而言,由于溶解性优异,因此与这些在滤色器制造中使用的材料的分散性优异,因此能够根据需要与其他材料混合、制膜,进行耐热性、吸光特性的评价。另外,即使在电沉积法、印刷法中,也能够使用将色素与树脂、其他成分混合的产物来制作着色图案。因此,作为本发明的滤色器用着色剂中的具体的成分,可列举出由通式(1)表示的化合物、其他染料、颜料等色素、树脂成分、有机溶剂、及光聚合引发剂等其他添加剂。另外,可从这些成分中取舍选择,或者根据需要追加其他成分。
[0252]
在将本发明的着色组合物作为滤色器用着色剂来使用的情况下,能够作为黄色系滤色器来使用,也能够混合用于红色、绿色等其他颜色用的滤色器。另外,可单独使用本发明的着色组合物,为了调整色调,可混合其他染料或者颜料等公知的色素。例如,可列举出碱性染料;酸性染料;分散染料;螺酮染料;偶氮系、二偶氮系、喹啉系、芪系、(多)次甲基系、菁系、靛蓝系、酞菁系、蒽醌系、吖啶系、三芳基甲烷系、阴丹士林系、噁嗪系、二噁嗪系、萘酚as系、苯并咪唑酮系、吡唑啉酮系、苝系、苝酮系、喹吖啶酮系、异吲哚啉酮系、呫吨系、二酮基吡咯并吡咯系等的染料或者颜料等。
[0253]
就本发明的着色组合物及滤色器用着色剂中的其他色素的混合比而言,相对于由通式(1)表示的化合物,优选为5~2000质量%,更优选10~1000质量%。就液体的滤色器用着色剂中的染料等色素成分的混合比而言,相对于着色剂整体,优选为0.5~70质量%,更优选1~50质量%。
[0254]
作为本发明的着色组合物及滤色器用着色剂中的树脂成分,只要具有使用它们所形成的滤色器树脂膜的制造方式、使用时所需的性质,能够使用公知的树脂成分。例如,可列举出丙烯酸类树脂、烯烃树脂、苯乙烯树脂、聚酰亚胺树脂、氨基甲酸酯树脂、聚酯树脂、环氧树脂、乙烯基醚树脂、酚醛(酚醛清漆)树脂、其他透明树脂、光固化性树脂、热固化性树脂、粘结剂树脂、光致抗蚀剂树脂,能够将它们适当地组合来使用。另外,也能够将这些树脂的共聚物组合来使用。就这些滤色器用着色剂中的树脂的含量而言,在液体的着色剂的情况下,优选5~95质量%,更优选10~50质量%。
[0255]
作为本发明的着色组合物及滤色器用着色剂中的其他添加剂,可列举出光聚合引发剂、交联剂等树脂的聚合、固化所需的成分,另外,可列举出为了使液体的滤色器用着色剂中的成分的性质稳定所需的表面活性剂、分散剂等。这些均能够使用公知的物质,并无特别限定。在滤色器用着色剂的固体成分整体中的这些添加剂的总量的混合比优选5~60质量%,更优选10~40质量%。
[0256]
实施例
[0257]
以下,对于本发明的实施方式,通过实施例来具体地说明,但本发明并不限定于以下的实施例。应予说明,在合成实施例中,就化合物的鉴定而言,通过1h-nmr分析(bruker公司制造、ascend
tm 400)来进行。
[0258]
[合成实施例1]化合物(a-3)的合成
[0259]
在反应容器中放入8-氨基-2-甲基喹啉5.0g、1-碘丁烷23.3g、碳酸钾17.5g、
dmf10ml,在80℃下搅拌17小时。在反应液中放入水,用醋酸乙酯萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:二氯甲烷/庚烷=1/3(体积比)),得到8-(n,n-二丁基氨基)喹哪啶(7.6g、收率89%)。
[0260]
接着,在反应容器中放入上述得到的8-(n,n-二丁基氨基)喹哪啶7.1g、偏苯三酸酐3.9g、苯甲酸2.5g、1,2,4-三氯苯16ml,在180℃下搅拌8小时。冷却到25℃后,在反应液中放入甲苯20ml,过滤,得到下述中间体(100)(8.2g、收率90%)。
[0261]
【化36】
[0262][0263]
接着,在反应容器中放入上述得到的中间体(100)5.7g、n,n
’‑
二乙基-1,6-二氨基己烷1.1g、三乙胺2.6g、dmf33ml、1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐(hatu)6.1g,在25℃下搅拌5小时。在反应液中放入水,用二氯甲烷萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:二氯甲烷/醋酸乙酯=3/1(体积比)),得到黄色粉末(a-3)(5.2g、收率79%)。
[0264]
进行得到的黄色粉末的nmr测定,检测出以下的76个氢的信号,鉴定为由下述式(a-3)表示的化合物的结构。
[0265]1h-nmr(400mhz、cdcl3):δ(ppm)=14.40(2h)、8.12(2h)、8.22(2h)、7.64-7.85(4h)、7.48-7.64(6h)、7.42(2h)、3.10-3.80(16h)、1.00-1.90(30h)、0.80-1.00(12h)。
[0266]
【化37】
[0267][0268]
[合成实施例2]化合物(a-4)的合成
[0269]
在反应容器中放入8-氨基-2-甲基喹啉8.0g、三乙胺6.7g、二氯甲烷64ml,用冰浴冷却到5℃以下。慢慢地放入2,4,6-三甲基苯甲酰氯13.8g,在25℃下搅拌7小时。在反应液中放入水,用二氯甲烷萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:庚烷/二氯甲烷/醋酸乙酯=10/3/1(体积比))。在反应液中放入庚烷,过滤,得到n-(2,4,6-三甲基苯甲酰基)-8-氨基喹哪啶(11.8g、收率77%)。
[0270]
接着,在反应容器1中放入氢化钠2.5g、脱水dmf48ml,用冰浴冷却到5℃以下。在另外的反应容器2中,制备将上述的n-(2,4,6-三甲基苯甲酰基)-8-氨基喹哪啶9.5g用脱水dmf48ml溶解的溶液。将该反应容器2的溶液慢慢地滴入到反应容器1中,在25℃下搅拌2小时。放入1-碘丙烷6.9g,在25℃下搅拌2小时。在反应液中放入二氯甲烷150ml,慢慢滴入水150ml,用二氯甲烷萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:二氯甲烷/庚烷=1/1(体积比)),得到n-(2,4,6-三甲基苯甲酰基)-n-丙基-8-氨基喹哪啶(10.0g、收率93%)。
[0271]
接着,在反应容器中放入上述的n-(2,4,6-三甲基苯甲酰基)-n-丙基-8-氨基喹哪啶9.4g、偏苯三酸酐4.0g、苯甲酸2.5g、1,2,4-三氯苯16ml,在180℃下搅拌8小时。冷却到25℃后,在反应液中放入甲苯40ml,过滤,得到下述中间体(101)(8.0g、收率74%)。
[0272]
【化38】
[0273][0274]
接着,在反应容器中放入上述中间体(101)4.5g、n,n
’‑
二乙基-1,6-二氨基己烷0.8g、三乙胺1.8g、dmf23ml、hatu4.1g,在25℃下搅拌6小时。在反应液中放入水,用二氯甲烷萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:二氯甲烷/醋酸乙酯=3/1(体积比)),得到黄色粉末(a-4)(4.4g、收率92%)。
[0275]
进行得到的黄色粉末的nmr测定,检测出以下的76个氢的信号,鉴定为由下述式(a-4)表示的化合物的结构。
[0276]1h-nmr(400mhz、cdcl3):δ(ppm)=14.00-14.60(2h)、8.60-8.80(2h)、8.25-8.50(1h)、7.98-8.20(2h)、7.50-7.90(6h)、7.30-7.43(2h)、7.10-7.25(3h)、6.90-7.08(2h)、6.72(1h)、6.41(1h)、5.10(1h)、3.10-3.80(10h)、2.80(6h)、2.60-2.72(2h)、2.48(4h)、2.35(2h)、2.09(2h)0.95-2.05(24h)、0.80-0.90(1h)、0.81(2h)。
[0277]
【化39】
[0278][0279]
[合成实施例3]比较例化合物(b-1)的合成
[0280]
在反应容器中放入用与上述合成实施例1同样的方法(除了将中间体(100)的二丁基氨基替换为二丙基氨基以外,为同样的方法)得到的下述中间体(102)2.0g、n,n
’‑
二丁基胺0.7g、三乙胺0.8g、dmf10ml、hatu1.9g,在25℃下搅拌2小时。在反应液中放入水,用二氯甲烷萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:二氯甲烷/醋酸乙酯=3/1(体积比)),得到黄色粉末(b-1)(1.7g、收率70%)。
[0281]
【化40】
[0282][0283]
进行得到的黄色粉末的nmr测定,检测出以下的41个氢的信号,鉴定为由下述式(b-1)表示的化合物的结构。
[0284]1h-nmr(400mhz、cdcl3):δ(ppm)=14.00(1h)、8.76(1h)、8.12(1h)、7.67-7.81(2h)、7.50-7.60(3h)、7.43(1h)、3.52(2h)、3.10-3.30(6h)、1.62-1.75(2h)、1.40-1.58(8h)、1.16(2h)、1.01(3h)、0.88(6h)、0.80(3h)。
[0285]
【化41】
[0286][0287]
[合成实施例4]比较例化合物(b-2)的合成
[0288]
在反应容器中放入上述中间体(101)5.0g、n,n
’‑
二丁基胺1.6g、三乙胺1.9g、dmf50ml、hatu4.8g,在25℃下搅拌2小时。在反应液中放入水,用二氯甲烷萃取。将萃取液减压浓缩,用柱色谱法进行精制(载体:硅胶、溶剂:二氯甲烷/醋酸乙酯=3/1(体积比)),得到黄色粉末(b-2)(5.0g、收率83%)。
[0289]
进行得到的黄色粉末的nmr测定,检测出以下的45个氢的信号,鉴定为由下述式(b-2)表示的化合物的结构。
[0290]1h-nmr(400mhz、cdcl3):δ(ppm)=14.00-14.60(1h)、8.60-8.80(1h)、7.98-8.16(1h)、7.62-7.84(3h)、7.48-7.62(2h)、7.10-7.40(1h)、6.40-7.05(2h)、5.10(0.5h)、3.40-3.80(2.5h)、3.10-3.30(3h)、2.69(1h)、2.48(3h)、2.36(1h)、2.10(1h)、1.30-2.00(12h)、0.68-1.25(10h)。
[0291]
【化42】
[0292][0293]
[实施例1]
[0294]
对于合成实施例1中得到的化合物(a-3),测定室温下的pgmea溶剂中的溶解度(质量%)(溶剂pgmea,25
±
2℃)。予以说明,溶解性以测定的溶解度的值为基础,用下述的4个等级来评价。将结果示于表1中。
[0295]
“◎”
:溶解度2质量%以上
[0296]
“○”
:1质量%以上且不到2质量%
[0297]
“△”
:0.1质量%以上且不到1质量%
[0298]
“×”
:不到0.1质量%
[0299]
将甲基丙烯酸、丙烯酸酯及苯乙烯的共聚物的2质量%dmf-pgmea混合溶液5.0g和合成实施例1中得到的化合物(a-3)20mg放入样品瓶中,搅拌混合30分钟。在玻璃基板上涂布得到的着色树脂溶液,在100℃下加热2分钟而制膜。对于得到的膜,使用分光测色计(柯尼卡美能达株式会社制造、cm-5)测定色彩值。然后,在230℃下进行2次20分钟加热,同样地测定色彩值。将230℃下的加热前后的色彩值的色差(δe
*ab
)作为耐热性的指标,将结果一
并示于表1中。
[0300]
[实施例2]
[0301]
作为化合物,代替(a-3)而使用合成实施例2中得到的化合物(a-4),除此以外,采用与实施例1同样的方法测定室温下的在pgmea溶剂中的溶解度(质量%)(溶剂pgmea,25
±
2℃),另外,对于制膜的膜,测定230℃下的加热前后的色彩值的色差(δe
*ab
)并评价。将结果汇总示于表1中。
[0302]
[比较例1及比较例2]
[0303]
作为化合物,代替(a-3)而使用作为不属于本发明的色素化合物的、合成实施例3及4中得到的化合物(b-1)及(b-2),除此以外,与实施例1同样地测定了室温下的在pgmea溶剂中的溶解度(质量%)(溶剂pgmea,25
±
2℃)。另外,对于制膜的膜,测定230℃下的加热前后的色彩值的色差(δe
*ab
)并评价。将结果汇总示于表1中。
[0304]
【表1】
[0305] 化合物溶解度色差实施例1(a-3)
◎
1.9实施例2(a-4)
◎
2.2比较例1(b-1)
◎
2.7比较例2(b-2)
◎
3.8
[0306]
如表1中所示,本发明的实施例的化合物显示出在pgmea中的高溶解性及制膜时的高耐热性,就含有本发明的化合物的着色组合物而言,作为滤色器用着色剂在实用上没有问题。另外,在制膜时具有比比较例高的耐热性,作为滤色器用着色剂优异。
[0307]
产业上的可利用性
[0308]
就含有本发明涉及的化合物(黄色系化合物)的着色组合物而言,在有机溶剂(pgmea等)中的溶解性优异,且制膜时的耐热性优异,因此可用作滤色器用着色剂等各种用途的色素材料。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。