1.本实用新型的实施例属于大分子物质跨膜运输领域,具体地说,是一种细胞膜射流穿孔装置、大分子物质跨膜传导系统。
背景技术:
2.细胞重编程是细胞生物学领域的一项关键技术,在再生医药、疾病模型和药物筛选等方面有着广泛应用。以往的研究表明,诱导多功能干细胞可由特定转录因子的异位表达使躯体干细胞发生细胞重编程得到。基因递送技术通过将目的基因导入细胞,也可以诱导细胞重编程发生。
3.实现基因跨细胞递送主要有生物方法、物理方法和力学方法。生物方法包括基因转化、接合和转导等。物理方法包括显微注射、粒子轰击、基因枪、电穿孔和光学方法等。目前,应用比较广泛的递送方法是病毒转导。病毒载体能保证诱导多功能干细胞中转基因的稳定表达,但其存在发生肿瘤等生物安全性方面的风险。一些学者因而致力于利用蛋白质诱导得到多功能干细胞的研究。蛋白质导入细胞常见方法之一是电穿孔。该方法产生电渗透作用的同时,可能会随机地使细胞膜发生破裂而导致细胞死亡,而且转染范围也受到电场方向的限制。因此,现有的生物、物理方法,或者可能会对细胞造成永久性损坏,甚至死亡;或者由于病毒转染和基因插入使得细胞发生癌变可能而存在生物安全性方面的隐患;或者因只能适用于少数种类或者少数数量的细胞等原因而被限制其广泛应用。
4.然而,运用力学方法,可使细胞膜发生变形,可以引起物质跨细胞膜输运,同时在生物安全性方面具有一定的优势。通过精确地控制细胞膜的受力,有可能实现高效的物质输运,并保证细胞的存活率。麻省理工大学提出了细胞挤压技术,即驱使细胞通过小于其直径30%—80%的收缩通道,使其受到挤压发生变形,促使细胞膜上力敏通道打开。目前的研究已证实该方法可运用于很多种类的细胞,具有应用的广泛性。但发明人发现,目前采用该细胞挤压技术存在两个因素制约其发展,其一,对细胞中的物质进行跨膜运输,压缩通道的直径约为数微米,对微制造工艺提出了很高要求;其二,同种类型的细胞尺寸大小不一,尺寸稍大的细胞可能阻塞通道,而尺寸稍小的细胞可能变形不够,导致输运效率降低。
5.因此,如何能够运用更好的力学方式,实现大分子物质的跨膜运输是目前所要解决的问题。
技术实现要素:
6.为了解决上述问题或至少部分地解决上述技术问题,本实用新型的部分实施方式中,设计了一种细胞膜射流穿孔装置、大分子物质跨膜的传导系统,可使细胞在受到外力作用下,可实现大分子物质的跨膜运输。
7.为了实现上述目的,本实用新型的部分实施方式提供了一种细胞膜射流穿孔装置,包括:
8.细胞导入流动腔;所述细胞导入流动腔具有:入口、远离所述入口设置的出口、设
置于所述入口和所述出口之间的输送孔;
9.细胞捕获腔,与所述细胞导入流动腔连通;所述细胞捕获腔用于捕获从所述入口进入所述细胞导入流动腔内的细胞;
10.射流装置,向所述细胞捕获腔提供射流,使被吸入至所述细胞捕获腔内的所述细胞的细胞膜形成至少一个微孔。
11.另外,本实用新型的实施方式设计了一种大分子物质跨膜的传导系统,包括:如上所述的细胞膜射流穿孔装置。
12.本实用新型的实施例相对于现有技术而言,由于细胞膜射流穿孔装置包括:细胞导入流动腔、细胞捕获腔和射流装置。在实际应用时,基于变截面管道漩涡原理,使得从入口进入细胞导入流动腔内的细胞,可顺着流场漩涡进入细胞捕获腔中,从而被细胞捕获腔捕获。然后,通过射流装置对细胞捕获腔内提供射流,细胞在捕获腔受到射流冲击产生的流场剪切力作用,产生巨烈的变形,细胞膜上会形成一个或多个微孔,此时溶液中的大分子物质通过微孔进入细胞,而在完成射流后,细胞膜微孔自行愈合,可利用负压,从出口获取细胞捕获腔内的细胞。由此不难看出,当此装置将流场剪切力控制在适当的范围内,可以使得细胞膜上开设一个或多个微孔,在最大限度降低细胞损伤的情况下,实现了大分子物质的跨膜运输。
13.另外,所述细胞捕获腔的底部具有射流进口;所述射流装置包括:
14.射流发生腔,与所述射流进口连接;所述射流发生腔相对于所述射流进口的一侧为不封闭的,形成开口,所述开口与所述射流进口面同轴设置;
15.振动部件,设置于所述射流发生腔相对于所述射流进口的一侧,封闭所述开口;
16.驱动部件,与所述振动部件连接;所述驱动部件用于驱动所述振动部件沿所述射流进口的轴线方向产生振动。
17.另外,所述射流发生腔相对于所述射流进口的一侧,有部分沿所述射流进口的轴线方向凸出,形成与所述射流进口连接的射流管道。
18.另外,所述射流管道远离所述射流进口的一端为锐缘形。
19.另外,所述开口、所述射流管道和所述射流进口同轴设置。
20.另外,所述振动部件为振动膜;
21.或者,所述振动部件为振动块。
22.另外,所述驱动部件为压电驱动部件;
23.或者,所述驱动部件为具有力学性能的驱动部件。
24.另外,所述细胞捕获腔和所述射流装置构成一细胞射流穿孔模块;
25.所述细胞导入流动腔自所述入口至所述出口的方向,设有若干所述细胞射流穿孔模块;各所述细胞射流穿孔模块的所述细胞捕获腔,均与所述细胞导入流动腔连通。
26.另外,各所述细胞捕获腔均沿所述细胞导入流动腔的所述入口至所述出口的方向,同侧依次设置;
27.或者,各所述细胞捕获腔均沿所述细胞导入流动腔的所述入口至所述出口的方向,两两相对设置。
附图说明
28.为了更清楚地说明本技术实施方式或现有技术中的技术方案,下面将对实施方式或现有技术描述中所需要使用的附图作简单介绍。显而易见地,下面描述中的附图仅用于示意本技术的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图中未提及的技术特征、连接关系乃至方法步骤。
29.图1为本实用新型的实施例一的细胞膜射流穿孔装置的结构示意图;
30.图2为本实用新型的实施例一中射流装置与细胞捕获腔的装配时,射流管道的内表面为锥面时的示意图;
31.图3为本实用新型的实施例一中,射流装置增加柔性环时,与细胞捕获腔的装配示意图;
32.图4为本实用新型的实施例一的细胞膜射流穿孔装置系统模块框图;
33.图5为本实用新型的实施例二中,各细胞捕获腔在细胞导入流动腔上同侧设置时的结构示意图;
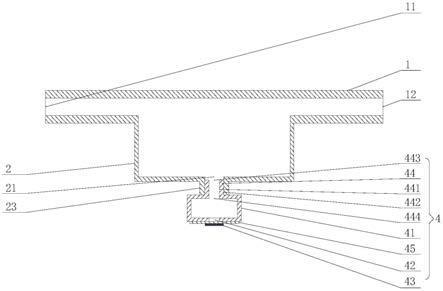
34.图6为本实用新型的实施例二中,各细胞捕获腔在细胞导入流动腔上两两相对设置时的结构示意图。
具体实施方式
35.为使本技术实施例的目的、技术方案和优点更加清楚,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例是本技术一部分实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本技术保护的范围。
36.实施例一
37.本实用新型的第一实施方式提供一种细胞膜射流穿孔装置,如图1所示,包括:细胞导入流动腔1、细胞捕获腔2和射流装置4。
38.其中,如图1所示,首先,细胞导入流动腔1具有:入口11、远离入口11设置的出口12,使细胞在流动细胞导入流动腔1内得以充分发展。其次,细胞捕获腔2位于入口11和出口12之间,并与细胞导入流动腔1连通。使细胞在通过气流从入口11进入细胞导入流动腔1的过程中,利用变截面管道漩涡原理,使细胞可顺着气流的流场进入被细胞捕获腔2内,被细胞捕获腔捕获。
39.另外,如图1所示,在本实施方式中,射流装置4向细胞捕获腔2提供射流,使被吸入至细胞捕获腔2内的细胞的细胞膜形成至少一个微孔。
40.最后,利用负压,可从细胞导入流动腔1的出口12获取细胞捕获腔2内的细胞。
41.通过上述内容不难看出,通过本实施方式的穿孔装置对细胞膜进行力学穿孔,使得从细胞导入流动腔1的出口12吸出的细胞的细胞膜上均可形成一个或多个微孔,此时溶液中的大分子物质在外力作用下可通过微孔进入细胞,而在完成射流后,细胞膜微孔自行愈合,此时,又可利用负压,从出口获取细胞捕获腔内的细胞,从而实现了大分子物质的跨膜运输。
42.具体地说,在本实施方式中,如图1所示,细胞捕获腔2的底部具有射流进口21。并且,射流装置4包括:射流发生腔41、振动部件45和驱动部件。其中,射流发生腔41与射流进
口21连接,同时,射流发生腔41相对于射流进口21的一侧为不封闭的,形成开口42,该开口42与射流进口21同轴设置。另外,振动部件45设置于射流发生腔41相对于射流进口21的一侧,振动部件45封闭开口42。需要说明的是,在本实施方式中,该振动部件45可与射流发生腔41相对于射流进口21的一侧采用可拆卸的连接方式进行固定,比如:采用锁紧件将振动部件45锁紧在射流发生腔41上。最后,驱动部件与振动部件连接,该驱动部件用于驱动振动部件沿射流进口21的轴线方向产生振动。
43.在实际应用时,结合图1所示,振动部件45可采用金属膜,同时,驱动部件可采用压电驱动部件,并且,在本实施方式中,该压电驱动部件为贴附于振动部件45背离射流发生腔41一侧的压电陶瓷片43,当射流装置4开始工作时,可向压电陶瓷片43上施加周期性变化的电压信号,从而使得压电陶瓷片43可驱动振动部件45沿射流进口21的轴线方向产生高频振动,此时,射流发生腔41内的液体受到压缩,并通过细胞捕获腔2的射流进口21排出至细胞捕获腔2内。需要说明的是,本实施方式中的压电驱动部件仅以压电陶瓷片43为例进行说明,而在实际应用时,压电驱动部件也可采用其他具有压电效应的部件,而在本实施方式中,对压电驱动部件的类型不作具体限定。
44.此外,作为一种替换方案,驱动部件也可采用具有力学性能的驱动部件,比如:注射器,通过注射器来推动振动部件45产生高频振动,同样可使射流发生腔41内的液体受到压缩,以实现向细胞捕获腔2提供射流。并且,需要说明的是,本实施方式中所提到的振动部件45可以采用振动薄膜,例如:金属薄膜、硅片薄膜、塑料薄膜等。或者,振动部件45也可采用振动块,而在本实施方式中,不对振动部件45的类型作具体限定。
45.另外,为了能够使射流发生腔41内的液体在射向细胞捕获腔2内时产生强大的冲击流,结合图2所示,射流发生腔41相对于射流进口21的一侧,有部分沿射流进口21的轴线方向凸出,形成与射流进口21连接的射流管道44。并且,通过图1不难看出,该射流管道44为狭长型的结构设计,使得射流管道44的内径极小,因此,当射流发生腔41内的液体在射向细胞捕获腔2内的过程中,射流通过射流管道44进入细胞捕获腔2内时,可形成剧烈的冲击使流场发生剧烈的涡旋,使细胞捕获腔2内的细胞受到强烈的流场剪切力,从而在细胞膜上形成一个或多个微孔,以满足细胞后续的大分子颗粒的跨膜运输需求。并且,需要说明的是,在本实施方式中,射流管道44与细胞捕获腔具有射流进口21的一侧之间,采用的是可拆卸地连接方式进行固定,比如,如图1所示,细胞捕获腔2具有射流进口21的一侧,有部分可沿射流进口21的轴线方向凸出,形成一与射流管道44连接的管接头23,并且该管接头23为一具有内螺纹(图中未标示)的螺纹接头,而射流管道44绕其轴线方向具有:内表面441、与内表面441相对的外表面442,并且,射流管道44的外表面442设有可与管接头23的内螺纹旋合的外螺纹(图中未标示),从而使得射流管道44与管接头23之间为螺纹旋合的连接方式。当然,作为一种替换方案,在部分实施方式中,射流管道44与细胞捕获腔2具有射流进口21的一侧之间,也可采用焊接连接的方式进行固定,而在本实施方式中,不对射流管道44与细胞捕获腔2之间的连接方式作具体限定。或者,在部分实施方式中,细胞捕获腔2、射流发生腔41和射流管道44也可为一个整体。
46.并且,在部分实施例中,射流管道44远离射流进口21的一端为锐缘形,即射流管道44的内表面441的进口侧444处形成锋利的倒角,因此,可进一步加速对气流的切割,使得细胞捕获腔2内的细胞受到漩涡流的剪切力更大。而作为优选地方案,如图2所示,射流管道44
的内表面441自远离射流进口21的一端至另一端的方向,逐渐扩张延伸形成,使得整个射流管道44的内表面441为一锥面结构,内部近似一锥形通道。因此,当细胞捕获腔2内的液体在通过射流管道44射入细胞捕获腔2内时,细胞捕获腔2受到气流影响的范围更大,从而能够进一步提高对细胞的剪切效果。同时,值得注意的是,当射流管道44与射流进口21之间采用管接头23的方式实现螺纹连接时,可适当延长射流管道44的长度,如图3所示,使得射流管道44能够的出口侧443可与射流进口21处于同一平面,或者,射流管道44也可有部分穿过射流进口21,使射流管道44的出口侧443直接进入细胞捕获腔2的内部,同时,如图3所示,射流管道44的出口侧443沿射流管道44的轴线方向还设有柔性环6,且柔性环6与射流管道44相连的一侧至另一侧的方向逐渐扩张弯曲延伸形成。由此不难看出,借助柔性环6的柔软特性,使得射流管道44在与管接头23对接时,柔性环6可轻松被挤入管接头6内,而当柔性环6在跟随射流管道44的出口侧443进入细胞捕获腔2的内部后,柔性环6又可直接利用自身的回弹特性迅速撑开恢复至初始状态,并可抵接在细胞捕获腔2的射流进口21的周缘部位,使得射流管道44在完成与管接头23的对接后,射流管道44不易被转动,在提高射流管道44与管接头23连接牢固性的同时,借助柔性管6的扩张结构,可进一步提高气流进入细胞捕获腔2时的导向性能,使细胞捕获腔2受到气流影响的范围更广。
47.另外,值得注意的是,通过图1和图4所示,在本实施方式中,射流发生腔41的开口42、射流管道44和射流进口21同轴设置,但作为一种优选地方案,射流发生腔41的开口42、射流管道44和射流进口21可均沿细胞捕获腔2的中轴线方向同轴设置,从而使得从射流发生腔41射出的气流可直接通过射流管道44进入细胞捕获腔2内,同时,保证了进入细胞捕获腔2内的细胞可在旋涡流的作用下,绕细胞捕获腔2的中轴线方向不断盘旋,有效防止了细胞出现贴壁现象,使得细胞能够更好的受到旋涡流的剪切力,从而提高了细胞膜穿孔的成功率。
48.此外,需要说明的是,为了能够对射流速度进行精确控制,本实施方式的细胞膜射流穿孔装置还包括:与细胞导入流动腔1的入口11连接的第一注射器(图中未标示)、与细胞导入流动腔的出口12连接的第二注射器(图中未标示),细胞可在第一注射器的推力作用下,借助气压从入口11被推入细胞导入流动腔1中,而在取出细胞时,又可通过第二注射器从出口12吸出位于细胞捕获腔2内的细胞。当然,在实际应用时,也可通过分离细胞导入流动腔1和细胞捕获腔2的方式,取出细胞。同时,为了对射流装置4射出的流体的剪切力进行精确控制,如图4所示,本实施方式的细胞膜射流穿孔装置还包括:主控模块,并且,该主控模块与向射流装置4的压电陶瓷片43施加电压信号的供电装置通讯连接,使得供电装置均可在主控模块的控制下工作,从而达到对流体剪切力的精确控制。
49.实施例二
50.本实用新型的第二实施方式提供了一种细胞膜射流穿孔装置,第二实施方式是在第一实施方式的基础上作了进一步改进,其主要改进在于,如图5和图6所示,在本实施方式中,细胞导入流动腔和驱动射流装置构成一细胞射流穿孔模块,并且,细胞导入流动腔1自入口11至出口12的方向,设有若干细胞射流穿孔模块,并且,各细胞射流穿孔模块的细胞捕获腔2均与细胞导入流动腔1连通。
51.通过上述内容不难看出,通过设置多个细胞射流穿孔模块,可满足高通量大分子物质的运输需求。
52.具体地说,在本实施方式中,如图5所示,各细胞捕获腔2均沿细胞导入流动腔1的入口11至出口12的方向,同侧依次设置,即各细胞获取2均设置在细胞导入流动腔的同一侧。当然,也可以如图6所示,各细胞捕获腔2均沿细胞导入流动腔1的入口至出口12的方向,两两相对设置。
53.并且,需要说明的是,在本实施方式中,各细胞捕获腔2仅以上述两种设置方式为例进行说明,而在实际使用过程中,各细胞捕获腔2也根据细胞的输送需求,在细胞导入流动腔1上采用其他的设置方式,而再此不在一一赘述。
54.实施例三
55.本实用新型的第三实施方式提供一种大分子物质跨膜的传导系统,包括:如第一或第二实施方式所述的细胞膜射流穿孔装置。
56.由于本实施方式的传导系统中包括了第一或第二实施方式中所述的细胞膜射流穿孔装置,通过该穿孔装置对细胞膜的穿孔,细胞在受到流场剪切力作用时发生剧烈变形,在细胞膜上形成一个或多个微孔,细胞外大分子物质可直接通过细胞膜上的微孔,从而在最大限度降低细胞损伤的情况下,实现了高通量细胞大分子物质的跨膜运输。
57.最后应说明的是,本领域的普通技术人员可以理解,为了使读者更好地理解本技术,本技术的实施方式提出了许多技术细节。但是,即使没有这些技术细节和基于上述各实施方式的种种变化和修改,也可以基本实现本技术各权利要求所要求保护的技术方案。因此,在实际应用中,可以在形式上和细节上对上述实施方式作各种改变,而不偏离本技术的精神和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。