一种脂肪间充质干细胞的外泌体rna提取方法
技术领域
1.本发明涉及生物技术领域,具体而言,涉及一种脂肪间充质干细胞的外泌体rna提取方法。
背景技术:
2.脂肪间充质干细胞具有多向分化潜能、能支持造血和促进造血干细胞植入、调节免疫以及分离培养操作简便等特点,正日益受到人们的关注。随着脂肪间充质干细胞培养及其相关技术的日益成熟,临床研究已经在许多国家开展。而外泌体作为活细胞分泌的、参与细胞间调控、且携带遗传物质及大分子蛋白等多种活性因子的物质,人体树突状细胞(dcs)和t淋巴细胞(t细胞),都可以轻松吸收和分泌外泌体,细胞间还可以通过外泌体携带的rna交换遗传物质。因此,在研究上外泌体也被视为是未来医学的关键突破点。对于脂肪间充质干细胞的外泌体的研究将被用于治疗机体无法自然修复的组织细胞和器官损伤的多种难治性疾病;而且由于外泌体同样具有一些蛋白参与抗原呈递,结合抗原多肽,并参与将多肽装载到组织相容性复合物mhc上等特性,因此它可以作为免疫调节因子,用于治疗免疫排斥和自身免疫性等疾病。
3.对外泌体的遗传物质进一步的研究,可以通过脂质体包裹基因技术,以基因载体的形式,通过分子技术手段注射到细胞组织中,完成释放相应基因到指定位点,进行基因转录,调控蛋白表达进行分析研究。当然,这些试验的基础必须是以能够充分、准确地提取出间充质干细胞中外泌体的rna为前提的。
4.要想研究间充质干细胞的外泌体的遗传物质或者内部代谢是否具有与别不同之处,就需要将外泌体打开,提取出外泌体的rna和相应物质进行具体研究,但现有技术多是针对外泌体本身的提取,而外泌体内的小rna以及与疾病相关抗原和抗体等的提取还是很少报道,其中一部分原因是由于外泌体的提取存在纯度不够,杂蛋白太多的困扰,另外,还有外泌体本身特殊的外层结构,使得裂解困难,遗传物质提取的纯度和量都受到影响。
5.有关外泌体的提取,由于外泌体直径大小接近病毒,相应的,其沉降系数可以清楚的将其与其他大分子物质区分开来,依据这一特性,目前主要以差速离心作为主要分离手段,再辅以聚合物沉淀、密度梯度、磁珠、过滤等化学或物理分离手段来增加外泌体提取的量和纯度,但提取花费的时间长,且对需要使用的设备要求也高,而目前市场上外泌体提取试剂盒价格也十分昂贵,对于这一技术的应用和推广造成了巨大阻力。而外泌体的rna提取,目前也多是在细胞rna提取方法上进行的改进,或仿照细菌裂解,在提取过程中辅以超声,或改变提取液的配比,主要目的均是想最大程度的将外泌体的外膜充分裂解,从而释放出遗传物质来,但同样存在设备要求高以及过程繁琐的问题。而常用的提取液trizol,主要成分是异硫氰酸胍,裂解组织的同时也使rna酶失活。它既可破坏细胞结构使核酸从核蛋白中解离出来,又对rna酶有强烈的变性作用。然而无论是动物、植物来源的组织还是细菌组织,trizol法对少量的组织(50~100mg)和细胞(5
×
106)以及大量的组织(≧1g)均有较好的分离效果,但是对于外泌体这种直径堪比病毒的物质其作用效果实则有待考证。
技术实现要素:
6.本发明的目的在于提供一种脂肪间充质干细胞的外泌体rna提取方法,为了更加快速便捷的从脂肪间充质干细胞外泌体中提取rna,为今后的研究提供稳定可靠的技术和数据支持。
7.本发明解决其技术问题是采用以下技术方案来实现的。
8.本发明提供了一种脂肪间充质干细胞的外泌体rna提取方法。主要包括以下步骤:培养脂肪间充质干细胞,收集细胞培养液;将细胞培养液差速离心,收集上清液,向上清液中先后加入(nh4)2so4和peg 6000静置反应进行沉淀,静置后超速离心,获得外泌体;将得到的外泌体通过磁珠法提取,得到外泌体的rna。
9.相对于现有技术,本发明的实施例至少具有如下优点或有益效果:
10.本发明提供的脂肪间充质干细胞外泌体的rna提取方法,通过特定的方法收集脂肪间充质干细胞培养液中的外泌体后进行了rna的提取,整个过程所采用的试剂价格便宜,所使用的方法步骤简明,整个过程所花费时间相对原有提取技术表现为大幅度降低,节约了成本。
具体实施方式
11.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
12.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
13.本技术提供了一种脂肪间充质干细胞培养的外泌体rna提取方法。主要包括以下步骤:培养脂肪间充质干细胞,收集细胞培养液;将细胞培养液差速离心,收集上清液,向上清液中先后加入(nh4)2so4和peg 6000静置反应进行沉淀,静置后超速离心,获得外泌体;将得到的外泌体通过磁珠法提取,得到脂肪间充质干细胞的外泌体rna。
14.在本发明的实施例中,上述脂肪间充质干细胞的培养液收集时间为细胞传代后48~96h,本发明所用的脂肪间充质干细胞为p3~p6的脂肪间充质干细胞。
15.在本发明的实施例中,脂肪间充质干细胞的外泌体rna提取方法中步骤(2)的主要目的是对脂肪间充质干细胞的外泌体进行提取,首先,采用盐析法对大分子蛋白进行先一步沉淀,其中所使用的(nh4)2so4的浓度为0.2~0.4m,而弃去大分子蛋白聚合物沉淀后,通过聚合物沉淀法进一步对收集的上清进行进一步沉淀收集纯化后的外泌体,其中所采用peg6000的目标体积百分浓度为4%~6%。
16.在本发明的实施例中,步骤(2)中对脂肪间充质干细胞培养液上清中外泌体提取时,先行进行大分子蛋白沉淀所用的(nh4)2so4加入后静置反应的时间10~15min;
17.在本发明的实施例中,步骤(2)中对脂肪间充质干细胞培养液上清中外泌体提取时,弃去大分子蛋白沉淀后,进一步对上清中的外泌体进行进一步沉淀收集所采用peg 6000加入后静置反应的时间为4~6h。
18.在本发明的实施例中,步骤(2)中对脂肪间充质干细胞培养液上清中外泌体提取
时,其中首先进行的差速离心具体条件为先500g离心10min,后15000g离心20min,加入(nh4)2so4静置反应后超速离心的具体条件为10000g离心5min,随后加入peg 6000静置反应后超速离心的具体条件为15000g离心30~60min。
19.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取步骤具体为:外泌体裂解;将步骤(2)中获得的外泌体裂解、加入磁珠缓冲液吸附、离心并除杂后得到脂肪间充质干细胞的外泌体rna。
20.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取时,在外泌体裂解过程中,外泌体与rnaiso plus的比例为5
×
106~1
×
107个:1ml,磁珠缓冲液吸附的过程中,裂解液和磁珠缓冲液的比例为200μl:50μl。
21.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取时,其中磁珠法提取的具体步骤为,将制备好的外泌体裂解液转移至1.5ml离心管中,室温静置5min,加入50μl磁珠缓冲液,振荡混匀后,静置反应3~5min,随后放在磁力架上吸附。
22.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取时,除杂时所选用的试剂为氯仿和异丙醇,上述氯仿的使用剂量为200μl,上述异丙醇的使用剂量为500μl。
23.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取时,上述氯仿的静置反应时间为5min。
24.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取时,上述异丙醇的静置反应时间为10min。
25.在本发明的实施例中,步骤(3)中对所得到的脂肪间充质干细胞培养液中外泌体的rna进行提取时,上述氯仿静置后超速离心的具体条件为12000g离心15min,上述异丙醇静置后超速离心的具体条件为12000g离心10min。
26.以下结合实施例对本发明的特征和性能作进一步的详细描述。
27.实施例1
28.本实施例的目的在于培养脂肪间充质干细胞,收集细胞培养液。
29.1、材料
30.脂肪间充质干细胞(该细胞为预先冻存的p1~p3人脂肪间充质干细胞,并已验证其在p3~p6可稳定传代)、pbs、edta、胰酶(trypsin)、胎牛血清。
31.2、细胞培养
32.2.1、细胞复苏
33.(1)从液氮容器中取出冻存管,直接浸入37℃温水中,并不时摇动令其尽快融化;
34.(2)从37℃水浴中取出冻存,打开盖子,用吸管吸出细胞悬液,加到离心管并滴加10倍以上培养液,混匀;
35.(3)离心,800g,5min;
36.(4)弃去上层清液,加入含10%胎牛血清培养液重悬细胞,吸取10μl计数,调整细胞密度,接种培养瓶,37℃,5%co2,饱和湿度的co2培养箱静置培养;
37.(5)48小时后更换一次培养液,继续培养;
38.(6)显微镜下观察细胞密度,当细胞密度达到90%,开始传代培养。
39.2.2、细胞传代
40.(1)将前述步骤(6)中的细胞弃去培养液,用3ml pbs(不含钙,镁离子)洗1~2次;
41.(2)加1ml消化液(0.25%trypsin-0.53mm edta)于t25培养瓶中,倒转放于37
°
培养箱1~3分钟预热,然后又将培养瓶倒转大约30秒后,在倒置显微镜下观察细胞消化情况,消化至细胞大部分变圆分散,轻敲几下培养瓶,细胞随即脱落下来;
42.(3)加入6~8ml完全培养基,离心除去培养基,然后重新加入新的培养基分装至新的培养瓶中,收集48~96h的细胞培养上清液,备用。
43.实施例2
44.本实施例的目的在于从脂肪间充质干细胞培养液中分离提纯出外泌体。
45.1、材料
46.实施例1中培养的脂肪间充质干细胞中收集的上清液;peg 6000;(nh4)2so4;pbs。
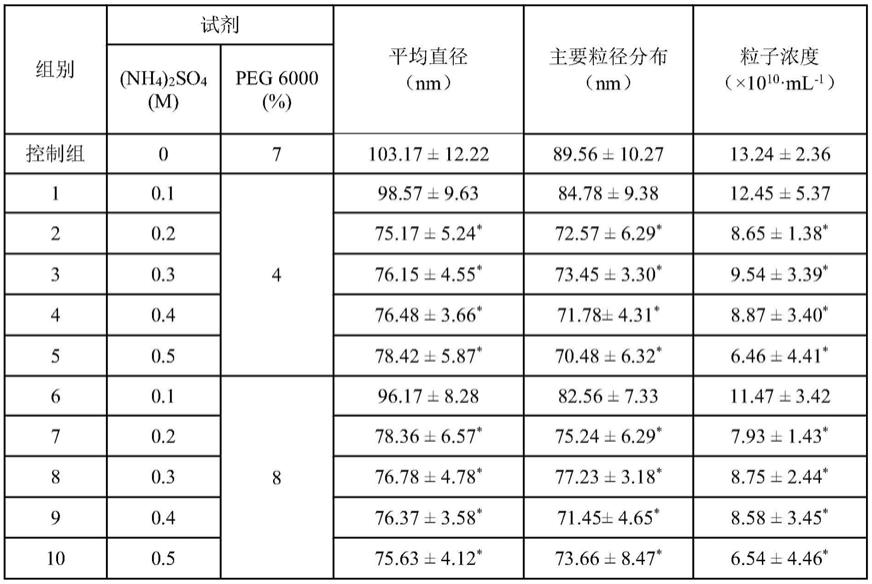
47.2、外泌体提取
48.(1)将收集的的脂肪间充质干细胞上清液分装在15ml离心管中;
49.(2)将装有上清液的离心管放入500g,4℃的离心机中,离心10min,弃沉淀,留上清;
50.(3)将(2)步骤中的上清继续离心,离心条件为15000g,4℃,离心20min,弃沉淀,收集上清;
51.(4)将步骤(3)得到的上清在4℃条件,加入0.1~0.5m的(nh4)2so4,振荡混匀,冰面静置10~15min,随后10000g,4℃,离心5min,弃沉淀,收集上清;
52.(5)将步骤(4)得到的上清,加入等体积的8%~16%的peg6000,以达到目标浓度4%~8%peg 6000,4℃条件下,倒置静置4~6h;
53.(6)将(5)步骤中的制备液继续离心,离心条件为15000g,4℃,离心30~60min,弃上清,收集的沉淀即为提纯之后的外泌体,加入pbs悬浮;
54.(7)冰箱4℃保存备用。
55.3、外泌体提取质量检测
56.运用纳米颗粒跟踪分析仪(nta),采用激光照射外泌体悬浮液,并对外泌体颗粒的散射光进行检测,通过统计散射颗粒的数量来计算纳米颗粒浓度。
57.将每个试验组中收集的外泌体中加入10μl cd9、cd63抗体,置于冰上,避光染色40min,随后用纳米流式检测仪对cd9
exo和cd63
exo的数量及cd9
exo和cd63
exo在总粒子中的百分比进行检测。
58.组内样本数均为3个,最后的数据采用均数
±
标准差(mean
±
s)表示,统计分析采用配对t检验。以p≤0.05表示为有显著统计学差异,下同。
59.4、结果
60.如表1所示当(nh4)2so4浓度在0.2~0.5m时,nta检测出的纳米粒径和粒子浓度呈现显著下降,主要粒径分布在70nm~77nm之间,粒子浓度在6
×
10
10
·
ml-1
~8
×
10
10
·
ml-1
之间。但如表2纳米流式检测仪的所示结果显示,当(nh4)2so4浓度在0.2~0.4m时,其外泌体标志蛋白cd 9
和cd 63
标记的粒子浓度呈显著降低,同时,其结果所显示反映外泌体的纯度呈现显著升高。
61.而peg 6000使用量在体积百分数4%到8%之间的变化对本发明提取的脂肪间充
质干细胞的外泌体纯度并无明显影响,而peg 6000作为生物化学中常用的化合物,在聚集水分子,沉淀纯化病毒颗粒上均有较好的应用,在本发明中的使用证实其联合(nh4)2so4对外泌体沉淀具有更优的效果,纯度显著提高,且peg 6000的使用量在4%也能起到很好的效果,这样也能降低成本。
62.表1nta检测培养上清中控制组与试验组中纳米颗粒的粒径及数量
[0063][0064]
注:控制组采用的外泌体提取方法为常用peg聚合物沉淀,其中具体的条件为(细胞上清液
→
500g,10min离心后收集上清
→
peg 6000,7%,4℃过夜孵化
→
10000g离心20min
→
弃去上清,收集沉淀即为收集的外泌体)。
[0065]
表2纳米流式检测仪检测cd9
exo和cd63
exo的数量及百分比
[0066]
[0067][0068]
注:控制组采用的外泌体提取方法为常用peg聚合物沉淀,其中具体的条件为(细胞上清液
→
500g,10min离心后收集上清
→
peg 6000,7%,4℃过夜孵化
→
10000g离心20min
→
弃去上清,收集沉淀即为收集的外泌体)。
[0069]
实施例3
[0070]
本实施例的目的在于从脂肪间充质干细胞得到的外泌体中提取高纯度的rna。
[0071]
1、材料
[0072]
实施例2中分离提纯的外泌体;rnaiso plus;磁珠缓冲液(粒径小于150nm);蒸馏水;洗脱缓冲液;depc水;氯仿;异丙醇。
[0073]
2、外泌体rna提取
[0074]
(1)首先将实施例2中制备好、保存在4℃的外泌体溶液取出,按照粒子数量每5
×
106~1
×
107加入1ml rnaiso plus的比例进行裂解;
[0075]
(2)然后将制备好的外泌体裂解液转移1ml至1.5ml离心管中,室温静置5min,按照每200μl裂解溶液加入50μl的磁珠缓冲液的比例,振荡混匀后,静置反应3~5min,置于磁力架上吸附;
[0076]
(3)弃去上清液,加入1ml蒸馏水洗涤两次;
[0077]
(4)加入洗脱缓冲液1ml,振荡混匀,磁铁吸附,收集上清于新的1.5ml离心管中;
[0078]
(5)随后放入12000g,4℃条件下的离心机中离心10min,取用上清液;
[0079]
(6)加入200μl氯仿,盖紧离心管盖,混合至溶液乳化成乳白色,室温静置5min,12000g,4℃条件下的离心机中离心15min;
[0080]
(7)将上清液转移约500μl至新的1.5ml离心管,加入等体积预冷的异丙醇,室温静置10min,12000g,4℃条件下离心10min;
[0081]
(8)弃去上清,向离心管中加入1ml预冷的75%depc酒精;
[0082]
(9)冰上静置5min,然后7500g,4℃条件下离心5min,弃去上清;
[0083]
(10)将离心管沉淀静置干燥;
[0084]
(11)最后根据rna沉淀的量加入depc水溶解rna;
[0085]
(12)-80℃冰箱保存备用。
[0086]
3、外泌体rna质量检测
[0087]
为了对比检测提取的rna质量和浓度,优选实施例2中(nh4)2so4浓度在0.2和0.4m时,peg 6000终浓度使用含量为4%提取所得到的外泌体(即表1中的组2和组4)进行后续分析,组内样本数均为3个。分别用凝胶电泳仪,凝胶成像分析仪及核酸蛋白仪测定分析rna条带,rna浓度与纯度。
[0088]
结果显示提取的rna质量均可用于下游分析,控制组和试验组之间均无显著差异(p>0.05)。
[0089]
表3rna质量检测数据
[0090][0091]
注:其中控制组所采用的rna提取方式为:1ml的rnaiso plus室温静置裂解5min
→
12000g 4℃离心10min,收集上清
→
200μl氯仿,室温静置5min,12000g 4℃离心15min,收集上清
→
转移约500μl至新的1.5ml离心管,加入等体积预冷的异丙醇,室温静置10min,12000g 4℃离心10min,收集沉淀
→
加入1ml预冷的75%depc酒精,冰上静置5min,然后7500g 4℃离心5min,禁止干燥,收集沉淀
→
depc水溶解rna,-80℃冰箱保存备用。
[0092]
3.1cdna合成及定量pcr
[0093]
3.1.1定量引物设计
[0094]
设计脂肪间充质干细胞的标志基因nanog和内参基因β-actin的引物片段,合成所需的目的基因引物。
[0095]
表4定量引物信息表
[0096][0097]
3.1.2cdna合成及定量pcr
[0098]
cdna合成是根据反转录试剂盒操作步骤进行,具体操作如下:(1)去除基因组dna反应体系:
[0099]
表5dna去除反应(step1)
[0100]
试剂用量5×
gdnaeraserbuffer2μlgdnaeraser1μltotalrna1μgrnasefreedh2o补齐至10μl
[0101]
注:反应条件:42℃,2min
[0102]
(2)反转录反应体系:
[0103]
表6反转录反应体系
[0104]
试剂用量5
×
primescriptbuffer2(forrealtime)4μlprimescriptrtenzymemixⅰ1μlrtprimemix1μlreactionsolutionfromstep110μlrnasefreedh2o补齐至20μl
[0105]
注:将反应体系加好之后,充分混匀,放置于pcr仪中进行反转录,反应条件:37℃,15 min;85℃,5 s。
[0106]
反转录获得的cdna保存于-20℃条件下。接下来利用合成的目的基因定量引物进行定量pcr试验。其反应体系如下:
[0107]
表7实时荧光定量pcr反应体系
[0108][0109][0110]
注:反应条件:
①
95℃,30s;
②
95℃,10s;
③
退火温度
‑‑
tm,30s;步骤
②
到
③
设定39个循环;
④
95℃,10s;
⑤
溶解曲线获取:65℃-95℃,0.5℃/sec
↑
[0111]
3.1.3rt-pcr结果
[0112]
利用2-δδct
法分析定量结果,结果显示试验组提取的rna的nanog基因的表达量相
比控制组更高,差异显著,说明本发明提取的rna确为脂肪间充质干细胞的外泌体rna,且提取的rna的质量和浓度可观。
[0113]
表8脂肪间充质干细胞外泌体rna定量分析结果
[0114][0115]
综上所述,本发明提供了一种脂肪间充质干细胞培养的外泌体rna提取方法,主要包括以下步骤:培养脂肪间充质干细胞,收集细胞培养液;将细胞培养液差速离心,收集上清液,向上清液中先后加入(nh4)2so4和peg 6000静置反应进行沉淀,静置后超速离心,获得外泌体;将得到的外泌体通过磁珠法提取,得到外泌体的rna。具有如下有益效果:
[0116]
效果一,本发明在脂肪间充质干细胞外泌体提取的一步中,相比原有的单独peg 6000提取方法,本发明所用时间在6~7个小时,而原来的方法时间至少在12小时以上,因此具节约时间的效果,且本发明用所提取的外泌体进行的rna提取试验仅增加了磁珠法吸附一步,这一步磁珠吸附和洗脱的时间也不超过20分钟,因此节约了时间。
[0117]
效果二,本发明所提取的脂肪间充质干细胞外泌体的纯度以及从中提取的rna纯度从纳米流式检测仪结果以及基因表达量上可以看出相对控制组有显著提高,这也说明了本发明的方法能够很好保证脂肪间充质干细胞外泌体rna提取的纯度。
[0118]
效果三,本发明中脂肪间充质干细胞外泌体提取方法相比现有技术,所需要的试验条件温和,也不需要孵育过夜、对器具仪器等要求也非严苛,本发明在这一过程所需设备和采用的方法均简便易操作。
[0119]
效果四,本发明所使用的试剂均为市场常见且工作反应所需使用的量少,器材也非必须昂贵高精密仪器,因此本发明中的脂肪间充质干细胞外泌体的rna提取所需成本较低。
[0120]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。