1.本发明属于生物医药材料技术领域,具体涉及一种功能生物材料及其制备方法和应用。
背景技术:
2.脊髓损伤修复是世界性医学难题,脊髓损伤导致损伤平面以下感觉及运动功能丧失,为患者和家庭带来沉重负担。据世界卫生组织及欧美流行病学研究表明,全世界平均每一百万人中就有10-40人会发生脊髓损伤。有数据表明,我国每年每百万人口中发生脊髓损伤的事件就有50-60例。
3.研究发现,脊髓损伤部位形成抑制性微环境,不仅抑制神经元轴突再生,而且抑制神经干细胞向神经元分化。目前,包括髓鞘蛋白等在内的许多蛋白被认为是脊髓抑制性微环境中主要成分。
4.cn110833543a公开了一种促进慢性脊髓损伤恢复的药物及其制备方法、用途。该发明公开一种促进脊髓损伤恢复的药物,其主要活性成分为特异性组蛋白去乙酰化酶3抑制剂rgfp966。该发明揭示了rgfp966治疗通过抑制hdac3抑制炎症反应、促进抗炎反应、促进轴突再生、促进慢性脊髓损伤后功能恢复的新功能。
5.cn105311620a公开了一种脊髓损伤治疗剂,公开了一种以hgf蛋白质作为有效成分的脊髓损伤治疗剂和脱髓鞘疾病治疗剂。
6.cn113171369a公开了一种多聚嘧啶序列结合蛋白在制备脊髓损伤的修复药物中的应用。该发明在体外通过病毒来沉默多聚嘧啶序列结合蛋白(ptb),同时联合添加与运动神经元分化相关的小分子维甲酸(ra)和嘌吗啡胺(pma),成功使小鼠脊髓反应性星形胶质细胞重编程为运动神经元,为进一步体内研究ptb联合小分子的重编程策略在脊髓损伤后修复中的作用提供帮助,进而实现更好的脊髓损伤修复和功能重建效果。
7.除蛋白以外,脂质是脊髓组织的重要组成部分,但是脂质对脊髓损伤后神经再生的作用仍不清楚。脂质一般可分为胆固醇脂、胆固醇、磷脂及糖脂。胆固醇的合成、转运、转化、储存对生物体生理调控发挥重要作用,在中枢神经系统中存在游离胆固醇和胆固醇脂,胆固醇脂的变化与阿尔茨海默、肌萎缩侧索硬化等存在一定关联,但通过调控脂质代谢手段促进脊髓损伤修复仍然未见报道。
8.因此,如何提供一种通过调控脂质代谢促进脊髓损伤修复的方法,成为目前亟待解决的问题。
技术实现要素:
9.针对现有技术的不足,本发明的目的在于提供一种功能生物材料及其制备方法和应用。本发明提供的功能生物材料通过调控脊髓损伤部位局部胆固醇脂合成代谢调控神经再生微环境,促进脊髓损伤修复。
10.为达到此发明目的,本发明采用以下技术方案:
11.第一方面,本发明提供一种功能生物材料,所述功能生物材料包括叠氮衍生物修饰的有序胶原及负载在所述叠氮衍生物修饰的有序胶原上的二苯并环辛炔衍生物修饰的脂质体;所述脂质体内包载胆固醇脂合成酶抑制剂。
12.本发明提供的功能生物材料通过调控脊髓损伤部位局部胆固醇脂合成代谢调控神经再生微环境,促进脊髓损伤修复;本发明提供的功能生物材料具有促进脊髓损伤后内源干细胞迁移到损伤部位的效果,促进脊髓损伤后神经桥接,促进脊髓损伤后运动功能的恢复;并且本发明提供的功能生物材料具有良好的抗拉伸性能。
13.在本发明中,所述叠氮衍生物修饰的有序胶原和二苯并环辛炔衍生物修饰的脂质体之间,通过叠氮衍生物和二苯并环辛炔衍生物形成的三唑键连接。
14.优选地,所述胆固醇脂合成酶抑制剂为胆固醇酰基转移酶抑制剂,优选为avasimibe。
15.在本发明中含有avasimibe的功能生物材料,通过调控脊髓损伤部位局部胆固醇脂合成代谢调控神经再生微环境,促进脊髓损伤修复。
16.优选地,所述功能生物材料为成束排列的细丝。
17.优选地,每束功能生物材料的直径为2-4mm,例如可以是2mm、2.2mm、2.4mm、2.6mm、2.8mm、3mm、3.2mm、3.4mm、3.6mm、3.8mm、4mm等;长度为8-15cm,例如可以是8cm、9cm、10cm、11cm、12cm、13cm、14cm、15cm等。
18.优选地,所述每束功能生物材料包括20-400根细丝,例如可以是20根、50根、70根、100根、120根、150根、170根、200根、220根、250根、270根、300根、320根、350根、370根、400根等。
19.优选地,所述细丝的直径为10-100μm,例如可以是10μm、20μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm等;长度为8-15cm,例如可以是8cm、9cm、10cm、11cm、12cm、13cm、14cm、15cm等。
20.在本发明中,所述叠氮衍生物修饰的有序胶原占所述功能生物材料总质量的90-99%,例如可以是90%、91%、92%、93%、94%、95%、96%、97%、98%、99%等。
21.优选地,所述叠氮衍生物占所述叠氮衍生物修饰的有序胶原总质量的10-30%,例如可以是10%、15%、20%、25%、30%等。
22.优选地,所述叠氮衍生物包括叠氮-(n-羟基琥珀酰亚胺)(n
3-nhs)和/或叠氮-聚乙二醇-(n-羟基琥珀酰亚胺)(n
3-peg-nhs),优选为叠氮-聚乙二醇-(n-羟基琥珀酰亚胺);聚乙二醇的英文简称为peg。
23.优选地,所述叠氮-聚乙二醇-(n-羟基琥珀酰亚胺)中聚乙二醇的数均分子量为2000-5000,例如可以是2000、2500、3000、3500、4000、4500、5000等。
24.在本发明中,所述二苯并环辛炔衍生物修饰的脂质体占所述功能生物材料总质量的1-10%,例如可以是1%、2%、3%、4%、5%、6%、7%、8%、9%、10%等。
25.优选地,所述二苯并环辛炔衍生物占所述二苯并环辛炔衍生物修饰的脂质体总质量的10-20%,例如可以是10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%等。
26.优选地,所述二苯并环辛炔衍生物包括二苯并环辛炔-疏水聚合物-聚乙二醇(dbco-疏水聚合物-peg)。
27.优选地,所述二苯并环辛炔-疏水聚合物-聚乙二醇中疏水聚合物包括二硬脂酰基磷脂酰乙醇胺(dspe)、二硬脂酰基磷脂酰胆碱(dspc)、二棕榈酰基磷脂酰乙醇胺(dppe)或二棕榈酰磷脂酰胆碱(dppc)中的任意一种或至少两种的组合。
28.优选地,所述二苯并环辛炔-疏水聚合物-聚乙二醇中聚乙二醇的数均分子量为2000-5000,例如可以是2000、2500、3000、3500、4000、4500、5000等。
29.在本发明中,叠氮衍生物(叠氮-(n-羟基琥珀酰亚胺)和/或叠氮-聚乙二醇-(n-羟基琥珀酰亚胺))中n-羟基琥珀酰亚胺可以与胶原中的氨基酸残基之间形成稳定的酰胺键;并且叠氮-聚乙二醇-(n-羟基琥珀酰亚胺)中的聚乙二醇能增强溶解性和稳定性,降低带电分子表面非特异性结合,降低多肽的免疫原性;叠氮衍生物中的叠氮可以与二苯并环辛炔衍生物(二苯并环辛炔-疏水聚合物-聚乙二醇)中的二苯并环辛炔通过点击化学反应生成稳定的三唑键;二苯并环辛炔衍生物中的疏水聚合物和聚乙二醇可以通过亲疏水作用与脂质体连接。
30.在本发明中,所述二苯并环辛炔衍生物修饰的脂质体包括大豆磷脂和胆固醇。
31.优选地,所述大豆磷脂和胆固醇的质量比为(2-5):1,例如可以是2:1、3:1、4:1、5:1等。
32.优选地,所述二苯并环辛炔衍生物修饰的脂质体的粒径为30-70nm,例如可以是30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm等。
33.优选地,所述二苯并环辛炔衍生物修饰的脂质体的载药量为60-80%,例如可以是60%、62%、64%、66%、68%、70%、72%、74%、76%、78%、80%等。
34.优选地,所述二苯并环辛炔衍生物修饰的脂质体的包封率为50-70%,例如可以是50%、52%、54%、56%、58%、60%、62%、64%、66%、68%、70%等。
35.第二方面,本发明提供一种如第一方面所述功能生物材料的制备方法,所述功能生物材料的制备方法包括以下步骤:将叠氮衍生物修饰的有序胶原和包载胆固醇脂合成酶抑制剂的二苯并环辛炔衍生物修饰的脂质体混合,反应,得到所述功能生物材料。
36.优选地,所述反应的温度为20-35℃,例如可以是20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃等;时间为10-15h,例如可以是10h、11h、12h、13h、14h、15h等。
37.优选地,得到的功能生物材料需捆扎成束,每束包括20-400根的所述功能生物材料,例如可以是20根、50根、70根、100根、120根、150根、170根、200根、220根、250根、270根、300根、320根、350根、370根、400根等。
38.在本发明中,所述叠氮衍生物修饰的有序胶原的制备方法包括以下步骤:将叠氮衍生物和有序胶原溶解于缓冲溶液中,反应,得到所述叠氮衍生物修饰的有序胶原。
39.优选地,所述缓冲溶液包括磷酸盐缓冲液,所述缓冲溶液的ph为6-8,例如可以是6、6.2、6.4、6.6、6.8、7、7.2、7.4、7.6、7.8、8等。
40.优选地,所述溶解后得到的混合溶液中叠氮衍生物的浓度为1-10mg/ml,例如可以是1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml、6mg/ml、7mg/ml、8mg/ml、9mg/ml、10mg/ml等,有序胶原的浓度为1-5g/ml,例如可以是1g/ml、2g/ml、3g/ml、4g/ml、5g/ml等。
41.优选地,所述反应的温度为35-39℃,例如可以是35℃、36℃、37℃、38℃、39℃等,反应的时间为3.5-4.5h,例如可以是3.5h、3.6h、3.7h、3.8h、3.9h、4.0h、4.1h、4.2h、4.3h、
.4.4h、4.5h等。
42.优选地,得到所述叠氮衍生物修饰的有序胶原还需进行清洗。
43.优选地,所述清洗采用的溶剂为水,所述清洗的次数为2-5次,例如可以是2次、3次、4次、5次等,每次清洗的时间为8-15min,例如可以是8min、9min、10min、11min、12min、13min、14min、15min等。
44.在本发明中,所述有序胶原由以下制备方法制备得到:将膜筋组织依次经过粗提纯处理、酶解处理、脱核酸处理、有机溶剂处理、去垢剂处理、表面活性剂处理、冷冻和冻干,得到所述有序胶原。
45.优选地,所述粗提纯包括去除肌肉和固体脂肪组织。
46.优选地,所述预处理后还要进行水处理,所述水处理的次数为2-5次,例如可以是2次、3次、4次、5次等,每次水处理的时间为12-17min,例如可以是12min、13min、14min、15min、16min、17min等。
47.优选地,所述酶解处理采用的蛋白酶包括木瓜蛋白酶,所述蛋白酶的酶活力为200-400u/g,例如可以是200u/g、250u/g、300u/g、350u/g、400u/g等;所述酶解处理采用的缓冲液包括磷酸盐缓冲液,所述缓冲液的ph为5.5-6.5,例如可以是5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5等;所述酶解处理的处理时间为0.1-1h,例如可以是0.1h、0.2h、0.3h、0.4h、0.5h、0.6h、0.7h、0.8h、0.9h、1h等。
48.优选地,所述脱核酸处理采用的酶包括rnase a和dnase i,所述酶的酶活力为80-120u/g,例如可以是80u/g、90u/g、100u/g、110u/g、120u/g等;所述脱核酸处理的时间为2.5-3.5h,例如可以是2.5h、2.6h、2.7h、2.8h、2.9h、3.0h、3.1h、3.2h、3.3h、3.4h、3.5h等。
49.优选地,所述有机溶剂处理所采用的有机溶剂包括正庚烷和乙醇,所述正庚烷和乙醇的体积比为(0.5-1.5):2,例如可以是0.5:2、0.8:2、1:2、1.2:2、1.5:2等;所述有机溶剂处理的时间为20-30h,例如可以是20h、22h、24h、26h、28h、30h等。
50.优选地,所述有机溶剂处理后还要进行水处理,所述水处理的次数为2-5次,例如可以是2次、3次、4次、5次等,每次水处理的时间为15-25min,例如可以是15min、16min、17min、18min、19min、20min、21min、22min、23min、24min、25min等。
51.优选地,所述去垢剂处理所采用的去垢剂包括脱氧胆酸钠水溶液,所述脱氧胆酸钠水溶液的质量含量为2-6%,例如可以是2%、3%、4%、5%、6%等;所述脱去垢剂处理的时间为1-3h,例如可以是1h、1.5h、2h、2.5h、3h等。
52.所述去垢剂处理后还要进行水处理,所述水处理的次数为4-7次,例如可以是4次、5次、6次、7次等,每次水处理的时间为8-15min,例如可以是8min、9min、10min、11min、12min、13min、14min、15min等。
53.优选地,所述表面活性剂处理所采用的表面活性剂包括十二烷基磺酸钠水溶液,所述十二烷基磺酸钠水溶液的质量含量为0.1-0.3%,例如可以是0.1%、0.15%、0.2%、0.25%、0.3%等;所述表面活性剂处理的时间为0.1-1h,例如可以是0.1h、0.2h、0.3h、0.4h、0.5h、0.6h、0.7h、0.8h、0.9h、1h等。
54.优选地,所述表面活性剂处理后还要进行水处理,所述水处理的次数为4-7次,例如可以是4次、5次、6次、7次等,每次水处理的时间为8-15min,例如可以是8min、9min、10min、11min、12min、13min、14min、15min等。
55.在本发明中,筋膜首先经过粗处理,除去肌肉和固体脂肪组织;粗处理之后用水处理,为了清洗附着的物质;酶解处理,为了去除胶原端肽,较少免疫原性;脱核酸处理,为了去除dna和rna;有机溶剂处理,为了去除脂质;有机溶剂处理后进行水处理,为了去除有机溶剂;去垢剂处理、去垢剂之后的水处理、表面活性剂处理和表面活性剂处理之后的水处理,均为了去除杂蛋白。
56.优选地,所述冷冻的温度为-90~-70℃,例如可以是-90℃、-85℃、-80℃、-75℃、-70℃等,时间为0.8-1.5h,例如可以是0.8h、0.9h、1.0h、1.1h、1.2h、1.3h、1.4h、1.5h等。
57.优选地,所述冻干的压力为0.05-0.15mbar,例如可以是0.05mbar、0.07mbar、0.09mbar、0.11mbar、0.13mbar、0.15mbar等,时间为20-30h,例如可以是20h、21h、22h、23h、24h、25h、26h、27h、28h、29h、30h等。
58.在本发明中,采用薄膜分散法制备所述二苯并环辛炔衍生物修饰的脂质体。
59.优选地,所述二苯并环辛炔衍生物修饰的脂质体的制备方法包括以下步骤:将大豆磷脂、胆固醇、二苯并环辛炔衍生物溶于有机溶剂中,浓缩,得到中间体;将得到的中间体、胆固醇脂合成酶抑制剂和缓冲液混合,得到所述二苯并环辛炔衍生物修饰的脂质体。
60.优选地,所述有机溶剂包括氯仿和甲醇。
61.优选地,所述氯仿和甲醇的体积比为(1.5-2.5):1,例如可以是1.5:1、1.7:1、2:1、2.2:1、2.5:1等。
62.优选地,所述混合后还包括依次进行的超声和过滤。
63.优选地,所述超声的功率为250-350w,例如可以是250w、270w、290w、310w、330w、350w等,时间为15-25min,例如可以是15min、17min、19min、21min、23min、25min等。
64.优选地,所述过滤所采用的滤膜为0.18-0.30μm,例如可以是0.18μm、0.20μm、0.22μm、0.24μm、0.26μm、0.28μm、0.30μm等。
65.第三方面,本发明提供一种如第一方面所述的功能生物材料在制备促进脊髓损伤后神经再生的材料上的应用。
66.相对于现有技术,本发明具有以下有益效果:
67.(1)本发明提供的功能生物材料通过调控脊髓损伤部位局部胆固醇脂合成代谢调控神经再生微环境,促进脊髓损伤修复;
68.(2)采用本发明提供的功能生物材料在脊髓损伤部位出现较多的nestin巢蛋白,表明在损伤部分有神经干细胞出现,阳性的神经干细胞出现表明本发明提供的功能生物材料具有促进脊髓损伤后内源干细胞迁移到损伤部位的效果;
69.(3)采用本发明提供的功能生物材料在损伤部位具有更多的nf阳性神经元,这为脊髓损伤后神经桥接奠定了基础;
70.(4)采用本发明提供的功能生物材料,大鼠bbb评分更高,表明本发明提供的功能生物材料可以促进脊髓损伤后运动功能的恢复;
71.(5)本发明提供的功能生物材料具有良好的抗拉伸性能。
附图说明
72.图1为实施例1所提供的功能生物材料扫描电镜图。
73.图2为实施例1所提供的功能生物材料的拉伸曲线。
74.图3a为不移植材料的对照组大鼠7天后,损伤部位nestin阳性细胞的免疫荧光染色图;其中白亮区域为神经干细胞标志物nestin的染色;
75.图3b为对比例1提供的功能生物材料移植到脊髓损伤大鼠7天后,损伤部位nestin阳性细胞的免疫荧光染色图;其中白亮区域为神经干细胞标志物nestin的染色;
76.图3c为实施例1提供的功能生物材料移植到脊髓损伤大鼠7天后,损伤部位nestin阳性细胞的免疫荧光染色图;其中白亮区域为神经干细胞标志物nestin的染色。
77.图4a为不移植材料的对照组大鼠30天后,损伤部位nf阳性细胞的免疫荧光染色图;其中白亮区域为神经元标志物nf的染色;
78.图4b为对比例1提供的功能生物材料移植到脊髓损伤大鼠30天后,损伤部位nf阳性细胞的免疫荧光染色图;其中白亮区域为神经元标志物nf的染色;
79.图4c为实施例1提供的功能生物材料移植到脊髓损伤大鼠30天后,损伤部位nf阳性细胞的免疫荧光染色图;其中白亮区域为神经元标志物nf的染色。
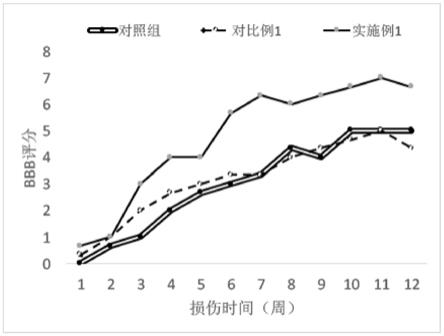
80.图5为空白对照组、实施例1和对比例1提供的功能生物材料移植到脊髓损伤大鼠后,大鼠运动功能bbb评分。
具体实施方式
81.下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
82.以下实施例中各组分来源如下所示:
83.84.实施例1
85.本实施例提供一种功能生物材料,所述功能生物材料的制备方法包括以下步骤:
86.(一)叠氮衍生物修饰的有序胶原的制备:
87.(1)取新鲜牛膜筋组织200g,去除肌肉和固体脂肪组织;然后用1000ml去离子水浸泡3次,每15min换液一次;
88.(2)向步骤(1)得到的产物中加入300u/g的木瓜蛋白酶200ml,缓冲液为磷酸盐缓冲液pbs(ph=6),处理30min;
89.(3)向步骤(2)得到的产物中加入100u/ml的rnase a和100u/ml的dnase i 200ml处理3h;
90.(4)向步骤(3)得到的产物中加入500ml正庚烷与乙醇混合溶液(v
正庚烷
:v
乙醇
=1:2)处理24h;然后用1000ml去离子水清洗3次,每次20min;
91.(5)将步骤(4)得到的产物用500ml 4%的脱氧胆酸钠溶液处理2h,然后用去离子水清洗5次,每次10min;
92.(6)将步骤(5)得到的产物用500ml 0.2%的十二烷基磺酸钠处理30min;然后用去离子水清洗5次,每次10min;
93.(7)将步骤(6)得到的产物放于-80℃冰箱中冷冻1h,然后在冻干机中冻干,在0.1mbar冻干24h得到2g有序胶原;
94.(8)将2g步骤(7)得到的有序胶原与500mg n
3-peg5k-nhs溶于100ml pbs(ph=7.2)溶液中,37℃反应4h;然后用去离子水清洗3次,每次10分钟,得到2.4g叠氮衍生物修饰的有序胶原;
95.(二)二苯并环辛炔衍生物修饰的脂质体的制备:
96.将50mg大豆磷脂、15mg胆固醇、12mg dbco-dspe-peg2k,溶于8ml氯仿甲醇溶液(v
氯仿
:v
甲醇
=2:1),在旋转蒸发仪蒸干后,加入4ml pbs溶液,加入1mg胆固醇脂合成酶抑制剂avasimibe,300w下超声20min;然后利用0.22um的滤膜过滤,得到二苯并环辛炔衍生物修饰的脂质体60mg;
97.(三)功能生物材料的制备
98.将得到的2.4g叠氮衍生物修饰的有序胶原和60mg二苯并环辛炔衍生物修饰的脂质体混合,在25℃反应12h,得到2.46g功能生物材料,捆扎成束,每束含有30根功能生物材料。
99.实施例2
100.本实施例提供一种功能生物材料,所述功能生物材料的制备方法包括以下步骤:
101.(一)叠氮衍生物修饰的有序胶原的制备:
102.(1)取新鲜牛膜筋组织200g,去除肌肉和固体脂肪组织;然后用950ml去离子水浸泡4次,每16min换液一次;
103.(2)向步骤(1)得到的产物中加入300u/g的木瓜蛋白酶205ml,缓冲液为磷酸盐缓冲液pbs(ph=6),处理35min;
104.(3)向步骤(2)得到的产物中加入100u/ml的rnase a和100u/ml的dnase i 205ml处理2.9h;
105.(4)向步骤(3)得到的产物中加入490ml正庚烷与乙醇混合溶液(v
正庚烷
:v
乙醇
=1:2)
处理25h;然后用1100ml去离子水清洗4次,每次18min;
106.(5)将步骤(4)得到的产物用505ml 4%的脱氧胆酸钠溶液处理2.1h,然后用去离子水清洗6次,每次8min;
107.(6)将步骤(5)得到的产物用505ml 0.2%的十二烷基磺酸钠处理27min;然后用去离子水清洗6次,每次8min;
108.(7)将步骤(6)得到的产物放于-80℃冰箱中冷冻1h,然后在冻干机中冻干,在0.11mbar冻干25h得到有2.1g序胶原;
109.(8)将2.1g步骤(7)得到的有序胶原与505mg n
3-peg5k-nhs溶于100ml pbs(ph=7.2)溶液中,37℃反应4.2h;然后用去离子水清洗3次,每次9分钟,得到2.5g叠氮衍生物修饰的有序胶原;
110.(二)二苯并环辛炔衍生物修饰的脂质体的制备:
111.将55mg大豆磷脂、17mg胆固醇、15mg dbco-dspe-peg2k,溶于9ml氯仿甲醇溶液(v
氯仿
:v
甲醇
=2:1),在旋转蒸发仪蒸干后,加入4ml pbs溶液,加入1.2mg胆固醇脂合成酶抑制剂avasimibe,310w下超声18min;然后利用0.22um的滤膜过滤,得到二苯并环辛炔衍生物修饰的脂质体60mg;
112.(三)功能生物材料的制备
113.将得到的2.5g叠氮衍生物修饰的有序胶原和60mg二苯并环辛炔衍生物修饰的脂质体混合,在27℃反应11.8h,得到2.56g功能生物材料,捆扎成束,每束含有30根功能生物材料。
114.实施例3
115.本实施例提供一种功能生物材料,所述功能生物材料的制备方法包括以下步骤:
116.(一)叠氮衍生物修饰的有序胶原的制备:
117.(1)取新鲜牛膜筋组织200g,去除肌肉和固体脂肪组织;然后用1050ml去离子水浸泡3次,每17min换液一次;
118.(2)向步骤(1)得到的产物中加入300u/g的木瓜蛋白酶195ml,缓冲液为磷酸盐缓冲液pbs(ph=6),处理35min;
119.(3)向步骤(2)得到的产物中加入100u/ml的rnase a和100u/ml的dnase i 210ml处理3.2h;
120.(4)向步骤(3)得到的产物中加入510ml正庚烷与乙醇混合溶液(v
正庚烷
:v
乙醇
=1:2)处理23h;然后用950ml去离子水清洗3次,每次25min;
121.(5)将步骤(4)得到的产物用495ml 4%的脱氧胆酸钠溶液处理1.8h,然后用去离子水清洗5次,每次9min;
122.(6)将步骤(5)得到的产物用495ml 0.2%的十二烷基磺酸钠处理33min;然后用去离子水清洗5次,每次12min;
123.(7)将步骤(6)得到的产物放于-80℃冰箱中冷冻1h,然后在冻干机中冻干,在0.12mbar冻干23.5h得到得到1.9g有序胶原;
124.(8)将1.9g步骤(7)得到的有序胶原与495mg n
3-peg5k-nhs溶于105ml pbs(ph=7.2)溶液中,37℃反应3.8h;然后用去离子水清洗3次,每次12分钟,得到2.3g叠氮衍生物修饰的有序胶原;
125.(二)二苯并环辛炔衍生物修饰的脂质体的制备:
126.将48mg大豆磷脂、13mg胆固醇、10mg dbco-dspe-peg2k,溶于7ml氯仿甲醇溶液(v
氯仿
:v
甲醇
=2:1),在旋转蒸发仪蒸干后,加入4ml pbs溶液,加入0.9mg胆固醇脂合成酶抑制剂avasimibe,295w下超声25min;然后利用0.22um的滤膜过滤,得到二苯并环辛炔衍生物修饰的脂质体53mg;
127.(三)功能生物材料的制备
128.将得到的2.3g叠氮衍生物修饰的有序胶原和53mg二苯并环辛炔衍生物修饰的脂质体混合,在24℃反应13h,得到2.35g功能生物材料,捆扎成束,每束含有30根功能生物材料。
129.实施例4
130.本实施例提供一种功能生物材料,与实施例1的区别仅在于,步骤(8)中,将n
3-peg5k-nhs替换为同等重量的azido
‑‑
nhs,其他步骤同实施例1。
131.实施例5
132.本实施例提供一种功能生物材料,与实施例1的区别仅在于,在二苯并环辛炔衍生物修饰的脂质体的制备中,将dbco-dspe-peg2k替换为同等重量的dbco
‑‑
mal,其他步骤同实施例1。
133.对比例1
134.本对比例提供一种功能生物材料,与实施例1的区别仅在于,仅含有步骤(1)-(7),得到有序胶原。
135.对比例2
136.本对比例提供一种功能生物材料,与实施例1的区别仅在于,缺少步骤(8),其他合成步骤同实施例1。
137.对比例3
138.本对比例提供一种功能生物材料,与实施例1的区别仅在于,在二苯并环辛炔衍生物修饰的脂质体的制备中,不含有dbco-dspe-peg2k,其他合成步骤同实施例1。
139.对比例4
140.本实施例提供一种功能生物材料,与实施例1的区别仅在于,在二苯并环辛炔衍生物修饰的脂质体的制备中,将胆固醇脂合成酶抑制剂avasimibe换成同等重量的紫杉醇,其他步骤同实施例1。
141.测试例1
142.二苯并环辛炔衍生物修饰的脂质体性能测试
143.测试样本:实施例1-5、对比例2、4提供的二苯并环辛炔衍生物修饰的脂质体;对比例3提供的脂质体
144.测试方法:使用冻干机和酶标仪进行载药量、包封率的测试计算,使用动态光散射激光粒度仪进行粒径分布测试,具体测试结果如表1所示:
145.表1
146.样本包封率/%载药量/%平均粒径/nm实施例1756850
实施例2767048实施例3806030实施例4607270实施例5725060对比例2687040对比例3625436对比例4656556
147.由表1数据可知,本发明(实施例1-5)提供的二苯并环辛炔衍生物修饰的脂质体的包封率为60-80%,载药量为50-72%,平均粒径为30-70nm。
148.测试例2
149.功能生物材料表面形貌测试
150.测试样本:实施例1提供的功能生物材料
151.测试方法:采用扫描电镜观察实施例1提供的功能生物材料的表面形貌,测试结果如图1所示。
152.如图1所示,实施例1所提供的功能生物材料扫描电镜图,从图中可以看出,功能生物材料内部纤维呈纵向有序排列。
153.测试例3
154.拉伸强度测试
155.测试样本:实施例1-5和对比例1-4提供的功能生物材料
156.测试方法:将功能生物材料在万能材料试验机上进行拉伸试验,测试样品的拉伸强度,测试结果如表2所示:
157.表2
158.测试样本拉伸强度(mpa)实施例1277实施例2230实施例3280实施例4198实施例5292对比例1232对比例2210对比例3262对比例4294
159.由表2数据可知,本发明(实施例1-5)所提供的功能生物材料的拉伸强度为198-292mpa。
160.如图2所示,实施例1所提供的功能生物材料的拉伸曲线可知,实施例1所提供的功能生物材料的拉伸强度为277mpa。
161.测试例4
162.动物实验
163.测试样本:实施例1-5和对比例1-4所提供的功能生物材料
164.建立大鼠胸段2mm全横断脊髓损伤模型:选雌性成年sd大鼠50只,体重为200
±
25g,分为10组,每组5只;腹腔注射戊巴比妥钠麻醉后,取俯卧位,大鼠腰背部脱毛,消毒,切开t7-t8皮肤和皮下,分离双侧棘突旁肌肉,拉钩拉开棘突旁肌肉,暴露出t7-t8棘突和椎板。小号持针器咬除棘突,再切除左侧椎板,内侧过中线,外侧至关节突内侧面,暴露出半侧脊髓及脊髓后正中静脉为止。用显微刀、显微拉钩、显微剪,沿后正中线纵向打开硬膜。横行切断脊髓,长约2mm。待止血后,每组分别采用实施例1-5和对比例1-4所提供的功能生物材料填充,以不移植材料的损伤大鼠为对照组。
165.(一)大鼠后神经再生效果评价
166.测试方法:移植7天后,利用genetex公司抗体gtx630201识别nestin巢蛋白;移植1个月后,利用merck公司抗体mab1651识别nf阳性神经元。
167.如图3a、图3b和图3c所示,通过对移植7天后大鼠进行染色分析,发现与对照组(图3a)和对比例1提供的功能生物材料(图3b)相比,采用实施例1提供的功能生物材料(图3c)在脊髓损伤部位有更多的nestin巢蛋白;nestin巢蛋白是一种中间丝类型的蛋白,能够特异性的表达在神经上皮干细胞上一种分子标记物,可能对神经元的分化有作用;阳性的神经干细胞出现表明实施例1提供的功能生物材料具有促进脊髓损伤后内源干细胞动迁移到损伤部位的效果。
168.如图4a、图4b和图4c所示,通过对移植1个月后大鼠进行染色分析,发现与对照组(图4a)和对比例1提供的功能生物材料(图4b)相比,采用实施例1提供的功能生物材料(图4c)的大鼠损伤部位具有更多的nf阳性神经元,这为脊髓损伤后神经桥接奠定基础。
169.(二)大鼠行为人学检查
170.测试方法:所有大鼠于移植后1-12周进行行为学检查,采用bbb评分等级法进行评分,分为0-21级,共22级。21分为功能正常,0分为功能完全丧失。bbb评分采用单盲检测方法,观察动物在空地上的损伤侧下肢即左侧下肢的行为,按照评分标准给分,观察时间为4分钟,测试结果如表3所示:
171.表3
[0172][0173]
由表3数据可知,移植本发明(实施例1-5)所提供的功能生物材料的大鼠4周后bbb评分为3-4,8周后bbb评分为6-6.67,12周后bbb评分为6-8。
[0174]
通过实施例1和实施例5的对比可知,将dbco-dspe-peg2k替换为同等重量的dbco
‑‑
mal后,会影响功能生物材料的效果。
[0175]
通过实施例1和对比例1的对比可知,当功能生物材料仅为有序胶原时,大鼠的运动功能恢复较差。
[0176]
如图5所示,移植实施例1提供的功能生物材料的大鼠bbb评分明显优于移植对比例1提供的功能生物材料的大鼠和对照组大鼠。
[0177]
通过实施例1和对比例2-3的对比可知,叠氮衍生物修饰的有序胶原和二苯并环辛炔衍生物修饰的脂质体之间没有形成共价键,会影响所述功能生物材料的性能。
[0178]
通过实施例1和对比例4的对比可知,当将胆固醇脂合成酶抑制剂avasimibe换成同等重量的紫杉醇,影响大鼠的运动功能恢复。
[0179]
申请人声明,本发明通过上述实施例来说明一种功能生物材料及其制备方法和应用,但本发明并不局限于上述实施例,即不意味着本发明必须依赖上述实施例才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
