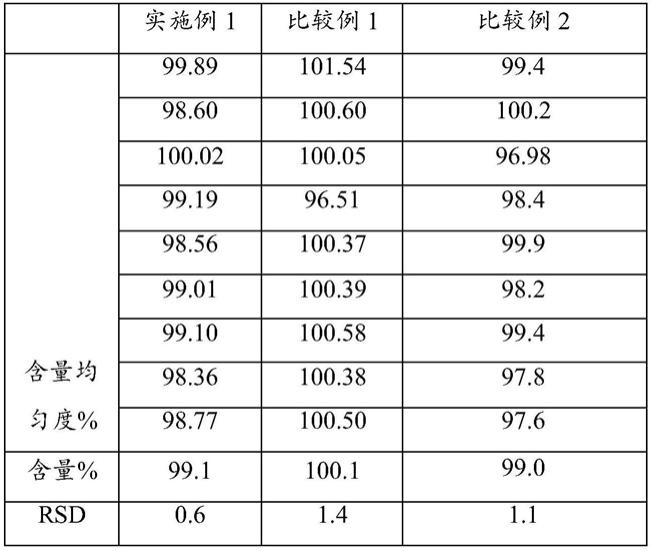
1.本发明涉及医药技术领域,特别涉及金石蚕苷在制备预防和/或治疗癌症药物中的应用。
背景技术:
2.广东紫珠(callicarpa kwangtungensis chun.),为马鞭草科紫珠属代表性药用植物,主要分布在中国大陆南部。全株入药,性凉、味苦涩,具有收敛止血、散瘀和清热解毒之功效,在民间主要用于治疗上呼吸道感染、扁桃体炎、肺炎和外伤出血等。广东紫珠是中成药“抗宫炎片”和“妇炎康泡腾片”等的主要原料药材,广泛应用于妇科炎症制剂,为2015版《中国药典》收录药材品种。作为民间临床妇科炎症及各类出血症的常用药物,广东紫珠具有良好的开发应用前景。
3.现代研究发现,广东紫珠中含有苯丙素苷类、黄酮类、多糖和挥发油等化学成分。2020版《中华人民共和国药典》一部中规定广东紫珠药材中金石蚕苷(c
35h46o19
)和连翘酯苷b(c
34h44o19
)的总量不得少于0.50%。金石蚕苷(poliumoside)为苯丙素苷类物质,cas号:94079-81-9,分子式:c
35h46o19
,分子量:770.73,其具有抗菌消炎抗病毒作用,可用于散瘀止血,消肿止痛。目前尚未见有将金石蚕苷用于预防和/或治疗宫颈癌的报道。
技术实现要素:
4.本发明的首要目的在于克服现有技术的缺点与不足,提供金石蚕苷在制备预防和/或治疗癌症药物中的应用。
5.本发明的目的通过下述技术方案实现:
6.金石蚕苷在制备预防和/或治疗癌症药物中的应用。
7.所述的金石蚕苷的浓度优选为3.125~200μm;更优选为50~100μm。
8.所述的预防和/或治疗癌症药物优选为预防和/或治疗宫颈癌的药物;更优选为通过诱导宫颈癌细胞凋亡来预防和/或治疗宫颈癌的药物。
9.一方面,金石蚕苷作用于hela细胞后,导致keap1蛋白表达量上调,核内nrf2蛋白表达量下降,使keap1-nrf2信号通路失活,从而导致抗氧化酶表达量减少,细胞中ros水平增多,进而导致细胞死亡。另一方面,金石蚕苷通过激活促凋亡蛋白bax并且抑制抗凋亡蛋白bcl-2活性,促使bax/bcl-2比例上调,使caspase-3活化为cleaved caspase-3,导致线粒体损伤,从而诱导细胞凋亡。
10.一种预防和/或治疗宫颈癌的药物,包括金石蚕苷。
11.所述的预防和/或治疗宫颈癌的药物还包含药学上可接受的辅料。
12.所述的药学上可接受的辅料优选包括但不限于抗氧化剂、缓释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、吸附载体、表面活性剂和润滑剂中的至少一种。
13.所述的预防和/或治疗宫颈癌的药物的给药方式包括但不限于口服给药。
14.本发明相对于现有技术具有如下的优点及效果:
15.本发明首次发现金石蚕苷能够诱导宫颈癌细胞凋亡,因此可将金石蚕苷用于制备预防和/或治疗宫颈癌的药物。金石蚕苷可以诱导hela细胞内产生大量ros,导致氧化应激通路keap1-nrf2失活,促使bax/bcl-2比例上调,使caspase-3活化为cleaved caspase-3,引发线粒体损伤,从而诱导细胞凋亡。
附图说明
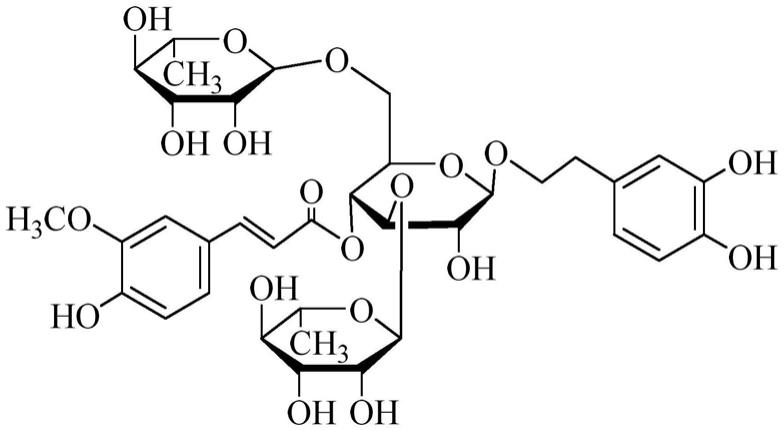
16.图1为金石蚕苷的结构式图。
17.图2为金石蚕苷的1h nmr谱图。
18.图3为金石蚕苷的
13
c nmr谱图。
19.图4为金石蚕苷的dept 13
c 135nmr谱图。
20.图5为金石蚕苷作用hela细胞后hoechst 33258荧光染色结果图。
21.图6为金石蚕苷作用hela细胞后ao/eb双荧光染色结果图。
22.图7为金石蚕苷对hela细胞生长周期的影响结果图。
23.图8为金石蚕苷对hela细胞凋亡的影响结果图。
24.图9为金石蚕苷对hela细胞内活性氧ros水平的影响结果图。
25.图10为金石蚕苷对hela细胞中keap1蛋白和nrf2核蛋白表达影响结果图。
26.图11为金石蚕苷对hela细胞中bax、bcl-2、casepase-3、cleaved casepase-3蛋白表达影响的结果图。
具体实施方式
27.下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
28.实施例1:金石蚕苷的制备
29.金石蚕苷的制备:
30.12kg干燥广东紫珠(购自于江西萍乡)枝和叶粉碎过筛,置于渗漉筒中用甲醇反复提取,提取液合并减压浓缩后得到浸膏1kg;然后用适量蒸馏水溶解,再依次用石油醚、乙酸乙酯、正丁醇进行萃取,萃取液分别减压浓缩至干,得到石油醚部位85g,乙酸乙酯部位108g,正丁醇部位400g,水部位260g。取正丁醇萃取物(即正丁醇部位390g)经ab-8型大孔树脂柱层析,依次以0%、20%、40%、70%、100%(v/v)甲醇梯度洗脱,tlc检测合并,减压浓缩得5个不同梯度甲醇洗脱组分fr.1~fr.5。fr.3经diaion hp-20型大孔树脂依次以0%、20%、40%、70%、100%甲醇梯度洗脱,40%甲醇洗脱部位经sephadex lh-20凝胶柱柱层析,以20%甲醇/水洗脱分离得到金石蚕苷poliumoside(516mg),结构式见图1,该化合物核磁图谱见图2-4。
31.实施例2:金石蚕苷对hela细胞凋亡的作用机制
32.(1)mtt检测细胞增殖抑制率
33.采用mtt法检测金石蚕苷在不同浓度下对宫颈癌hela细胞存活率的影响。具体操作如下:
34.胰酶消化,1000rpm离心5min收集hela细胞,hela细胞购于中国上海细胞库(atcc),将细胞悬液吹打均匀,调整浓度为5
×
103个/ml,准备96孔板,每孔中加入100μl,重
复3孔,培养24h。分别设置空白组、对照组和给药组。给药组中金石蚕苷的浓度梯度分别为3.125μm、6.25μm、12.5μm、25μm、50μm、100μm和200μm。空白组加入完全培养基,对照组加入含dmso的完全培养基。终止培养前4h,每孔加入5mg/ml mtt溶液20μl,继续避光培养。孵育完毕后,加入150μl dmso,使结晶充分溶解,采用酶标仪在λ=490nm处检测od值。
35.结果表明:金石蚕苷对hela细胞增殖的抑制作用呈量效关系,ic
50
为58.77
±
0.24μm。
36.(2)hoechst 33258荧光染色
37.hoechst 33258染色试剂盒购于上海贝博生物科技有限公司,hoechst 33258是一种可以穿透细胞膜的蓝色荧光染料,是特异性dna染料,主要用于细胞核染色。具体操作步骤如下:
38.染色液的配制:将hoechest 33258染色液用pbs缓冲液(hoechest 33258染色液与pbs缓冲液体积比(ml:ml)1:100;pbs缓冲液ph=7.4,0.01m;下同)稀释,配制成染色液。试剂b用纯水稀释(试剂b与纯水体积比(ml:ml)1:10)。用70%(v/v)的酒精浸泡洁净的盖玻片大约5min,完全培养基洗涤1次,把消毒后的盖玻片置于6孔板中。
39.胰酶消化hela细胞,制成细胞悬液,细胞数为5
×
105个/ml。准备6孔板,每孔1ml细胞悬液,37℃、5%co2培养24h。分组处理,给药组分别加入50μm、100μm含金石蚕苷的完全培养基2ml,对照组加入完全培养基2ml,重复3孔,培养24h。吸去板中旧的培养液,每孔加入0.5ml 4%多聚甲醛组织固定液固定5min,吸去固定液,加入0.5ml染色液,室温条件下,锡箔纸包裹孵育15min。用试剂b洗涤盖玻片,将抗荧光淬灭剂滴至载玻片上,盖上贴有细胞的盖玻片,在荧光显微镜下观察。
40.荧光显微镜观察如图5显示:对照组细胞是均匀蓝色荧光,与对照组相比,给药组经不同浓度金石蚕苷处理hela细胞后,出现亮蓝色荧光,蓝色呈浓染致密,且金石蚕苷浓度越大,蓝色荧光越亮。说明金石蚕苷能够诱导hela细胞凋亡,且呈剂量依赖性。
41.(3)ao/eb双荧光染色
42.吖啶橙(ao)具有膜通透性,能透过细胞膜,使核dna和rna染色,发出绿色荧光;而eb无膜通透性,只能透过细胞膜受损的细胞,与核dna结合后发出橘红色荧光,当两者联用时,绿色且细胞形态正常的则为活细胞,绿色但呈固缩状则为早凋细胞,当核染色呈现橘红色且细胞核呈固缩状,则为晚凋细胞;因此可以通过双染来区分细胞的状态。
43.ao/eb双染细胞凋亡检测试剂盒购于上海贝博生物科技有限公司,具体操作步骤如下:
44.染色缓冲液的配制:试剂c由无菌去离子水10倍稀释。
45.胰酶消化hela细胞,制成细胞悬液,细胞数为5
×
105个/ml,准备洁净的6孔板,每孔中加入1ml细胞悬液,培养24h。分组处理,实验组分别加入50μm、100μm的含药完全培养基2ml,对照组加入完全培养基2ml,重复3孔,培养24h。
46.消化收集细胞,用0.5ml染色缓冲液重悬细胞。加入5μl ao染色液和5μl eb染色液,混匀后,于4℃条件下,锡箔纸包裹孵育15min。取洁净且无菌的载玻片,将抗荧光淬灭剂滴在载玻片上,再滴加上5μl细胞悬液,轻轻盖上盖玻片后立即置荧光显微镜下观察。
47.荧光显微镜结果如图6,对照组细胞呈现绿色,与对照组细胞相比,给药组在不同浓度金石蚕苷处理hela细胞后,细胞核被染色成为黄色或者橘黄色,并且细胞有的呈念珠
状,细胞膜呈固缩状,该现象与细胞凋亡有关,表明金石蚕苷能够诱导hela细胞凋亡。
48.(4)细胞周期分析
49.为了明确金石蚕苷对hela细胞周期的影响,采用不同浓度(50μm、100μm)的金石蚕苷处理hela细胞后用pi染色法检测了细胞周期分布。具体操作步骤如下:
50.收集细胞,细胞浓度为5
×
105个/ml,将细胞悬液移取至6孔板中,培养24h。分组处理,吸去旧培养液,给药组分别加入50μm、100μm含金石蚕苷的完全培养基2ml,对照组加入完全培养基2ml,重复3孔,于培养箱中培养24h。
51.胰酶消化hela细胞,使细胞浓度为5
×
106个/ml,用4℃的pbs缓冲液润洗2次,0.5ml pbs缓冲液重悬细胞,均匀吹打,缓缓滴加乙醇,边加边涡旋,防止细胞成团,4℃条件下,固定过夜。取5
×
106个细胞,放在锥形离心管中,1000g离心10min,弃上清,收集细胞。用4℃的pbs缓冲液润洗2次,0.5ml pbs缓冲液重悬细胞。加入rnase a溶液20μl,37℃水浴30min,1000rpm离心10min,弃上清,收集细胞,加入0.4ml pi(碘化丙啶)染液重悬细胞,混匀后,4℃避光孵育40min,流式细胞仪检测。
52.结果如图7所示,金石蚕苷浓度分别为50μm和100μm作用于hela细胞24h后,与对照组(42.84%)对比,金石蚕苷在g0/g1期dna含量分别增加为46.8%和49.3%。由此可知金石蚕苷刺激hela细胞后,会将细胞周期停滞在g0/g1期,导致细胞增殖生长受到抑制,最终诱导细胞凋亡。
53.(5)annexin v-fitc/pi双染法检测细胞凋亡
54.为探究金石蚕苷对细胞凋亡的影响,采用不同浓度的金石蚕苷作用于hela细胞后用annexin v-fitc/pi检测了细胞凋亡,通过计算早期凋亡和晚期凋亡的总和来分析细胞凋亡。
55.具体操作步骤如下:
56.收集hela细胞,使细胞数为5
×
105个/ml,种于6孔板中,培养24h。分组处理,给药组分别加入50μm、100μm含金石蚕苷的完全培养基2ml,对照组加入完全培养基2ml,重复3孔,培养24h。
57.使用不含edta的胰酶消化培养后的hela细胞,4℃的pbs缓冲液润洗2次。用0.4ml结合液将细胞吹匀,使细胞浓度为1
×
106个/ml。加入5μl annexin v染色液,摇晃均匀,4℃条件下,锡箔纸包裹孵育15min。加入5μl pi染色液,吹打均匀,4℃条件下,锡箔纸包裹孵育5min,流式细胞仪检测。
58.结果如图8所示,金石蚕苷浓度分别为50μm和100μm作用于hela细胞24h后,与对照组对比,金石蚕苷对hela细胞的凋亡率分别为10.43%和11.04%。
59.(6)hela细胞中活性氧的测定
60.为了研究金石蚕苷对hela细胞中ros水平的影响,采用流式细胞仪检测了不同浓度金石蚕苷作用于细胞后ros含量的变化。具体操作步骤如下:
61.dcfh-da工作液配制:用无血清培养基将活性氧ros荧光探针dcfh-da稀释为1/1000。
62.(1)收集hela细胞,细胞数为5
×
105个/ml,种于6孔板中,培养24h。分组处理,给药组分别加入50μm、100μm含金石蚕苷的完全培养基2ml,对照组加入完全培养基2ml,阴性组加入完全培养基2ml,重复3孔,培养24h。收集细胞,阴性组细胞用无血清培养基重悬,其他
组细胞用dcfh-da工作液制成细胞悬液,使细胞浓度为1
×
106个/ml,室温条件下,锡箔纸包裹孵育20min。基础培养基洗涤细胞3次后重悬细胞,流式检测结果。
63.(2)同时调整细胞密度为5
×
104个/ml,每孔100μl接种于96孔板中,培养24h。设置对照组(对照组加入完全培养基)、不同浓度的金石蚕苷给药组(50μm、100μm)以及n-乙酰-l-半胱氨酸(nac) 金石蚕苷给药组(nac 药物组中,预先加入1ml 10mm的nac预处理1小时后,再加入1ml不同浓度的金石蚕苷溶液,使得nac终浓度为5mm,金石蚕苷终浓度为50μm、100μm。)培养24h,去除细胞培养基,用pbs缓冲液洗细胞2次,每孔加入0.2ml dcfh-da工作液,室温条件下,锡箔纸包裹孵育20min,酶标仪检测结果。
64.结果如图9显示,金石蚕苷浓度分别为50μm和100μm作用于hela细胞24h后,与对照组(ros含量为53.4%)对比,金石蚕苷给药组细胞内的ros含量分别为82.4%和87.4%,说明金石蚕苷的加入提高了hela细胞内ros含量。加入抗氧化剂n-乙酰-l-半胱氨酸(nac)后,胞内ros含量有不同程度下降,与对照组对比具有显著性差异(p《0.01)。可知金石蚕苷刺激细胞后可诱导细胞内ros水平提高,从而诱导细胞凋亡。
65.实施例3:金石蚕苷对hela细胞氧化应激通路中keap1和nrf2蛋白含量的影响
66.keap1-nrf2信号通路在保护细胞免受氧化应激损害方面发挥着重要作用。细胞为了对抗ros会启动一系列抗氧化的信号通路,以减弱ros对细胞的损害。nrf2是抗氧化应激的关键因子,nrf2的激活受keap1的严格调控。
67.核蛋白和胞浆蛋白提取试剂盒购于上海贝博生物科技有限公司,具体操作步骤如下:
68.(1)细胞总蛋白提取
69.弃去6孔板中培养基,加入预冷的pbs缓冲液,洗涤分别经实施例2的50μm、100μm金石蚕苷处理的hela细胞2次,冰上操作,洗涤后每孔加入1ml预冷的pbs缓冲液浸没细胞,将细胞用细胞刮刀轻柔地刮出来,放至2ml离心管中,低速离心5min,弃去上清,每管加100μl提前配制好的裂解液(ripa:pmsf体积比(ml:ml)99:1,购于上海碧云天生物技术有限公司),冰上裂解15min,低温高速离心10min,收集上清液,得细胞总蛋白。
70.(2)细胞核蛋白提取
71.弃去6孔板中培养基,用预冷的pbs缓冲液洗3次,低速离心10min,弃上清,留下分别经实施例2的50μm、100μm金石蚕苷处理的hela细胞沉淀备用。每20μl沉淀加入200μl提取液a(每200μl蛋白提取液a加入1μl蛋白酶抑制剂混合物,混匀后得到提取液a,置冰上备用。)吹打均匀,使细胞团分开,放置冰上,摇晃10min,低温高速离心5min,弃上清,沉淀用pbs缓冲液重悬,再低温高速离心5分钟,弃上清,加入200μl预先配制好的提取液b(每200μl蛋白提取液b加入1μl蛋白酶抑制剂混合物,混匀后得到提取液b,置冰上备用。)在沉淀中,吹匀后涡旋,放置冰上,摇床摇晃30min,低温高速离心10min,取上清,得细胞核蛋白。
72.(3)蛋白含量测定
73.bca蛋白定量试剂盒购于上海贝博生物科技有限公司。
74.配制bca工作液;稀释标准品;每孔加入1μl或者2μl的待测蛋白后,加入pbs缓冲液补足20μl;向各孔加入0.2ml bca工作液,放置37℃烘箱中孵育30min;取出96孔板,摇晃均匀,酶标仪检测结果,于λ=562nm处测定吸光值,计算出蛋白浓度。
75.蛋白变性:加入5
×
上样缓冲液,100℃煮沸10min,使蛋白变性,保存于-20℃中。
76.(4)电泳步骤
77.配胶:将下层胶配置液加入到50ml离心管中,颠倒混匀。将配制好的下层胶溶液用1ml长枪头缓慢地加入到玻璃板中,小心的注入,避免产生气泡,再用超纯水进行液封40min,待凝固后,取上层胶配制液加入到50ml离心管中,颠倒混匀。小心地倒出超纯水,用吸水纸将残留的超纯水吸净,将上层胶缓缓加入玻璃板中,使液面超过玻璃板,垂直插上10孔梳子,待上层胶凝固后,可直接进行实验,如果隔天使用则置于4℃放入电泳液中浸泡。
78.上样:将5
×
上样缓冲液加入蛋白样品,煮沸10min,贴上封口膜,防止ep管爆开漏液。将蛋白样品进行涡旋,高速涡旋5s。按照长玻璃在外侧,短玻璃在内侧,安装电泳装置;缓缓加入电泳缓冲液,缓冲液没过电泳槽,垂直拔出梳子,上样,使用上样枪头,插入上样孔中,不要扎入胶内,缓慢上样。marker孔加入3μl,上样完毕后再补满电泳液,上层胶恒压电泳,设定参数为(恒压80v;30min),设置下层胶恒压电泳,设定参数为(恒压120v;60min),跑至距长板底部0.5cm处停止电泳。
79.切胶:打开两块玻璃板,记住上样顺序,根据marker的痕迹,将胶放在电泳液中,将含有目的蛋白的胶切下,根据胶的大小剪pvdf膜。
80.转膜:将pvdf膜提前在甲醇中激活,活化1min。电转槽中加入电转液,用电转液润湿转印滤纸,采用三明治法,在电泳槽中加入冰袋(电转过程中热量较大),将电转槽放入含有冰块的冰盒中,恒流转膜,设置参数为(恒流300ma,70min),根据目的蛋白分子量的大小进行时间的调整。
81.封闭:将条带放置盒内,用5%牛血清白蛋白(bsa)浸没过条带,冰上封闭1h。封闭结束后,用tbst缓冲液(取2.42g三羟甲基氨基甲烷,8g nacl,1ml吐温-20定容至1l,即得;下同)清洗条带3次,每次10min。
82.封闭及一抗杂交:配制好含5%脱脂奶粉的tbst封闭液(每个条带约用3ml)。把膜取出,用镊子把pvdf膜放进手套中,根据marker的位置,用剪刀将膜剪成不同的条带,将条带取出,放入含有封闭液的转膜盒中,放置摇床上,冰上封闭50min;倾出封闭液,用tbst缓冲液润洗3遍,每次5min;一抗杂交(5%脱脂奶粉),从-20℃冰箱中取出待用抗体(稀释比例1:1500),4℃摇床过夜。
83.二抗杂交:回收一抗,tbst缓冲液润洗3次,每次10min;二抗杂交(tbst),50min,抗体(稀释比例1:5000);弃去二抗杂交液,tbst缓冲液润洗3次,每次5min;
84.显影:倾出tbst缓冲液,将购于affinity公司的ecl化学发光显影液中i液和ii液按体积比(ml:ml)1:1混匀,直接加于膜表面。
85.由图10可知,金石蚕苷作用于hela细胞24h后,可导致keap1蛋白表达量上调,核内nrf2蛋白表达量下降,提示金石蚕苷能够诱导细胞核nrf2蛋白水平下降,使keap1-nrf2信号通路失活,从而导致抗氧化酶表达量减少,细胞中ros水平增多,最终细胞无法对抗过多的ros,导致细胞死亡。
86.实施例4:金石蚕苷对hela细胞中bax、bcl-2、casepase-3、cleaved casepase-3蛋白表达影响
87.细胞凋亡的重要途径之一是线粒体途径。bcl-2家族的成员与该途径的调节密切相关,其中促凋亡蛋白bax和抗凋亡蛋白bcl-2的平衡能够决定细胞是否会发生凋亡。具体操作步骤同实施例3。
88.由图11可知,金石蚕苷作用于hela细胞后,与对照组相比较,bax/bcl-2比例明显上升,呈现明显剂量依赖性;cleaved caspase-3蛋白含量增加,caspase-3含量降低。因此推测:由于ros的大量产生,可以激活线粒体途径的凋亡发生。金石蚕苷主要通过激活促凋亡蛋白bax并且抑制抗凋亡蛋白bcl-2活性,促使bax/bcl-2比例上调,使caspase-3活化为cleaved caspase-3,导致线粒体损伤,从而诱导细胞凋亡。
89.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。