含有葡萄糖激酶激活剂和ppar受体激活剂的药物组合及其制备方法和用途
1.本技术是申请日为2019年5月28日、申请号为201910453724.4、发明名称为“含有葡萄糖激酶激活剂和ppar受体激活剂的药物组合及其制备方法和用途”的发明专利申请的分案申请。
2.优先权要求
3.本技术要求申请日为2018年5月31日的中国发明专利申请号201810556685.6的优先权,其全部公开内容通过引用并入本文。
技术领域
4.本发明涉及包含葡萄糖激酶激活剂(glucokinase activator,gka)药物与组合药物(partner drug)的药物组合、组合物和固定剂量复方(fixed dose combination,fdc)制剂,其制备方法及其用于治疗某些疾病的用途。
5.在更详细方面中,本发明涉及包含葡萄糖激酶激活剂药物与组合药物的药物组合、药物组合物或固定剂量复方的口服固体制剂,及其制备方法。本发明还涉及包含葡萄糖激酶激活剂的药物组合、药物组合物或固定剂量复方制剂的用途,其用于治疗和/或预防一种或多种疾病及医学病症,包括但不限于i型糖尿病、ii型糖尿病、非酒精性脂肪肝病,非酒精性脂肪肝炎、葡萄糖耐量降低、空腹血糖异常、肥胖症以及高血压症。此外,本发明还涉及治疗和/或预防一种或多种疾病及医学病症的方法,其中包括向有需要的受试者给予治疗有效量的本发明的药物组合、药物组合物或固定剂量复方制剂。
背景技术:
6.糖尿病已成为世界范围的普遍性疾病,其全球患者数量现为4.25亿,而中国患者人数高达1.2亿(international diabetes federation,diabetes atlas,2015)。ii型糖尿病即非胰岛素依赖型糖尿病(non-insulin dependent diabetes mellitus,niddm),占糖尿病患者的90%以上。ii型糖尿病,是一种由于胰岛素分泌障碍和胰岛素抵抗引起的人体血糖稳态平衡失调而导致的高血糖慢性代谢功能紊乱性疾病。人体血糖平衡主要是由胰岛素、胰高糖素两个控糖激素协调完成。
7.葡萄糖传感器葡萄糖激酶(glucokinase,gk)感应血糖变化,调控信使控糖激素、胰岛素和胰高糖素以及glp-1(胰高血糖素样肽-1)的分泌,构成人体血糖稳态调控的传感系统。控糖激素控制的葡萄糖摄取时葡萄糖储备和空腹时葡萄糖供给,构成人体血糖稳态调控。参与葡萄糖储备的器官主要有肝脏、肌肉和脂肪,在血糖和胰岛素的作用下摄取葡萄糖并转化为肝糖原、肌糖原和甘油三酯。参与葡萄糖供给的主要器官为肝脏,在血糖和胰高糖素的作用下,通过肝糖合成和肝糖输出为人体供糖。胰岛素还可有效调节钠-葡萄糖协同转运蛋白sglt-2的活性,在血糖升高时,把肾脏排泄的葡萄糖重新吸收,为人体葡萄糖储备所用。葡萄糖摄取和肝糖输出,以及各器官对葡萄糖的使用构成人体血糖稳态平衡的操作运营系统。葡萄糖的传感系统和操作运营系统的协同运作,构成对人体血糖稳态的随机调
控。
8.在糖尿病患者中,由于葡萄糖激酶功能和表达受损,传感器功能失调,造成控糖激素早相分泌失调,影响葡萄糖的摄取和输出,造成餐后高血糖、餐前低血糖。控糖激素信号指令异常,造成葡萄糖摄取和输出操作执行系统中关键蛋白的功能和表达异常,形成异常状态运行,形成ii型糖尿病。
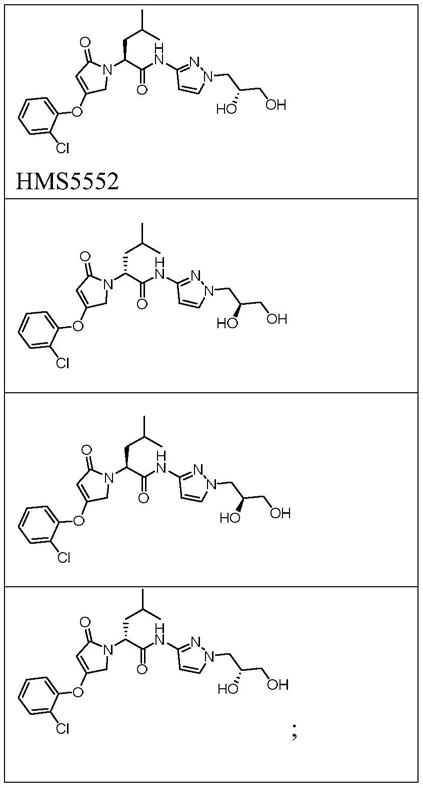
9.现有糖尿病口服降糖药,通常作用于单一控糖器官,不能有效治疗血糖稳态平衡系统失调的问题。葡萄糖激酶激活剂代表一类开发用于治疗或者改进患有ii型糖尿病患者疾病状态的新药。例如,((s)-2-[4-((2-氯-苯氧基)-2-氧代-2,5-二氢-吡咯-1-基]-4-甲基-戊酸[1-((r)-2,3-二羟基-丙基)-1h-吡唑-3-基]-酰胺(下文中称作hms5552)能有效改善糖尿病患者的葡萄糖传感器功能,是目前最有希望解决以上临床需求的糖尿病治疗药物。
技术实现要素:
[0010]
糖尿病患者在治疗中经常碰到这样的情况:仅使用ppar受体激活剂疗效不佳,无法将血糖控制在理想水平,尤其在使用一段时间之后。对此,本发明人发现,将ppar受体激活剂和葡萄糖激酶激活剂联合,能够显著提高ppar受体激活剂的降糖效果并降低安全风险,因而得到了本发明的含有葡萄糖激酶激活剂和ppar受体激活剂的药物组合、组合物和复方制剂。
[0011]
更具体而言,ppar受体激活剂和葡萄糖激酶激活剂联合,能提高中晚期患者多器官功能,更有效地治疗糖尿病以及伴随疾病和并发症;能够减少患者的服药粒数,提高患者的顺应性;减少了达到相同疗效的药物总剂量,使用最小的剂量达到了最大的药效,对治疗或预防一种或多种ⅰ型糖尿病、ii型糖尿病、高血糖症、葡萄糖耐量降低、肥胖症等症状有良好的效果和实际的意义。
[0012]
另一方面,本发明的含有葡萄糖激酶激活剂和组合药物(第二种或更多种活性药物成分)的固定剂量复方制剂,不仅其治疗效果优于这两种或多种药物的单独使用,还解决了复方制剂中通常存在的技术挑战。本发明的固定剂量复方制剂能够解决两种或者多种活性成分释放同步且含量均匀的问题,并可优化制剂中含有的活性成分的溶出速率,尤其是使得制剂中含有的活性成分在小肠ph环境中快速释放,这有益于药物及时或同时到达在肠道,胰岛和肝脏靶点器官,实现一靶多点、协同降糖的临床优势,起到发挥更好的疗效和降低毒副作用的效果。其次,本发明的含有葡萄糖激酶激活剂和组合药物(第二种或更多种活性药物成分)的固定剂量复方制剂还具有较短的崩解时限,并具有良好溶出特性和/或使得葡萄糖激酶激活剂能够在患者中具有高生物利用度。
[0013]
本发明提供了包含葡萄糖激酶激活剂,例如,结构如下所示的hms5552,或其同位素标记物,或其可药用盐,与其他口服降糖药物的药物组合、药物组合物、固定剂量复方制剂,尤其固体制剂,例如口服固体制剂,例如片剂,
[0014][0015]
具体的,本发明还提供了包含葡萄糖激酶激活剂药物例如hms5552或其可药用盐与ppar受体激活剂的药物组合、药物组合物或固定剂量复方制剂。所述ppar受体激活剂的实例包括罗格列酮、吡格列酮、西格列他钠(chiglitazar),及其可药用盐。
[0016]
更具体而言,本发明还提供了包含葡萄糖激酶激活剂药物例如hms5552或其可药用盐及组合药物例如罗格列酮的固定剂量复方的固体制剂。所述固体制剂优选为片剂,并且更优选是包衣片剂。在一个实施方案中,所述葡萄糖激酶激活剂hms5552为包含聚合物载体的固体分散体形式。
[0017]
更具体而言,本发明还提供了包含葡萄糖激酶激活剂药物例如hms5552或其可药用盐及组合药物例如吡格列酮的固定剂量复方的固体制剂。所述固体制剂优选为片剂,并且更优选是包衣片剂。在一个实施方案中,所述葡萄糖激酶激活剂hms5552为包含聚合物载体的固体分散体形式。
[0018]
本发明还提供了通过干法或者湿法处理方法制备的葡萄糖激酶激活剂药物和组合药物(第二种或更多种活性药物成分)的药物组合、药物组合物或固定剂量复方制剂。本发明的药物组合、药物组合物或固定剂量复方制剂的释放方式为所述两种或多种活性药物成分的快速释放。
[0019]
本发明还提供了包含葡萄糖激酶激活剂药物及组合药物(第二种或更多种活性药物成分)的药物制剂,其具有短的崩解时限,其具有良好溶出特性和/或使得葡萄糖激酶激活剂能够在患者中具有高生物利用度。本发明还提供了通过干法或者湿法处理方法制备葡萄糖激酶激活剂药物和组合药物(第二种或更多种活性药物成分,例如罗格列酮或吡格列酮)的固定剂量组合的药物组合物或药物制剂的方法。干法处理方法包括干法压缩(压片)和干法制粒;湿法处理方法包括湿法制粒。
[0020]
本发明还提供了包含葡萄糖激酶激活剂药物及组合药物(第二种或更多种活性药物成分)的药物组合、药物组合物或药物制剂,以及用于预防代谢病症(尤其为ii型糖尿病)、减缓其进展、延迟或治疗该代谢病症的方法。
[0021]
本发明还提供了包含葡萄糖激酶激活剂药物及组合药物(第二种或更多种活性药物成分)的药物组合、药物组合物或药物制剂,以及用于在有需要的患者(尤其为患有ii型糖尿病的患者)中改善血糖控制的方法。
[0022]
本发明还提供了包含葡萄糖激酶激活剂药物及组合药物的药物组合、药物组合物或药物制剂,以及在血糖控制不充分的患者中改善血糖控制的方法。
[0023]
本发明还提供了包含葡萄糖激酶激活剂药物及组合药物的药物组合、药物组合物或药物制剂,以及用于预防、减缓或延迟葡萄糖耐量降低(igt)、空腹血糖异常(ifg)、高血压症、胰岛素抵抗和/或代谢综合征进展成ii型糖尿病的方法。
[0024]
本发明还提供了包含葡萄糖激酶激活剂药物及组合药物的药物组合、药物组合物及药物制剂,以及用于预防包括糖尿病并发症在内的疾病或病症、减缓其进展、延迟或治疗该疾病或病症的方法。
[0025]
本领域技术人员通过上下文说明以及通过实施例可明了本发明的其他目的。
[0026]
发明概述
[0027]
本发明的第一个方面提供包含以下组分的药物组合、药物组合物或药物制剂,及其制备方法和治疗糖尿病及其相关疾病的用途:
[0028]
(a)葡萄糖激酶激活剂,其为选自下列的化合物,或其可药用盐、其同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式;优选的,所述葡萄糖激酶激活剂为hms5552;更优选的,hms5552的存在方式是固体分散体形式,
[0029][0030]
(b)ppar受体激活剂;和
[0031]
(c)一种或多种赋形剂。
[0032]
本发明的另一个方面提供包含以下组分的药物组合、药物组合物或药物制剂,及其制备方法和治疗糖尿病及其相关疾病的用途:
[0033]
(a)葡萄糖激酶激活剂,其为选自hms5552化合物,或其可药用盐、其同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式;优选的,所述葡萄糖激酶激活剂为hms5552;更优选的,hms5552的存在方式是固体分散体形式;
[0034]
(b)罗格列酮、吡格列酮,或其可药用盐、其同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式;和
[0035]
(c)一种或多种赋形剂。
[0036]
特别是,本发明的一个方面还涉及含有hms5552固体分散体和组合药物(例如,罗格列酮、吡格列酮)的固定剂量组合的药物组合、药物组合物或药物制剂,及其制备方法和用途。
[0037]
定义
[0038]
除非另有说明,本文使用的所有技术和科学术语具有与本发明所属领域的技术人员通常理解相同的含义,但如有冲突,则以本说明书中的定义为准。
[0039]
如说明书和权利要求书中所用,单数形式“一”、“一个”和“该(所述)”包括复数形式,除非上下文另有明确说明。
[0040]
如无特殊说明,本说明书中的百分比(%)均为重量百分比(重量%)。
[0041]
在说明书和权利要求书中使用的涉及组分量、工艺条件等的所有数值或表述在所有情形中均应理解被“约”修饰。术语“约”当指数量或数值范围时,意思是所指数量或者数值范围是试验变异性内(或统计学实验误差内)的近似值,因此该数量或者数值范围可以在所述数量或数值范围的例如 5之间变化。
[0042]
涉及相同组分或性质的所有范围均包括端点,该端点可独立地组合。由于这些范
围是连续的,因此它们包括在最小值与最大值之间的每一数值。还应理解的是,本技术引用的任何数值范围预期包括该范围内的所有子范围。
[0043]
当本发明针对物理性质例如分子量或者针对化学性质以范围定义时,应包括范围的所有组合和亚组合以及其内的具体实施方式。术语“包含”(以及相关术语例如“含有”或“含”或“具有”或“包括”)包括这样一些实施方式,该实施方式为例如,物质、组合物、方法或过程等的任何组合,其“由所描述的特征组成”或者“基本上由所描述的特征组成”。
[0044]
本说明书和权利要求中使用的“和/或”,应当理解为相关联的组分“二者择一或二者”,即组分在一些情况中联合存在而在另一些情况中分开存在。多个用“和/或”列出的组分应当以同样的方式理解,即“一种或多种”相关联的组分。除了“和/或”从句具体确定的组分,其它组分可任选地存在,无论与那些具体确定的组分相关还是不相关。因此,作为非限制性实例,提及“a和/或b”,当用于连接开放式结尾的文字如“包括”,在一个实施方案中,可仅指a(任选地包括除b外的组分);在另一实施方案,可仅指b(任选地包括除a外的组分);在再一实施方案中,指a和b(任选的包括其它组分)等。
[0045]
应当理解,除非明确地相反指示,否则在本文要求保护的包括多于一步或一个行为的任何方法中,该方法的步骤和行为的顺序不必限制于所叙及的方法的步骤和行为的顺序。
[0046]
本发明使用的缩写具有在化学、生物学和制剂领域的通常含义。
[0047]
除非另有说明,否则在本发明上下文中的术语“ppar受体激活剂”或其任何种类(如“罗格列酮”、“吡格列酮”)还意欲包括其任一药学上可接受的盐、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体。
[0048]
hms5552,其曾用名为ro5305552,英文名为dorzagliatin,化学名为(s)-2-[4-(2-氯-苯氧基)-2-氧代-2,5-二氢-吡咯-1-基]-4-甲基-戊酸[1-((r)-2,3-二羟基-丙基)-1h-吡唑-3-基]-酰胺。
[0049]
除非另有说明,重量%(wt%)表示为占药物组合、药物组合物或药物制剂的总重量的百分比。
[0050]
固体分散体(solid dispersion,sd)是指将一种或多种药物活性成分高度分散到无活性的辅料或载体所形成的固体分散体系。
[0051]
eudragit(尤特奇)是合成药用辅料的商品名,它包括甲基丙烯酸共聚物和甲基丙烯酸酯共聚物,通称为聚丙烯酸树脂。聚丙烯酸树脂类辅料按其构成、比例及聚合度不同而分为不同的型号。其中,eudragit e为甲基丙烯酸二甲胺基乙酯与甲基丙烯酸酯的聚合物;eudragit l为甲基丙烯酸与甲基丙烯酸甲酯的聚合物,游离羧基:酯=1:1,eudragit s为甲基丙烯酸与甲基丙烯酸甲酯的聚合物,游离羧基:酯=1:2。
[0052]
在此使用的术语“片剂”意图包括所有形状和大小的经压缩的药物制剂,无论包衣与否。
[0053]
术语“有效量”或“治疗有效量”是指足以提供希望的生物结果的试剂的量。该结果可为疾病的征兆、症状或原因的减少和/或减轻,或任何其它希望的生物系统的变化。例如,治疗用途的“有效量”是指包含作为本发明活性成分的化合物的临床上显著减少疾病所需要的组合物的量。在任何个案中,适当的“有效”量可由本领域普通技术人员使用常规实验来测定。因此,表达方式“有效量”通常是指活性物质具有治疗效果时的量。
[0054]
本技术使用的术语“治疗(treat)”或“处置(treatment)”与术语“预防(prevent)”同义,意在表示推迟疾病发展、防止疾病发展和/或降低将会发展或预期会发展的所述症状的严重性。因此,这些术语包括改善已有的疾病症状、预防另外的症状、改善或预防症状的潜在的代谢原因、抑制障碍或疾病,例如,阻止障碍或疾病的发展、减轻障碍或疾病、使障碍或疾病退行、减轻由疾病或障碍导致的病症,或使疾病或障碍的症状停止。
[0055]“药用的”或“药理上可接受的”是指并非在生物学上或其它方面实质上不希望的物质,即,可将所述物质给药于个体,而不会导致任何不希望的生物作用或不会以有害的方式与包含这种物质的组合物的任何其它组分相互作用。
[0056]
本技术使用的术语“受试者”包括哺乳动物和非哺乳动物。哺乳动物的实例包括但不限于哺乳动物纲的任何成员:人、非人灵长类如黑猩猩及其它猿类和猴类;农场动物如牛、马、绵羊、山羊、猪;家养动物如兔、狗和猫;实验室动物,包括啮齿类动物如大鼠、小鼠和豚鼠等。非哺乳动物的实例包括但不限于鸟、鱼等。在本发明一个实施方案中,哺乳动物为人。
[0057]
作为本发明的含有葡萄糖激酶激活剂的药物组合、药物组合物或药物制剂(例如,固定剂量组合制剂)中的活性成分的化合物可以形成盐。除非另有说明,当提及本技术中具有所述化合物时,应理解为其包括对其盐的提及。本技术使用的术语“盐(一种或多种)”是指与无机和/或有机酸形成的酸式盐及与无机和/或有机碱形成的碱式盐。另外,当所述化合物含有碱性部分(例如但不限于,吡啶或咪唑)和酸性部分(例如但不限于,羧酸)时,可形成两性离子(“内盐”)且所述两性离子(“内盐”)包含在本技术使用的术语“盐(一种或多种)”中。优选为药用(即,无毒的,生理学上可接受的)盐,但其它盐也是有用的。所述化合物的盐可例如通过以下方法形成:在介质中使所述化合物与一定量的(例如等量的)酸或碱反应,所述介质为例如盐在其中析出的介质或为含水介质(反应后冻干)。
[0058]
不同化合物及其盐、溶剂化物、酯和前药的多晶型形式意在包括在本发明中。
[0059]
应当理解本文采用的术语用于描述具体实施方案的目的,而不意在进行限制。此外,尽管在本发明的实践或试验中可以使用与本文描述的那些类似或等价的任何方法、装置和材料,但是下文描述了优选的方法、装置和材料。
附图说明
[0060]
图1为罗格列酮单独给药,以及hms5552和罗格列酮联合给药对正常小鼠葡萄糖负荷后血糖的影响(n=10);
[0061]
图2为罗格列酮单独给药,以及hms5552和罗格列酮联合给药对正常小鼠葡萄糖负荷后auc
0-120min
的影响(n=10;***,p《0.001)。
[0062]
发明详述
[0063]
本发明的一方面涉及葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)和组合药物(例如,罗格列酮、吡格列酮)的药物组合、药物组合物或者药物制剂如固定剂量复方制剂。所述制剂可以为粉剂、颗粒剂、片剂、胶囊、小袋或者其他固体形式等。具体而言,本发明的一个方面涉及含有葡萄糖激酶激活剂和组合药物(例如,罗格列酮、吡格列酮)的固定剂量组合的片剂。
[0064]
在本发明的一个具体方面中,药物组合、药物组合物或药物制剂包含:
[0065]
(1)葡萄糖激酶激活剂或其可药用盐、或其同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式;优选的,所述葡萄糖激酶激活剂优选为hms5552;更优选的,hms5552的存在形式是固体分散体形式,例如包含聚合物载体的固体分散体形式(例如,喷雾干燥粉末);
[0066]
(2)ppar受体激活剂;优选的,其选自:罗格列酮、吡格列酮,或其可药用盐、其同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式;和/或
[0067]
(3)填充剂;和/或
[0068]
(4)粘合剂;和/或
[0069]
(5)崩解剂;和/或
[0070]
(6)润滑剂或者助流剂;和/或
[0071]
(7)包衣剂。
[0072]
在本发明的一个实施方案中,药物组合、药物组合物或者药物制剂还可以含有一种或者多种赋形剂,所述赋形剂选自一种或者多种粘合剂;一种或者多种稀释剂(填充剂);一种或者多种崩解剂;一种或者多种润滑剂;一种或者多种助流剂;一种或者多种表面活性剂或者润湿剂;和一种或者多种抗氧化剂;和一种或多种包衣剂。
[0073]
药物组合、药物组合物或药物制剂
[0074]
葡萄糖激酶激活剂 ppar受体激活剂
[0075]
在一个实施方案中,本发明涉及一种药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂),其包含:
[0076]
(a)葡萄糖激酶激活剂,其为下式表示的化合物,或其可药用盐、或其同位素标记物,或其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式
[0077][0078]
(b)ppar受体激活剂;
[0079]
优选地,其中所述ppar受体激活剂选自罗格列酮或马来酸罗格列酮、吡格列酮或盐酸吡格列酮和西格列他钠;
[0080]
(c)一种或多种赋形剂;
[0081]
其中上述药物(a)和(b)同时、分别或相继使用。
[0082]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,所述葡萄糖激酶激活剂与ppar受体激活剂的重量比为约50:1至1:10,优选地为约25:1至1:5,更优选地为约1:10、约1:5、约1:2、约1.67:1、约3.33:1、约5:1、约6.25:1、约6.67:1、约12.5:1、约18.75:1或约25:1。
[0083]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,所述葡萄糖激酶激活剂以约1毫克至约200毫克,优选地约25毫克至约100毫克的剂量(优选单位剂量)范围存在,优选地,其中所述葡萄糖激酶激活剂的剂量(优选单位剂量)为约25毫克、约50毫克、约75毫克或约100毫克。
[0084]
在一个实施方案中,上述药物组合、药物组合物或药物制剂中,所述ppar受体激活剂以约1毫克至约50毫克,优选地约4毫克至约15毫克的剂量(优选单位剂量)范围存在,优选地,其中所述ppar受体激活剂的剂量(优选单位剂量)为约1毫克、约2毫克、约4毫克、约5毫克、约10毫克、约12毫克、约14毫克或约15毫克,最优选为约4毫克或约15毫克;优选地,所
述ppar受体激活剂为罗格列酮或吡格列酮。
[0085]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,上述的葡萄糖激酶激活剂为化合物hms5552,或其同位素标记物,或其可药用盐。
[0086][0087]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,葡萄糖激酶激活剂以固体分散体的形式存在。
[0088]
在一个实施方案中,所述固体分散体通过葡萄糖激酶激活剂,或其同位素标记物,或其药学上可接受的盐与聚合物载体一起通过喷雾干燥、热熔或冷冻干燥等方式得到。
[0089]
在一个实施方案中,固体分散体中葡萄糖激酶激活剂的含量,以固体分散体的总重量计,可以在约1重量%至约99重量%之间变化,优选为10重量%~90重量%。在一个实施方案中,葡萄糖激酶激活剂的含量范围为约1重量%,约2重量%,约3重量%,约4重量%,约5重量%,约6重量%,约7重量%,约8重量%,约9重量%,约10重量%,约11重量%,约12重量%,约13重量%,约14重量%,约15重量%,约16重量%,约17重量%,约18重量%,约19重量%,约20重量%,约21重量%,约22重量%,约23重量%,约24重量%,约25重量%,约26重量%,约27重量%,约28重量%,约29重量%,约30重量%,约31重量%,约32重量%,约33重量%,约34重量%,约35重量%,约36重量%,约37重量%,约38重量%,约39重量%,约40重量%,约41重量%,约42重量%,约43重量%,约44重量%,约45重量%,约46重量%,约47重量%,约48重量%,约49重量%,约50重量%,约51重量%,约52重量%,约53重量%,约54重量%,约55重量%,约56重量%,约57重量%,约58重量%,约59重量%,约60重量%,约61重量%,约62重量%,约63重量%,约64重量%,约65重量%,约66重量%,约67重量%,约68重量%,约69重量%,约70重量%,约71重量%,约72重量%,约73重量%,约74重量%,约75重量%,约76重量%,约77重量%,约78重量%,约79重量%,约80重量%,约81重量%,约82重量%,约83重量%,约84重量%,约85重量%,约86重量%,约87重量%,约88重量%,约89重量%,约90重量%,约91重量%,约92重量%,约93重量%,约94重量%,约95重量%,约96重量%,约97重量%,约98重量%,或约99重量%,或其间的任意范围。
[0090]
在一个实施方案中,固体分散体中葡萄糖激酶激活剂的含量,以固体分散体的总重量计,为约1重量%至约20重量%、约2重量%至约40重量%、约30重量%至约60重量%、约60重量%至约80重量%、约70重量%至约90重量%或者约80重量%至约100重量%。
[0091]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,所述葡萄糖激酶激活剂以固体分散体的形式存在,所述葡萄糖激酶激活剂的固体分散体与ppar受体激活剂的重量比为约100:1至1:5,优选地为约50:1至2:5,更优选地为约1:5、约2:5、约1:1、约3.33:1、约6.67:1、约10:1、约12.5:1、约13.3:1、约25:1、约37.5:1或约50:1。
[0092]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方
制剂)中,葡萄糖激酶激活剂为化合物hms5552、其同位素标记物或其药学上可接受的盐,其与聚合物载体一起通过喷雾干燥、热熔或冷冻干燥等方式得到固体分散体。
[0093]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,上述固体分散体中的聚合物载体选自聚丙烯树脂类聚合物,其是由丙烯酸(或甲基丙烯酸及它们的酯如:甲酯、乙酯等)以本体(一种单体)聚合,或者与甲基丙烯酸(或它的酯如:甲酯、乙酯、二甲胺基乙酯等)以二种单体(二元)或以三种单体(三元)按一定比例共聚而形成的高分子化合物。
[0094]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中的固体分散体中使用的所述聚合物载体选自甲基丙烯酸丁酯、甲基丙烯酸二甲胺基乙酯和甲基丙烯酸甲酯的共聚物,甲基丙烯酸和丙烯酸乙酯的共聚物,甲基丙烯酸和甲基丙烯酸甲酯的共聚物,丙烯酸乙酯、甲基丙烯酸甲酯和甲基丙烯酸氯化三甲胺基乙酯的共聚物,丙烯酸乙酯和甲基丙烯酸甲酯的共聚物,甲基丙烯酸、丙烯酸甲酯和甲基丙烯酸甲酯的共聚物,甲基丙烯酸与丙烯酸丁酯的共聚物。
[0095]
在一个实施方案中,上述聚合物载体选自甲基丙烯酸丁酯、甲基丙烯酸二甲胺基乙酯和甲基丙烯酸甲酯(1:2:1)共聚物,甲基丙烯酸和丙烯酸乙酯(1:1)共聚物,甲基丙烯酸和甲基丙烯酸甲酯(1:2)共聚物,丙烯酸乙酯、甲基丙烯酸甲酯和甲基丙烯酸氯化三甲胺基乙酯(1:2:0.2)共聚物,丙烯酸乙酯、甲基丙烯酸甲酯和甲基丙烯酸氯化三甲胺基乙酯(1:2:0.1)共聚物,丙烯酸乙酯和甲基丙烯酸甲酯(2:1)共聚物,甲基丙烯酸与丙烯酸丁酯(35:65)共聚物,甲基丙烯酸与甲基丙烯酸甲酯(1:1)共聚物,甲基丙烯酸与甲基丙烯酸甲酯(35:65)共聚物。
[0096]
在一个实施方案中,上述聚合物载体为eudragit(尤特奇),包括eudragit e、eudragit l、eudragit s、eudragit rl和eudragit rs,其中eudragit e是以二甲胺基甲基丙烯酸酯和其他中性甲基丙烯酸酯类共聚而成,包括甲基丙烯酸二甲胺基乙酯与甲基丙烯酸酯的聚合物;eudragit l和eudragit s是以甲基丙烯酸与不同比例甲基丙烯酸酯类共聚而成,包括甲基丙烯酸与甲基丙烯酸甲酯共聚物,其中游离羧基:酯=1:1,或甲基丙烯酸与甲基丙烯酸甲酯共聚物,其中游离羧基:酯=1:2;eudragit rl和eudragit rs型为含有某些季胺基因的丙烯酸和甲基丙烯酸酯的共聚物,包括含有10%季胺基团的丙烯酸与甲基丙烯酸酯的共聚物和含有5%季胺基团的丙烯酸与甲基丙烯酸酯的共聚物。
[0097]
在一个实施方案中,上述聚合物载体选自:
[0098]
eudragit e100(尤特奇e 100),其为甲基丙烯酸丁酯、甲基丙烯酸二甲胺基乙酯和甲基丙烯酸甲酯(1:2:1)共聚物,包括尤特奇e po;
[0099]
eudragit l100(尤特奇l100),是甲基丙烯酸共聚物a型,其为甲基丙烯酸和甲基丙烯酸甲酯(1:1)阴离子共聚物;
[0100]
eudragit s100(尤特奇s 100),其为甲基丙烯酸和甲基丙烯酸甲酯(1:2)共聚物;
[0101]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552固体分散体中的聚合物载体为甲基丙烯酸共聚物a型(甲基丙烯酸与甲基丙烯酸甲酯(1:1)的阴离子共聚物),优选为eudragit,更优选为eudragitl100。
[0102]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552固体分散体中hms5552与eudragit l100的重量比为约1:10至10:1、约1:9
至9:1、约2:3至9:1、约3:4至9:1、约4:5至9:1、约5:6至9:1或约1:1至9:1;约2:3至4:1、约3:4至4:1、约4:5至4:1、约5:6至4:1或约1:1至4:1;约2:3至7:3、约3:4至7:3、约4:5至7:3、约5:6至7:3或约1:1至7:3;约2:3至3:2、约3:4至4:3、约4:5至5:4或约5:6至6:5;约1:4至4:1、约3:7至7:3、约2:3至3:2、约3:4至4:3、约4:5至5:4或约5:6至6:5或其间的任意范围。
[0103]
优选的,在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552固体分散体中hms5552与eudragit l100的重量比为约1:1、约2:3、约3:2、约1:4、约4:1、约3:4、约4:3、约4:5、约5:4、约5:6、约6:5、约7:3、约3:7、约1:9、约9:1,或其间的任意范围。
[0104]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,第二种活性成分为罗格列酮(或马来酸罗格列酮)。上述葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和罗格列酮(或马来酸罗格列酮)的药物组合、药物组合物或者固定剂量复方制剂中,按重量计,包含约1~98%葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约0.1~25%罗格列酮或马来酸罗格列酮;约0~90%的填充剂;约1~25%的粘合剂;约0~15%的崩解剂;约0.1~10%的润滑剂;约0~3%的助流剂;和约0~5%的包衣剂。所述药物组合物或药物制剂(优选为固定剂量复方制剂)通过湿法制粒方法或干法制粒方法制备,优选通过湿法制粒方法制备。
[0105]
在一个实施方案中,上述葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和罗格列酮(或马来酸罗格列酮)的药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)的剂量(优选单位剂量)为约1毫克~200毫克。优选的葡萄糖激酶激活剂的剂量(优选单位剂量)为约5毫克~100毫克。优选的,葡萄糖激酶激活剂的剂量(优选单位剂量)为约5毫克、约10毫克、约20毫克、约25毫克、约30毫克、约40毫克、约50毫克、约60毫克、约75毫克、约80毫克、约90毫克、约100毫克,或其间任意范围。更优选的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)的剂量(优选单位剂量)为约25毫克、约50毫克、约75毫克、约100毫克。优选的,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552以固体分散体的形式存在。
[0106]
在一个实施方案中,上述葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和罗格列酮(或马来酸罗格列酮)的药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,以罗格列酮的含量计算,其剂量(优选单位剂量)为约2毫克~约8毫克,优选的其剂量(优选单位剂量)为约2毫克、约4毫克和约8毫克。优选的,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552以固体分散体的形式存在。
[0107]
在本发明的药物组合、药物组合物或固定剂量复方制剂中,hms5552和罗格列酮(或马来酸罗格列酮)的剂量(优选单位剂量)的具体实施方案如下:
[0108]
(1)约25毫克hms5552和约4毫克罗格列酮(或约5.30毫克马来酸罗格列酮);
[0109]
(2)约50毫克hms5552和约4毫克罗格列酮(或约5.30毫克马来酸罗格列酮);
[0110]
(3)约75毫克hms5552和约4毫克罗格列酮(或约5.30毫克马来酸罗格列酮);和
[0111]
(4)约100毫克hms5552和约4毫克罗格列酮(或约5.30毫克马来酸罗格列酮);
[0112]
优选的,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552以固体分散体的形式存在。
[0113]
在一个实施方案中,本发明的药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)优选剂型为片剂。
[0114]
在一个实施方案中,上述片剂为葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和罗格列酮(或马来酸罗格列酮)的固定剂量复方片剂。
[0115]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为25mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/4mg罗格列酮(或可获得该剂量的量的马来酸罗格列酮)的片剂),按重量计,包含以下含量的各组分:约25mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约4mg的罗格列酮(或可获得该剂量的量的马来酸罗格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.5~3%的润滑剂;约0~0.5%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0116]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为50mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/4mg罗格列酮(或可获得该剂量的量的马来酸罗格列酮)的片剂),按重量计,包含以下含量的各组分:约50mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约4mg的罗格列酮(或可获得该剂量的量的马来酸罗格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.5~3%的润滑剂;约0~0.5%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0117]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为75mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/4mg罗格列酮(或可获得该剂量的量的马来酸罗格列酮)的片剂),按重量计,包含以下含量的各组分:约75mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约4mg的罗格列酮(或可获得该剂量的量的马来酸罗格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.5~3%的润滑剂;约0~0.5%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0118]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为100mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/4mg罗格列酮(或可获得该剂量的量的马来酸罗格列酮)的片剂),按重量计,包含以下含量的各组分:约100mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约4mg的罗格列酮(或可获得该剂量的量的马来酸罗格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.5~3%的润滑剂;约0~0.5%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激
活剂和eudragit l100。
[0119]
在一个实施方案中,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,第二种活性成分为吡格列酮(或盐酸吡格列酮)。上述葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和吡格列酮(或盐酸吡格列酮)的药物组合、药物组合物或者固定剂量复方制剂中,按重量计,包含约1~85%葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约0.1~25%吡格列酮(或盐酸吡格列酮);约0~90%的填充剂;约1~25%的粘合剂;约0~15%的崩解剂;约0.1~10%的润滑剂;约0~3%的助流剂;和约0~5%的包衣剂。所述药物组合物或药物制剂(优选为固定剂量复方制剂)通过湿法制粒方法或干法制粒方法制备,优选通过湿法制粒方法制备。
[0120]
在一个实施方案中,上述葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和吡格列酮(或盐酸吡格列酮)的药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)的剂量(优选单位剂量)为约1毫克~200毫克。优选的葡萄糖激酶激活剂的剂量(优选单位剂量)为约5毫克~100毫克。优选的,葡萄糖激酶激活剂的剂量(优选单位剂量)为约5毫克、约10毫克、约20毫克、约25毫克、约30毫克、约40毫克、约50毫克、约60毫克、约75毫克、约80毫克、约90毫克、约100毫克,或其间任意范围。更优选的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)的剂量(优选单位剂量)为约25毫克、约50毫克、约75毫克、约100毫克。优选的,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552以固体分散体的形式存在。
[0121]
在一个实施方案中,上述葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和吡格列酮(或盐酸吡格列酮)的药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,以吡格列酮的含量计算,其剂量(优选单位剂量)为约15毫克~约45毫克,优选的其剂量(优选单位剂量)为约15毫克、约30毫克和约45毫克。优选的,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552以固体分散体的形式存在。
[0122]
在本发明的药物组合、药物组合物或固定剂量复方制剂中,hms5552和吡格列酮(或盐酸吡格列酮)的剂量(优选单位剂量)的具体实施方案如下:
[0123]
(1)约25毫克hms5552和约15毫克吡格列酮(或约15.91毫克盐酸吡格列酮);
[0124]
(2)约50毫克hms5552和约15毫克吡格列酮(或约15.91毫克盐酸吡格列酮);
[0125]
(3)约75毫克hms5552和约15毫克吡格列酮(或约15.91毫克盐酸吡格列酮);
[0126]
(4)约100毫克hms5552和约15毫克吡格列酮(或约15.91毫克盐酸吡格列酮);
[0127]
优选的,上述药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)中,hms5552以固体分散体的形式存在
[0128]
在一个实施方案中,本发明的药物组合、药物组合物或药物制剂(优选为固定剂量复方制剂)优选剂型为片剂。
[0129]
在一个实施方案中,上述片剂为葡萄糖激酶激活剂(hms5552或其同位素标记物或药学上可接受的盐)和吡格列酮(或盐酸吡格列酮)的固定剂量复方片剂。
[0130]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为25mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的
盐)/15mg吡格列酮(或可获得该剂量的量的盐酸吡格列酮)的片剂),按重量计,包含以下含量的各组分:约25mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约15mg的吡格列酮(或可获得该剂量的量的盐酸吡格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.1~10%的润滑剂;约0~3%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0131]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为50mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/15mg吡格列酮(或可获得该剂量的量的盐酸吡格列酮)的片剂),按重量计,包含以下含量的各组分:约50mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约15mg的吡格列酮(或可获得该剂量的量的盐酸吡格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.1~10%的润滑剂;约0~3%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0132]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为75mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/15mg吡格列酮(或可获得该剂量的量的盐酸吡格列酮)的片剂),按重量计,包含以下含量的各组分:约75mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约15mg的吡格列酮(或可获得该剂量的量的盐酸吡格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.1~10%的润滑剂;约0~3%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0133]
在一个实施方案中,所述药物组合、药物组合物或药物制剂(优选为固定剂量复方片剂,其为100mg葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐)/15mg吡格列酮(或可获得该剂量的量的盐酸吡格列酮)的片剂),按重量计,包含以下含量的各组分:约100mg的葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐);约15mg的吡格列酮(或可获得该剂量的量的盐酸吡格列酮);约0~75%的任选的填充剂;约2~8%的粘合剂;约1~15%的崩解剂;约0.1~10%的润滑剂;约0~3%的助流剂和约0~5%的包衣剂;优选地,上述葡萄糖激酶激活剂为上文所述的固体分散体形式,优选所述固体分散体含葡萄糖激酶激活剂和聚合物载体,优选含约1:1的葡萄糖激酶激活剂和eudragit l100。
[0134]
在一个实施方案中,上述药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)还包含其它赋形剂,其中所述其它赋形剂包括但不限于稀释剂、增香剂(香精)、甜味剂和着色剂中的一种或它们的混合物。
[0135]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)中,含有任选的一种或者多种填充剂(稀释剂)。填充剂的实例包括但不限于纤
维素衍生物诸如微晶纤维素或木纤维素(包括微晶纤维素和硅化微晶纤维素)、乳糖、无水或一水乳糖、蔗糖、淀粉、预胶化淀粉、右旋糖、甘露醇(包括甘露醇pearlitol sd 200)、果糖、木糖醇、山梨醇、玉米淀粉、改性玉米淀粉、无机盐诸如碳酸钙、磷酸钙、磷酸二钙、硫酸钙、糊精/葡萄糖结合剂、麦芽糊精、可压缩糖及其它已知的增容剂或填充剂和/或它们中两种或更多种的混合物。
[0136]
优选的填充剂(稀释剂)的实例包括微晶纤维素(mcc)、硅化微晶纤维素(smcc)、乳糖、甘露醇、山梨醇、磷酸二氢钙(二水合物)、玉米淀粉、预胶化淀粉和粉化纤维素。更优选的填充剂(稀释剂)是微晶纤维素、硅化微晶纤维素。微晶纤维素可以得自于数个供应商,包括fmc corporation制造的avicel ph 101、avicel ph 102,avicel ph 103,avicel ph105和avicel ph 200。
[0137]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)中,含有任选的一种或者多种粘合剂。实例包括但不限于羧甲基纤维素(包括羧甲基纤维素钠)、羟丙基纤维素(包括羟丙基纤维素exf)、玉米淀粉、预胶化淀粉、改性玉米淀粉、聚乙烯基吡咯烷酮(pvp)、羟丙基甲基纤维素(hpmc)(包括羟丙基甲基纤维素2208)、乳糖、蔗糖、阿拉伯胶、乙基纤维素、乙酸纤维素及蜡粘合剂诸如巴西棕榈蜡、石蜡、鲸蜡、聚乙烯类或微晶蜡及其它常规粘合剂和/或它们中两种或更多种的混合物。进一步,除了上述粘合剂外,适用于本发明的粘合剂还包括但不限于海藻酸、微晶纤维素、糊精、明胶、支链淀粉、液体葡萄糖、瓜尔胶、甲基纤维素、聚氧化乙烯、聚维酮和糖浆以及它们的组合。
[0138]
粘合剂的优选实施方案包括羟丙基纤维素(hpc)、羟丙基甲基纤维素(hmpc)、聚乙烯吡咯烷酮(聚维酮)、羟乙基纤维素、淀粉1500和共聚烯吡酮。更优选的粘合剂是羟丙基纤维素、羟丙基甲基纤维素和聚乙烯吡咯烷酮。
[0139]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)中,含有任选的一种或者多种崩解剂。适用于本发明的崩解剂的实例包括但不限于交联羧甲基纤维素钠、交聚维酮、乳糖、蔗糖、淀粉、马铃薯淀粉、预胶化淀粉、玉米淀粉、羧甲基淀粉钠、羟基乙酸淀粉钠、微晶纤维素、轻质硅酸酐、低取代的羟丙基纤维素及其它已知的崩解剂。
[0140]
在一个实施方案中,崩解剂选自改性淀粉、改性纤维素聚合物或者聚羧酸中的一种或多种,具体为选自交联羧甲基纤维素钠、交联聚维酮、羟基乙酸淀粉钠、波拉克林钾和羧甲基纤维素钙(cmc calcium)。在一个实施方案中,崩解剂是交联聚维酮。在另一种实施方案中,崩解剂是羟基乙酸淀粉钠。在另一个实施方案中,崩解剂是交联羧甲基纤维素钠。交联羧甲基纤维素钠nf类型a在市场上以商品名“ac-di-sol”获得。
[0141]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)含有一种或者多种润滑剂。适用于本发明的润滑剂的实例包括但不限于硬脂酸镁、硬脂酸锌、硬脂酸钙、滑石、巴西棕榈蜡、硬脂酸、棕榈酸、硬脂基富马酸钠、月桂基硫酸钠、棕榈酸硬脂酸甘油酯、棕榈酸、豆蔻酸及氢化植物油(包括氢化蓖麻油)和脂肪及其它已知的润滑剂和/或它们中两种或更多种的混合物。
[0142]
在一个实施方案中,润滑剂的实施方案包括硬脂酸镁、硬脂酸钙、硬脂酸、硬脂酰富马酸钠、氢化蓖麻油及其混合物。更优选的润滑剂是硬脂酸镁,或者硬脂富马酸钠,或者
其混合物。
[0143]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)含有一种或者多种助流剂和/或抗粘附剂。适用于本发明的助流剂和/或抗粘附剂的实例包括但不限于二氧化硅、胶态二氧化硅、硅酸镁、磷酸钙、三硅酸镁、滑石及其它形式的二氧化硅诸如聚集的硅酸盐和水化硅胶。
[0144]
在一个实施方案中,助流剂的实施方案包括胶体二氧化硅、磷酸钙、硅酸镁和滑石,或及其混合物。优选的助流剂是胶体二氧化硅。
[0145]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)还可以任选的含有一种或者多种表面活性剂或者润湿剂。表面活性剂可以为阴离子、阳离子或者中性表面活性剂。阴离子表面活性剂包括月桂基硫酸钠、十二烷基磺酸钠、油烯基硫酸钠和与硬脂酸酯和滑石混合的月桂酸钠。阳离子表面活性剂包括苯扎氯铵和烷基三甲基溴化铵。中性表面活性剂包括甘油单油酸酯、聚氧乙烯脱水山梨糖醇脂肪酸酯、聚乙烯醇和脱水山梨糖醇酯。润湿剂的实施方案包括泊洛沙姆、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物和聚氧乙烯硬脂酸酯。
[0146]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂)中还可以含有任选的抗氧化剂从而给予其化学稳定性。适用于本发明的抗氧化剂的实例包括但不限于生育酚、抗坏血酸、五倍子酸酯、抗坏血酸棕榈酸酯、丁羟茴醚、丁羟甲苯、硫代甘油、焦亚硫酸钾、丙酸、没食子酸丙酯、抗坏血酸钠、亚硫酸氢钠、偏亚硫酸氢钠和亚硫酸钠以及它们的组合。
[0147]
在一个实施方案中,抗氧化剂选自α-生育酚、γ-生育酚、δ-生育酚、富集生育酚的天然来源的提取物,l-抗坏血酸和它的钠或者钙盐、抗坏血酰棕榈酸酯、五倍子酸丙酯、五倍子酸辛酯、五倍子酸十二烷基酯、丁羟甲苯(bht)和丁羟茴醚(bha)。在一种实施方案中,抗氧化剂为bht或者bha。
[0148]
在一个实施方案中,本发明固定剂量复方制剂的优选制剂是通过压制方法制备的片剂。所述片剂可以进行包衣,包衣基材的优选例包括糖包衣基材、水溶性膜包衣基材、肠溶膜包衣基材等。
[0149]
糖包衣基材使用蔗糖。另外,还可组合使用选自滑石粉、沉淀碳酸钙、明胶、阿拉伯胶、支链淀粉、巴西棕榈蜡等中的一种或多种。
[0150]
水溶性膜包衣基材的例子包括纤维素聚合物,例如羟丙基纤维素、羟丙基甲基纤维素、羟乙基纤维素、甲基羟乙基纤维素等;合成的聚合物例如聚乙烯醇缩醛二乙基氨基乙酸酯、甲基丙烯酸氨基烷基酯共聚物e[eudragit e(商品名称)]、聚乙烯吡咯烷酮等。
[0151]
肠溶膜包衣基材的例子包括纤维素聚合物,例如羟丙基甲基纤维素邻苯二甲酸酯、乙酸琥珀酸羟丙基甲基纤维素、羧甲基乙基纤维素、乙酸邻苯二甲酸纤维素等;丙烯酸聚合物,例如甲基丙烯酸共聚物l[eudragit l(商品名称)]、甲基丙烯酸共聚物ld[eudragit l-30d55(商品名称)]、甲基丙烯酸共聚物s[eudragit s(商品名称)]等。
[0152]
包衣添加剂的优选例包括:增塑剂例如聚乙烯醇(pva)、聚乙二醇(peg)、丙二醇、柠檬酸三乙酯、蓖麻油、聚山梨酯等或其中两种或更多种的混合物;遮光剂例如二氧化钛等;着色剂、染料和色淀例如氧化铁红(三氧化二铁),氧化铁黄等;助流剂例如滑石等。
[0153]
在一个实施方案中,所述片剂可以用例如羟丙基纤维素和羟丙基甲基纤维素的混
合物进行包衣,该混合物中含有二氧化钛和/或其它着色剂,例如氧化铁、染料和色淀;聚乙烯醇(pva)和聚乙二醇(peg)的混合物;或者任何其它适宜的即时释放包衣剂。包衣对最终的片剂提供味道掩蔽和另外的稳定性。市售的包衣材料为colorcon提供的为预配制粉末混合物的欧巴代例如欧巴代03k12429。
[0154]
在一个实施方案中,本发明的药物组合、药物组合物或者药物制剂(优选为固定剂量复方制剂),也可以根据需要加入甜味剂和/或增香剂。
[0155]
在一个实施方案中,上述粘合剂为聚乙烯吡咯烷酮或者羟丙基纤维素或者羟丙基甲基纤维素,上述填充剂为微晶纤维素或硅化微晶纤维素或乳糖或磷酸二氢钙或甘露醇或玉米淀粉及预胶化淀粉,上述崩解剂为交联羧甲基纤维素钠或交联聚维酮或羟基乙酸淀粉钠,和上述润滑剂为硬脂酸镁或者硬脂富马酸钠,上述助流剂为胶体二氧化硅。
[0156]
在一个实施方案中,上述粘合剂为羟丙基纤维素,上述填充剂为微晶纤维素或硅化微晶纤维素或乳糖,上述崩解剂为交联羧甲基纤维素钠或交联聚维酮或羟基乙酸淀粉钠,和上述润滑剂为硬脂酸镁或者硬脂富马酸钠,上述助流剂为胶体二氧化硅。
[0157]
在一个实施方案中,上述粘合剂为聚乙烯吡咯烷酮,上述填充剂为微晶纤维素或硅化微晶纤维素,上述崩解剂为交联羧甲基纤维素钠或交联聚维酮,和上述润滑剂为硬脂酸镁或者硬脂富马酸钠,上述助流剂为胶体二氧化硅。
[0158]
在一个实施方案中,上述粘合剂为羟丙基甲基纤维素,上述填充剂为微晶纤维素或硅化微晶纤维素或乳糖,上述崩解剂为交联羧甲基纤维素钠或交联聚维酮或羟基乙酸淀粉钠,和上述润滑剂为硬脂酸镁或者硬脂富马酸钠,上述助流剂为胶体二氧化硅。
[0159]
在一个实施方案中,上述粘合剂为羟丙基纤维素,上述填充剂为微晶纤维素或硅化微晶纤维素或乳糖,上述崩解剂为交联羧甲基纤维素钠,和上述润滑剂为硬脂酸镁或者硬脂富马酸钠。
[0160]
在一个实施方案中,上述粘合剂为聚乙烯吡咯烷酮,上述润滑剂为硬脂酸镁,上述助流剂为胶体二氧化硅。
[0161]
制备方法
[0162]
在一个实施方案中,通过湿法制粒(高剪切和/或流化床)制备本发明的药物组合物或者固定剂量复方制剂。制粒是将粘合剂加入到溶剂中配制成粘合剂溶液,然后加入或者直接加入到制粒机中制成湿颗粒的方法。在湿法粒化方法中涉及的步骤包括以下:
[0163]
(1)将活性药物成分葡萄糖激酶激活剂(优选为hms5552)和组合药物(优选为罗格列酮或吡格列酮)加入到制粒机中;
[0164]
(2)将任选的填充剂(例如微晶纤维素,硅化微晶纤维素,乳糖)加入到步骤(1)得到的混合物中;
[0165]
(3)将任选的崩解剂(例如交联羧甲基纤维素钠,交联聚维酮,羟基乙酸淀粉钠)加入到步骤(1)或(2)得到的混合物中;
[0166]
(4)对于高剪切制粒,将粘合剂(例如羟丙基纤维素或聚乙烯吡咯烷酮或者羟丙基甲基纤维素)加入到纯水中配成粘合剂溶液,然后将其加入到制粒机中进行搅拌制粒。对于流化床制粒,将两种活性药物成分加入到流化床中,并通过压缩空气将粘合剂溶液喷入,所述粘合剂溶液为由粘合剂和纯水配成的水溶液;
[0167]
(5)得到的湿颗粒通过在适宜的整粒机整粒,得到适宜尺寸的湿颗粒;
[0168]
(6)通过高剪切制粒制备的颗粒在烘箱中进行托架干燥或者在流化床干燥器中进行干燥。对于通过流化床制粒得到的颗粒,颗粒然后在流化床中进行干燥;
[0169]
(7)在适宜的研磨机上整粒,得到适宜尺寸的干燥颗粒;
[0170]
(8)在适宜的混合机中,加入任选的填充剂(稀释剂,例如微晶纤维素)和任选的崩解剂(例如交联羧甲基纤维素钠)与干燥的颗粒混合;
[0171]
(9)将润滑剂(例如硬脂酸镁和硬脂富马酸钠)加入到步骤(8)的混合物中;
[0172]
(10)将任选的助流剂(例如胶态二氧化硅)加入到步骤(9)的混合物中;
[0173]
(11)将步骤(9)或(10)的经润滑颗粒混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状;和
[0174]
(12)任选地,将所得的片剂进行薄膜包衣。
[0175]
在另一种实施方案中,本发明的药物组合物通过湿法制粒(高剪切和/或流化床)进行制备。制粒是其中将粘合剂和第二种活性成分加入到溶剂中配制成粘合剂溶液(或混悬液),然后加入到制粒机中制成湿颗粒的方法。在湿法粒化方法中涉及的步骤包括以下:
[0176]
(1)将活性药物成分葡萄糖激酶激活剂(优选为hms5552)加入到制粒机中;
[0177]
(2)将任选的填充剂(例如微晶纤维素,硅化微晶纤维素,乳糖)加入到步骤(1)混合物中;
[0178]
(3)将任选的崩解剂(例如交联羧甲基纤维素钠,交联聚维酮,羟基乙酸淀粉钠)加入到步骤(1)或(2)得到的混合物中;
[0179]
(4)对于高剪切制粒,将粘合剂(例如羟丙基纤维素或聚乙烯吡咯烷酮或者羟丙基甲基纤维素)加入到溶剂中均匀分散或溶解,然后加入处方量的第二种活性成分(优选为罗格列酮或吡格列酮)进行分散或溶解,配成均匀的粘合剂体系。将该体系加入到制粒机中进行搅拌制粒。对于流化床制粒,将一种活性药物成分例如hms5552加入到流化床中,并通过压缩空气将粘合剂体系喷入,所述粘合剂溶液为由粘合剂和纯水或有机溶剂(例如乙醇)配成的溶液或混悬液;
[0180]
(5)得到的湿颗粒通过在适宜的整粒机中整粒,得到适宜尺寸的湿颗粒;
[0181]
(6)通过高剪切制粒制备的颗粒在烘箱中进行托架干燥或者在流化床干燥器中进行干燥。对于通过流化床制粒得到的颗粒,颗粒然后在流化床中进行干燥;
[0182]
(7)在适宜的研磨机上整粒,得到适宜尺寸的干燥颗粒;
[0183]
(8)在适宜的混合机中,加入任选的填充剂(稀释剂,例如微晶纤维素)和任选的崩解剂(例如交联羧甲基纤维素钠)与干燥的颗粒混合;
[0184]
(9)将润滑剂(例如硬脂酸镁和硬脂富马酸钠)加入到步骤(8)的混合物中;
[0185]
(10)任选地,将助流剂(例如胶态二氧化硅)加入到步骤(9)的混合物中;
[0186]
(11)将(9)或(10)的经润滑颗粒混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状;和
[0187]
(12)任选地,将所得的片剂进行薄膜包衣。
[0188]
在干法处理(直接压制或者干法制粒)方法中涉及的步骤包括:
[0189]
(1)将活性药物成分葡萄糖激酶激活剂(优选为hms5552)和组合药物(优选为罗格列酮或吡格列酮)加入到混合桶中;
[0190]
(2)将任选的填充剂(例如微晶纤维素,硅化微晶纤维素,乳糖)加入到步骤(1)中;
[0191]
(3)将任选的粘合剂(例如羟丙基纤维素或聚乙烯吡咯烷酮或者羟丙基甲基纤维素)加入到步骤(1)或(2)得到的混合物中;
[0192]
(4)将润滑剂或者助流剂加入到步骤(3)中,进行混合;
[0193]
(5)可以将步骤(4)的混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状,或者通过滚轴压缩机进行处理;
[0194]
(6)如果通过滚轴压缩机进行处理,将步骤(3)中的混合物事先进行混合,再进行滚轴碾压;如有必要,可以在适宜的研磨机上整粒得到所需尺寸的颗粒;
[0195]
(7)在适宜的混合器中,可以将任选的稀释剂加入到步骤(6)所得的颗粒中,从而改良压缩性能;
[0196]
(8)将任选的崩解剂(例如交联羧甲基纤维素钠,交联聚维酮,羟基乙酸淀粉钠)加入到步骤(7)中;
[0197]
(9)将任选的润滑剂或者助流剂加入到步骤(8)的混合物中;
[0198]
(10)将(9)或(10)的经润滑的颗粒混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状;和
[0199]
(11)任选地,将步骤(5)或者步骤(10)所得的片剂可以进行薄膜包衣。
[0200]
本发明一个实施方案中,本发明的药物组合、药物组合物或者固定剂量复方制剂中的葡萄糖激酶激活剂为固体分散体形式,其可通过选自喷雾干燥法,流化床干燥法,溶剂法,熔融挤出法等的方法制备。
[0201]
本发明一个实施方案为通过喷雾干燥法制备葡萄糖激酶激活剂的固体分散体的方法,其包括的步骤为:
[0202]
(1)配制喷雾干燥溶液,包括将聚合物载体和葡萄糖激酶激活剂(优选为hms5552)溶于溶剂中;
[0203]
(2)喷雾干燥,控制进风温度,进风量,雾化气流的流速和压力,和溶液的喷液速度等。
[0204]
本发明实施方案中,葡萄糖激酶激活剂的固体分散体的制备中所使用的溶剂包括但不限于链烷醇、酯、腈、环烷烃、芳烃、酮等。具体地,所述溶剂选自以下溶剂:无水乙醇,甲醇,异丙醇,乙酸乙酯,丙酮,乙腈,异丁醇,正己烷,苯和甲苯。可以是单一溶剂,也可以是混合溶剂,或者是有机溶剂和水的混合物。
[0205]
治疗和/或预防疾病的方法和用途
[0206]
本发明又一个实施方案涉及使用本发明的含有葡萄糖激酶激活剂的组合物或者制剂(优选固定剂量组合药物组合物或者固定剂量复方制剂)治疗和/或预防下列疾病及医学病症,尤其是一种或多种选自i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常以及高血糖症的疾病的方法或用途,包括向受试者给予治疗有效量的本发明的组合物或者制剂(优选固定剂量组合药物组合物或者固定剂量复方制剂):
[0207]-预防选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症和代谢综合征;或
[0208]-改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或
[0209]-预防、减缓、延迟或逆转葡萄糖耐量降低、胰岛素抵抗和/或代谢综合征进展成ii型糖尿病;或
[0210]-预防选自以下的病症或障碍、减缓该病症或障碍进展、延迟或治疗该病症或障碍:糖尿病并发症,例如白内障及微血管及大血管疾病,例如肾病、视网膜病变、神经病变、学习和记忆受损、神经变性或认知障碍、心血管或脑血管疾病、组织缺血、糖尿病足或溃疡、动脉硬化、高血压、内皮功能障碍、心肌梗塞、急性冠状动脉综合征、不稳定型心绞痛、稳定型心绞痛、中风、外周动脉阻塞性疾病、心肌病、心力衰竭、心律失常及血管再狭窄;或
[0211]-降低体重和/或身体脂肪、或预防体重和/或身体脂肪增加、或促进体重和/或身体脂肪的降低;或
[0212]-预防、减缓、延迟或治疗胰腺β细胞退化和/或胰腺β细胞功能降低,和/或改善和/或恢复或保护胰腺β细胞功能和/或恢复胰腺胰岛素分泌功能;或
[0213]-预防、减缓、延迟或治疗由肝脏或异位脂肪异常蓄积引起的疾病或病症;或
[0214]-保持和/或改善胰岛素敏感性和/或治疗或预防高胰岛素血症和/或胰岛素抵抗;或
[0215]-预防移植后新发作的糖尿病(nodat)和/或移植后的代谢综合征(ptms)、减缓其进展、延迟或治疗这些病症;或-预防、延迟或减少nodat和/或ptms相关并发症,包括微血管及大血管疾病及事件、移植排斥、感染及死亡;或
[0216]-治疗高尿酸血症及高尿酸血症相关病症;或
[0217]-非酒精性脂肪肝病,非酒精性脂肪肝炎。
[0218]
本发明还提供了通过口服给药需要所述治疗的受试者治疗有效量的一种本发明的含有葡萄糖激酶激活剂和组合药物的药物组合物或者制剂(优选固定剂量组合药物组合物或者固定剂量复方制剂)治疗ii型糖尿病的方法。在一种实施方案中,需要所述治疗的受试者是人类。在另一实施方案中,药物组合物为片剂的形式。本发明的含有葡萄糖激酶激活剂的组合物或者制剂(优选固定剂量组合药物组合物或者固定剂量复方制剂)可以每日一次(qd)、每日两次(bid)或者每日三次(tid)给药。
[0219]
具体地,本发明涉及以下具体实施方案。
[0220]
实施方案i
‑‑
葡萄糖激酶激活剂 ppar受体激活剂(例如罗格列酮)
[0221]
方案1.药物组合、药物组合物或固定剂量复方制剂,其包含:
[0222]
(a)葡萄糖激酶激活剂,其为下式表示的化合物,或其可药用盐、其同位素标记物、结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式,
[0223][0224]
(b)ppar受体激活剂;
[0225]
(c)一种或多种赋形剂;
[0226]
其中上述药物(a)和(b)同时、分别或相继使用。
[0227]
方案2.方案1的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂与ppar受体激活剂的重量比为约50:1至1:10,优选地为约25:1至1:5,更优选地为约1:10、约1:5、约1:2、约1.67:1、约3.33:1、约5:1、约6.25:1、约6.67:1、约12.5:1、约18.75:1或约25:1。
[0228]
方案3.方案1或2的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂按重量计约为1~98%;所述ppar受体激活剂按重量计约为0.1-25%。
[0229]
方案4.方案1-3中任一项的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂为下式表示的化合物hms5552或其可药用盐、其同位素标记物、结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式,
[0230]
[0231]
方案5.方案1-4中任一项的药物组合、药物组合物或固定剂量复方制剂,其中所述葡萄糖激酶激活剂为固体分散体形式。
[0232]
方案6.方案5的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂为包含聚合物载体的固体分散体形式,所述聚合物载体为甲基丙烯酸共聚物a型(甲基丙烯酸与甲基丙烯酸甲酯(1:1)的阴离子共聚物),优选为eudragit,更优选为eudragit l100。
[0233]
方案7.方案6的药物组合、药物组合物或固定剂量复方制剂,其中所述葡萄糖激酶激活剂与聚合物载体的重量比为约1:10至10:1,优选地为约1:9至9:1、约1:4至4:1、约3:7至7:3、约2:3至3:2、约3:4至4:3、约4:5至5:4或约5:6至6:5,更优选地为约1:1、约2:3、约3:4、约4:5或约5:6或其间的任意范围。
[0234]
方案8.方案1-7中任一项的药物组合、药物组合物或固定剂量复方制剂,其中所述ppar受体激活剂选自罗格列酮(或马来酸罗格列酮)、吡格列酮(或盐酸吡格列酮)、西格列他钠及其可药用盐。
[0235]
方案9.方案1-8中任一项的药物组合、药物组合物或固定剂量复方制剂,其中所述葡萄糖激酶激活剂以约1毫克至约200毫克,优选地约25毫克至约100毫克的剂量(优选为单位剂量)范围存在,优选地,其中所述葡萄糖激酶激活剂的剂量(优选为单位剂量)为约25毫克、约50毫克、约75毫克或约100毫克。
[0236]
方案10.方案1-9中任一项的药物组合、药物组合物或固定剂量复方制剂,其中,所述ppar受体激活剂以约1毫克至约50毫克,优选地约4毫克至约15毫克的剂量(优选单位剂量)范围存在,优选地,其中所述ppar受体激活剂的剂量(优选单位剂量)为约1毫克、约2毫克、约4毫克、约5毫克、约10毫克、约12毫克、约14毫克或约15毫克,最优选为约4毫克或约15毫克;优选地,所述ppar受体激活剂为罗格列酮或吡格列酮。
[0237]
方案11.方案1-10中任一项的药物组合、药物组合物或固定剂量复方制剂,所述一种或者多种赋形剂选自粘合剂、填充剂、崩解剂、润滑剂、助流剂、表面活性剂、润湿剂、抗氧化剂、增香剂、甜味剂、着色剂或者包衣剂。
[0238]
方案12.方案1-11中任一项的药物组合、药物组合物或固定剂量复方制剂,其为片剂。
[0239]
方案13.方案12的药物组合、药物组合物或固定剂量复方制剂,其为包衣片剂。
[0240]
方案14.方案13的药物组合、药物组合物或固定剂量复方制剂,所述包衣片剂为膜包衣片剂,所述膜包衣剂包含:
[0241]
膜包衣基材,例如羟丙基纤维素、羟丙基甲基纤维素或其混合物;
[0242]
任选的增塑剂,例如聚乙烯醇、聚乙二醇、丙二醇、聚山梨酯或它们的混合物;
[0243]
任选的着色剂,例如氧化铁红、氧化铁黄或其混合物;
[0244]
任选的遮光剂,如二氧化钛,和
[0245]
任选的助流剂。
[0246]
方案15.方案14的药物组合、药物组合物或固定剂量复方制剂,所述包衣片剂为膜包衣片剂,所述膜包衣剂为欧巴代。
[0247]
方案16.方案1-15中任一项的药物组合、药物组合物或固定剂量复方制剂,按重量计,其包含:
[0248]
约1~98%葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐),优选hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0249]
约0.1~25%罗格列酮;
[0250]
约0~90%的填充剂;
[0251]
约1~25%的粘合剂;
[0252]
约0~15%的崩解剂;
[0253]
约0.1~10%的润滑剂;
[0254]
约0~3%的助流剂;和
[0255]
约0~5%的包衣剂。
[0256]
方案17.方案方案16的药物组合、药物组合物或固定剂量复方制剂,按重量计,其包含
[0257]
约1~75%葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐),优选hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0258]
约0.1~15%罗格列酮;
[0259]
约0~90%的填充剂;
[0260]
约1~10%的粘合剂;
[0261]
约1~10%的崩解剂;
[0262]
约0.1~5%的润滑剂;
[0263]
约0~3%的助流剂;和
[0264]
约0~5%的包衣剂。
[0265]
方案18.方案16的药物组合、药物组合物或固定剂量复方制剂,按重量计,活性成分的剂量(优选为单位剂量)为:
[0266]
约25mg,约50mg,约75mg或约100mg的葡萄糖激酶激活剂,优选hms5552;
[0267]
约2毫克、约4毫克和约8毫克的罗格列酮;
[0268]
约0~90%的填充剂;
[0269]
约1~25%的粘合剂;
[0270]
约0~15%的崩解剂;
[0271]
约0.1~10%的润滑剂;
[0272]
约0~3%的助流剂;和
[0273]
约0~5%的包衣剂。
[0274]
方案19.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为25mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂),按重量计,其包含以下含量的各组分:
[0275]-约25mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0276]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0277]-约0~75%的填充剂;
[0278]-约2~8%的粘合剂;
[0279]-约1~5%的崩解剂;
[0280]-约0.5~3%的润滑剂;
[0281]-约0~0.5%的助流剂;和
[0282]-约0~5%的包衣剂。
[0283]
方案20.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为50mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂),按重量计,其包含以下含量的各组分:
[0284]-约50mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0285]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0286]-约0~75%的填充剂;
[0287]-约2~8%的粘合剂;
[0288]-约1~5%的崩解剂;
[0289]-约0.5~3%的润滑剂;
[0290]-约0~0.5%的助流剂;和
[0291]-约0~5%的包衣剂。
[0292]
方案21.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为75mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂),按重量计,其包含以下含量的各组分:
[0293]-约75mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0294]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0295]-约0~75%的填充剂;
[0296]-约2~8%的粘合剂;
[0297]-约1~5%的崩解剂;
[0298]-约0.5~3%的润滑剂;
[0299]-约0~0.5%的助流剂;和
[0300]-约0~5%的包衣剂。
[0301]
方案22.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为100mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂),按重量计,其包含以下含量的各组分:
[0302]-约100mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0303]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0304]-约0~75%的填充剂;
[0305]-约2~8%的粘合剂;
[0306]-约1~5%的崩解剂;
[0307]-约0.5~3%的润滑剂;
[0308]-约0~0.5%的助流剂;和
[0309]-约0~5%的包衣剂。
[0310]
方案23.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约50mg固体分散体、约5.30mg的马来酸罗格列酮、约177.20mg微晶纤维素、约7.50mg羟丙基纤维素、约7.50mg交联羧甲基纤维素钠、约2.50mg硬脂酸镁和约7.50mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约25mg hms5552。
[0311]
方案24.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约100mg固体分散体、约5.30mg的马来酸罗格列酮、约127.20mg微晶纤维素、约7.50mg羟丙基纤维素、约7.50mg交联羧甲基纤维素钠、约2.50mg硬脂酸镁和约7.50mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约50mg hms5552。
[0312]
方案25.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约150mg固体分散体、约5.30mg的马来酸罗格列酮、约123.70mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约75mg hms5552。
[0313]
方案26.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约200mg固体分散体、约5.30mg的马来酸罗格列酮、约63.09mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约100mg hms5552。
[0314]
方案27.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约50mg固体分散体、约5.30mg的马来酸罗格列酮、约177.20mg微晶纤维素、约7.50mg聚乙烯吡咯烷酮、约7.50mg交联羧甲基纤维素钠、约2.50mg硬脂酸镁和约7.50mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约25mg hms5552。
[0315]
方案28.一种方案1-27中任一项的药物组合、药物组合物或固定剂量复方制剂的方法,该方法包括将活性成份掺入一种或多种赋形剂进行制粒,优选进一步地将制得的颗粒混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状;更优选更进一步的将所得的片剂进行包衣。
[0316]
方案29.方案28的制备药物组合、药物组合物或固定剂量复方制剂的方法,其中通过湿法制粒(高剪切和/或流化床)制备,或者通过干法处理(直接压制或者干法制粒)制备。
[0317]
方案30.方案28-29中任一项的制备药物组合、药物组合物或固定剂量复方制剂的方法,其中所述葡萄糖激酶激活剂制备成固体分散体形式。
[0318]
方案31.方案28-30中任一项的制备药物组合、药物组合物或固定剂量复方制剂的方法,其中所述葡萄糖激酶激活剂和第二种或更多种活性成分也可以一起制备成复方固体分散体形式(即含有2种或多种活性成分的固体分散体)。
[0319]
方案32.如方案1-27中任意一项所述的药物组合、药物组合物或固定剂量复方制剂,其用于预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或预防、减缓、延迟或逆转糖尿病并发症。
[0320]
方案33.预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍的方法:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或预防、减缓、延迟或逆转糖尿病并发症,包括向受试者给予治疗有效量的方案1-27中任意一项所述的药物组合、药物组合物或固定剂量复方制剂。
[0321]
方案34.方案1-27中任意一项所述的药物组合、药物组合物或固定剂量复方制剂在制备用于预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍或预防、减缓、延迟或逆转糖尿病并发症的药物中的用途:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c。
[0322]
实施方案ii
‑‑
葡萄糖激酶激活剂 ppar受体激活剂-(例如吡格列酮)
[0323]
方案1.药物组合、药物组合物或固定剂量复方制剂,其包含:
[0324]
(a)葡萄糖激酶激活剂,其为下式表示的化合物,或其可药用盐、其同位素标记物、结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式,
[0325][0326]
(b)ppar受体激活剂;
[0327]
(c)一种或多种赋形剂;
[0328]
其中上述药物(a)和(b)同时、分别或相继使用。
[0329]
方案2.方案1的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂与ppar受体激活剂的重量比为约50:1至1:10,优选地为约25:1至1:5,更优选地为约1:10、约1:5、约1:2、约1.67:1、约3.33:1、约5:1、约6.25:1、约6.67:1、约12.5:1、约18.75:1或约25:1。
[0330]
方案3.方案1或2的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂按重量计约为1~95%;所述ppar受体激活剂按重量计约为0.1~25%。
[0331]
方案4.方案1-3中任一项的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂为下式表示的化合物hms5552或其可药用盐、其同位素标记物、结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式,
[0332][0333]
方案5.方案1-4中任一项的药物组合、药物组合物或固定剂量复方制剂,其中所述葡萄糖激酶激活剂为固体分散体形式。
[0334]
方案6.方案5的药物组合、药物组合物或固定剂量复方制剂,其中,所述葡萄糖激酶激活剂为包含聚合物载体的固体分散体形式,所述聚合物载体为甲基丙烯酸共聚物a型(甲基丙烯酸与甲基丙烯酸甲酯(1:1)的阴离子共聚物),优选为eudragit,更优选为eudragit l100。
[0335]
方案7.方案6的药物组合、药物组合物或固定剂量复方制剂,其中所述葡萄糖激酶激活剂与聚合物载体的重量比为约1:10至10:1,优选地为约1:9至9:1、约1:4至4:1、约3:7至7:3、约2:3至3:2、约3:4至4:3、约4:5至5:4或约5:6至6:5,更优选地为约1:1、约2:3、约3:4、约4:5或约5:6或其间的任意范围。
[0336]
方案8.方案1-7中任一项的药物组合、药物组合物或固定剂量复方制剂,其中所述ppar受体激活剂选自罗格列酮(或马来酸罗格列酮)、吡格列酮(或盐酸吡格列酮)、西格列他钠及其可药用盐。
[0337]
方案9.方案1-8中任一项的药物组合、药物组合物或固定剂量复方制剂,其中所述葡萄糖激酶激活剂约1毫克至约200毫克,优选地约25毫克至约100毫克的剂量(优选为单位剂量)范围存在,优选地,其中所述葡萄糖激酶激活剂的剂量(优选为单位剂量)为约25毫克、约50毫克、约75毫克或约100毫克。
[0338]
方案10.方案1-9中任一项的药物组合、药物组合物或固定剂量复方制剂,其中,所述ppar受体激活剂以约1毫克至约50毫克,优选地约4毫克至约15毫克的剂量(优选单位剂量)范围存在,优选地,其中所述ppar受体激活剂的剂量(优选单位剂量)为约1毫克、约2毫克、约4毫克、约5毫克、约10毫克、约12毫克、约14毫克或约15毫克,最优选为约4毫克或约15毫克;优选地,所述ppar受体激活剂为罗格列酮或吡格列酮。
[0339]
方案11.方案1-10中任一项的药物组合、药物组合物或固定剂量复方制剂,所述一
种或者多种赋形剂选自粘合剂、填充剂、崩解剂、润滑剂、助流剂、表面活性剂、润湿剂、抗氧化剂、增香剂、甜味剂、着色剂或者包衣剂。
[0340]
方案12.方案1-11中任一项的药物组合、药物组合物或固定剂量复方制剂,其为片剂。
[0341]
方案13.方案12的药物组合、药物组合物或固定剂量复方制剂,其为包衣片剂。
[0342]
方案14.方案13的药物组合、药物组合物或固定剂量复方制剂,所述包衣片剂为膜包衣片剂,所述膜包衣剂包含:
[0343]
膜包衣基材,例如羟丙基纤维素、羟丙基甲基纤维素或其混合物;
[0344]
任选的增塑剂,例如聚乙烯醇、聚乙二醇、丙二醇、聚山梨酯或它们的混合物;
[0345]
任选的着色剂,例如氧化铁红、氧化铁黄或其混合物;
[0346]
任选的遮光剂,如二氧化钛,和
[0347]
任选的助流剂。
[0348]
方案15.方案14的药物组合、药物组合物或固定剂量复方制剂,所述包衣片剂为膜包衣片剂,所述膜包衣剂为欧巴代。
[0349]
方案16.方案1-15中任一项的药物组合、药物组合物或固定剂量复方制剂,按重量计,其包含:
[0350]
约1~95%的葡萄糖激酶激活剂,优选hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0351]
约1~65%的吡格列酮或盐酸吡格列酮;
[0352]
约0~80%的填充剂;
[0353]
约1~25%的粘合剂;
[0354]
约0~15%的崩解剂;
[0355]
约0.1~10%的润滑剂;
[0356]
约0~3%的助流剂;和
[0357]
约0~5%的包衣剂。
[0358]
方案17.方案方案16的药物组合、药物组合物或固定剂量复方制剂,按重量计,其包含
[0359]
约1~85%葡萄糖激酶激活剂(优选为hms5552或其同位素标记物或药学上可接受的盐),优选hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0360]
约5~25%吡格列酮或盐酸吡格列酮;
[0361]
约0~90%的填充剂;
[0362]
约1~25%的粘合剂;
[0363]
约0~15%的崩解剂;
[0364]
约0.1~10%的润滑剂,和
[0365]
约0~3%的助流剂。
[0366]
方案18.方案16的药物组合、药物组合物或固定剂量复方制剂,按重量计,活性成分的剂量(优选为单位剂量)为:
[0367]
约25mg,约50mg,约75mg或约100mg的葡萄糖激酶激活剂,优选hms5552;
[0368]
约15毫克、约30毫克和约45毫克的吡格列酮或可获得该剂量的量的盐酸吡格列酮;
[0369]
约0~90%的填充剂;
[0370]
约1~25%的粘合剂;
[0371]
约0~15%的崩解剂;
[0372]
约0.1~10%的润滑剂;
[0373]
约0~3%的助流剂;和
[0374]
约0~5%的包衣剂。
[0375]
方案19.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为25mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂),按重量计,其包含以下含量的各组分:
[0376]-约25mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0377]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0378]-约0~90%的填充剂;
[0379]-约1~25%的粘合剂;
[0380]-约1~8%的崩解剂;
[0381]-约0.5~3%的润滑剂;
[0382]-约0~0.5%的助流剂;和
[0383]-约0~5%的包衣剂。
[0384]
方案20.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为50mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂),按重量计,其包含以下含量的各组分:
[0385]-约50mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0386]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0387]-约0~90%的填充剂;
[0388]-约1~25%的粘合剂;
[0389]-约1~8%的崩解剂;
[0390]-约0.5~3%的润滑剂;
[0391]-约0~0.5%的助流剂;和
[0392]-约0~5%的包衣剂。
[0393]
方案21.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为75mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂),按重量计,其包含以下含量的各组分:
[0394]-约75mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0395]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0396]-约0~90%的填充剂;
[0397]-约1~25%的粘合剂;
[0398]-约1~8%的崩解剂;
[0399]-约0.5~3%的润滑剂;
[0400]-约0~0.5%的助流剂;和
[0401]-约0~5%的包衣剂。
[0402]
方案22.方案18的药物组合、药物组合物或固定剂量复方制剂(所述固定剂量复方制剂优选为100mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂),按重量计,其包含以下含量的各组分:
[0403]-约100mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0404]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0405]-约0~90%的填充剂;
[0406]-约1~25%的粘合剂;
[0407]-约1~8%的崩解剂;
[0408]-约0.5~3%的润滑剂;
[0409]-约0~0.5%的助流剂;和
[0410]-约0~5%的包衣剂。
[0411]
方案23.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约150mg固体分散体、约15.91mg的盐酸吡格列酮、约113.09mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg的硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约75mg hms5552。
[0412]
方案24.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约200mg固体分散体、约15.91mg的盐酸吡格列酮、约73.09mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg的硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约100mg hms5552。
[0413]
方案25.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约100mg固体分散体、约15.91mg的盐酸吡格列酮、约260.09mg微晶纤维素、约12.00mg羟丙基纤维素、约8.00mg交联羧甲基纤维素钠、约4.00mg的硬脂酸镁和约12.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约50mg hms5552。
[0414]
方案26.方案18的药物组合、药物组合物或固定剂量复方制剂,其中包含约50mg固体分散体、约15.91mg的盐酸吡格列酮、约216.09mg微晶纤维素、约9.00mg羟丙基纤维素、约6.00mg交联羧甲基纤维素钠、约3.00mg的硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约25mg hms5552。
[0415]
方案27.一种方案1-26中任一项的药物组合、药物组合物或固定剂量复方制剂的方法,该方法包括将活性成份掺入一种或多种赋形剂进行制粒,优选进一步地将制得的颗粒混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状;更优选更进一步的将所得的片剂进行包衣。
[0416]
方案28.方案27的制备药物组合、药物组合物或固定剂量复方制剂的方法,其中通
过湿法制粒(高剪切和/或流化床)制备,或者通过干法处理(直接压制或者干法制粒)制备。
[0417]
方案29.方案27-28中任一项的制备药物组合、药物组合物或固定剂量复方制剂的方法,其中所述葡萄糖激酶激活剂制备成固体分散体形式。
[0418]
方案30.方案27-29中任一项的制备药物组合、药物组合物或固定剂量复方制剂的方法,其中所述葡萄糖激酶激活剂和第二种或更多种活性成分也可以一起制备成复方固体分散体形式(即含有2种或多种活性成分的固体分散体)。
[0419]
方案31.如方案1-26中任意一项所述的药物组合、药物组合物或固定剂量复方制剂,其用于治疗或预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或预防、减缓、延迟或逆转糖尿病并发症。
[0420]
方案32.治疗或预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍的方法:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或预防、减缓、延迟或逆转糖尿病并发症,包括向受试者给予治疗有效量的方案1-26中任意一项所述的药物组合、药物组合物或固定剂量复方制剂。
[0421]
方案33.方案1-26中任意一项所述的药物组合、药物组合物或固定剂量复方制剂在制备用于治疗或预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍或预防、减缓、延迟或逆转糖尿病并发症的药物中的用途:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c。
[0422]
以下实施例进一步描述和说明了在本发明范围内的实施方案。但本发明并不局限于实施例,在本发明的技术基础上做出的若干修改和替换均属于本发明的保护范围。
实施例
[0423]
葡萄糖激酶激活剂的复方片剂的制备
[0424]
本发明使用的化学品可以购自公司如shin-etsu japan,evonik germany,j.t.baker us,scr china,ashland us,fmc us,jrs germany,colorcon us,capsugel,basf,振兴试剂等。生产设备和分析测试仪器等可以购自这样的公司如sartorius,nikon,sympatec,bruker,gea niro,korsch,erweka,agilent,quadro engineering,canada;warters,us;ta,us;sotax,switzerland;mettler toledo instrument newark,de。
[0425]
i.葡萄糖激酶激活剂的固体分散体的制备
[0426]
1.1固体分散体喷雾干燥前溶液的制备
[0427]
实施例1a(活性成分与聚合物的重量比为1:9)
[0428]
称取eudragit l100(优特奇l100,evonik germany)6.75克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入0.75克化合物hms5552,加足量无水乙醇后继续
搅拌得到50ml溶液。
[0429]
实施例2a(活性成分与聚合物的重量比为3:7)
[0430]
称取eudragit l100(优特奇l100,evonik germany)5.25克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入2.25克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0431]
实施例3a(活性成分与聚合物的重量比为5:5)
[0432]
称取eudragit l100(优特奇l100,evonik germany)3.75克,在搅拌条件下加入无水乙醇(j.t.baker/)中,至完全溶解后加入3.75克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0433]
实施例4a(活性成分与聚合物的重量比为7:3)
[0434]
称取eudragit l100(优特奇l100,evonik germany)2.25克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入5.25克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0435]
实施例5a(活性成分与聚合物的重量比为8:2)
[0436]
称取eudragit l100(优特奇l100,evonik germany)1.5克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入6克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0437]
实施例6a(活性成分与聚合物的重量比为9:1)
[0438]
称取eudragit l100(优特奇l100,evonik germany)0.75克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入6.75克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0439]
实施例7a(活性成分与聚合物的重量比为6:4)
[0440]
称取eudragit l100(优特奇l100,evonik germany)3.0克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入4.5克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0441]
实施例8a(活性成分与聚合物的重量比为4:6)
[0442]
称取eudragit l100(优特奇l100,evonik germany)4.5克,在搅拌条件下加入无水乙醇(j.t.baker)中,至完全溶解后加入3.0克化合物hms5552,加足量无水乙醇后继续搅拌得到50ml溶液。
[0443]
实施例9a(活性成分与聚合物的重量比为5:5)
[0444]
称取eudragit l100(优特奇l100,evonik germany)187.5克,在搅拌条件下加入无水乙醇(振兴试剂)中,至完全溶解后加入187.5克化合物hms5552,继续搅拌得到2500ml溶液。
[0445]
1.2葡萄糖激酶激活剂的固体分散体的制备
[0446]
针对上述制备的溶液进行喷雾干燥,来制备葡萄糖激酶激活剂固体分散体。所得固体分散体的编号与上面实施例的编号对应。适用于本发明喷雾干燥设备包括但不限于niro gea process engineering inc.,buchi labortechnik ag,procept和spx anhydrous公司制作的喷雾干燥设备。可以通过选择合适的干燥气体进风温度、进风量、进液速度和雾化压力进行喷雾干燥,以便液滴在其到达装置壁时被充分干燥。这有助于确保
干燥的液滴基本上是固体,可以形成细粉末,并且不会粘壁,也不至于难以在旋风器中收集。所得粉末进行二次干燥,确保产品符合质量要求。
[0447]
喷雾干燥法制备葡萄糖激酶激活剂固体分散体生产工艺流程描述
[0448]
对上述实施例1a-8a中制备的溶液通过喷雾干燥来制备固体分散体,其中喷雾干燥机设置的进风温度为90-150℃,进风流速设置为0.3-0.5m3/min,气流的流速为15-30l/min,上述溶液的喷液速度为5-7ml/min,喷雾干燥得到固体分散体1-8。
[0449]
对上述实施例9a中制备的溶液通过喷雾干燥来制备固体分散体,其中喷雾干燥机设置的进风温度为90-150℃,进风流速设置为20-30kg/h,气流的流速为3-30kg/h,上述溶液的喷液速度为5-200ml/min,喷雾干燥得到固体分散体9。
[0450]
按照上述方式,分别制备了固体分散体1-9,其中:
[0451]
固体分散体1中化合物hms5552的质量分数为10%;固体分散体2中化合物hms5552的质量分数为30%;固体分散体3中化合物hms5552的质量分数为50%;固体分散体4中化合物hms5552的质量分数为70%;固体分散体5中化合物hms5552的质量分数为80%;固体分散体6中化合物hms5552的质量分数为90%;固体分散体7中化合物hms5552的质量分数为60%;固体分散体8中化合物hms5552的质量分数为40%;固体分散体9中化合物hms5552的质量分数为50%。
[0452]
ii.制备复方片剂
[0453]
2.1高剪切湿法制粒制备复方片剂
[0454]
将按照上述葡萄糖激酶激活剂的固体分散体的制备实施例制备的hms5552固体分散体和组合药物加入到高剪切湿法制粒机中,加入填充剂(例如微晶纤维素,或硅化微晶纤维素,或乳糖)和崩解剂(例如交联羧甲基纤维素钠,或交联聚维酮,或羟基乙酸淀粉钠),加入部分粘合剂粉末,高剪切搅拌混合5min。在1-6分钟时间内将配好的粘合剂(例如羟丙基纤维素或聚乙烯吡咯烷酮或者羟丙基甲基纤维素)溶液,高剪切搅拌下加入到上述干混物中进行制粒。湿颗粒在comil整粒机上进行整粒得到适宜尺寸的湿颗粒。将湿颗粒在约60℃托盘烘箱或者在流化床干燥机中(进风温度40-60℃)干燥20-40分钟。然后,利用研磨机对干燥的物料进行研磨,从而获得合适大小的颗粒。在研磨之后,将微晶纤维素或硅化微晶纤维素(针对有外加部分的填充剂)和崩解剂(例如交联羧甲基纤维素钠,或交联聚维酮,或羟基乙酸淀粉钠)加入到颗粒中和在桶式混合器中将其混合。然后,将润滑剂(硬脂酸镁或硬脂富马酸钠)和/或任选的助流剂(微粉硅胶)加入其中并且另外混合均匀。润滑的混合物利用旋转压片机进行压片,得到对应不同规格的不同片重和片型的片剂(素片,未包衣的片芯)。所得片剂任选用ii进行薄膜包衣重量增加大约3%,从而得到薄膜包衣片。
[0455]
实施例1b hms5552 罗格列酮复方片剂(剂量规格25mg/4mg)
[0456]
处方组成单位处方量/mg%(w/w)马来酸罗格列酮*5.302.12hms5552固体分散体**50.0020.00微晶纤维素177.2070.88羟丙基纤维素7.503.00交联羧甲基纤维素钠7.503.00硬脂酸镁2.501.00
片芯总重250.0100.00欧巴代7.503.00包衣片总重257.5
‑‑
[0457]
*5.30mg马来酸罗格列酮相当于4mg游离罗格列酮无水化物
[0458]
**50.00mg hms5552固体分散体相当于25mg hms5552。
[0459]
实施例2b hms5552 罗格列酮复方片剂(剂量规格50mg/4mg)
[0460][0461][0462]
*5.30mg马来酸罗格列酮相当于4mg游离罗格列酮无水化物
[0463]
**100.00mg hms5552固体分散体相当于50mg hms5552。
[0464]
实施例3b hms5552 罗格列酮复方片剂(剂量规格75mg/4mg)
[0465]
处方组成单位处方量/mg%(w/w)马来酸罗格列酮*5.301.77hms5552固体分散体**150.050.00微晶纤维素123.7041.23羟丙基纤维素9.003.00交联羧甲基纤维素钠9.003.00硬脂酸镁3.001.00片芯总重300.00100.00欧巴代9.003.00包衣片总重309.00
‑‑
[0466]
*5.30mg马来酸罗格列酮相当于4mg游离罗格列酮无水化物
[0467]
**150.00mg hms5552固体分散体相当于75mg hms5552。
[0468]
实施例4b hms5552 罗格列酮复方片剂(剂量规格100mg/4mg)
[0469]
处方组成单位处方量/mg%(w/w)马来酸罗格列酮*5.301.77hms5552固体分散体**200.0066.67微晶纤维素73.7024.57羟丙基纤维素9.003.00交联羧甲基纤维素钠9.003.00
硬脂酸镁3.001.00片芯总重300.00100.00欧巴代9.003.00包衣片总重309.00
‑‑
[0470]
*5.30mg马来酸罗格列酮相当于4mg游离罗格列酮无水化物
[0471]
**200.00mg hms5552固体分散体相当于100mg hms5552。
[0472]
实施例5b hms5552 吡格列酮复方片剂(剂量规格75mg/15mg)
[0473][0474][0475]
*15.91mg盐酸吡格列酮相当于15mg游离吡格列酮无水化物
[0476]
**150.00mg hms5552固体分散体相当于75mg hms5552。
[0477]
实施例6b hms5552 吡格列酮复方片剂(剂量规格100mg/15mg)
[0478]
处方组成单位处方量/mg%(w/w)盐酸吡格列酮*15.915.30hms5552固体分散体**200.0066.67微晶纤维素63.0921.03羟丙基纤维素9.003.00交联羧甲基纤维素钠9.003.00硬脂酸镁3.001.00片芯总重300.00100.00欧巴代9.003.00包衣片总重309.00
‑‑
[0479]
*15.91mg盐酸吡格列酮相当于15mg游离吡格列酮无水化物
[0480]
**200.00mg hms5552固体分散体相当于100mg hms5552。
[0481]
2.2流化床湿法制粒制备复方片剂
[0482]
将按照上述葡萄糖激酶激活剂的固体分散体的制备实施例制备的hms5552固体分散体和组合药物加入到流化床制粒机中,加入可选的填充剂(例如微晶纤维素)。在20-60分钟时间内将配好的粘合剂(例如聚乙烯吡咯烷酮)溶液喷入流化床中混合物中进行制粒,然后在流化床干燥机中(进风温度40-60℃)继续干燥。然后,利用研磨机对干燥的物料进行研磨,从而获得合适大小的颗粒。在研磨之后,将微晶纤维素或硅化微晶纤维素(针对有外加部分的填充剂的处方)加入到颗粒中和在桶式混合器中将其混合。然后,将润滑剂(硬脂酸
镁)和/或任选的助流剂(微粉硅胶)加入其中并且另外混合均匀。润滑的混合物利用旋转压片机进行压片,得到对应不同规格的不同片重和片型的片剂(素片,未包衣的片芯)。所得片剂任选用将按照上述葡萄糖激酶激活剂的固体分散体的制备方法制备的进行薄膜包衣重量增加大约3%,从而得到薄膜包衣片。
[0483]
实施例7b hms5552 罗格列酮复方片剂(剂量规格25mg/4mg)
[0484][0485][0486]
*5.30mg马来酸罗格列酮相当于4mg游离罗格列酮无水化物
[0487]
**50.00mg hms5552固体分散体相当于25mg hms5552。
[0488]
2.3干法碾压制粒制备复方片剂
[0489]
将按照上述葡萄糖激酶激活剂的固体分散体的制备实施例制备的hms5552固体分散体和组合药物加入到混合桶中,加入填充剂(例如微晶纤维素)和粘合剂(例如羟丙基纤维素)混合均匀。然后通过滚轴碾压制粒机进行碾压,得到条状物通过粉碎机进行粉碎整粒,从而获得合适大小的颗粒。在研磨之后,将可选的微晶纤维素或硅化微晶纤维素(针对有外加部分的填充剂)和崩解剂(例如交联羧甲基纤维素钠)加入到颗粒中和在桶式混合器中将其混合。然后,将润滑剂(硬脂酸镁或硬脂富马酸钠)和/或任选的助流剂(微粉硅胶)加入其中并且另外混合均匀。润滑的混合物利用旋转压片机进行压片,得到对应不同规格的不同片重和片型的片剂(素片,未包衣的片芯)。所得片剂任选用ii进行薄膜包衣重量增加大约3%,从而得到薄膜包衣片。
[0490]
实施例8b hms5552 吡格列酮复方片剂(剂量规格50mg/15mg)
[0491]
处方组成单位处方量/mg%(w/w)盐酸吡格列酮*15.913.98hms5552固体分散体**100.0025.00微晶纤维素260.0965.02羟丙基纤维素12.003.00交联羧甲基纤维素钠8.002.00硬脂酸镁4.001.00片芯总重400.00100.00欧巴代12.003.00包衣片总重412.00
‑‑
[0492]
*15.91mg盐酸吡格列酮相当于15mg游离吡格列酮无水化物;
[0493]
**100.00mg hms5552固体分散体相当于50mg hms5552。
[0494]
2.4粉末混合直接压片制备复方片剂
[0495]
将按照上述葡萄糖激酶激活剂的固体分散体的制备实施例制备的hms5552固体分散体和组合药物按照几何递增原则预混均匀后加入到混合桶中,加入填充剂(例如微晶纤维素),崩解剂(例如交联羧甲基纤维素钠)和任选的助流剂(微粉硅胶)加入到颗粒中和在桶式混合器中将其混合。然后,将润滑剂(硬脂酸镁或硬脂富马酸钠)加入其中并且另外混合均匀。润滑的混合物利用旋转压片机进行压片,得到对应不同规格的不同片重和片型的片剂(素片,未包衣的片芯)。所得片剂任选用ii进行薄膜包衣重量增加大约3%,从而得到薄膜包衣片。
[0496]
按上述制备工艺描述的复方片剂的配方组成为:
[0497]
实施例9b hms5552 吡格列酮复方片剂(剂量规格25mg/15mg)
[0498]
处方组成单位处方量/mg%(w/w)盐酸吡格列酮*15.915.30hms5552固体分散体**50.0016.67微晶纤维素216.0972.03羟丙基纤维素9.003.00交联羧甲基纤维素钠6.002.00硬脂酸镁3.001.00片芯总重300.00100.00欧巴代9.003.00包衣片总重309.00
‑‑
[0499]
*15.91mg盐酸吡格列酮相当于15mg游离吡格列酮无水化物
[0500]
**50.00mg hms5552固体分散体相当于25mg hms5552。
[0501]
iii.含有葡萄糖激酶激活剂的复方制剂的体外溶出度测试
[0502]
片剂的溶出度是采用《中国药典》(2015年版)的桨法,分别测试在ph6.8的介质中的hms5552和另一种组合药物的溶出,在5分钟,15分钟,30分钟,45分钟和60分钟时,分别取样5ml,进行hplc分析。
[0503]
按照上述测试方法,测量上述几种固定剂量规格的片剂和其相应的单方片剂,其溶出度结果如下。
[0504]
表1实施例2b制备的固定剂量复方片剂的溶出结果
[0505][0506]
表2实施例3b制备的固定剂量复方片剂的溶出结果
[0507][0508]
从上述固定剂量复方制剂的溶出结果可以看出,本发明的固定复方制剂的溶出达到快速释放制剂的要求。
[0509]
iv.含有葡萄糖激酶激活剂的复方制剂物理属性
[0510]
按照药典相关的仪器和方法,对上述几种固定剂量规格的片剂的物理属性进行测试,结果描述如下。
[0511]
表3不同实施例制备的固定剂量复方片芯的物理属性
[0512][0513]
表4不同实施例制备的固定剂量复方片芯的物理属性
[0514][0515]
v.含有葡萄糖激酶激活剂的复方制剂的药效学研究
[0516]
实施例1c
[0517]
葡萄糖激酶激活剂与组合药物联合对正常小鼠葡萄糖/蔗糖耐量影响的研究
[0518]
正常雄性c57bl/6j小鼠,禁食6h后,分别口服给予溶剂对照、20mg/kg罗格列酮、或10mg/kg hms5552联合20mg/kg罗格列酮;1小时后,经口服给予葡萄糖2g/kg;于给药前(-60
分钟)、给糖前(0分钟)和给糖后15、30、60、120分钟尾静脉取血,测定全血葡萄糖含量。分析0-120分钟血糖曲线下面积(auc0-120 min,毫摩尔/升*分钟),对比溶剂对照的变化,结果显示10mg/kg hms5552联合20mg/kg罗格列酮的降糖效果显著优于20mg/kg罗格列酮单药治疗,具有统计学差异,p《0.001。
[0519]
罗格列酮,属噻唑烷二酮类胰岛素增敏剂,是一类过氧化物酶体增殖物激活受体(ppar)激活剂,通过提高骨骼肌、肝脏、脂肪组织对胰岛素的敏感性发挥降低血糖的疗效,并对非酒精性脂肪性肝炎有良好的临床疗效。hms5552,一种新型葡萄糖激酶激活剂,能够改善2型糖尿病患者胰岛功能、促进肠促胰岛素的分泌、降低胰岛素抵抗,具有减低空腹和餐后血糖的双重治疗效果,ppar受体激活剂联合hms5552,可针对ppar受体激活剂控制血糖失效的患者和伴有非酒精性脂肪肝的糖尿病患者,具有更好的血糖控制疗效和降低糖尿病并发症的风险,以及治疗非酒精性脂肪性肝炎的疗效。
[0520]
上述关于hms5552联合现有口服糖尿病药进行的有效性研究表明,联合使用能够提高hms5552或现有降糖药的功效,降低安全风险,提高医疗效果。将hms5552和现有口服糖尿病药开发成口服固定剂量复方制剂,是目前最有希望解决以上临床需求的复方糖尿病治疗药物。
[0521]
综上所述,本发明涉及以下技术方案:
[0522]
1.药物组合,其包含:
[0523]
(a)葡萄糖激酶激活剂,其中所述葡萄糖激酶激活剂为下式表示的化合物,或其可药用盐、其同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式:
[0524]
[0525][0526]
(b)ppar受体激活剂;
[0527]
其中上述药物(a)和(b)同时、分别或相继使用。
[0528]
2.技术方案1的药物组合,其中所述葡萄糖激酶激活剂与ppar受体激活剂的重量比为约50:1至1:10,优选地为约25:1至1:5,更优选地为约1:10、约1:5、约1:2、约1.67:1、约3.33:1、约5:1、约6.25:1、约6.67:1、约12.5:1、约18.75:1或约25:1。
[0529]
3.技术方案1或2的药物组合,其中,所述葡萄糖激酶激活剂为下式表示的化合物hms5552,或其同位素标记物或其可药用盐,
[0530][0531]
4.技术方案1-3中任一项的药物组合,其中所述葡萄糖激酶激活剂为固体分散体形式;优选地,所述葡萄糖激酶激活剂为包含聚合物载体的固体分散体形式,其中所述聚合物载体为甲基丙烯酸共聚物a型(甲基丙烯酸与甲基丙烯酸甲酯(1:1)的阴离子共聚物),优选为eudragit,更优选为eudragit l100。
[0532]
5.技术方案4的药物组合,其中所述葡萄糖激酶激活剂与聚合物载体的重量比为约1:10至10:1,优选地为约1:9至9:1、约1:4至4:1、约3:7至7:3、约2:3至3:2、约3:4至4:3、约4:5至5:4或约5:6至6:5,更优选地为约1:1、约2:3、约3:4、约4:5或约5:6。
[0533]
6.技术方案1-5中任一项所述的药物组合,其中所述ppar受体激活剂选自罗格列酮(或马来酸罗格列酮)、吡格列酮(或盐酸吡格列酮)、西格列他钠及其可药用盐。
[0534]
7.技术方案1-6中任一项所述的药物组合,其中所述葡萄糖激酶激活剂以约1毫克
至约200毫克,优选地约25毫克至约100毫克的剂量(优选单位剂量)范围存在,优选地,其中所述葡萄糖激酶激活剂的剂量(优选单位剂量)为约25毫克、约50毫克、约75毫克或约100毫克。
[0535]
8.技术方案1-7中任一项所述的药物组合,其中所述ppar受体激活剂以约1毫克至约50毫克,优选地约4毫克至约15毫克的剂量(优选单位剂量)范围存在,优选地,其中所述ppar受体激活剂的剂量(优选单位剂量)为约1毫克、约2毫克、约4毫克、约5毫克、约10毫克、约12毫克、约14毫克或约15毫克,最优选为约4毫克或约15毫克;优选地,所述ppar受体激活剂为罗格列酮或吡格列酮。
[0536]
9.技术方案1-8中任一项所述的药物组合,其为药物组合物的形式。
[0537]
10.技术方案9所述的药物组合物,其包含葡萄糖激酶激活剂的固体分散体和ppar受体激活剂,优选地,其中葡萄糖激酶激活剂的固体分散体与ppar受体激活剂的重量比为约100:1至1:5,优选地为约50:1至2:5,更优选地为约1:5、约2:5、约1:1、约3.33:1、约6.67:1、约10:1、约12.5:1、约13.3:1、约25:1、约37.5:1或约50:1。
[0538]
11.技术方案9或10的药物组合物,其中所述葡萄糖激酶激活剂的固体分散体按重量计约为1~98%;所述ppar受体激活剂按重量计约为0.1~25%。
[0539]
12.技术方案9-11中任一项所述的药物组合物,其中还包含一种或者多种赋形剂,优选地,所述赋形剂选自粘合剂、填充剂、崩解剂、润滑剂、助流剂、表面活性剂、润湿剂、抗氧化剂、增香剂、甜味剂、着色剂或者包衣剂。
[0540]
13.技术方案9-12中任一项所述的药物组合物,其为选自片剂、胶囊、丸剂和锭剂的形式,优选为片剂,更优选为包衣片剂。
[0541]
14.一种固定剂量复方制剂,其包含:
[0542]
(a)葡萄糖激酶激活剂,其为下式表示的化合物,或其可药用盐、其
[0543]
同位素标记物、其结晶形式、水合物、溶剂合物、非对映异构体或对映异构体形式:
[0544]
[0545][0546]
(b)ppar受体激活剂;
[0547]
(c)一种或多种赋形剂。
[0548]
15.技术方案14的固定剂量复方制剂,其中葡萄糖激酶激活剂与ppar受体激活剂的重量比为约50:1至1:10,优选地为约25:1至1:5,更优选地为约1:10、约1:5、约1:2、约1.67:1、约3.33:1、约5:1、约6.25:1、约6.67:1、约12.5:1、约18.75:1或约25:1。
[0549]
16.技术方案14或15的固定剂量复方制剂,其中,所述葡萄糖激酶激活剂按重量计约为1~98%;所述ppar受体激活剂按重量计约为0.1~25%。
[0550]
17.技术方案14-16中任一项的固定剂量复方制剂,其中,所述葡萄糖激酶激活剂为下式表示的化合物hms5552,或其同位素标记物或其可药用盐,
[0551][0552]
18.技术方案14-17中任一项的固定剂量复方制剂,其中所述葡萄糖激酶激活剂为固体分散体形式,优选地,其中,所述葡萄糖激酶激活剂为包含聚合物载体的固体分散体形式,所述聚合物载体为甲基丙烯酸共聚物a型(甲基丙烯酸与甲基丙烯酸甲酯(1:1)的阴离子共聚物),优选为eudragit,更优选为eudragit l100。
[0553]
19.技术方案14-18中任一项的固定剂量复方制剂,其中所述葡萄糖激酶激活剂与聚合物载体的重量比为约1:10至10:1,优选地为约1:9至9:1、约1:4至4:1、约3:7至7:3、约2:3至3:2、约3:4至4:3、约4:5至5:4或约5:6至6:5,更优选地为约1:1、约2:3、约3:4、约4:5或约5:6。
[0554]
20.技术方案14-19中任一项的固定剂量复方制剂,其中所述ppar受体激活剂选自罗格列酮(或马来酸罗格列酮)、吡格列酮(或盐酸吡格列酮)、西格列他钠及其可药用盐。
[0555]
21.技术方案14-20中任一项所述的固定剂量复方制剂,其中所述葡萄糖激酶激活剂以约1毫克至约200毫克,优选地约25毫克至约100毫克的剂量(优选单位剂量)范围存在,优选地,其中所述葡萄糖激酶激活剂的剂量(优选单位剂量)为约25毫克、约50毫克、约75毫克或约100毫克。
[0556]
22.技术方案14-21中任一项所述的固定剂量复方制剂,其中所述ppar受体激活剂以约1毫克至约50毫克,优选地约4毫克至约15毫克的剂量(优选单位剂量)范围存在,优选地,其中所述ppar受体激活剂的剂量(优选单位剂量)为约1毫克、约2毫克、约4毫克、约5毫克、约10毫克、约12毫克、约14毫克或约15毫克,最优选为约4毫克或约15毫克;优选地,所述ppar受体激活剂为罗格列酮或吡格列酮。
[0557]
23.技术方案14-22中任一项的固定剂量复方制剂,其中葡萄糖激酶激活剂的固体分散体与ppar受体激活剂的重量比为约100:1至1:5,优选地为约50:1至2:5,更优选地为约1:5、约2:5、约1:1、约3.33:1、约6.67:1、约10:1、约12.5:1、约13.3:1、约25:1、约37.5:1或约50:1。
[0558]
24.技术方案23的固定剂量复方制剂,其中,所述葡萄糖激酶激活剂按重量计约为1~98%;所述ppar受体激活剂按重量计约为0.1~25%。
[0559]
25.技术方案14-24中任一项的固定剂量复方制剂,所述一种或者多种赋形剂选自粘合剂、填充剂、崩解剂、润滑剂、助流剂、表面活性剂、润湿剂、抗氧化剂、增香剂、甜味剂、着色剂或者包衣剂。
[0560]
26.技术方案25的固定剂量复方制剂,所述粘合剂选自聚乙烯吡咯烷酮、羟丙基纤维素或者羟丙基甲基纤维素;填充剂选自微晶纤维素、硅化微晶纤维素、乳糖、磷酸二氢钙、甘露醇、玉米淀粉或预胶化淀粉;崩解剂选自交联羧甲基纤维素钠、交联聚维酮或羟基乙酸淀粉钠;润滑剂选自硬脂酸镁或者硬脂酰富马酸钠;助流剂选自胶体二氧化硅或者滑石。
[0561]
27.技术方案11-26中任一项的固定剂量复方制剂,其为片剂。
[0562]
28.技术方案27的固定剂量复方制剂,其为包衣片剂。
[0563]
29.技术方案28的固定剂量复方制剂,所述包衣片剂为膜包衣片剂,其中膜包衣剂包含:
[0564]
膜包衣基材,例如羟丙基纤维素、羟丙基甲基纤维素或其混合物;
[0565]
任选的增塑剂,例如聚乙烯醇、聚乙二醇、丙二醇、聚山梨酯或它们的混合物;
[0566]
任选的着色剂,例如氧化铁红、氧化铁黄或其混合物;
[0567]
任选的遮光剂,如二氧化钛,和
[0568]
任选的助流剂。
[0569]
30.技术方案29的固定剂量复方制剂,所述包衣片剂为膜包衣片剂,所述膜包衣剂为欧巴代。
[0570]
31.技术方案14-30中任一项的固定剂量复方制剂,按重量计,其包含:
[0571]-约1~98%葡萄糖激酶激活剂,优选hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0572]-约0.1~15%ppar受体激活剂;
[0573]-约0~80%的填充剂;
[0574]-约1~25%的粘合剂;
[0575]-约0~15%的崩解剂;
[0576]-约0.1~10%的润滑剂;
[0577]-约0~3%的助流剂;和
[0578]-约0~5%的包衣剂。
[0579]
32.技术方案31的固定剂量复方制剂,按重量计,活性成分的剂量(优选单位剂量)为:
[0580]
约25mg,约50mg,约75mg或约100mg的葡萄糖激酶激活剂,优选hms5552;
[0581]
约2毫克、约4毫克和约8毫克的罗格列酮或相应量的马来酸罗格列酮。
[0582]
33.技术方案32的固定剂量复方制剂,所述固定剂量复方制剂为25mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂,按重量计,其包含以下含量的各组分:
[0583]-约25mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0584]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0585]-约0~75%的填充剂;
[0586]-约2~8%的粘合剂;
[0587]-约1~5%的崩解剂;
[0588]-约0.5~3%的润滑剂;
[0589]-约0~0.5%的助流剂;和
[0590]-约0~5%的包衣剂。
[0591]
34.技术方案32的固定剂量复方制剂,所述固定剂量复方制剂为50mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂,按重量计,其包含以下含量的各组分:
[0592]-约50mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0593]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0594]-约0~75%的填充剂;
[0595]-约2~8%的粘合剂;
[0596]-约1~5%的崩解剂;
[0597]-约0.5~3%的润滑剂;
[0598]-约0~0.5%的助流剂;和
[0599]-约0~5%的包衣剂。
[0600]
35.技术方案32的固定剂量复方制剂,所述固定剂量复方制剂为75mg hms5552/4mg罗格列酮或相应量的马来酸罗格列酮的片剂,按重量计,其包含以下含量的各组分:
[0601]-约75mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0602]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0603]-约0~75%的填充剂;
[0604]-约2~8%的粘合剂;
[0605]-约1~5%的崩解剂;
[0606]-约0.5~3%的润滑剂;
[0607]-约0~0.5%的助流剂;和
[0608]-约0~5%的包衣剂。
[0609]
36.技术方案32的固定剂量复方制剂,所述固定剂量复方制剂为100mg hms5552/
4mg罗格列酮或相应量的马来酸罗格列酮的片剂,按重量计,其包含以下含量的各组分:
[0610]-约100mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0611]-约4mg的罗格列酮或相应量的马来酸罗格列酮;
[0612]-约0~75%的填充剂;
[0613]-约2~8%的粘合剂;
[0614]-约1~5%的崩解剂;
[0615]-约0.5~3%的润滑剂;
[0616]-约0~0.5%的助流剂;和
[0617]-约0~5%的包衣剂。
[0618]
37.技术方案32的固定剂量复方制剂,其中包含约50mg固体分散体、约5.30mg的马来酸罗格列酮、约177.20mg微晶纤维素、约7.50mg羟丙基纤维素、约7.50mg交联羧甲基纤维素钠、约2.50mg硬脂酸镁和约7.50mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约25mg hms5552。
[0619]
38.技术方案32的固定剂量复方制剂,其中包含约100mg固体分散体、约5.30mg的马来酸罗格列酮、约77.20mg微晶纤维素、约7.50mg羟丙基纤维素、约7.50mg交联羧甲基纤维素钠、约2.50mg硬脂酸镁和约7.50mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约50mg hms5552。
[0620]
39.技术方案32的固定剂量复方制剂,其中包含约150mg固体分散体、约5.30mg的马来酸罗格列酮、约123.70mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约75mg hms5552。
[0621]
40.技术方案32的固定剂量复方制剂,其中包含约200mg固体分散体、约5.30mg的马来酸罗格列酮、约73.7mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约100mg hms5552。
[0622]
41.技术方案32的固定剂量复方制剂,其中包含约50mg固体分散体、约5.30mg的马来酸罗格列酮、约127.20mg微晶纤维素、约7.50mg聚乙烯吡咯烷酮、约7.50mg交联羧甲基纤维素钠、约2.50mg硬脂酸镁和约7.50mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约25mg hms5552。
[0623]
42.技术方案31的固定剂量复方制剂,按重量计,活性成分的剂量(优选单位剂量)为:
[0624]
约25mg,约50mg,约75mg或约100mg的葡萄糖激酶激活剂,优选hms5552;
[0625]
约15毫克、约30毫克和约45毫克的吡格列酮或相应量的盐酸吡格列酮。
[0626]
43.技术方案42的固定剂量复方制剂,所述固定剂量复方制剂为25mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂,按重量计,其包含以下含量的各组分:
[0627]-约25mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0628]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0629]-约0~90%的填充剂;
[0630]-约1~25%的粘合剂;
[0631]-约1~8%的崩解剂;
[0632]-约0.5~3%的润滑剂;
[0633]-约0~0.5%的助流剂;和
[0634]-约0~5%的包衣剂。
[0635]
44.技术方案42的固定剂量复方制剂,所述固定剂量复方制剂为50mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂,按重量计,其包含以下含量的各组分:
[0636]-约50mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0637]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0638]-约0~90%的填充剂;
[0639]-约1~25%的粘合剂;
[0640]-约1~8%的崩解剂;
[0641]-约0.5~3%的润滑剂;
[0642]-约0~0.5%的助流剂;和
[0643]-约0~5%的包衣剂。
[0644]
45.技术方案42的固定剂量复方制剂,所述固定剂量复方制剂为75mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂,按重量计,其包含以下含量的各组分:
[0645]-约75mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0646]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0647]-约0~90%的填充剂;
[0648]-约1~25%的粘合剂;
[0649]-约1~8%的崩解剂;
[0650]-约0.5~3%的润滑剂;
[0651]-约0~0.5%的助流剂;和
[0652]-约0~5%的包衣剂。
[0653]
46.技术方案42的固定剂量复方制剂,所述固定剂量复方制剂为100mg hms5552/15mg吡格列酮或相应量的盐酸吡格列酮的片剂,按重量计,其包含以下含量的各组分:
[0654]-约100mg的hms5552,优选hms5552的固体分散体,优选含hms5552和聚合物载体的固体分散体,优选含约1:1的hms5552和eudragit l100的固体分散体;
[0655]-约15mg的吡格列酮或相应量的盐酸吡格列酮;
[0656]-约0~90%的填充剂;
[0657]-约1~25%的粘合剂;
[0658]-约1~8%的崩解剂;
[0659]-约0.5~3%的润滑剂;
[0660]-约0~0.5%的助流剂;和
[0661]-约0~5%的包衣剂。
[0662]
47.技术方案42的固定剂量复方制剂,其中包含约150mg固体分散体、约15.91mg的盐酸吡格列酮、约113.09mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg的硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约75mg hms5552。
[0663]
48.技术方案42的固定剂量复方制剂,其中包含约200mg固体分散体、约15.91mg的盐酸吡格列酮、约63.09mg微晶纤维素、约9.00mg羟丙基纤维素、约9.00mg交联羧甲基纤维素钠、约3.00mg的硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约100mg hms5552。
[0664]
49.技术方案42的固定剂量复方制剂,其中包含约100mg固体分散体、约15.91mg的盐酸吡格列酮、约260.09mg微晶纤维素、约12.00mg羟丙基纤维素、约8.00mg交联羧甲基纤维素钠、约4.00mg的硬脂酸镁和约12.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约50mg hms5552。
[0665]
50.技术方案42的固定剂量复方制剂,其中包含约50mg固体分散体、约15.91mg的盐酸吡格列酮、约216.09mg微晶纤维素、约9.00mg羟丙基纤维素、约6.00mg交联羧甲基纤维素钠、约3.00mg的硬脂酸镁和约9.00mg欧巴代,其中所述固体分散体含约1:1的hms5552和eudragit l100,并且含约25mg hms5552。
[0666]
51.一种制备前述任一项技术方案的固定剂量复方制剂的方法,该方法包括将活性成份掺入一种或多种赋形剂进行制粒,优选进一步地将制得的颗粒混合物填装入小瓶、小袋或者胶囊中或者压缩成期望的片剂形状;更优选更进一步的将所得的片剂进行包衣。
[0667]
52.技术方案51的制备固定剂量复方制剂的方法,其中通过湿法制粒(高剪切和/或流化床)制备,或者通过干法处理(直接压制或者干法制粒)制备。
[0668]
53.技术方案51-52任一项的制备固定剂量复方制剂的方法,其中将所述葡萄糖激酶激活剂制备成固体分散体形式。
[0669]
54.技术方案51-53任一项的制备固定剂量复方制剂的方法,其中所述葡萄糖激酶激活剂和第二种或更多种活性成分一起制备成复方固体分散体形式。
[0670]
55.如技术方案1-13中任一项所述的药物组合或药物组合物或技术方案14-50中任一项所述的固定剂量复方制剂,其用于预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或预防、减缓、延迟或逆转糖尿病并发症。
[0671]
56.预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍的方法:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c;或预防、减缓、延迟或逆转糖尿病并发症,包括向受试者给予治疗有效量的技术方案1-13中任一项所述的药物组合或药物组合物或技术方案14-50中任一项所述的固定剂量复方制剂。
[0672]
57.技术方案1-13中任一项所述的药物组合或药物组合物或技术方案14-50中任
意一项所述的固定剂量复方制剂在制备用于预防一种或多种选自以下的代谢障碍、减缓该代谢障碍的进展、延迟或治疗该代谢障碍或预防、减缓、延迟或逆转糖尿病并发症的药物中的用途:i型糖尿病、ii型糖尿病、葡萄糖耐量降低、空腹血糖异常、高血糖症、餐后高血糖症、超重、肥胖症、高血压症、非酒精性脂肪肝病、非酒精性脂肪肝炎、胰岛素抵抗和/或代谢综合征;或改善血糖控制和/或降低空腹血浆葡萄糖、餐后血浆葡萄糖和/或糖基化血红蛋白hba1c。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。