1.本发明属于医药领域,具体涉及β-乳球蛋白-阿司匹林复合物在制备缓解阿司匹林对胃黏膜的损伤的药物中的应用。
背景技术:
2.阿司匹林(乙酰水杨酸)的分子式为:c9h8o4,分子相对质量:180.16。无臭或微带醋酸臭,微溶于水,易溶于乙醇,可溶于乙醚、氯仿,水溶液呈酸性。阿司匹林是一种非甾体类抗炎药,可以用于镇痛、解热以及抗炎等,在预防和治疗心血管疾病方面具有重要的临床应用价值
[1-3]
。同时在治疗神经退行性疾病、败血症、急性呼吸窘迫综合征和抗肿瘤等方面也有潜在的临床疗效
[1,4,5]
。长期服用阿司匹林容易引起胃粘膜损伤,增加胃溃疡和胃出血的风险
[6-8]
。阿司匹林引起胃损伤的机制大致可分为两类:
[2,7,9]
一是前列腺素依赖机制,阿司匹林通过抑制环氧化酶(cox-1和cox-2)的活性进而减少前列腺素合成;二是非前列腺素依赖机制,阿司匹林在胃粘膜细胞内的积累会引起的胃上皮细胞凋亡。无论哪种方式,一旦胃粘膜屏障被打破,浸润的免疫细胞都会触发免疫反应,导致炎症,加剧胃粘膜损伤
[9-11]
。这表明,减少阿司匹林对胃黏膜的刺激是减轻阿司匹林胃损伤的关键。
[0003]
目前已有一些方法可减弱阿司匹林对胃粘膜的损伤,比如改变阿司匹林的给药途径(吸入式给药、经皮给药等)以及与其他药物联合使用。然而这些方法仍有一些局限。首先,口服仍是阿司匹林最常见的使用方式;其次,联合给药的治疗范围非常有限,而且所使用的药物有可能带来新的副作用。因此,利用载体结合阿司匹林以减弱阿司匹林对胃黏膜的刺激,是一种可用于口服阿司匹林的潜在方法,但是目前仍然缺少合适的载体可应用于口服阿司匹林。其原因主要有以下几点:首先,口服一般使用的是接近ph中性的药液,这样利于服用,而药液进入胃部之后,其ph值会明显的变小并接近胃液的ph值(1~2)。由此,需要载体在中性条件和胃酸环境下对阿司匹林都具有较高的亲和力。其形成的复合物具有较高的稳定性。第二,载体与阿司匹林形成的复合物应具有较强的抗胃液消化能力,阻止胃液对复合物的破坏,以防止阿司匹林脱离载体。第三,该载体还应具有成本低廉、易于生产、生物相容性好和生物降解性好等优点。
[0004]
β-乳球蛋白是牛奶中主要的蛋白质之一。β-乳球蛋白属于lipocalin蛋白家族,其单体含162个氨基酸,分子量为18.3kda,直径约为7nm
[12,13]
。其二级结构为9个反向平行的β折叠和1个α螺旋,其核心区域为8个β折叠(a-h段)进行反平行排列而形成的β-桶型结构
[14,15]
。已有研究表明β-乳球蛋白可以与一些双亲性和疏水性的小分子形成复合物,而且β-乳球蛋白具有抗胃蛋白酶分解、生物安全性好、来源广泛、提取便宜等优点
[16-19]
。由此,β-乳球蛋白作为载体给药在医药领域已经引起了广泛的关注。但是周围环境的ph值会显著影响β-乳球蛋白的结构特征,并改变其与目标分子的结合形式(空间位置和结合能大小等)。例如申请人前期的研究发现β-乳球蛋白与卟啉类药物(如:血卟啉和原卟啉)具有多种结合机制,其结合方式取决于ph值对蛋白质结构的影响
[20]
。因此,β-乳球蛋白到底与那种
有效成分结合后可发挥目标效力,且在何种外界环境下发生效力,并不可知。
[0005]
参考文献:
[0006]
[1]k.,voelker,m.nsaids and aspirin:recent advances and implications for clinical management.lanas,a.,ed.;springer international publishing:switzerland,2016:p 107-p 122.
[0007]
[2]ricciotti,e.;fitzgerald,g.a.aspirin in the prevention of cardiovascular disease and cancer.annu.rev.med.2021,72,473-495.
[0008]
[3]thun,m.j.;jacobs,e.j.;patrono,c.the role of aspirin in cancer prevention.nat.rev.clin.oncol.2012,9,259-267.
[0009]
[4]kalathil,a.a.;kumar,a.;banik,b.;ruiter,t.a.;pathak,r.k.;dhar,s.new formulation of old aspirin for better delivery.chem.commun.2016,52,140-143.
[0010]
[5]rothwell,p.m.;wilson,m.;price,j.f.;belch,j.f.;meade,t.w.;mehta,z.effect of daily aspirin on risk of cancer metastasis:a study of incident cancers during randomised controlled trials.lancet 2012,379,1591-601.
[0011]
[6]lanas,a.;scheiman,j.low-dose aspirin and upper gastrointestinal damage:epidemiology,prevention and treatment.curr.med.res.opin.2007,23,163-173.
[0012]
[7]handa,o.;naito,y.;fukui,a.;omatsu,t.;yoshikawa,t.the impact of non-steroidal anti-inflammatory drugs on the small intestinal epithelium.j.clin.biochem.nutr.2014,54,2-6.
[0013]
[8]wu,y.;hu,y.;you,p.;chi,y.j.;zhou,j.h.;zhang,y.y.;liu,y.l.study of clinical and genetic risk factors for aspirin-induced gastric mucosal injury.chin.med.j.2016,129,174-80.
[0014]
[9]matsui,h.;shimokawa,o.;kaneko,t.;nagano,y.;rai,k.;hyodo,i.the pathophysiology of non-steroidal anti-inflammatory drug(nsaid)-induced mucosal injuries in stomach and small intestine.j.clin.biochem.nutr.2011,48,107-111.
[0015]
[10]basson,m.d.hierarchies of healing in gut mucosal injury.j.physiol.pharmacol.2017,68,789-795.
[0016]
[11]odashima,m.;otaka,m.;jin,m.;komatsu,k.;konishi,n.;wada,i.;horikawa,y.;matsuhashi,t.;ohba,r.;oyake,j.;hatakeyama,n.;watanabe,s.rolipram,a specific type iv phosphodiesterase inhibitor,ameliorates aspirin-induced gastric mucosal injury in rats.dig.dis.sci.2005,50,1097-1102.
[0017]
[12]bonarek,p.;loch,j.i.;m.;cooper,d.r.;milto,k.;wr
ó
bel,p.;kurpiewska,k.;lewi
ń
ski,k.structure-based design approach to rational site-directed mutagenesis ofβ-lactoglobulin.j.struct.biol.2020,210,107493.
[0018]
[13]loch,j.i.;bonarek,p.;lewi
ń
ski k.conformational flexibility and ligand binding properties of ovineβ-lactoglobulin.acta biochim.pol.2019,66,577-584.
[0019]
[14]kontopidis,g.;holt,c.;sawyer,l.invited review:β-lactoglobulin:binding properties,structure,and function.j.dairy sci.2004,87,785-796.
[0020]
[15]maux,s.l;bouhallab,s.;giblin,l.;brodkorb,a.;croguennec,t.bovineβ-lactoglobulin/fatty acid complexes:binding,structural,and biological properties.dairy sci.technol.2014,94,409-426.
[0021]
[16]ghalandari,b.;divsalar,a.;saboury,a.akbar.;haertl
é
,thomas.;parivar,k.;bazl,roya.;eslami-moghadam,m.;amanlou,m.spectroscopic and theoretical investigation of oxali
–
palladium interactions with b-lactoglobulin.spectrochim.acta,part a 2014,118,1038-1046.
[0022]
[17]izadi,z.;divsalar,a.;saboury,a.a.;sawyer,l.β-lactoglobulin-pectin nanoparticle-based oral drug delivery system for potential treatment of colon cancer.chem.biol.drug des.2016,88,209-216.
[0023]
[18]jung,j.m.;mezzenga,r.liquid crystalline phase behavior of protein fibers in water:experiments versus theory.langmuir 2010,26,504
–
514.
[0024]
[19]s.;komorek,p.;turner,g.;jachimska,b.β-lactoglobulin as a potential carrier for bioactive molecules.bioelectrochemistry 2019,126,137-145.
[0025]
[20]wang,y.;gong,m.;huang,z.;min,h.;yu,p.;tang,f.;ye,y.;zhu,s.;hu,z.zeng,z.;chen,j.spectroscopic and theoretical investigation ofβ-lactoglobulin interactions with hematoporphyrin and protoporphyrin ix.acs omega 2021,6,9680-9691.
技术实现要素:
[0026]
本发明的目的在于提供β-乳球蛋白-阿司匹林复合物在制备缓解阿司匹林对胃黏膜的损伤的药物中的应用,为了减弱阿司匹林对胃黏膜的损伤,本发明以β-乳球蛋白作为阿司匹林的载体,在ph=7.4条件下β-乳球蛋白可与阿司匹林结合形成稳定的复合物。该复合物进入胃液之后也具有很好的稳定性,从而缓解服用阿司匹林所带来的胃损伤。
[0027]
为了达到上述目的,本发明采取以下技术措施:
[0028]
β-乳球蛋白-阿司匹林复合物在制备缓解阿司匹林对胃黏膜的损伤的药物中的应用,所述的β-乳球蛋白-阿司匹林复合物是将溶于磷酸盐缓冲液的β-乳球蛋白和溶于无水乙醇的阿司匹林混合孵育后获得。
[0029]
以上所述的应用中,优选的,所述的β-乳球蛋白-阿司匹林复合物的制备步骤如下:
[0030]
步骤1:将β-乳球蛋白粉末溶于磷酸盐缓冲液;
[0031]
步骤2:将阿司匹林溶于无水乙醇;
[0032]
步骤3:将步骤1和步骤2中的β-乳球蛋白储存液和阿司匹林储存液滴加到磷酸盐缓冲液中,β-乳球蛋白与阿司匹林的最终摩尔比为1:1,二者的浓度为16.5~17.0mmol/l,溶液ph 7.4。将该溶液至于37℃水浴中孵育10~40分钟,即得β-乳球蛋白-阿司匹林复合物。
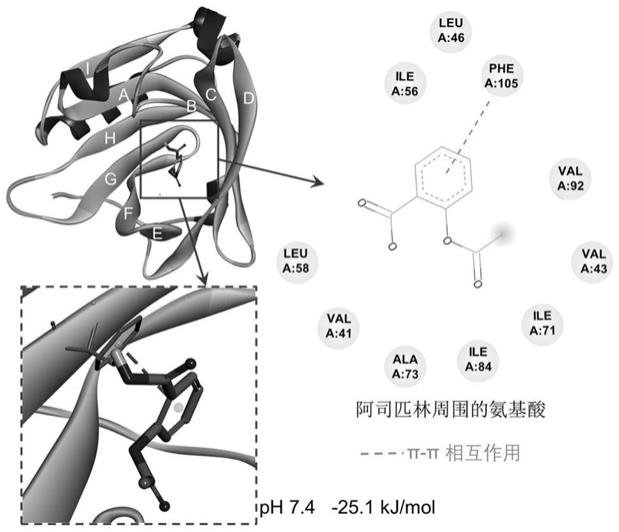
professional 19软件建模阿司匹林的分子结构,并优化到最小的能量状态。在对接分析之前,使用autodocktools对β-乳球蛋白分子进行脱水和加氢处理。对接过程中使用的网格盒尺寸为网格间距为利用autodock vina软件进行分子对接分析。结果如图1所示,在ph=7.4的条件下,阿司匹林通过疏水力(结合能为-25.12kj mol-1
)结合在β-桶型疏水腔的内部,并形成β-乳球蛋白-阿司匹林复合物。
[0051]
2)该复合物进入胃液之后,其周围的ph值会显著下降(ph=1~2)。
[0052]
从rcsb蛋白数据库中获得了ph=2时β-乳球蛋白的蛋白结构(id:1cj5),此条件下β-乳球蛋白的结构会发生明显的改变。使用chemdraw professional 19软件建模阿司匹林的分子结构,并优化到最小的能量状态。在对接分析之前,使用autodocktools对β-乳球蛋白分子进行脱水和加氢处理。对接过程中使用的网格盒尺寸为网格间距为利用autodock vina软件进行分子对接分析。
[0053]
结果如图2所示,在ph=2的条件下,β-乳球蛋白的ef loop结构域会封闭β-桶型疏水腔,这有利于保护结合在β-桶型疏水腔中的阿司匹林分子。此外β-乳球蛋白表面会形成新的阿司匹林结合位点,该位点的结合能(-29.3kj mol-1
)甚至低于β-桶型疏水腔位点的结合能,这有利于β-乳球蛋白进一步结合周围游离的阿司匹林分子。
[0054]
3)为了验证该复合物在胃液中的稳定性,sds-page凝胶电泳检测了β-乳球蛋白在胃模拟液中消化一段时间后的变化。胃模拟液的配置方法为:将2.0g氯化钠、3.2g胃蛋白酶以及7.0ml 37%盐酸加入去离子水并定容至1000ml,该溶液的ph值为1.2。胃模拟液中加入β-乳球蛋白后在37℃水浴中分别培养0.5h、1h、2h、3h。然后,每个样品取8μl溶液与loading buffer混合,在100℃下加热5min。采用sds-page凝胶试剂盒制备sds-聚丙烯酰胺凝胶,其浓缩胶和分离胶的丙烯酰胺含量分别为5%和15%。电泳分离后,用考马斯蓝r250染色蛋白条带。凝胶脱色后,使用gel doc xr 扫描。
[0055]
图3的结果表明β-乳球蛋白具有很好抗胃液消化能力,在胃液中可维持数小时的稳定而不被分解。
[0056]
4)为了验证该复合物在肠液中的稳定性,sds-page凝胶电泳检测了β-乳球蛋白在肠模拟液中消化一段时间后的变化。肠模拟液的配置方法为:将6.8g kh2po4溶于750ml去离子水,然后加入77ml浓度为0.2mol/l的naoh,再加入10g胰酶。用0.2mol/l naoh或0.2mol/l hcl调ph=6.8,最后加去离子水定容至1000ml。肠模拟液中加入β-乳球蛋白后在37℃水浴中分别培养0.5h、1h、2h、3h。然后,每个样品取8μl溶液与loading buffer混合,在100℃下加热5min。采用sds-page凝胶试剂盒制备sds-聚丙烯酰胺凝胶,其浓缩胶和分离胶的丙烯酰胺含量分别为5%和15%。电泳分离后,用考马斯蓝r250染色蛋白条带。凝胶脱色后,使用gel doc xr 扫描。
[0057]
图4的结果表明在肠液的消化作用,β-乳球蛋白可快速被降解,这有利于阿司匹林的释放和吸收。
[0058]
综上,本发明在ph=7.4的磷酸盐缓冲液中制备了β-乳球蛋白-阿司匹林复合物,阿司匹林通过疏水力结合在β-乳球蛋白的β-桶型疏水腔中。当该复合物进入胃液后,β-乳球蛋白的结构受到ph值的影响,其ef loop结构域会封闭β-桶型疏水腔,同时β-乳球蛋白表面会形成新的阿司匹林结合位点,这两点改变都能增强阿司匹林与β-乳球蛋白的亲和力。此外,β-乳球蛋白具有良好的抗胃液消化能力,这有利于保持复合物在胃液中的稳定性,以
减弱阿司匹林对胃黏膜的刺激。而β-乳球蛋白在肠液中的快速降解则有利于阿司匹林的释放和吸收。
[0059]
实施例2:
[0060]
β-乳球蛋白-阿司匹林复合物在制备缓解阿司匹林对胃黏膜的损伤的药物中的应用:
[0061]
将wistar大鼠饲养于常温(~22℃)条件下,昼夜循环时间为12h,大鼠可自由取食和饮水。适应饲养1周后,将体重~90g的大鼠随机平均分为3组,每天灌胃不同药液(每100g体重灌胃1ml)。第一组大鼠灌服ph 7.4的磷酸盐缓冲液,标记为磷酸盐缓冲液组。第二组给大鼠服用阿司匹林溶液,标记为阿司匹林组。第三组大鼠服用β-乳球蛋白-阿司匹林复合物溶液,标记为β-乳球蛋白-阿司匹林组。连续服药14天后处死大鼠,分离胃组织进行切片,并用苏木精-伊红(h&e)进行染色,分离胃组织并研磨使用qrt-pcr技术分析胃组织中tnf-α和il-1β的mrna表达水平。
[0062]
结果如图5所示:
[0063]
组织形态和he染色结果表明,阿司匹林实验组的大鼠胃部出现了明显的粘膜损伤,而β-乳球蛋白-阿司匹林复合物实验组的大鼠没有出现明显的胃粘膜损伤。
[0064]
同时胃组织的qrt-pcr的结果(图6)也证实,阿司匹林实验组大鼠胃部组织有明显的炎症,表现为tnf-α和il-1β水平的明显上升。而β-乳球蛋白-阿司匹林复合物实验组大鼠部组织没有明显的炎症,其tnf-α和il-1β水平均接近与服用磷酸盐缓冲液的对照组大鼠。以上结果说明,本发明制备的β-乳球蛋白-阿司匹林复合物在胃液中不被降解,可以减弱阿司匹林对胃黏膜的刺激,最终缓解阿司匹林对胃的损伤。
[0065]
因此,本发明提供的复合物的在机体中的效用发挥机理为:
[0066]
在ph=7.4的条件下,β-乳球蛋白可与阿司匹林发生非共价的结合,疏水力为主要的作用力。在该条件下的主要结合点位于β-乳球蛋白的β-桶型疏水腔的内部,并与β-乳球蛋白形成稳定的复合物(结合能为-25.12kj mol-1
)。
[0067]
当β-乳球蛋白-阿司匹林复合物进入胃液后,其周围的ph值会显著下降(约1~2)。此时β-乳球蛋白的结构会发生明显的改变,其ef loop结构域会封闭β-桶型疏水腔,以保护结合在β-桶型疏水腔中的阿司匹林分子。此外β-乳球蛋白表面会形成新的阿司匹林结合位点,该位点的结合能(-29.3kj mol-1
)甚至低于β-桶型疏水腔位点的结合能,这有利于β-乳球蛋白进一步结合周围游离的阿司匹林分子。以上两点最终表现为在胃液环境下,β-乳球蛋白与阿司匹林具有更强的亲和力,所形成的β-乳球蛋白-阿司匹林复合物具有更好的稳定性。凝胶电泳实验的结果表明,β-乳球蛋白具有很好抗胃液消化能力,可维持数小时的稳定以减弱阿司匹林对胃粘膜的刺激。而在肠液中,β-乳球蛋白可快速被分解并释放阿司匹林,以利于阿司匹林在肠道的吸收。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。