一种多肽rk12用于制备治疗痤疮药物的应用
技术领域
1.本发明涉及生物制药技术领域,具体涉及一种多肽rk12用于制备治疗痤疮药物的应用。
背景技术:
2.寻常痤疮是一种慢性细菌性皮脂腺炎性疾病,通常在青少年的面部和上躯干(前胸部和后背)上形成,其特征是形成粉刺,丘疹,结节,脓疱和囊肿。它是一种常见的皮肤病,在青春期感染者中占35%至90%以上。痤疮病变通常分为非炎性(开放和闭合粉刺)或炎性(丘疹和脓疱)。炎性痤疮难以治疗,严重程度通常会增加,并可能导致疤痕形成。目前的研究表明,痤疮的病理生理学涉及三个因素:脂溢性皮脂过多,毛囊角质化异常和痤疮丙酸杆菌在毛囊皮脂腺的增殖。由于它们的相互作用,皮肤的微环境发生变化并导致宿主的炎症反应,促进痤疮病变。其中痤疮丙酸杆菌的过度生长被广泛认为是形成寻常痤疮的关键因素。
3.痤疮丙酸杆菌(p.acnes)是一种与皮肤病痤疮相关的革兰氏阳性细菌,属于放线菌门的多形性厌氧杆菌,在细胞内寄生,是形成皮肤,口腔以及胃肠道和泌尿生殖道的正常微生物群的一部分。
4.传统治疗痤疮方法用抗生素治疗,抗生素是消除微生物生长或生存必不可少的条件,如使酶失活变性,来达到杀菌的目的,细菌只要改变一种基因就足以抵抗此类抗生素的攻击。近年来由于抗生素的广泛应用,使得某些国家的耐药高达60%,抗生素耐药现象已成为了公共卫生方面一个重要的威胁。
技术实现要素:
5.本发明的目的在于,针对现有技术的上述不足,提出一种多肽rk12用于制备治疗痤疮药物的应用。
6.为实现上述目的,本发明采用如下的技术方案:
7.本发明提供了一种多肽rk12作为活性成分用于制备治疗痤疮药物中的应用,其中多肽rk12的氨基酸序列如seq id no.1所示。
8.进一步的,所述小分子多肽具有抗痤疮丙酸杆菌和抗炎作用,所述多肽rk12对痤疮丙酸杆菌的最低抑菌浓度为8μg/ml。
9.进一步的,所述小分子多肽还具有抗耐克林霉素痤疮丙酸杆菌作用,所述多肽rk12对耐克林霉素痤疮丙酸杆菌的最低抑菌浓度为8μg/ml。
10.进一步的,所述多肽rk12作为有效成分的剂量为50~200μg。本发明提供的小分子多肽rk12在水性溶液中是可溶的,其以有效活性成分存在于制备治疗痤疮药物中,治疗痤疮的有效浓度约0.0002%~90%的范围内,在其他实施方式中,所述多肽rk12作为唯一活性成分用于制备治疗痤疮药物,其治疗痤疮的有效剂量50~200μg。
11.进一步的,将所述多肽rk12制成药物制剂。该药物制剂是以小分子多肽为有效活
性成分,包括液体制剂、固体制剂、半固体制剂或气体制剂等。
12.进一步的,所述药物制剂的剂型包括药剂学上可接受的任意一种剂型。
13.进一步的,所述药物制剂还包括药剂学上可接受药用辅料中的任一种或者多种。
14.进一步的,所述小分子多肽制备施用于皮肤或皮肤伤口的药物中的应用。
15.本发明提供的技术方案带来的有益效果是:
16.本发明提供小分子多肽rk12一种新的用途,用于制备治疗痤疮药物,其对痤疮丙酸杆菌和耐克林霉素痤疮丙酸杆菌有显著的抑制作用,而且相较于抗生素,耐药性低,体外抗菌谱实验的研究结果也证明其能快速抑制痤疮丙酸杆菌和耐克林霉素痤疮丙酸杆菌的生长,小分子多肽rk12的抑菌机制涉及与细菌细胞壁膜的相互作用并诱导细胞内部内容物的泄漏,破坏细菌菌体的完整性导致细菌细胞死亡,同时可能还具有改变细菌细胞壁膜的通透性,干扰细菌细胞壁、蛋白质和dna合成以及降低酶活性,辅助抗生素等药物进入菌体内等,除了直接杀死微生物和间接杀死微生物以外,小分子多肽rk12可能还参与免疫调节功能并减轻感染,例如控制促炎细胞因子的分泌以防止细胞因子分泌过高导致组织损伤、免疫细胞的募集和激活以及促进血管生成等,体外抗炎症实验的研究结果也证明其具有明显抗炎作用,其不同于抗生素的抑菌机制也更不易产生耐药性细菌。本发明提供的治疗痤疮的新策略和思路,其抗菌作用机制将有助于临床上限制抗生素耐药性的影响。
附图说明
17.图1为rk12的时间-抗菌效应关系图;
18.图2a为未经过药物处理的空白组扫描电镜图;
19.图2b为经rk12处理后的实验组1的扫描电镜图;
20.图2c为经rk12处理后的实验组2的扫描电镜图;
21.图2d为经rk12处理后的实验组3的扫描电镜图;
22.图3a为使用痤疮丙酸杆菌处理的炎性动物模型的小鼠耳内皮中注射pbs图;
23.图3b为使用痤疮丙酸杆菌处理的炎性动物模型的空白对照图;
24.图3c为使用痤疮丙酸杆菌处理的炎性动物模型中施用20μg/ml rk12的小鼠耳朵炎症图;
25.图3d为使用痤疮丙酸杆菌处理的炎性动物模型中施用100μg/ml rk12的小鼠耳朵炎症图;
26.图3e为使用痤疮丙酸杆菌处理的炎性动物模型中施用200μg/ml rk12的小鼠耳朵炎症图;
27.图3f为使用痤疮丙酸杆菌处理的炎性动物模型中施用0.05μg/ml克林霉素的小鼠耳朵炎症图;
28.图4a为使用痤疮丙酸杆菌处理的炎性动物模型的注射pbs组小鼠耳朵组织he染色结果图;
29.图4b为使用痤疮丙酸杆菌处理的炎性动物模型的空白小鼠耳朵组织he染色结果图;
30.图4c为使用痤疮丙酸杆菌处理的炎性动物模型中施用20μg/ml rk12治疗后的小鼠耳朵组织he染色结果图;
31.图4d为使用痤疮丙酸杆菌处理的炎性动物模型中施用100μg/ml rk12治疗后的小鼠耳朵组织he染色结果图;
32.图4e为使用痤疮丙酸杆菌处理的炎性动物模型中施用200μg/ml rk12治疗后的小鼠耳朵组织he染色结果图;
33.图4f为使用痤疮丙酸杆菌处理的炎性动物模型中施用0.05μg/ml克林霉素治疗后的小鼠耳朵组织he染色结果图;
34.图5a为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型的小鼠耳内皮中注射pbs图;
35.图5b为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型的空白对照图;
36.图5c为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型中施用200μg/ml rk12的小鼠耳朵炎症图;
37.图5d为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型中施用10μg/ml克林霉素的小鼠耳朵炎症图;
38.图6a为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型的注射pbs组小鼠耳朵组织he染色结果图;
39.图6b为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型的空白小鼠耳朵组织he染色结果图;
40.图6c为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型中施用200μg/ml rk12治疗后的小鼠耳朵组织he染色结果图;
41.图6d为使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型中施用100μg/ml rk12治疗后的小鼠耳朵组织he染色结果图。
具体实施方式
42.为使本发明的目的、技术方案和优点更加清楚,下面结合附图和具体实施例,对本发明的具体实施方式作进一步详细描述。
43.本发明的小分子多肽rk12,其氨基酸序列为rwwrffkfwwkk,如seq id no.1所示,其抗菌活性与其特定位置上特定氨基酸存在高度相关性,因此包括亲/疏水性、等电点和氨基酸组成等物理化学参数都会影响rk12的抗菌活性。amps最初通过静电相互作用对微生物膜具有靶向作用,小分子阳离子多肽rk12的疏水性为-1.325,它能够识别阴离子微生物膜并结合,折叠形成两栖结构,其疏水面融入磷脂双层界面,导致膜破裂和崩溃。除此之外,小分子多肽rk12中富含具有高疏水性残基色氨酸和苯丙氨酸,不仅提高了该肽的抗微生物活性同时增加穿透细菌膜能力并改变其膜结构使抗菌肽不易产生耐药性。
44.本发明的小分子多肽rk12是基于天然amp序列设计合成新型amp,根据青蛙皮肤分泌物中20残留肽ranacyclinaj的氨基酸序列,设计了10种新型的短肽,这些肽被称为akk1、akk2等,直到akk10。小分子多肽rk12由akk8衍生而来的新型多肽,akk8的氨基酸序列为rwrfkwwkk,是一种富含色氨酸和赖氨酸的新型肽。小分子多肽rk12在akk8的基础上,通过增加具有高疏水性残基色氨酸来提高多肽的α-螺旋程度和两亲性,从而提高多肽的抗菌活性和选择性。相对于akk8,小分子多肽rk12还增加疏水性苯丙氨酸提高了该肽穿透细菌膜能力并改变其膜结构使抗菌肽不易产生耐药性。
45.本发明的小分子多肽rk12可以通过人工合成即多肽固相合成的方法制备,其可以用作抗微生物制剂的多肽及其相关化合物,解决日益严重的细菌、真菌抗药性问题及顽固感染对广大患者造成的痛苦。本发明的小分子多肽rk12抗菌作用起效稳定,无毒性,易于人体接受,可以应用于各种顽固感染性疾病及普通感染,尤其对痤疮丙酸杆菌和临床耐药痤疮丙酸杆菌表现出很强的抑制作用,最低抑菌浓度均为8μg/ml,可在短时间内杀死痤疮丙酸杆菌或耐药痤疮丙酸杆菌,这种抑制作用可持续数小时,可作为现有治疗痤疮的优良替代药物或辅助药物。
46.本发明中利用多肽固相技术从头设计,在akk8序列基础上进行优化,合成得到了小分子多肽rk12。其结构简单、溶血活性小、细胞毒性低、生理稳定性高。
47.在临床实践中,微生物感染包括细菌、病毒、真菌或原生动物的一种或多种病原体所引起的感染。本发明的小分子多肽rk12对痤疮丙酸杆菌、耐药痤疮丙酸杆菌、金黄色葡萄球菌、变形链球菌、枯草杆菌和大肠杆菌均表现不同的抗菌作用,尤其对痤疮丙酸杆菌和耐药痤疮丙酸杆菌的抗菌作用最强,同时还表现出优异的抗炎作用。
48.本发明提供的一种典型的实施方式,提供一种药物制剂。该药物制剂包括有效剂量的小分子多肽rk12,如以及药学上可接受的载体、赋形剂或稀释剂。
49.本发明的小分子多肽rk12原料药优选制剂剂量范围是50~200μg重量份。
50.制备本发明液体制剂常用辅料包括:甘露醇、乙醇、丙二醇、甘油、盐酸、醋酸、醋酸钠乳酸、氢氧化钠、枸缘酸、枸缘酸钠、酒石酸、酒石酸钠、磷酸氢二钠、磷酸二氢钠碳酸氢钠、碳酸钠、亚硫酸钠、焦亚硫酸钠、硫代硫酸钠、苯酚、苯甲醇、硫柳汞、氯化钠、葡萄糖、乙二胺四乙酸二钠、明胶、甲基纤维素、羧甲基纤维素、果胶、乳糖、蔗糖、聚氧乙烯蓖麻油、聚山梨酯、聚维酮等。
51.制备本发明固体制剂常用的辅料包括:聚乙烯吡咯烷酮、滑石粉、乳糖、糊精、蔗糖、甘露醇、葡萄糖、山梨醇、果糖、赤鲜糖、氯化钠、淀粉、微晶纤维素、磷酸二氢钙、碳酸镁、碳酸钙、硫酸钙、硅酸铝、硅酸钙、甲基纤维素、羟甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、微晶纤维素、乙基纤维素、聚乙二醇、聚乙烯醇、聚维酮、明胶、阿拉伯胶、西黄耆胶、海藻酸钠、琼脂、海藻酸、海藻酸钠、羟丙基淀粉、羧甲基淀粉钠、羧甲基纤维素钙、硬脂酸镁、硬脂酸钙、硬脂酸、微粉硅胶、聚乙二醇、十二烷基硫酸钠、十二烷基硫酸镁、聚氧乙烯单硬脂酸酯、聚氧乙烯月桂醇醚等。
52.制备本发明口服液体制剂辅料包括:乙醇、羟苯乙酯、羟苯甲酯、苯甲酸钠、山梨酸、蜂蜜、蔗糖、亚硫酸氢钠、硫代硫酸钠、抗坏血酸、硫脲、乙二胺四乙酸二钠、磷酸、枸橼酸、枸橼酸盐、酒石酸、酒石酸盐、甘油、乳糖、聚氧乙烯脂肪酸酯、碘化钾、醋酸钠、丙二醇、聚乙二醇、苯甲醇、对羟基苯甲酸酯、苯扎溴铵、邻苯基苯酚、桉叶油、桂皮油、薄荷油、甘露醇、阿司帕坦、糖精钠、天冬甜精、蛋白糖、香精、阿拉伯胶、羧甲基纤维素钠、琼脂、明胶、甲基纤维素、碳酸氢钠、色素、阿拉伯胶、西黄耆胶、桃胶、海藻酸钠、琼脂、淀粉浆、硅皂土、甲基纤维素、羧甲基纤维素钠、羟甲基纤维素、卡波普、聚维酮、葡聚糖、单硬脂酸铝、聚山梨酯类、聚氧乙烯蓖麻油类、泊洛沙姆、硬脂酸钠、硬脂酸钾、油酸钠、硬脂酸钙、十二烷基硫酸钠、十六烷基硫酸化蓖麻油、单甘油脂肪酸酯、三甘油脂肪酸酯、聚甘油硬脂酸酯、蔗糖单月桂酸酯、脂肪酸山梨坦、聚山梨坦、氢氧化钙、氢氧化锌、鲸蜡醇、蜂蜡、单硬脂酸甘油脂、硬脂酸、硬脂醇等。
53.制备本发明外用制剂所述常用辅料包括:甘露醇、聚山梨酯-80、硬脂酸聚烃氧酯、三乙醇胺、聚乙烯吡咯烷酮、碳酸氢钠、氯化钠、葡萄糖、硼酸、硼砂、凡士林、石蜡、液体石蜡、羊毛脂、蜂蜡、鲸蜡、二甲基硅油、硬脂酸、石蜡、十八醇、甘油、丙二醇、山梨醇、甲基纤维素、羟甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、海藻酸钠、海藻酸、皂土、卡波姆、果胶、没食子酸烷酯、丁羟基茴香醚、丁羟基甲苯、抗坏血酸、异抗坏血酸、亚硫酸盐、枸橼酸、酒石酸、乙二胺四乙酸二钠、巯基二丙酸、乙醇、异丙醇、氯丁醇、三氯叔丁醇、苯基-对-氯苯丙二醇、苯氧乙醇、苯甲酸、脱氢乙酸、丙酸、山梨酸、肉桂酸、茴香醚、香茅醛、丁子香酚、香兰酸酯、醋酸苯汞、硼酸苯汞、硝酸苯汞、苯酚、苯甲酚、麝香草酚、对氯邻甲苯酚、对氯-间二甲苯酚、煤酚、水杨酸、对羟基苯甲酸(乙酸、丙酸、丁酸)酯、苯扎氯铵、溴化烷基三甲基铵、可可豆酯、半合成椰油酯、半合成棕榈油脂、硬脂酸丙二醇酯、聚乙二醇、聚氧乙烯、单硬脂酸酯类、泊洛沙姆、硬脂酸、氢化蓖麻油、单硬脂酸甘油酯、硬脂酸铝等。
54.本发明的小分子多肽rk12原料药可与一定比例的上述常用药用辅料相配,按照本领域常规方法可制成包含口服剂、注射剂、片剂、散剂、丸剂、乳剂、混悬剂、胶囊剂、颗粒剂、口服液、软膏剂、凝胶剂、滴眼剂、贴膜剂、栓剂、喷雾剂、气雾剂、涂膜剂、洗剂中的任一种。
55.在具体的实施方案中,本发明提供的治疗痤疮的方法,包括施用在皮肤或皮肤伤口处有效剂量的小分子多肽rk12,其有效剂量为100~200μg重量份。
56.下面结合具体实施例对本发明做进一步详细说明。
57.实施例1:
58.小分子多肽rk12的抗痤疮丙酸杆菌的研究
59.一、小分子多肽rk12的制备
60.本发明采用的是α-氨基用fmoc(9-芴甲氧羰基)固相化学合成法合成氨基酸序列为rwwrffkfwwkk的抗菌肽,首先将树脂进行膨化(膨化树脂的目的是使树脂上活性基团暴露出来),然后向膨化后的树脂中加入2.5ml的20%的哌啶去保护,同时进行氨基酸的活化。将已经活化好的氨基酸加入到已经去保护和清洗干净的树脂中进行偶联,偶联完成时候将管中液体抽干并用dmf清洗8次,全部合成完毕后将树脂转移到裂解管中加入裂解液(tfa:phenol:tis:edt=87.5:5:5:2.5)进行裂解。最后,向裂解液中加冰乙醚至45ml,在4000r/min转速下离心5min,取出弃上清液,重复两次后得到下层我们所需的肽链粗品。
61.hplc分离纯化的具体方法为:
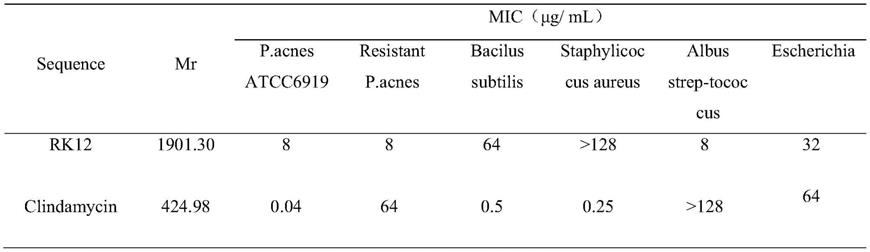
62.合成的多肽粗品用制备型waters2615的反相高效液相色谱(rp-hplc,柱型:xb-c18反相柱)进行分离纯化,流动相使用超纯水和乙腈;检测波长215nm和280nm;流速为20ml/min;其中流动相a相为乙腈,b相为含0.1%tfa的超纯水。将每一个洗脱峰收集并用质谱进行目的峰的鉴定,将较纯的目的蛋白的洗脱峰收集,冻干机冻干后-20℃保存。
63.制备得到的小分子多肽rk12的纯度不低于95%。
64.二、将制备得到的小分子多肽rk12进行抗菌谱测定
65.细菌的培养:痤疮丙酸杆菌(atcc6919)在bhi培养基中厌氧条件下生长;金黄色葡萄球菌(staphylicoccus aureus)、白色念球菌(albus strep-tococcus)、枯草杆菌(bacilus subtilis)和大肠杆菌(escherichia coli)在有氧条件下的琼脂培养基中生长,所有菌株均在37℃下培养。
66.菌悬液制备:细菌的浓度测定一般通过麦氏比浊管进行测定,麦氏比浊管浊度在
0.5麦氏浊度左右,此时细菌菌落数约为1
×
108cfu/ml,然后再按1:1000稀释成10
5-106cfu/ml的菌悬液。
67.抗菌实验:肽浓度为128-0.5μg/ml。在对数生长期取细菌悬浮液,将痤疮丙酸杆菌(p.acnes atcc6919)和耐克林霉素痤疮丙酸杆菌(resistant p.acnes)稀释至终浓度1
×
10 6
cfu/ml,将其他菌株稀释至1
×
10 5
cfu/ml。向每个孔中加入100μl细菌悬浮液。痤疮丙酸杆菌96小时静态培养和其他菌株17-20小时静态培养后在用酶标仪测定菌液在600nm处的吸收值,mic值是观察到的最低药物浓度,没有任何细菌生长迹象,按照检测不到细菌生长的孔和相邻孔的样品浓度平均值作为mic值。测试结果重复4至6次独立实验。
68.结果如表1所示,通过使用mic检测小分子多肽对痤疮丙酸杆菌的抗微生物活性。多肽rk12对痤疮丙酸杆菌的mic为8μg/ml,其对痤疮丙酸杆菌的mic值在其他测试的细菌菌株如金黄色葡萄球菌和变形链球菌中是最低的。
69.表1小分子多肽rk12抗菌谱测定结果
[0070][0071]
这表明小分子多肽rk12对抗痤疮丙酸杆菌具有特异性,此外,根据抗菌肽与抗生素的杀菌机制不同培养出耐克林霉素的痤疮丙酸杆菌,对耐药菌进行mic测定,结果如表1所示,小分子多肽rk12对耐克林霉素痤疮丙酸杆菌的mic为8μg/ml,与寻常痤疮丙酸杆菌的mic结果一致,表明该肽对耐克林霉素痤疮丙酸杆菌也具有很好的抑菌效果。
[0072]
接下来测量了小分子多肽rk12在不同时间点的痤疮丙酸杆菌杀伤动力学,如图1所示,用1
×
mic的rk12浓度处理痤疮丙酸杆菌(1
×
106cfu/ml)45分钟后,对比相同条件下克林霉素组出现明显的抑菌效果,并且小分子多肽rk12的快速抑菌效果远远高于临床常用抗生素克林霉素。与广谱抗生素相比,小分子多肽治疗更加关注病原体本身,不仅对细菌有快速抑菌作用同时也减少细菌耐药性的发展。
[0073]
三、研究小分子多肽抗痤疮丙酸杆菌的机理
[0074]
将痤疮丙酸杆菌(5
×
10 6
cfu/ml)用10μg/ml rk12处理2小时。通过离心(1000
×
g,5min)收获细菌,用pbs缓冲液洗涤两次,然后用2.5%戊二醛处理过夜。将细胞用0.1m磷酸盐冲洗15分钟至少三次,并用1%四氧化锇固定2-3小时。脱水条件如下:50%乙醇15-20分钟,70%乙醇15-20分钟,90%乙醇15-20分钟,90%乙醇15-20分钟和90%丙酮(1:1,v/v)。孵育条件如下:丙酮和包埋培养基(2:1,v/v)在室温下孵育3-4小时,丙酮和包埋培养基(1:2,v/v)在室温下孵育过夜,100%将包埋培养基在37℃下孵育2-3小时。固化条件是37℃过夜,45℃下12小时和60℃下24小时。切片切片后,使用3%乙酸铀酰和柠檬酸铅作为染料,通过扫描电镜观察样品。
[0075]
结果如图2a-2d所示,通过使用透射电子显微镜(tem)来揭示rk12杀菌的可能机制,图2a为没有经过药物处理的空白组,图2b、2c、2d为经rk12处理后的实验组1、实验组2和
实验组3。与空白组相比,将痤疮丙酸杆菌(1
×
106cfu/ml)用10μg/ml rk12处理2小时后,箭头所标明的痤疮丙酸杆菌出现明显的菌体内容物泄露情况,结果表明经过rk12处理后的痤疮丙酸杆菌的细菌壁膜完整性受到破坏。
[0076]
实施例2:
[0077]
小分子多肽rk12的抗炎症的研究
[0078]
(1)为了研究rk12对痤疮丙酸杆菌诱导的皮肤病的抗炎作用,本发明通过使用痤疮丙酸杆菌处理的炎性动物模型监测动物耳朵的变化来验证该肽的抗炎作用。
[0079]
取6周龄雌性昆明小鼠(22-25g)(n=5)随机分为5组,每组5只小鼠。如图3a所示为小鼠耳内皮中注射pbs组,如图3b所示为空白对照,剩余的三组小鼠耳内皮中注射浓度为1
×
10 7
cfu/20μl的痤疮丙酸杆菌。之后,将分别施用rk12(20,100,200μg)(如图3c、3d、3e所示)和克林霉素(0.05μg)(如图3f所示)于右耳的表面。72小时后,通过颈脱位处死动物并迅速切除耳朵。结果显示在注射痤疮丙酸杆菌24h后观察到小鼠耳皮肤红斑和肿胀,在仅用pbs注射的对照小鼠的耳朵中未观察到肿胀。经过72h治疗后,可以观察到不同药物组对小鼠耳朵炎症程度的变化,其中rk12组小鼠右耳炎症反应明显降低,而克林霉素组和对照组小鼠右耳出现不同程度的坏死情况。接下来,采用组织学测试来确认rk12在小鼠模型中的抗炎作用。
[0080]
结果如图4a-4f所示,图4a为注射pbs组小鼠耳朵组织he染色结果,图4b为空白小鼠耳朵组织he染色结果,图4c、4d、4e为20,100,200μg/ml rk12治疗后的小鼠耳朵组织he染色结果,图4f是使用0.05μg/ml克林霉素治疗后小鼠耳朵组织he染色结果。he染色组织学分析显示对照组渗入的炎性细胞的数量显着增加,尤其是在菌液注射部位。而在小鼠耳朵上表皮施用rk12后,由痤疮丙酸杆菌诱导的浸润的炎性细胞和炎症会减少,并且根据使用rk12的浓度不同,治疗效果也有所变化,治疗效果与rk12浓度呈依赖性变化。由此证明rk12对痤疮丙酸杆菌有一定治疗效果。
[0081]
(2)为了研究rk12对耐克林霉素痤疮丙酸杆菌诱导的皮肤病的抗炎作用,本发明通过使用耐克林霉素痤疮丙酸杆菌处理的炎性动物模型监测动物耳朵的变化来验证该肽的抗炎作用。
[0082]
取6周龄雌性昆明小鼠(22-25g)(n=5)随机分为3组,每组5只小鼠。如图5a所示,为小鼠耳内皮中注射pbs组;如图5b所示为空白对照,剩余的三组小鼠耳内皮中注射浓度为1
×
10 7
cfu/20μl的耐克林霉素痤疮丙酸杆菌。之后,将分别施用200μg/ml rk12(如图5c所示)和10μg/ml克林霉素(如图5d所示)于右耳的表面。72小时后,通过颈脱位处死动物并迅速切除耳朵。结果显示在注射痤疮丙酸杆菌后24小时观察到小鼠耳朵皮肤红斑和肿胀,在仅用pbs注射的对照小鼠的耳朵中未观察到肿胀。经过72h治疗后,可以观察到不同药物组对小鼠耳朵炎症程度的变化,其中200μg/ml rk12组小鼠右耳炎症反应明显降低,而克林霉素组和空白组小鼠右耳出现不同程度的坏死情况。接下来,采用组织学测试来确认rk12在小鼠模型中的抗炎作用。
[0083]
结果如图6a-6d所示,图6a为注射pbs组小鼠耳朵组织he染色结果,图6b为空白小鼠耳朵组织he染色结果,图6c为200μg/ml rk12治疗后的小鼠耳朵组织he染色结果,图6d是使用10μg/ml克林霉素治疗后小鼠耳朵组织he染色结果。he染色组织学分析显示对照组渗入的炎性细胞的数量显着增加,尤其是在菌液注射部位。而在小鼠耳朵上表皮施用rk12后,
由耐克林霉素痤疮丙酸杆菌诱导的浸润的炎性细胞和炎症会减少,由此证明rk12对耐克林霉素痤疮丙酸杆菌有一定治疗效果。
[0084]
序列表
[0085][0086]
在不冲突的情况下,本文中上述实施例及实施例中的特征可以相互结合。
[0087]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
