光皮桦mir156a前体基因及在促进植物分枝形成中的应用
技术领域
1.本发明属于植物生物技术领域,涉及一种光皮桦mir156a前体基因及在促进植物分枝形成中的应用。
背景技术:
2.microrna(mirna)是一类长度约为20-24nt内源非编码单链rna分子,具有调控基因表达的功能,在植物的生长发育、信号转导和胁迫响应等过程中起着关键作用。mirna基因以单拷贝、多拷贝或基因簇等多种形式存在于基因组中,而且绝大部分定位于基因间隔区。在植物中,细胞核内编码mirna的基因在转录后经过一系列加工成为成熟的双链mirna分子,该双链mirna与沉默复合体risc结合,通过剪切靶mrna或抑制靶mrna翻译来负调控基因表达。
3.microrna156s(mir156s)是植物micrornas中最为保守成员之一,在种子萌发、发育阶段转变、分蘖、花青素合成和赤霉素信号转导等方面有重要的调控作用。研究也显示,不同的mir156基因通过靶向不同的基因,在植物中发挥不同的功能。mir156在树木中调控分枝形成的作用尚未见有报道,因此,利用基因工程技术,将从光皮桦中克隆获得mir156a前体基因转入其它植物中,对于研究其功能具有重要意义,同时极具应用前景。
技术实现要素:
4.为解决上述问题,本发明的目的在于提供一种光皮桦mir156a前体基因及其促进在植物分枝形成中的应用。
5.本发明提供一种光皮桦mir156a成熟mirna,其序列如seq id no:1所示。
6.本发明还提供一种编码所述光皮桦mir156a成熟mirna的前体基因。
7.在一个实施方案中,该光皮桦mir156a前体基因的序列如seq id no:2所示。
8.本发明提供了含有上述基因的重组载体、宿主细胞、转基因细胞系或重组菌。
9.在一个实施方案中,该重组菌为将上述基因插入表达载体得到的重组菌。
10.另一方面,本发明提供了一种光皮桦mir156a前体基因在促进植物分枝形成中的应用,该基因的序列如seq id no:2所示的核苷酸序列。
11.在一个实施方案中,该光皮桦mir156a前体基因经剪切后的成熟序列为seq id no:1。
12.在一个实施方案汇总,将所述前体基因转入寄主植物基因组中,并在转基因植物中超量表达,促进植物分枝形成。
13.在一个实施方案中,该植物为烟草或拟南芥。
14.在一个实施方案中,该植物为烟草。
15.在一个实施方案中,包括:将包含上述光皮桦mir156a前体基因连接到过表达载体上,利用农杆菌介导转化到烟草,通过筛选和培养获得转基因株系。
16.本发明还提供一种转基因植株的构建方法,采用农杆菌介导的方法,将含有所述
前体基因的过表达载体转入植物基因组中,筛选获得转基因植株,所述的转基因植株与野生型相比,转基因植株分化生长出更多的分枝。
17.本发明提供了光皮桦mir156a前体基因在促进植物分枝形成中的应用。通过光皮桦mir156a前体基因的过量表达,有望人为地促进植物分枝的形成,增加侧枝的数量,在调控植物株形及产量等方面有重要的应用前景。
附图说明
18.图1为本发明的光皮桦叶片的基因组dna。
19.图2为光皮桦mir156a前体的表达载体菌液pcr检测。
20.图3为光皮桦mir156a前体转基因烟草植株的抗性筛选。
21.图4为转基因烟草mir156a前体表达水平检测。
22.图5为过量表达mir156a烟草与野生型烟草分枝数量的比较。
具体实施方式
23.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
24.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
25.为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图和具体实施例对本发明作进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
26.实验材料取自浙江农林大学林木遗传育种实验室的组培苗,品种光皮桦优3,叶片样品采下后立即液氮速冻并放置在-80℃冰箱保存待用。烟草野生型采用本生烟(nicotiana benthamiana)。
27.dna聚合酶、dna marker和trizol试剂均购自宝生物工程(大连)有限公司;十六烷基三甲基溴化铵(ctab)、β-疏基乙醇、聚乙烯吡咯烷酮(pvp)、nacl、tris-hcl等dna提取试剂购自上海生工生物工程股份有限公司;质粒提取试剂盒、dna胶回收试剂盒购自爱思进生物技术有限公司,无缝克隆试剂盒购置海南你行生物技术有限公司。pcr仪为美国伯乐pcr仪,超净工作台购自苏州诚净净化科技有限公司。
28.引物合成及测序均由北京擎科生物技术有限公司杭州分公司完成。
29.实施例1光皮桦mir156a前体基因克隆
30.利用改良ctab法提取光皮桦叶片基因组dna(图1),通过nanodrop分光光度计测定每个dna样品的od260、od280,并以此计算dna的浓度及纯度,并在1%琼脂糖凝胶电泳检测rna的完整性。所提dna的od260/od280比值均在1.80-1.90之间,浓度均在200ng/μl以上,说明dna无多糖、酚及蛋白质的污染;琼脂糖凝胶电泳结果显示dna样品条带清晰,大小在10kb以上,可推断dna没有降解,符合后续实验的要求。
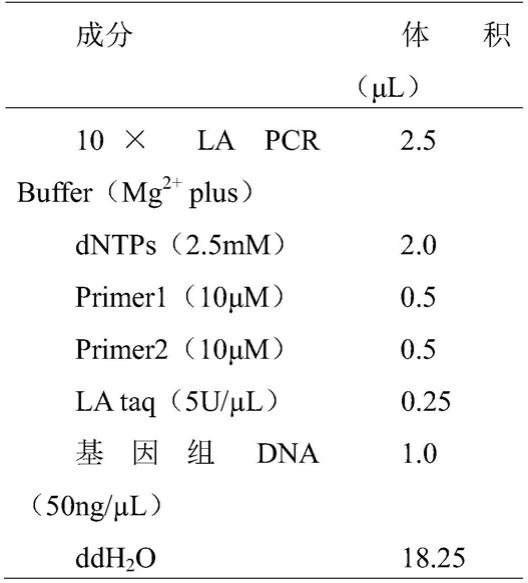
31.将光皮桦的基因组dna用适量ddh2o稀释至50ng/μl后,进行pcr扩增。基因克隆pcr体系如下(25μl):
[0032][0033]
反应程序为:94℃,3min;94℃,30sec,60℃,20sec,72℃,20sec,循环35次;72℃,5min。
[0034]
基因克隆所用引物为primer1:5
’‑
aggcatcatgttgacagaagag-3’,primer2:5
’‑
atggaagtgatggtgacagaag-3’。
[0035]
通过琼脂糖凝胶电泳进行pcr产物检测(图2),然后利用axyprep dna凝胶回收试剂盒(爱思进)进行目的片段回收。将目的片段连接到peasy-t1 cloning vector后,转化trans-t1感受态细胞,挑取阳性克隆鉴定和测序,序列如seq id no:2所示,该光皮桦mir156a前体基因经剪切后的成熟序列如seq id no:1所示。
[0036]
实施例2表达载体构建
[0037]
根据无缝克隆nimble cloning试剂盒(海南你行生物科技有限公司)说明书构建入门载体。
[0038]
(1)提取测序正确的阳性克隆质粒,利用高保真taq酶pcr扩增光皮桦mir156a前体基因片段,配制如下pcr体系(25μl):
[0039][0040]
(2)pcr程序为:94℃,3min;94℃,30sec,60℃,20sec,72℃,20sec,循环35次;72℃,5min。基因克隆所用引物为nc_primer1:5
’‑
agtggtctctgtccagtcctaggcatcatgttgacagaagag-3’,nc_primer2:5
’‑
ggtctcagcagaccacaagtatggaagtgatggtgacagaag-3’。
[0041]
(3)回收pcr产物,利用无缝克隆方法将mir156a前体基因构建至表达载体pnc-cam1304-35s,配制反应体系(10μl)如下:
[0042][0043][0044]
(4)将上述混合液充分混匀,在pcr仪上按50℃反应30min。
[0045]
(5)取2-5μl步骤4中的反应液,加入50μl dh5α感受态中,轻柔混匀,冰浴25-30min。
[0046]
(6)置于42℃水浴锅中热激60s,加250μl lb液体培养基,200rpm 37℃孵育45min。
[0047]
(7)4000rpm离心3min去部分上清液,余下100μl菌液涂于lb固体培养基(含50mg/l卡那霉素)上,37℃培养过夜。
[0048]
(8)用基因特异引物nc_primer1和nc_primer2进行菌液pcr检测,并测序确认。
[0049]
(9)提取测序结果正确的菌株质粒,待用。
[0050]
实施例3化学转化农杆菌及其检测
[0051]
(1)取-80℃保存的农杆菌感受态gv3101于室温或手心片刻待其部分融化,处于冰
水混合状态时插入冰浴中。
[0052]
(2)取1.0μl质粒dna加入50μl感受态中,用手拨打管底混匀,依次于冰上静置5分钟、液氮5分钟、37℃水浴5分钟、冰浴5分钟。
[0053]
(3)加入700μl无抗生素的lb液体培养基,于28℃振荡培养2~3小时。
[0054]
(4)6000rpm离心1min,留取100μl左右上清轻轻吹打重悬菌块涂布于lb(含50mg/l卡那霉素和50mg/l利福平)平板上,倒置放于28℃培养箱培养2-3天。
[0055]
(5)挑取单克隆,通过pcr鉴定阳性农杆菌,-80℃保存菌种。
[0056]
实施例4叶圆盘法转化烟草
[0057]
(1)取保存于-80℃的菌种,划线于lb平板,倒置放于28℃培养箱培养3天,从平板上挑取含有目的基因的单菌落,接种到3-5ml yeb液体培养基中(含50mg/l卡那霉素和50mg/l利福平)于恒温摇床上28℃,180rpm摇培过夜至od 600
为0.6-0.8。
[0058]
(2)培养过夜的菌液按1%-2%的比例,转入新配置的无抗生素的yeb培养基中,在与上述相同的条件下培养6h左右,待od
600
为0.2-0.5时即可用于转化。
[0059]
(3)取烟草无菌小苗的幼嫩、健壮叶片,去主脉,在无菌条件下用打孔器将其打成5mm直径的叶圆盘,放入固体诱导培养基ms1(ms 1mg/l 6-ba 0.1mg/l naa)中预培养48h。
[0060]
(4)将叶圆盘在稀释的农杆菌中浸泡30-60s,用无菌滤纸吸干。
[0061]
(5)将侵染后的叶圆盘放入固体诱导培养基ms1(ms 1mg/l6-ba 0.1mg/l naa)中,黑暗28℃共培养7天,至有微菌落产生。
[0062]
(6)取出叶圆盘,用含500mg/l羧苄青霉素的无菌水漂洗5次左右,无菌滤纸吸干。
[0063]
(7)将叶圆盘置于诱导出芽的固体选择培养基ms2(ms1 30mg/l潮霉素 400mg/l羧苄青霉素)中,在25-28℃,16h/8h光暗条件下选择培养。
[0064]
(8)20天后转入ms3(ms1 30mg/l潮霉素 300mg/l羧苄青霉素)固体选择培养基中,培养2周后转入ms4(ms1 30mg/l潮霉素 200mg/l羧苄青霉素)固体选择培养基中培养(图3)。
[0065]
(9)待不定芽长到1cm左右,将不定芽移至1/2ms固体培养基中(含200mg/l羧苄青霉素)生根培养,约5-10天长出不定根。
[0066]
(10)将生根的小苗移入基质中,在培养室中培养40-50天,开花结种按单株收集种子。
[0067]
实施例5转基因烟草纯合株系获取
[0068]
(1)取适量的转基因烟草种子,加入75%乙醇,充分振荡10min。弃去75%乙醇后,加入无水乙醇振荡1min,重复操作3次。加入无菌水振荡1min,重复3次,将无菌水吸去。
[0069]
(2)将灭菌后的烟草种子,均匀的播种于固体培养基(ms 30mg/l潮霉素)上,封好培养皿,置于光照培养箱萌发。
[0070]
(3)烟草萌发后长至有4-5张叶片时,选择生长良好的幼苗,移栽至基质中培养。
[0071]
(4)待烟草长至8-10张叶片时,提取叶片dna,进行pcr检测。
[0072]
(5)按上述方法培养3代,得到mir156a前体基因的转基因烟草的纯合株系。
[0073]
实施例6转基因烟草mir156a表达水平检测及分枝性状观察
[0074]
(1)取野生型和转基因烟草纯化株系种子,用无菌水浸泡2小时。
[0075]
(2)将浸泡后的种子播种于基质上,培养箱内25℃,16h/8h光暗条件下萌发。
[0076]
(3)萌发一周后,将小苗移栽至育苗盆内,每个株系至少移栽10株,培养室内25-28℃,16h/8h光暗条件下培养40-50天。
[0077]
(4)取烟草叶片提取rna,通过定量pcr对mir156a前体基因的表达进行检测(图4)。定量pcr结果显示不同,转基因株系mir156a前体基因表达水平存在差异。
[0078]
(5)观察野生型和转基因烟草植株的形态,统计各个植株的分枝数量,比较野生型和转基因植株间分枝数量的差异。观察野生型和转基因植株在生长40天后的植株形态和分枝数量,发现野生型植株的平均分枝数量为4.4个;而转基因植株分枝数量随着mir156a表达水平的提高而明显增加,其中表达水平最低的株系植株平均分枝数为6.8个,表达水平最高的株系植株平均分枝数为12.8个,表明mir156a过量表达植株可以分化生长出更多的分枝(图5)。
[0079]
综上所述,转入光皮桦mir156a前体基因使得植物的生长发育受到影响,促进分枝的形成,植株可产生更多的分枝。
[0080]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。