抑制tert表达的试剂在制备预防或治疗胸主动脉瘤的药物中的应用
技术领域
1.本发明涉及生物技术领域,具体地说,是抑制端粒酶逆转录酶(telomerase reverse transcriptase,tert)表达的试剂在制备预防或治疗胸主动脉瘤的药物中的应用。
背景技术:
2.主动脉瘤是一种在内外因素作用下主动脉壁结构改变导致主动脉管腔进行性扩张,超过正常直径50%的一种疾病。胸主动脉瘤(thoracic aortic aneurysm,taa)则是发生在主动脉窦、升主动脉、主动脉弓或降主动脉的动脉瘤。相较于其他常见的心血管疾病,虽然其发病率较低,但由于起病隐匿,早期多无症状,随着疾病的进展,可发生胸主动脉夹层或动脉瘤破裂而危及生命。目前尚无taa的早期诊断方法和有效的防治药物。因此,阐明taa的发病机制对其诊断标志物和药物靶点的研究都具有重要的理论价值和临床意义。
3.胸主动脉壁由主动脉内膜层、中膜层和外膜层组成,中膜层是维持主动脉壁张力和强度主要成分。血管平滑肌细胞(vascular smooth muscle cells,vsmcs)作为主动脉中膜层的主要细胞成分,在维持管壁结构完整性和功能方面发挥关键作用。其表型转化,凋亡坏死等生物学功能的改变则在胸主动脉瘤的发病中扮演重要角色。血管vsmc有收缩型和合成型两种表型;稳态下大多数以收缩表型为主,细胞形态呈长梭形,具有较强的收缩能力,增殖迁移能力弱,α-平滑肌肌动蛋白(α-smooth muscle actin,α-sma)和sm22(smooth muscle 22alpha,sm22)等收缩相关蛋白表达丰富。而合成表型则在血管发育,疾病过程中发挥重要作用,细胞呈现多角形,骨桥蛋白(osteopontin,opn)等分泌相关蛋白表达上调,同时分泌能力增强,细胞活性氧类(reactive oxygen species,ros),基质金属蛋白酶类(matrix metalloproteinase,mmps)等分子表达分泌增加,使得细胞外弹力纤维逐渐降解,进而使得主动脉壁的张力减弱,扩张进展,最终发生主动脉瘤。
4.端粒酶是一种核糖核蛋白酶,其功能是延长端粒,保持有丝分裂过程中端粒的稳定,在维持基因组完整、细胞长期的活性和潜在的继续增殖能力等方面发挥重要作用。端粒酶逆转录酶(telomerase reverse transcriptase,tert)作为端粒酶的催化核心,是端粒酶的重要组成成分。一直以来,维持有丝分裂后端粒的长度被认为是tert最重要的功能。然而越来越多的证据表明tert可以调节多种细胞功能,并在肿瘤,衰老等病理生理过程中发挥重要作用。tert在心血管系统中同样有着不可替代的功能,tert可以通过促进心肌细胞和vsmc的增殖在血管和心脏的发育等生理过程中发挥重要作用;同时,tert也被证明在冠状动脉粥样硬化和心肌梗死等心血管疾病过程中表达明显上调。tert在心血管领域的作用和巨大潜力不容小觑,其在大血管中的功能研究有助于我们更好的理解其发病机理,进一步找到大血管疾病相关的药物靶点,填补这一药物治疗的空白区,从而为这类疾病的预防或治疗提供行之有效的途径。
技术实现要素:
5.本发明的目的在于提供一种防治胸主动脉瘤的新的靶点,以及抑制端粒酶逆转录酶(telomerase reverse transcriptase,tert)表达的试剂在防治胸主动脉瘤中的新用途。
6.为了实现上述目的,本发明采用以下技术方案:
7.本发明首先通过检测taa患者胸主动脉中tert和vsmcs表型标志物的表达情况探索tert,vsmcs表型转化与taa的相关性,证明了taa主动脉组织中tert表达上调且伴随着vsmcs的表型转化过程,并在小鼠taa模型中证明了这种相关性。随后通过细胞学实验诱导vsmcs合成表型的方法证明了tert与vsmcs表型转化的相关性。最后,通过转染tert特异性si-rna至合成表型vsmcs的方法干预tert的表达,通过检测干预前后vsmcs表型标志物的表达情况,发现抑制tert使vsmcs合成标志物opn,代表细胞增殖能力的pcna表达下调,收缩表型标志物sm22α表达上调。说明tert对vsmcs的表型转化具有调控作用。结合现有研究结果,taa的发病过程伴随着vsmcs表型由收缩型向合成型转化,据此推断tert sirna在防止taa的发病过程中发挥作用。
8.本发明的第一方面,提供tert作为治疗靶点在制备预防或治疗胸主动脉瘤的药物中的应用。
9.本发明的第二方面,提供抑制tert表达的试剂在制备预防或治疗胸主动脉瘤的药物中的应用。
10.进一步的,所述的抑制tert表达的试剂是指任何可降低tert的活性、降低tert的稳定性、抑制tert的表达、减少tert的有效作用时间、或抑制tert的转录和加工的物质等。
11.进一步的,所述的抑制tert表达的试剂包括但不限于:
12.特异性结合tert的蛋白;
13.特异性干扰tert基因表达、加工的小干扰分子,如sirna分子、mirna分子、反义核苷酸等;以及包含上述小干扰分子的重组载体或重组菌;
14.tert拮抗剂、下调剂、阻滞剂、阻断剂等。
15.在本发明的一个优选实施方式中,所述的抑制tert表达的试剂为tert的小干扰rna(small interfering rna,sirna),其核苷酸序列如seq id no.1所示:
[0016]5’‑
uauauucaguauuuuacuccc-3’(seq id no.1)。
[0017]
进一步的,所述的抑制tert表达的试剂特异性用于胸主动脉血管平滑肌细胞(vascular smooth muscle cells,vsmcs)。
[0018]
进一步的,所述的抑制tert表达的试剂抑制血小板源生长因子(pdgf-bb)诱导的血管vsmcs的增殖和迁移。
[0019]
进一步的,所述的抑制tert表达的试剂调控血管vsmcs的表型转化。
[0020]
更进一步的,所述的调控血管vsmcs的表型转化是指:抑制tert表达的试剂缓解收缩型vsmcs向合成型转化的进程,表现为收缩型标志物sm22α的升高以及合成型标志物opn的降低。
[0021]
本发明的第三方面,提供抑制tert表达的试剂在制备抑制pdgf-bb诱导的胸主动脉vsmcs增殖、迁移和调控胸主动脉vsmcs表型转化的药物中的应用。
[0022]
本发明的第四方面,提供一种预防或治疗胸主动脉瘤的药物或试剂,其包含:治疗
有效量的抑制tert表达的试剂,以及药学上或免疫学上可接受的载体或辅料。
[0023]
本发明的第五方面,提供一种筛选预防或治疗胸主动脉瘤的潜在物质的方法,所述方法包括:
[0024]
(1)检测候选物质在胸主动脉疾病中的表达水平;
[0025]
(2)用候选物质抑制剂处理胸主动脉vsmcs;
[0026]
(3)检测所述体系中vsmcs相关生物活性指标的表达或活性;
[0027]
其中,若所述候选物质可降低增殖以及迁移能力,同时降低vsmcs合成型标志物的表达,则表明该候选物质是预防或治疗胸主动脉瘤的潜在物质。
[0028]
在一个优选例中,
[0029]
步骤(1)包括:在测试组中,测试候选物质在体系中的表达水平;
[0030]
步骤(2)包括:在测试组中,首先诱导vsmcs向合成型转化,再将候选物质加入到vsmcs的培养体系中;
[0031]
步骤(3)包括:检测测试组的体系中vsmcs合成型标志物的表达或活性,并与对照组比较,其中所述的对照组是不添加所述候选物质的培养体系;
[0032]
如果测试组中vsmcs合成型标志物的表达或活性在统计学上低于(优选显著低于,如低20%以上,较佳的低50%以上;更佳的低80%以上)对照组,就表明该候选物是预防或治疗胸主动脉瘤的潜在物质。
[0033]
tert及其用途
[0034]
tert作为端粒酶的催化核心,是端粒酶的重要组成成分。一直以来,tert因其能够维持真核生物有丝分裂过程中端粒的长度,在衰老和肿瘤等生理病理过程中的作用已被广泛研究。最近的研究结果表明,tert同样在心血管系统中发挥重要作用。tert可以通过调控有丝分裂周期促进vsmc的增殖;tert也可以促进心肌细胞增殖,使正常的心肌细胞向肥大形态转化。在心血管疾病中,tert在冠状动脉粥样硬化中表达显著上调,并且在心肌梗死病变中对恢复缺血后再灌注的心肌细胞的功能起着关键作用。目前已有关于tert可能参与taa发病过程的报道,但具体机制尚不清楚。
[0035]
本发明优点在于:
[0036]
本发明经过深入的研究,首次揭示了tert的表达与主动脉疾病密切相关,证实了tert抑制剂可以特异性地抑制主动脉血管vsmc的增殖以及由收缩型向合成型的转化过程,从而为主动脉疾病的防治提供了新的靶点和药物。
附图说明
[0037]
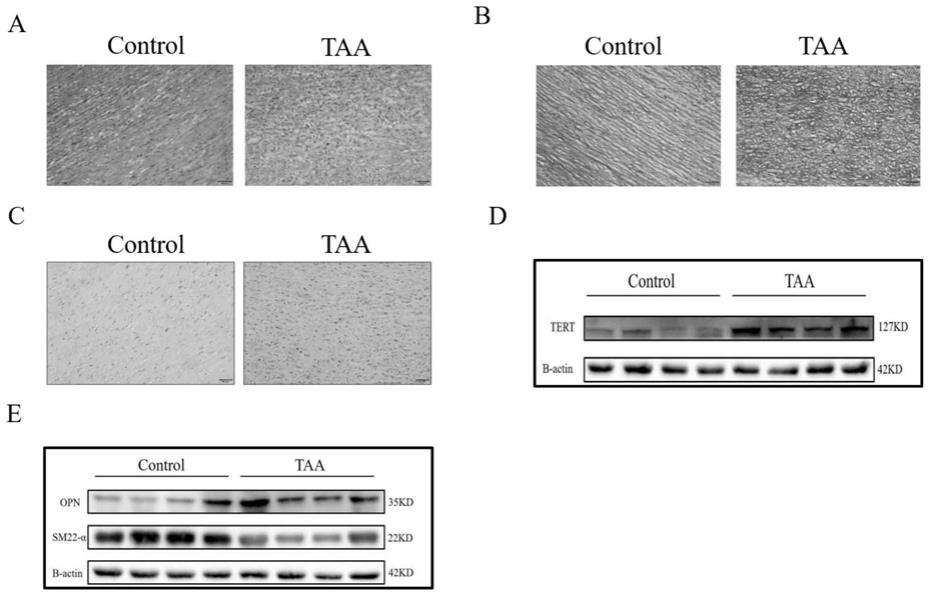
图1.免疫印迹及免疫组化对人主动脉组织tert及vsmcs表型标志物的表达进行分析,以期获得tert及vsmcs表型标志物在正常主动脉及胸主动脉瘤组织中的差异表达。a、he染色显示相比于正常胸主动脉,tta组织中细胞排列无序,极性紊乱。b、vb染色显示taa中着蓝绿色的弹力纤维板断裂破坏,同时着红色的胶原纤维虽然增多,但是结构排列杂乱。c、免疫组化结果显示tert在taa组织中表达水平较正常主动脉组织明显升高。d、western blot结果显示tert在taa组织中表达水平较正常主动脉组织升高。e、taa组织中opn表达较正常主动脉组织上调,而sm22α在taa组织中表达下调。
[0038]
图2.angii微量缓释泵构建小鼠胸主动脉瘤模型,he&vb染色及免疫组化分析胸主
动脉模型构建进程。a、he染色显示随着angii的持续泵入,从建模的第3周开始实验组小鼠的胸主动脉中膜层中vsmc开始出现排列紊乱;至第4周时,vsmc排列更加紊乱,且极性消失。b、vb染色的结果显示,在建模的前两周,实验组与对照组相比没有明显差异;随着angii的持续泵入,从建模的第3周开始实验组小鼠的胸主动脉中膜层中弹力纤维间距离增宽,偶有断裂;至第4周时,弹力纤维数量减少,间距变得更宽,断裂更加明显。c、tert免疫组化结果显示,至建模第三周开始tert表达升高,第四周表达明显上调。d、sm22α免疫组化结果显示,至建模第三周开始sm22α表达下调,第四周表达明显下调。
[0039]
图3.tert与vsmc表型的相关性验证。分别使用含fbs浓度为10%、5%、1%的dmem培养基培养vsmc 48小时,提取细胞蛋白,使用western blot方法检测vsmc表型标志物和tert表达。a、随着血清浓度由10%降低至1%,vsmc合成表型标志物opn和代表细胞增殖能力的pcna表达逐渐下调,vsmc收缩表型标志物sm22α表达逐渐上调,且伴随着tert的表达逐渐下调。在含fbs浓度为5%的dmem培养基中加入1μl浓度为10μg/ml的pdgf-bb,分别培养vsmc 24小时,48小时,72小时后,提取细胞蛋白,使用western blot方法检测vsmc表型标志物和tert表达。b、随着pdgf-bb刺激时间的增加,opn和pcna表达逐渐上调,sm22α逐渐下调;且tert表达逐渐上调。
[0040]
图4.抑制tert表达。通过使用脂质体转染试剂ribofect
tm cp转染梯度浓度的tert特异性sirna至合成表型vsmcs以干扰tert的表达。a、转染tert特异性sirna组与对照组相比tert表达下调,opn,pcna表达下调,sm22α表达上调。b、cck-8实验的结果表明,抑制tert后细胞增殖能力减弱。c、划痕实验结果表明抑制tert表达后vsmc的水平迁移能力减弱。
具体实施方式
[0041]
下面结合实施例对本发明提供的具体实施方式作详细说明。
[0042]
应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室指南(new york:cold spring harbor laboratory press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
[0043]
以下实施例中采用的材料和方法:
[0044]
蛋白制备
[0045]
人主动脉总蛋白、小鼠组织以及培养细胞的总蛋白用sds裂解液提取。
[0046]
western blot
[0047]
bca测定法调整蛋白浓度;配置分离胶和浓缩胶;电泳;转模;抗体敷育;显影。
[0048]
小鼠胸主动脉瘤模型
[0049]
选取重量为16-18克c57bl/6成年雄鼠,随机分为空白对照组和模型组。常规饲料及常规饮用水喂养,taa组皮下植入已预装的angii微量缓释泵(alzet,10370),并持续释放angii 1000ng/(min
·
kg)。分别在1周、3周、4周解剖模型组2只老鼠,观察建模情况。其余小鼠在模型建立结束后即进行解剖,标本分别行液氮保存及甲醛固定。
[0050]
组织学常规染色分析
[0051]
取对照组和模型组小鼠胸主动脉,用4%多聚甲醛固定过夜,石蜡包埋。石蜡切片(4μm)后用苏木精&伊红染色(h&e)及维多利亚兰染色(vb),观察分析。
[0052]
组织免疫组化及分析
[0053]
采用链霉素抗生素蛋白-过氧化酶法。对石蜡切片进行常规脱蜡水化,柠檬酸盐缓冲液热修复抗原,依次滴加过氧化物酶阻断液(37℃封闭10min)、10%非免疫性动物血清(37℃孵育30min)、一抗(1:100稀释,4℃过夜)、生物素标记的二抗(37℃孵育1h),dab显色后行苏木素复染,脱水透明,中性树胶封片。结果判定标准:切片均采用双盲法由2位病理科医生独立阅片,细胞质内出现黄褐色颗粒者为阳性结果。
[0054]
统计学分析
[0055]
分类数据显示为百分比,连续变量显示为平均值
±
标准误。student’s t test用于检验连续变量;通过卡方检验或fisher精确检验比较分类变量。spearman检验进行相关性分析。spss21程序用于数据分析。p《0.05为显著差异。
[0056]
实施例1:胸主动脉瘤患者标本收集及tert表达水平
[0057]
采用2018年12月至2019年12月,22例胸主动脉组织取自长海医院胸心外科因胸主动脉瘤行外科手术的患者术中切除的血管标本,10例正常对照组取自器官捐献者。取材后置于液氮中保存,取1cm大小的组织进行4%多聚甲醛固定,包埋蜡块,行组织化学染色及免疫组织化学染色,提取组织蛋白行western blot。he染色显示相比于正常胸主动脉,tta组织中细胞排列无序,极性紊乱(图1a)。vb染色显示taa中着蓝绿色的弹力纤维板断裂破坏,同时着红色的胶原纤维虽然增多,但是结构排列杂乱(图1b)。免疫组化结果显示tert在taa组织中表达水平较正常主动脉组织明显升高(图1c)。western blot结果显示tert在taa组织中表达水平较正常主动脉组织升高(图1d)。taa组织中opn表达较正常主动脉组织上调,而sm22α在taa组织中表达下调(图1e)。
[0058]
结果显示:胸主动脉瘤组tert水平显著高于正常对照组(图1c,1d),western blot显示胸主动脉瘤组opn水平明显高于正常对照组,sm22α明显低于对照组(图1e)。
[0059]
实施例2:胸主动脉瘤小鼠模型建立及验证
[0060]
选取重量为16-18克c57bl/6成年雄鼠45只,采用标准饲料分笼进行适应性饲养1周。之后采用数字表法,将小鼠随机分为对照组(control,n=20),模型组(taa,n=25),常规饲料及常规饮用水喂养。taa组皮下植入已预装的angii的微量缓释泵(alzet,10370),并持续释放angii 1000ng/(min
·
kg);小鼠在模型建立结束后即进行解剖,标本分别行液氮保存及甲醛固定,行病理切片及常规染色,结果显示埋泵第4周,主动脉血管壁的弹力纤维明显遭到破坏,管腔明显扩大,标志着建模成功(图2a,2b)。
[0061]
免疫组化结果显示:从第1周至第4周,tert的表达逐渐增加,sm22α的表达逐渐降低(图2c和2d)。
[0062]
实施例3:tert与vsmc表型的相关性
[0063]
分别使用含fbs浓度为10%、5%、1%的dmem培养基培养vsmc 48小时,提取细胞蛋白,使用western blot方法检测vsmc表型标志物和tert表达。随着血清浓度由10%降低至1%,vsmc合成表型标志物opn和代表细胞增殖能力的pcna表达逐渐下调,vsmc收缩表型标志物sm22α表达逐渐上调,且伴随着tert的表达逐渐下调。在含fbs浓度为5%的dmem培养基
中加入1μl浓度为10μg/ml的pdgf-bb,分别培养vsmc 24小时,48小时,72小时后,提取细胞蛋白,使用western blot方法检测vsmc表型标志物和tert表达(图3a)。b、随着pdgf-bb刺激时间的增加,opn和pcna表达逐渐上调,sm22α逐渐下调;且tert表达逐渐上调(图3b)。
[0064]
结果显示:在pdgf-bb或含高浓度fbs的dmem培养基的诱导下,vsmcs会向着合成表型转化,伴随着tert和合成型标志物的表达升高以及收缩型标志物的降低,这证明了tert与vsmcs表型转化之间的相关性。
[0065]
实施例4:抑制tert对vsmc生物学功能的影响
[0066]
通过使用脂质体转染试剂ribofect
tm cp转染梯度浓度的tert特异性sirna(seq id no.1)至合成表型vsmcs以干扰tert的表达。转染tert特异性sirna组与对照组相比tert表达下调,opn,pcna表达下调,sm22α表达上调(图4a)。cck-8实验的结果表明,抑制tert后细胞增殖能力减弱(图4b)。划痕实验结果表明抑制tert表达后vsmc的水平迁移能力减弱(图4c)。
[0067]
结果显示:转染tert sirna至vsmcs以抑制tert的表达,合成型vsmcs会向着收缩表型转化,伴随着收缩型标志物sm22α的升高以及合成型标志物opn的降低(图4a)。另外,应用tert sirna可明显降低vsmcs的增殖和水平迁移能力(图4b,4c)。
[0068]
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本技术权利要求所限定的范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。