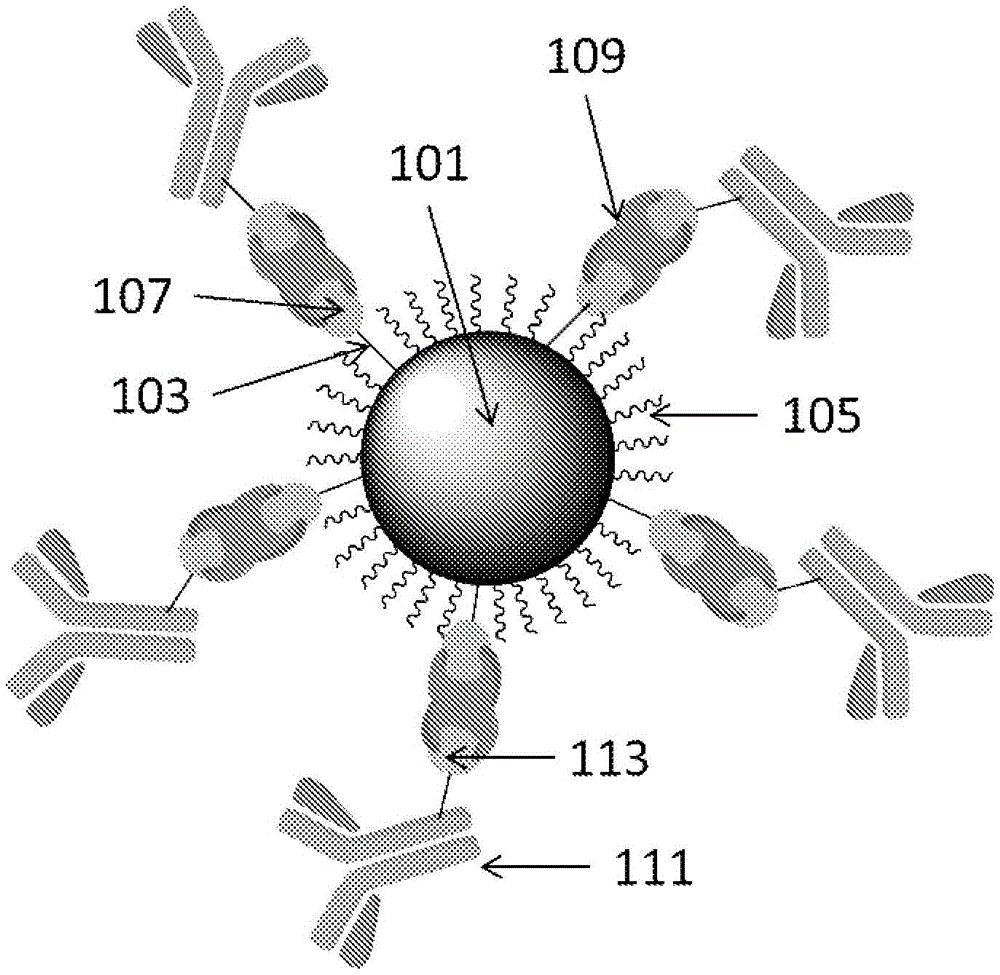
在一些实施方案中,本公开提供了用作生物传感器应用中的标记物的发光标记物,任选为发光标记物颗粒。已经公开了氧化硅纳米颗粒和发光材料作为标记或检测试剂。WO2018/060722公开了包含氧化硅和具有极性基团的发光聚合物的混合物的复合颗粒。Estevez,M-C.等人‘HighlyFluorescentDye-DopedSilicaNanoparticlesIncreaseFlowCytometrySensitivityforCancerCellMonitoring’Nano.Res.2009,2,448-461公开了用聚乙二醇官能化的染料掺杂的氧化硅纳米颗粒。US2010/209946公开了用水分散基团、屏蔽基团和生物分子结合基团官能化的氧化硅纳米颗粒。Pellegrino等人的“MultipleDyeDopedCore-ShellSilicaNanoparticles:OutstandingStabilityandSignalIntensityExploitingFRETPhenomenonforBiomedicalApplication”J.Nanomater.Mol.Nanotechnol.2018,S6;doi:10.4172/2324-8777.S6-003公开了掺杂有不同染料的芯-壳氧化硅纳米颗粒,所述染料包埋在氧化硅芯中并且与抗人类CD8抗体缀合。US2013/0183665公开了一种制备选自贵金属、氧化硅或聚合物纳米颗粒的荧光纳米颗粒的方法。技术实现要素:下面阐述本文公开的特定实施方案的方面的概述。应当理解,呈现这些方面仅仅是为了向读者提供这些特定实施方案的简要概述,并且这些方面并不意图限制本公开的范围。实际上,本公开可以涵盖可能未阐述的多个方面和/或方面的组合。在一些实施方案中,提供了一种用于靶标分析物的测定方法,该方法包括使样品接触发光标记物,以及确定靶标分析物与发光标记物的任何结合,其中发光标记物具有包含发光材料或由发光材料组成的发光芯部。包含第一生物素基团的第一基团结合到发光芯部。第二生物素基团结合到生物分子。蛋白质结合到第一生物素基团和第二生物素基团。任选地,所述生物分子包含抗原结合片段。所述生物分子可以是抗体。任选地,所述蛋白质选自亲和素(avidin)、链霉亲和素(streptavidin)、中性亲和素(neutravidin)及其重组变体。任选地,所述发光芯部包含发光聚合物或由发光聚合物组成。在一些实施方案中,使发光标记物分散在样品中。任选地,所述发光标记物是发光颗粒,所述发光颗粒具有包含所述发光材料的粒状发光芯部,并且其中与所述发光芯部的表面结合的第一表面基团包括所述第一生物素基团。任选地,所述第一表面基团具有设置在所述发光芯部的表面与所述第一生物素基团之间的聚醚链。任选地,聚醚基团是式(I)的基团:-((CR14R15)bO)c-(I)其中R14和R15各自独立地为H或C1-6烷基;b为至少1;且c为至少2。在一些实施方案中,使发光标记物溶解在样品中。任选地,第二表面基团结合到发光芯部的表面,其中第二表面基团不包含生物素。任选地,第二表面基团包含聚醚。任选地,第一表面基团:第二表面基团的摩尔比在1:1000至1:10的范围内。任选地,所述发光芯部含有发光材料和基质材料。任选地,基质材料是氧化硅。任选地,靶标分析物是靶标抗原。任选地,通过流式细胞术来分析与发光标记物接触的样品。任选地,确定结合到发光标记物的靶标分析物的量,例如通过流式细胞术分析来确定。任选地,样品包含细胞的混合物,并且对结合到发光标记物的一种或多种不同类型的靶标细胞进行鉴定和/或量化。在一些实施方案中,本公开提供了一种发光标记物,所述发光标记物包含:发光芯部,该发光芯部包含发光材料;第一基团,该第一基团结合到发光芯部并且包含第一生物素基团;第二生物素基团,该第二生物素基团结合到生物分子;以及蛋白质,该蛋白质结合到所述第一生物素基团和所述第二生物素基团。发光标记物可以如本文所述。所述发光标记物可包含芯部、第一基团、第二基团、蛋白质基团、第一表面基团、第二表面基团或如本文任何地方所述的基质。在一些实施方案中,提供了一种胶体,该胶体包含悬浮在液体中的如本文所述的发光标记颗粒。任选地,所述液体包含水或由水组成。任选地,所述液体是缓冲溶液。在一些实施方案中,提供了一种形成如本文所述的发光标记物的方法,其中使结合到第二生物素基团的生物分子与具有第一生物素基团的前体发光标记物和结合到第一生物素基团的蛋白质接触。任选地,在接触这些材料之后并且在将发光标记物用于测定之前,将未结合到前体发光标记物的与第二生物素基团结合的任何生物分子从所述发光标记物分离。附图说明结合附图描述本公开。要强调的是,根据行业中的标准实践,各个特征未按比例绘制。实际上,为了讨论的清楚,各个特征的尺寸可以任意增加或减小。在附图中,相似的部件和/或特征可以具有相同的附图标记。此外,可以通过在附图标记之后加上破折号和第二标记来区分相同类型的各种部件,所述破折号和第二标记在相似部件之间进行区分。如果在说明书中仅使用第一附图标记,则该描述适用于具有相同的第一附图标记的类似部件中的任一个,而与第二附图标记无关。现在将参考附图更详细地描述本发明,其中:图1是根据一些实施方案的纳米颗粒的示意图;图2是根据一些实施方案的形成纳米颗粒的方法的示意图;图3是用于形成DBCO官能化抗体的反应方案;图4是根据本公开一个实施方案的使用缀合到生物素化抗体的发光纳米颗粒的板测定(plateassay)的柱状图;图5是使用比较性发光纳米颗粒的板测定的柱状图,其中抗体通过EDC/NHS化学缀合到纳米颗粒;图6是使用比较性发光纳米颗粒的板测定的柱状图,其中抗体通过叠氮化物/炔烃点击化学缀合到纳米颗粒;图7是以下的染色指数图:根据本公开实施方案的用生物素化的溶解发光聚合物标记物染色的Cyto-Trol细胞,其通过链霉亲和素缀合到抗人类CD4抗体;以及与相同抗体缀合的比较性发光纳米颗粒;图8是以下的染色指数图:用图7的链菌亲和素缀合的纳米颗粒染色的Cyto-Trol细胞;与同种型缀合的发光纳米颗粒;以及不缀合到链霉亲和素的发光纳米颗粒;图9是以下的染色指数图:根据本公开实施方案的用生物素化的纳米颗粒染色的Cyto-Trol细胞,其通过中性亲和素缀合至抗人类CD4抗体;以及与相同抗体缀合的比较性的溶解发光聚合物标记物;图10是以下的染色指数图:用图9的中性亲和素缀合的纳米颗粒染色的Cyto-Trol细胞;与同种型缀合的发光纳米颗粒;以及不与中性亲和素缀合的发光纳米颗粒;图11是以下的染色指数图:根据本公开实施方案的用具有不同量的生物素的生物素化纳米颗粒染色的Cyto-Trol细胞,其通过链霉亲和素缀合至抗人类CD4抗体;以及与相同抗体缀合的比较性的溶解发光聚合物标记物。具体实施方式除非上下文清楚地另外要求,否则在整个说明书和权利要求书中,词语“包括”、“包含”等应被解释为包含性意义,而不是排他性或穷举性含义;也就是说,为“包括但不限于”的意义。本文中所使用的术语“连接”、“偶联”或其任何变体是指两个或更多个要素之间的任何连接或偶联,要么直接的要么间接的。另外,当在本申请中使用时,词语“本文”、“上文”,“下文”和类似含义的词语是指本申请整体,而不是本申请的任何特定部分。在上下文允许的情况下,详细描述中的使用单数或复数的词语也可以分别包括复数或单数。涉及两个或更多个项目的列表中的词语“或”涵盖该单词的所有以下解释:列表中的任何项目、列表中的所有项目以及列表中项目的任何组合。本文提供的技术的教导可以应用于其它系统,不一定是下面描述的系统。可以将下面描述的各个实施例的要素和动作进行组合以提供该技术的其它实施方式。该技术的一些替代实施方式不仅可以包括下文提到的那些实施方式的额外要素,而且可以包括更少的要素。可以根据以下详细描述对该技术进行这些和其它改变。尽管说明书描述了该技术的某些实施例,并且描述了所考虑的最佳模式,但是无论该描述有多么详细,该技术都可以按许多方式来实践。该系统的细节在其具体实施方式中可能显著变化,而仍被本文公开的技术所涵盖。如上文所述,在描述该技术的某些特征或方面时使用的特定术语不应被认为暗示该术语在本文中被重新定义为限于与该术语相关联的技术的任何具体的特性、特征或方面。通常,不应将以下权利要求书中使用的术语解释为将该技术限制为说明书中公开的具体实例,除非详细描述章节明确定义了这些术语。因此,该技术的实际范围不仅涵盖所公开的实例,而且还包括实践或实施权利要求书下的技术的所有等效方式。为了减少权利要求的数目,下文以某些权利要求的形式呈现该技术的某些方面,但是申请人以任何数目的权利要求形式设想该技术的各个方面。在下面的描述中,出于解释的目的,阐述了许多具体细节以便提供对所公开技术的实施方式的透彻理解。然而,本领域技术人员将清楚可以在没有这些具体细节中的一些的情况下实践所公开技术的实施方案。本发明人已经发现,通过具有多个生物素结合位点的蛋白质(例如链霉亲和素)结合到生物素化的生物分子(例如抗体)的生物素化的发光芯部能够产生具有高信噪比、低标准偏差和/或在流式细胞术情况下的高染色指数的测定。宽范围的生物素化抗体是可商购的,并且因此适用于检测相应宽范围的抗原的发光标记物可以由蛋白质缀合的生物素化发光芯部形成。优选地,生物素化生物分子与蛋白质之间的结合发生在环境温度(例如20℃)或在较低温度(例如在0-20℃的范围内)混合时,即不需要任何活化,例如在EDC/NHS结合中。任何过量的经由蛋白质保持未结合到生物素化发光芯部的生物素化生物分子可被从发光标记物分离。在一些实施方案中,发光标记物的发光芯部可以由有机发光材料组成,例如非聚合有机发光化合物或发光聚合物。根据这些实施方案的发光标记物的第一生物素基团可以直接结合到发光材料,或通过设置在发光材料和生物素基团之间的结合基团结合。在使用时,发光标记物可以溶解或分散在载液中。发光芯部可以是具有粒状发光芯部的发光颗粒,所述粒状发光芯部包含以下材料或由以下材料组成:有机发光材料或无机发光材料。所述芯部可以包含与发光材料混合或结合的基质材料。在使用时,所述发光颗粒分散在载液中。所述发光颗粒芯部可以包含发光材料的多个副本,与包含单一发光材料的发光标记物相比,这可以导致发光标记物的更高的亮度。根据这些实施方案的发光标记物的第一生物素基团可结合到发光材料或基质材料。第一生物素基团可以直接结合到发光材料或基质材料,或者可以通过设置在发光材料和生物素基团之间的结合基团结合。图1说明了根据本公开一些实施方案的颗粒100。发光颗粒100具有芯部101,所述芯部包含发光材料或者由发光材料组成。优选地,在发光聚合物材料的情况下,所述芯部包含多于一个发光材料分子,例如多于一个发光聚合物链。所述芯部可包含主体材料和发色团,其中所述主体材料被配置为吸收来自能量源(例如光源)的激发能量并将能量传递到发色团,并且其中所述发色团被配置成在从主体材料传递能量时发射光。主体材料和发色团各自独立地为非聚合材料或聚合材料。芯部101可包含基质材料,任选地包含聚合或无机基质材料。示例性的聚合基质材料包括但不限于聚苯乙烯以及(烷基)丙烯酸的均聚物或共聚物。聚合基质材料可以是交联的,例如交联的壳聚糖-聚丙烯酸聚合物。聚合物基质可以是包含脂质或聚合物表面活性剂的自组装胶束或囊泡(vesicle)。聚合物基质优选为无机氧化物。聚合物基质更优选是氧化硅。如果存在基质材料,则在一些实施方案中,发光材料可以直接或间接地共价结合到基质材料。在一些实施方案中,发光材料可以与基质材料混合(即并不共价结合)。发光材料可以均匀地或非均匀地分布在发光材料/基质混合物中。芯部101可包含与基质材料混合并延伸穿过基质材料的一个或多个发光聚合物链。一个或多个发光聚合物链可以突出由基质材料限定的芯部表面。芯部101可包括壳,例如氧化硅壳,所述壳部分地或完全地覆盖内芯,所述内芯包含发光材料或由发光材料组成,优选发光聚合物。优选地,所述颗粒的数均直径不超过5000nm,更优选地不超过2500nm,1000nm,900nm,800nm,700nm,600nm,500nm或400nm,通过使用MalvernZetasizerNanoZS的动态光散射(DLS)测量。优选地,颗粒的数均直径在5-5000nm之间,任选地在10-1000nm之间,优选在10-500nm之间,最优选在10-100nm之间,通过MalvernZetasizerNanoZS测量。在一些实施方案中,发光材料是无机的。任选地,无机发光材料是量子点。在一些实施方案中,发光材料是有机的。在一些实施方案中,有机发光材料是非聚合的。在一些实施方案中,有机发光材料是发光聚合物。第一表面基团103结合到发光颗粒芯部。任选地,一个或多个另外的表面基团也结合到发光颗粒芯部,例如第二表面基团105。在一些实施方案中,第一表面基团103和/或第二表面基团105可以共价结合到发光颗粒芯部的发光材料。优选地,第一表面基团103和/或第二表面基团105共价结合到发光颗粒芯部的基质材料。第一表面基团103包含第一生物素基团107。第二表面基团105不包含生物素。第一生物素基团可通过生物素结合基团结合到所述发光颗粒芯部的表面,所述生物素结合基团在一端处结合到所述芯部并且在另一端处结合到所述生物素。第一生物素基团结合到具有多个生物素结合位点的蛋白质109,优选链霉亲和素、中性亲和素、亲和素或其重组变体或衍生物。优选地,所述蛋白质不是发光的。具有第二生物素基团113的生物素化的生物分子111(例如图1所示的生物素化的IgG抗体)结合到相同的蛋白质。图2示出了根据本公开一些实施方案的形成如本文所述的发光标记物颗粒的过程。包含发光材料或由发光材料组成的发光颗粒芯部可以通过本文所述的任何过程形成。优选地,氧化硅被设置在发光颗粒芯部的表面。反应性基团RG1可被设置在发光颗粒芯部的表面。在RG1和RG2之间的反应条件下,可以使具有反应性基团RG2的第一材料与发光颗粒芯部接触,从而将第一材料结合到发光颗粒芯部。第一材料可包含生物素或者可包含用于在RG1与RG2之间的反应之后结合到生物素的第三反应性基团RG3。除第一材料之外,可以使具有反应性基团RG2的第二材料接触所述发光颗粒芯部,其中第一材料和第二材料的RG2可以相同或不同。第一材料和第二材料可以按任何顺序相继地或同时与颗粒芯部接触。第二材料不包含生物素或不具有能够结合到生物素的基团。可以选择与发光颗粒芯部接触的第一材料和第二材料的比例以便控制发光标记物颗粒的生物素的量,并且因此控制能够结合到发光纳米颗粒的蛋白质和生物素化抗体的数目。优选地,第二表面基团105的数量大于第一表面基团103的数量。任选地,第二表面基团的摩尔数是第一表面基团的摩尔数的至少2倍,优选3倍,更优选至少5倍。最优选地,第一表面基团的数目是第一表面基团和第二表面基团的总摩尔数的小于10摩尔%,任选至多5摩尔%。优选地,第一表面基团的数目是第一表面基团和第二表面基团的总摩尔数的大于0.1摩尔%,任选至少0.5摩尔%。第一表面基团的生物素可以缀合到具有多于一个生物素结合位点的蛋白质,以形成可与生物素化的生物分子缀合的前体颗粒。所述蛋白质可以是天然的,例如天然链霉亲和素。所述蛋白质可以是重组的,例如二价链霉亲和素。生物分子可以是但不限于:抗体;抗原结合片段(Fab);模拟物,例如微抗体、纳米抗体、单抗体(monobody)、双抗体(diabody)或三抗体(triabody)或亲和体(affibody);DARPin;或融合蛋白,例如单链可变片段(scFv);线性或环状肽;膜联蛋白V;RNA或DNA;或适体(aptamer)。可以根据要检测的抗原选择抗体生物分子。宽范围的生物素化抗体是已知的和可商购的,或者可以使用技术人员已知的技术来制备,例如,在例如https://www.abcam.com/ps/pdf/protocols/biotin_conjugation.pdf中公开的,通过引用将其内容并入本文。第二表面基团105可以选自本文任何地方关于第一表面基团描述的基团,区别在于它不包含生物素。第二表面基团105可以如关于第一表面基团所述,其中第一生物素基团(以及蛋白质和生物素化的抗体)被另一基团代替,包括但不限于:H;C1-12烷基;C1-12烷氧基;OH;-N(R5)2,其中每个R5独立地为H或C1-12烃基;COOH;和COOH的酯,例如COOH的C1-20烃基酯。发光标记物颗粒的第一基团和第二基团可以仅在与之结合的蛋白质和生物素基团存在或不存在方面不同,或者可以在一个或多个其它方面不同。任选地,当在25℃的水中与抗原接触时,第二表面基团不结合到第一表面基团的抗体的抗原。第一表面基团和第二表面基团可以是多分散的。第二表面基团可具有至少500、任选地至少2000的Mn。不包括第一生物素基团和第二生物素基团、抗体和蛋白质的第一表面基团可以具有至少500、任选地至少2000的Mn。第一表面基团和第二表面基团可以各自独立地具有多峰重量分布,任选地是双峰重量分布。可以通过混合具有不同平均分子量的多分散材料来实现多峰重量分布。第一表面基团和其它表面基团的形成在一些实施方案中,可以通过式(Ia)的第一材料的反应来形成第一表面基团。RG2-PG-生物素(Ia)其中PG是极性基团,并且RG2反应从而结合到发光颗粒芯部的表面上的基团RG1。可以通过式(Ib)的第一材料的反应形成第一表面基团:RG2-PG-RG3(I)其中PG是极性基团;RG2反应从而结合到发光颗粒芯部的表面上的基团RG1,并且RG3能够结合到生物素。在RG1与RG2之间的反应之后,RG3可结合到生物素。PG可以是直链或支化的极性基团。PG可以包含能够与水形成氢键的杂原子,任选为直链或支化的亚烷基链,其中该亚烷基链的一个或多个C原子被O或NR6替换,其中R6为C1-12烃基,任选为C1-12烷基或C1-4烷基。优选地,PG的分子量小于5000,任选地在130-3500Da的范围内。优选地,PG是聚醚链。本文所用的“聚醚链”是指包含多个醚基的二价链。优选地,PG包含式(II)的基团:-((CR14R15)bO)c-(II)其中R14和R15各自独立地为H或C1-6烷基,并且b为至少1,任选地为1-5,优选为2,并且c为至少2,任选为2-1000,优选为10-500、10-200或10-100,最优选为10-50。最优选地,PG包含聚乙二醇链或由聚乙二醇链组成。RG1和RG2可以选自以下:胺基团,任选为-NR82,其中R8在每次出现时独立地为H或取代基,优选为H或C1-5烷基,更优选为H;羧酸或其衍生物,其在RG1和RG2之间的反应中形成羧酸基团或其盐,例如酸酐、酰氯或酯;-OH;-SH;烯烃;炔烃;和叠氮化物(azide)。RG1和RG2可以反应形成选自以下的基团:酯、酰胺、脲、硫脲、席夫碱、伯胺(C-N)键、马来酰亚胺-硫醇加合物或通过叠氮化物和炔烃的环加成反应形成的三唑。优选地,RG1和RG2之一是羧酸或其衍生物,例如酯,优选NHS酯、酰氯或酸酐基团,并且RG1和Rg2中的另一者是质子基团,例如羟基、硫醇或氨基,优选氨基,其中RG1和Rg2能够反应形成酯或酰胺基团。RG1和RG2之一可以在反应之前被转化为活化形式,例如使用碳化二亚胺(例如EDC)活化羧酸基团。任选地,通过使包含RG1的化合物与颗粒芯部反应从而在发光颗粒芯部的表面处形成反应性基团RG1。任选地,颗粒芯部包含氧化硅,并且包含反应性基团RG1的化合物具有式(II):(R7O)3Si-(Sp1)x-RG1(II)其中R7为H或取代基,优选为C1-10烷基;Sp1是间隔基团;x是0或1;和RG1是第一反应性基团。优选地,通过式(I)化合物的反应形成的硅烷在颗粒芯部的表面处的氧化硅上形成单层。任选地,Sp1选自直链或支化的二价亚烷基链,其中一个或多个不相邻的C原子可以被O、S、C(=O)、C(=O)O、C(=O)NR12或NR12替换,其中R12在每次出现时独立地选自H和C1-12烃基,任选为C1-12烷基。式(II)的示例性化合物是3-氨基丙基三乙氧基硅烷。第二表面基团105可以如关于第一表面基团RG1所描述那样,只是除了存在生物素。颗粒芯部颗粒芯部可以由一种或多种发光材料组成。颗粒芯部可以包含一种或多种发光材料和基质材料或者由它们组成。基质材料包括但不限于无机基质材料,任选地无机氧化物,任选地氧化硅。在一些实施方案中,可以通过在发光材料的存在下使氧化硅单体聚合来形成颗粒芯部,例如WO2018/060722中所述,通过引用将其内容并入本文。在一些实施方案中,颗粒芯部包含内芯,该内芯包含以下或由以下组成:至少一种发光材料和包围内芯的至少一个壳。所述至少一个壳可以是氧化硅。任选地,颗粒芯部总重量的至少0.1重量%由一种或多种发光材料组成。优选地,颗粒芯部总重量的至少1、10、25重量%由一种或多种发光材料组成。任选地,颗粒芯部总重量的至少50重量%由氧化硅组成。优选地,颗粒芯部总重量的至少60、70、80、90、95、98、99、99.5、99.9重量%由氧化硅组成。本文所述的颗粒芯部是其上没有任何表面基团的发光颗粒。在本公开的一个实施方案中,颗粒芯部总重量的至少70重量%由一种或多种发光材料和氧化硅组成。优选地,颗粒芯部总重量的至少80、90、95、98、99、99.5、99.9重量%由一种或多种发光材料和氧化硅组成。更优选地,颗粒芯部基本上由一种或多种发光材料和氧化硅组成。发光材料发光标记物的发光芯部可以包含以下发光材料或由其组成:该发光材料发射荧光、磷光或其组合。该发光材料可以发射具有在350-1000nm范围内的峰值波长的光。如本文所述的蓝色发光材料可以具有峰值不超过500nm、优选在400-500nm、任选400-490nm的光致发光光谱。如本文所述的绿色发光材料可以具有峰值大于500nm至580nm、任选地大于500nm至540nm的光致发光光谱。如本文所述的红色发光材料可以具有峰值大于580nm至950nm、任选地至多630nm、任选地585nm至625nm的光致发光光谱。该发光材料可以具有10-850nm范围内的斯托克斯位移。可以使用Cary5000UV-vis-IR光谱仪在甲醇溶液或悬浮液中测量本文所述的发光标记物的紫外/可见吸收光谱。可以使用JobinYvonHoribaFluoromax-3在甲醇溶液或悬浮液中测量本文所述的发光颗粒的光致发光光谱。发光材料可以是无机发光材料;非聚合有机发光材料;或发光聚合物。示例性的非聚合荧光材料包括但不限于:荧光素及其盐,例如,荧光素异硫氰酸酯(FITC)、荧光素NHS、AlexaFluor488、DyLight488、俄勒冈绿、DAF-FM、6-FAM2,7-二氯荧光素、3'-(对氨基苯基)荧光素和3'-(羟基苯基)荧光素;若丹明,例如若丹明6G和若丹明110氯化物;香豆素类;硼-二吡咯亚甲基类(BODIPY);萘酰亚胺类;二萘嵌苯类;苯并蒽酮类(benzanthrones);苯并蒽酚酮类(benzoxanthrones);和苯并噻蒽酚酮类(benzothiooxanthrones),其中的每一个可以是未取代的或取代有一个或多个取代基。示例性的取代基是氯、烷基氨基、苯基氨基和羟苯基。发光聚合物是优选的。发光聚合物可以是均聚物,或者可以是包含两种或更多种不同重复单元的共聚物。发光聚合物可以包含处在聚合物主链中、侧挂于聚合物主链或作为聚合物主链的端基的发光基团。在磷光聚合物的情形中,磷光金属络合物(优选磷光铱络合物)可被提供在聚合物主链中、侧挂于聚合物主链或作为聚合物主链的端基。发光聚合物可以具有非共轭主链或者可以是共轭聚合物。“共轭聚合物”是指在聚合物主链中包含与相邻重复单元直接共轭的重复单元的聚合物。共轭的发光聚合物包括但不限于包含沿聚合物主链彼此共轭的亚芳基、杂亚芳基和亚乙烯基中的一种或多种的聚合物。发光聚合物可具有直链、支化或交联的主链。发光聚合物可包含处在聚合物主链中的一个或多个重复单元,所述重复单元取代有一个或多个取代基,所述取代基选自非极性取代基和极性取代基。优选地,所述发光聚合物包含至少一个极性取代基。所述一个或多个极性取代基可以是所述重复单元的仅有取代基,或者所述重复单元可以进一步取代有一个或多个非极性取代基,任选为一个或多个C1-40烃基。取代有一个或多个极性取代基的重复单元可以是聚合物的仅有重复单元,或者该聚合物可以包含一种或多种其它共聚重复单元,其中所述或每个共聚重复单元是未取代的或取代有非极性取代基,任选为一个或多个C1-40烃基取代基。本文所述的C1-40烃基取代基包括但不限于C1-20烷基、未取代的苯基和取代有一个或多个C1-20烷基的苯基。如本文所用的“极性取代基”可以指(单独或与一种或多种其他极性取代基组合)使得发光聚合物在醇溶剂中的溶解度为至少0.01mg/ml的取代基,任选地,溶解度在0.01-10mg/ml的范围内。任选地,溶解度为至少0.1mg/mL或1mg/mL。在25℃下测量溶解度。优选地,该醇溶剂是C1-10醇,更优选地是甲醇。极性取代基优选是能够形成氢键或离子基团的取代基。在一些实施方案中,发光聚合物包含式-O(R3O)t-R4的极性取代基,其中R3在每次出现时是C1-10亚烷基,任选C1-5亚烷基,其中该亚烷基的一个或多个不相邻的非末端C原子可以被O替换,R4是H或C1-5烷基,并且t是至少1,任选1-10。优选地,t为至少2。更优选地,t为2至5。在式-O(R3O)t-R4的所有极性基团中的t值可以相同。在相同聚合物的极性基团之间的t值可以不同。本文中关于R3使用的“C1-5亚烷基”是指式-(CH2)f-的基团,其中f为1-5。优选地,发光聚合物包含式-O(CH2CH2O)t-R4的极性取代基,其中t为至少1,任选为1-10,并且R4为C1-5烷基,优选为甲基。优选地,t为至少2。更优选地,t为2至5,最优选q为3。在一些实施方案中,发光聚合物包含式-N(R5)2的极性取代基,其中R5是H或C1-12烃基。优选地,每个R5是C1-12烃基。在一些实施方案中,发光聚合物包含极性取代基,所述极性取代基是离子基团,其可以是阴离子型、阳离子型或两性离子型。优选地,该离子基团是阴离子基团。示例性的阴离子基团是:-COO-;磺酸根基团;氢氧根;硫酸根;磷酸根;次膦酸根;或膦酸根。示例性的阳离子基团是-N(R5)3 ,其中R5在每次出现时是H或C1-12烃基。优选地,每个R5是C1-12烃基。包含阳离子基团或阴离子基团的发光聚合物包含抗衡离子以平衡这些离子基团的电荷。阴离子基团或阳离子基团和抗衡离子可以具有相同的化合价,其中抗衡离子平衡每个阴离子基团或阳离子基团的电荷。阴离子基团或阳离子基团可以是单价的或多价的。优选地,阴离子基团和阳离子基团是单价的。发光聚合物可包含多个阴离子极性取代基或阳离子极性取代基,其中两个或更多个阴离子基团或阳离子基团的电荷被单个抗衡离子平衡。任选地,极性取代基包括含有二价或三价抗衡离子的阴离子基团或阳离子基团。抗衡离子任选为阳离子,任选金属阳离子,任选Li 、Na 、K 、Cs ,优选Cs ,或者有机阳离子,任选铵,如四烷基铵、乙基甲基咪唑鎓或吡啶鎓。抗衡离子任选为阴离子,任选为卤离子;磺酸根基团,任选甲磺酸根或甲苯磺酸根;氢氧根;羧酸根;硫酸根;磷酸根;次膦酸根;膦酸根;或硼酸根。在一些实施方案中,发光聚合物包含选自如下的极性取代基:式-O(R3O)t-R4的基团,式-N(R5)2的基团,式OR4的基团,和/或离子基团。优选地,发光聚合物包含选自如下的极性取代基:式-O(CH2CH2O)tR4的基团,式-N(R5)2的基团,和/或式-COO-的阴离子基团。优选地,极性取代基选自于由如下构成的组:式-O(R3O)t-R4的基团,式-N(R5)2的基团,和/或离子基团。优选地,极性取代基选自于由如下构成的组:式-O(CH2CH2O)tR4的聚乙二醇(PEG)基团,式-N(R5)2的基团,和/或式-COO-的阴离子基团。R3、R4、R5和t如上所述。任选地,发光聚合物的主链是共轭聚合物。任选地,该共轭发光聚合物的主链包含式(III)的重复单元:其中Ar1是亚芳基或杂亚芳基;Sp是间隔基团;m是0或1;R1在每次出现时独立地为极性取代基;如果m为0则n为1,并且如果m为1则n为至少1,任选为1、2、3或4;R2在每次出现时独立地是非极性取代基;p为0或正整数,任选为1、2、3或4;q为至少0或正整数,任选为1、2、3或4;并且其中Sp、R1和R2在每次出现时可以独立地相同或不同。Ar1的两个取代基可以连接形成环。优选地,m为1且n为2-4,更优选为4。优选地,p为0。优选地,q为至少1。式(III)的Ar1任选为C6-20亚芳基或5-20元杂亚芳基。Ar1优选为二苯并噻咯或C6-20亚芳基,任选为亚苯基、芴、苯并芴、菲、萘或蒽,更优选为芴或亚苯基,最优选为芴。式(III)的示例性Ar1基团包括式(IV)-(X)的基团:其中R9在每次出现时独立地为H、R1或R2,优选为H;R10在每次出现时独立地为R1或R2;R6为C1-12烃基,任选地为C1-12烷基或C1-4烷基;c为0、1、2、3或4,优选为1或2;d为0、1或2;X在每次出现时独立地为取代基,优选为选自以下的取代基:支化、直链或环状的C1-20烷基;未取代的或取代有一个或多个取代基的苯基,例如一个或多个C1-12烷基;以及F;和Z1-Z2-Z3是C2(亚乙基)C3亚烷基(亚丙基)链,其中一个或两个不相邻的C原子可以被O、S或NR6替换。Sp-(R1)n可以是支化基团,任选为树枝状基团,取代有极性基团,任选为-NH2或-OH基团,例如聚亚乙基亚胺。优选地,Sp选自以下:-C1-20亚烷基或亚苯基-C1-20亚烷基,其中一个或多个不相邻C原子可以被O、S、N或C=O替换;-C6-20亚芳基或5-20元杂亚芳基,更优选亚苯基,除所述一个或多个取代基R1之外,其可以是未取代的或取代有一个或多个非极性取代基,任选一个或多个C1-20烷基。本文所用的“亚烷基”是指支化或直链的二价烷基链。本文所用的烷基的“非末端C原子”是指除正烷基末端处的甲基或支化烷基链末端处的甲基以外的C原子。更优选地,Sp选自以下:-C1-20亚烷基,其中一个或多个不相邻C原子可以被O、S或CO替换;和-C6-20亚芳基或5-20元杂亚芳基,甚至更优选亚苯基,其可以是未取代的或取代有一个或多个非极性取代基。R1可以是如本文任何地方所述的极性取代基。优选地,R1是:-式-O(CH2CH2O)tR4的聚乙二醇(PEG)基团,其中t为至少1,任选1-10,并且R4为C1-5烷基,优选甲基;-式-N(R5)2的基团,其中R5是H或C1-12烃基;或-式-COO-的阴离子基团。在n为至少2的情形中,每个R1在每次出现时可以独立地相同或不同。优选地,与给定Sp基团连接的每个R1是不同的。在p是正整数(任选1、2、3或4)的情形中,基团R2可以选自:-烷基,任选C1-20烷基;和-芳基和杂芳基,其可以是未取代的或取代有一个或多个取代基,优选为取代有一个或多个C1-20烷基的苯基;-芳基或杂芳基基团的直链或支化链,每个所述基团可独立地被取代,例如式-(Ar3)s的基团,其中每个Ar3独立地为芳基或杂芳基且s为至少2,优选为苯基的支化链或直链,每个苯基可以是未取代的或取代有一个或多个C1-20烷基;和-可交联基团,例如包含双键的基团如乙烯基或丙烯酸酯基团,或苯并环丁烷基团。优选地,每个R2(当存在时)独立地选自C1-40烃基,并且更优选地选自C1-20烷基;未取代的苯基;取代有一个或多个C1-20烷基的苯基;和苯基的直链或支化链,其中每个苯基可以是未取代的或取代有一个或多个取代基。本文所述的聚合物可包含仅一种形式的式(III)重复单元或由仅一种形式的式(III)重复单元组成,或者可包含两种或更多种不同的式(III)重复单元或由两种或更多种不同的式(III)重复单元组成。任选地,包含一种或多种式(III)重复单元的聚合物是包含一种或多种共聚重复单元的共聚物。如果存在共聚重复单元,则式(III)的重复单元可以形成聚合物重复单元的0.1-99摩尔%,任选50-99摩尔%或80-99摩尔%。优选地,式(I)的重复单元形成聚合物重复单元的至少50摩尔%,更优选至少60、70、80、90、95、98或99摩尔%。最优选地,聚合物的重复单元由一种或多种式(I)的重复单元组成。可以选择聚合物的所述或每种重复单元以产生聚合物的期望发射颜色。聚合物的亚芳基重复单元包括但不限于:芴,优选2,7-连接的芴;亚苯基,优选1,4-连接的亚苯基;萘,蒽,茚并芴,菲和二氢菲重复单元。本文所述的发光聚合物或氧化硅聚合物的通过凝胶渗透色谱法测量的聚苯乙烯当量数均分子量(Mn)可以在约1×103至1×108的范围内,并且优选在1×104至5×106的范围内。本文所述聚合物的聚苯乙烯当量重均分子量(Mw)可以为1×103至1×108,且优选为1×104至1×107。如本文所述的聚合物适宜地是无定形聚合物。胶体可以以胶体悬浮液的形式提供所述颗粒,所述胶体悬浮液包含悬浮在液体中的颗粒。优选地,所述液体选自水、C1-10醇及其混合物。优选地,颗粒在所述液体中形成均匀的(非聚集的)胶体。所述液体可以是包含溶解在其中的盐的溶液,任选为缓冲溶液。该缓冲溶液可具有在1-14、优选5-8的范围内的pH值。该缓冲溶液可包含但不限于:磷酸盐,例如磷酸钠,三(羟甲基)氨基甲烷(tris),乙酸盐,例如乙酸钠,硼酸盐,和/或2-(N-吗啉)乙磺酸(MES)。缓冲溶液中的盐浓度可以在约1mmol/L至200mmol/L的范围内。胶体悬浮液中的颗粒浓度优选在0.1-20mg/mL的范围内,任选在5-20mg/mL的范围内。在一些实施方案中,可以以胶体悬浮液的形式存储颗粒,任选地,胶体悬浮液的颗粒浓度大于0.1mg/mL,优选至少0.5mg/mL或1mg/mL。在一些实施方案中,可以按冻干或冷冻的形式存储颗粒。应用本公开的颗粒可以是荧光的或磷光的。优选地,该颗粒是荧光的。优选地,所述颗粒用作荧光探针,例如检测生物分子或标记生物分子的荧光探针。在一些实施方案中,所述颗粒可以用作荧光探针,例如在免疫测定法如横向流动或固态免疫测定法中的荧光探针。任选地,所述颗粒用于荧光显微术、流式细胞术、下一代测序、体内成像或其中使配置成与靶标分析物结合的发光标记物与待分析的样品接触的任何其它应用。这些应用可以是医疗、兽医、农业或环境应用,无论是涉及患者(当适用时)还是用于研究目的。优选地,靶标分析物的存在和/或浓度包括测量被结合到靶标分析物的样品中分散或溶解的任何发光标记物(与结合到靶标分析物并固定在表面上的发光标记物相反)。优选地,靶标分析物的存在和/或浓度包括检测直接从发光标记物发射的光。在一些实施方案中,可以使待分析样品与颗粒接触,例如胶体悬浮液中的颗粒。在一些实施方案中,通过流式细胞术分析与颗粒接触后的样品。在流式细胞术中,用至少一种波长的光、任选地两种或更多种不同波长的光(例如包括355、405、488、562和640nm中至少一种的一种或多种波长)照射颗粒。颗粒发射的光可被一个或多个检测器收集。所述检测器可以选自但不限于:光电倍增管和光电二极管。为了提供用于计算染色指数的背景信号,可以对与细胞混合的颗粒进行测量,所述细胞不结合到所述颗粒。在一些实施方案中,例如板测定,可以使样品中的任何靶标抗原固定在与颗粒接触的表面上。实施例1—链霉亲和素官能化的前体纳米颗粒形成具有反应性胺基的发光纳米颗粒核的形成通过斯德博工艺形成具有氧化硅和发光聚合物的芯部的纳米颗粒,并使该纳米颗粒核与(3-氨基丙基)三乙氧基硅烷反应,如WO2018/060722的实施例中所述(通过引用将其内容并入本文),从而产生具有80nm的通过动态光散射测定的数均直径以及核表面上的胺反应性基团的纳米颗粒。表面基团附着至氨基修饰的发光纳米颗粒将上述实施例中形成的氨基改性的纳米颗粒核在甲醇中的1mL悬浮液以14000rpm离心2分钟,从而通过倾析上清液分离纳米颗粒。将9.9毫克α,ω-双{2-[(3-羧基-1-氧丙基)氨基]乙基}聚乙二醇(SAA-PEG-SAA,如下所示,MW=2000g/mol)、0.1mg生物素-PEG-COOH(MW=2000g/mol)、N-(3-氨基丙基)-N-乙基碳化二亚胺(2.1mg)和N-羟基琥珀酰亚胺(2.5mg)在甲醇中的1mL溶液用于通过温柔的超声处理使5mg纳米颗粒球团重新分散,并将所得悬浮液在室温下搅拌1小时。将悬浮液以14000rpm离心2分钟以便使所得氧化硅-LEP纳米颗粒从含有过量的未反应聚乙二醇化试剂的上清液分离。通过倾析除去上清液,并使用温柔的超声处理将分离的纳米颗粒球团重新分散在1mL的新鲜甲醇中。将由离心、倾析和重新分散于甲醇(1mL)中组成的洗涤循环重复另外两次。通过温柔的超声处理,将分离的聚乙二醇化纳米颗粒球团之一重新悬浮于1mL磷酸盐缓冲盐水(pH7.4,含有1重量%的牛血清白蛋白)中,然后立即添加50μL链霉亲和素在相同缓冲液中的溶液(1mg/mL)。将悬浮液在室温下搅拌1小时,然后将样品以14000rpm离心3分钟,以便将蛋白质缀合的纳米颗粒与上清液和未缀合的蛋白质分离。通过温柔的超声处理将球团重新悬浮于具有1%BSA的100μL磷酸盐缓冲盐水中以便存储。实施例2—与生物素化抗体缀合向实施例1中所述的1mg链霉亲和素官能化的纳米颗粒,添加250μL的0.5mg/mL生物素化山羊抗小鼠抗体(克隆Poly4053,购自Biolegend),然后将混合物在室温下搅动1小时。重复该步骤四次。在最后一步时,将球团重新悬浮于500μL的BSA/PBS中从而产生2mg/mL的最终颗粒浓度。比较例1—EDC/NHS缀合的颗粒出于比较的目的,使具有携带NHS酯而非生物素的表面基团的纳米颗粒缀合至抗体。实施例1中所述的具有反应性胺基团的发光纳米颗粒核,即在实施例1中所述的表面基团的附接之前,与琥珀酸酐反应以在颗粒芯部表面上形成羧基,并通过使用EDC和磺基-NHS活化该羧基来官能化,从而产生反应性NHS酯。1.使实施例1中所述的具有反应性胺基团的发光纳米颗粒核与琥珀酸酐反应,以便在颗粒芯部表面处形成羧基,并且将2.5mg的纳米颗粒作为在甲醇中的悬浮液等分加入到微离心管中。以14000rpm将悬浮液离心4分钟;将溶剂滗析,并且用超声处理使球团重新悬浮在500μL的MES缓冲液中。2.向纳米颗粒中添加在MES缓冲液中的60μL的200mMN-羟基磺基琥珀酰亚胺[磺基-NHS]。3.向纳米颗粒中添加6μL的在MES缓冲液中的200mMN-(3-二甲基氨基丙基)-N'-乙基碳二亚胺的盐酸盐[EDC],并将悬浮液在室温下搅动30分钟。4.通过离心(14000rpm,4分钟)将纳米颗粒球团化,滗析出上清液,并且用超声处理将球团重新悬浮在500μLMES中。5.重复步骤4另外3次;在最后的步骤时,用超声处理将球团重新悬浮在200μLMES中。6.在搅动纳米颗粒的同时,使用zeba柱将300μL的0.5mg/mL山羊抗小鼠抗体(克隆Poly4053,购自Biolegend)脱盐至MES。7.在完成纳米颗粒清洗(步骤5)之后立即,将脱盐的抗体加入纳米颗粒中,并搅动悬浮液2小时。8.将124μL的1.0M甘氨酸溶液加入纳米颗粒中,以猝灭纳米颗粒表面上的任何剩余的NHS-活化官能团。将悬浮液搅动30分钟。9.通过离心(14000rpm,4分钟)使纳米颗粒球团化,滗析出上清液,并且用超声处理将球团重新悬浮在500μLBSA/MES中。10.在室温下搅动悬浮液1小时,然后转移到冰箱过夜,其后将步骤9重复另外2次。比较例2—颗粒的点击化学缀合使用应变炔烃二苯并环辛炔[DBCO]和叠氮基团之间的无金属点击反应的生物缀合,如BilsteinJ.Org.2018,14,11-24和Polym.Chem.2019,10,705-717中所述。使用以DBCO和NHS酯端基为特征的小分子杂双官能连接体制备DBCO官能化的山羊抗小鼠IgG,如图3所示。DBCO连接体的NHS酯与PBS中的蛋白质赖氨酸链反应,并且使用自旋过滤从过量的连接体中纯化所得抗体缀合物。可以通过改变DBCO连接体与IgG的摩尔当量数来改变每个IgG的DBCO连接体数目。通过紫外-可见光谱(UV-vis)测量纯化缀合物中的DBCO连接体数目:DBCO具有在309nm处的λmax(ε=12,000M-1cm-1),并且IgG具有在280nm处的λmax(ε=204,000M-1cm-1)。DBCO标记的抗体缀合物相对于天然未缀合抗体的活性根据每个抗体的DBCO连接体的数目进行测定。以这种方式,每个IgG的连接体数目在6-24之间变化,最佳为<10个连接体/IgG。根据以下程序,使用DBCO连接体将抗体连接到发光标记物纳米颗粒。1.将二苄基环辛炔-PEG4-NHS酯(购自JenaBioscience的DBCO-PEG4-NHS,产品代码CLK-A134)在无水DMSO中的6.5μL新制备的10mM溶液添加到195μL的山羊抗小鼠IgG(由制造商提供的1mg/mL溶液)中,并在室温下搅动混合物30分钟。2.添加10.1μL的1MTris盐酸盐缓冲液(pH值为8)以猝灭任何未反应的DBCO-PEG4-NHS连接体,并且将溶液搅动5分钟。3.使用zeba柱将混合物脱盐至PBS。4.使用紫外-可见光谱来量化每个抗体的DBCO连接体的数目,并将其储存在4℃,直到与叠氮官能化的纳米颗粒缀合(步骤5-8)。5.如实施例1中所述形成纳米颗粒,不同之处在于使用下述的叠氮-PEG-COOH(Mw为2000g/mol)代替生物素-PEG-COOH。将1mg的作为甲醇悬浮液的1%叠氮-官能化的80nm纳米颗粒等分加入微离心管中。将悬浮液以14000rpm离心4分钟;将溶剂滗析,并且利用超声处理将球团重新悬浮在1mL的BSA/PBS中。6.添加136μL上述DBCO官能化抗体,并在室温下搅动该混合物4小时。7.通过离心(14000rpm,4分钟)使纳米颗粒球团化,滗析上清液,并且利用超声处理将球团重新悬浮在1mLBSA/PBS中。8.将步骤3重复另外3次;在最后步骤时,利用超声处理将球团重新悬浮在100μL的BSA/PBS中。板测定在暗室设施中的OlympusBX60直立显微镜上对测定板进行成像,使用紫外通道和10倍放大率镜头。设定积分时间(以ms为单位)以便在没有检测器饱和的情况下使2mg/mL( )阱的发射最大化,并且这用于给定板的所有后续测量。还在测量长度处进行背景测量,并从每个测量的阱发射中减去该背景测量。由每个阱的纳米颗粒中的发光聚合物引起的光发射强度是400-600nm之间的发射的积分。如下计算信噪比:对于给定浓度的( )阱发射强度的背景校正平均值,除以相同浓度的(-)阱发射强度的背景校正平均值。使用实施例2纳米颗粒的测定:相对于浓度为0.5、1和2mg/mL纳米颗粒的( )小鼠抗人类CD4和(-)BSA测定实施例2的纳米颗粒。参考附图4,测定结果示出随纳米颗粒浓度增加的正信号,在阴性阱上具有最小背景,从而导致大的信噪比(在括号中示出)。对于各浓度的荧光标准偏差较低。使用比较例1纳米颗粒的测定:对于比较例1的EDC/NHS缀合纳米颗粒,筛选各种缀合反应参数以使测定信噪比最大化:·缓冲剂pH值和离子强度;·反应中的抗体浓度;·使用Trizma(2-氨基-2-(羟甲基)-1,3-丙二醇)代替甘氨酸以便在IgG反应之后猝灭过量的表面NHS-酯。图5中示出了这些条件中的最佳条件的测定结果。比较例1的EDC/NHS缀合颗粒的最大正信号(6.2×106)与相同浓度下的实施例1的链霉亲和素-生物素颗粒的最大正信号(3.6×106)相当。然而,比较例1颗粒的阴性阱中的背景比链霉亲和素-生物素的示例颗粒高一个数量级(1.2×106对1.9×105)。另外,看到荧光强度的标准偏差增加,这暗示颗粒在阱表面上的不均匀分布,表明颗粒在测定条件下聚集。使用比较例2纳米颗粒的测定:图6中示出了比较例2的DBCO-N3缀合的IgG-纳米颗粒的测定结果。该结果显著不同于实施例1的链霉亲和素-生物素缀合颗粒的结果:在0.5mg/mL和1mg/mL的浓度下,阳性阱信号和阴性阱信号之间的差异是可忽略的,并且所得信噪比是<2。虽然在2mg/mL下观察到阳性信号的大跳跃,但是光致发光强度比相同浓度下的实施例1的链霉亲和素-生物素缀合颗粒低一个数量级(DBCO-N3的2.2×105相对链霉亲和素-生物素的3.6×106)。在2mg/mL对于阴性阱还可看到光致发光强度的上升;因此,在该浓度下的信噪比也是差的,为3.1。流式细胞术测定在PropelLabsYETI分析仪上进行流式细胞术分析。BV421-抗人类CD4(克隆SK3)[BV421-hCD4]和BV421-小鼠IgG1,κ同种型(克隆MOPC-21)[BV421-同种型]购自Biolegend。CYTO-TROL细胞由BeckmanCoulter提供。1.使用前将CYTO-TROL细胞升至室温,并重新悬浮于制造商提供的缓冲液中。2.在微量离心管中的BSA/PBS中将抗体标签稀释至所需浓度。3.将100μL的制备Cyto-Trol添加到每种抗体-NP稀释液中。将制剂充分混合,并在4℃下培养30分钟,避免直射光。4.在培养之后,用细胞染色缓冲液将细胞清洗两次,在4℃以2000rpm离心3分钟,并将上清液丢弃。5.将细胞重新悬浮于200μL细胞染色缓冲液中以备分析。6.为了分析,使用0.5μL/秒的流速。对单个细胞进行数据选通,对于每次测量在该选通中获取10000个事件。筛选一系列不同的示例性纳米颗粒NP(x)-hCD4(其中NP是如实施例1中所述的纳米颗粒;对于链霉亲和素x=s;对于中性亲和素x=n;hCD4=抗人类CD4抗体)稀释液以确定每种染料的最大染色指数的最佳工作浓度。使用中性亲和素的抗体缀合如上文关于链霉亲和素所述,不同之处在于,使用50μL的中性亲和素在PBS中的1mg/mL溶液代替链霉亲和素。染色指数[SI]为:SI=(MFI1-MFI2)/(2×SD)其中MFI1是阳性群体的中值荧光强度;MFI2是阴性群体的中值荧光强度,并且SD是阴性信号的标准偏差。对比较标记物BV421-hCD4进行相同的操作,其中BV421是可从BioLegend获得的溶解的荧光聚合物BrilliantViolet421TM。调节电压以确保阴性信号和阳性信号均在刻度上。对于NP(n)-hCD4,不可能找到阴性信号和阳性信号完全在刻度上的电压,因此使用阴性信号完全在刻度上的电压进行分析。表1每个标签的最佳浓度经确定为:·BV421-hCD4:250μg/mL·NP(s)-hCD4:31.3μg/mL·NP(n)-hCD4:15.6μg/mL对于每个通道的BV421-hCD4、NP(s)-hCD4和NP(n)-hCD4的最佳电压相同,总结于表2中:表2按上文所述,对表3中的以下标签中的每一种以它们的最佳浓度和优化电压按一式三份进行测量:表3标签类型标签对照物BV421BV421-hCD4BV421—同种型NP(s)NP(s)-hCD4NP(s)—同种型NP(n)NP(n)-hCD4NP(n)—同种型对实施例1的生物素化的纳米颗粒(即没有链霉亲和素或中性亲和素)和未染色的细胞进行相同的操作。将未缀合到链霉亲和素或中性亲和素的这些颗粒等分加入到微量离心管中。将悬浮液以14000rpm离心4分钟;将溶剂倾析,并且使用超声处理将球团重新悬浮于100μL的BSA/PBS中,从而得到10mg/mL的最终颗粒浓度。结果:NP(s)-hCD4在图7和表4中将使用NP(s)-hCD4的Cyto-Trol细胞的染色与使用BV421-hCD4时进行对比。与BV421-hCD4相似,NP(s)-hCD4对阴性细胞的染色可忽略不计。然而,NP(s)-hCD4的阳性信号明显移向更高的消光系数,而相对于BV421-hCD4的阳性信号的标准偏差仅略有增加。MFI1的这种增加导致NP(s)-hCD4相对于BV421的染色指数增加约2.5倍。表4在图8和表5中进一步证明了源于NP(s)的颗粒的低阴性染色。未官能化的NP(s)-同种型或NP(s)-hCD4均未显示任何显著的阴性染色,这表明如本文所述的荧光纳米颗粒以及它们的链霉亲和素缀合的衍生物和抗体缀合的衍生物对细胞具有低的非特异性吸收。表5结果:NP(n)-hCD4对于NP(s)-hCD4,在图9和表6中将用NP(n)-hCD4对Cyto-Trol细胞的染色与BV421-hCD4进行了比较。正如NP(s)-hCD4,NP(n)-hCD4显示出可忽略不计的阴性染色。NP(n)-hCD4的较明亮的阳性信号给出了相对于BV421-hCD4为5.4倍的染色指数。表6在图10和表7中进一步证明了源于NP(n)颗粒的低阴性染色。未官能化的NP(n)-同种型或NP(n)-hCD4均未显示任何明显的阴性染色,这表明荧光NP以及它们的中性亲和素缀合的衍射物和抗体缀合的衍生物对细胞具有低的非特异性吸收。表7第一生物素基团密度的影响使用实施例1和2中所述的纳米颗粒研究了第一生物素基团密度(以及因此前体纳米颗粒表面上的蛋白质结合位点的数目)的影响,区别在于生物素-PEG-COOH占生物素-PEG-COOH SAA-PEG-SAA总重量的百分比变为0.5重量%、1重量%、5重量%和10重量%。表8中显示了用于第一表面基团和第二表面基团的不同重量百分比的试剂的体积:表8使用Biolegend提供的生物素小鼠抗人类CD4抗体(克隆SK3)形成与抗人类CD4[NP(x)-hCD4]缀合的纳米颗粒。同种型对照颗粒[NP(x)-同种型]使用Biolegend提供的生物素小鼠IgG1,κ同种型(克隆MOPC-21)。筛选了一系列不同的NP(s)-x%hCD4(其中x=0.5、1、5或10,代表用于使NP官能化的PEG-生物素的百分比)和BV421-hCD4稀释液,以确定每种染料的最大染色指数的最佳工作浓度。调节电压以确保阴性信号和阳性信号均在刻度上。表9每个标签的最佳浓度经确定为:·BV421-hCD4:250μg/mL·NP(s)-0.5%hCD4:62.5μg/mL·NP(s)-1%hCD4:250μg/mL·NP(s)-5%hCD4:125μg/mL·NP(s)-10%hCD4:62.5μg/mL对于每个通道的BV421-hCD4和NP(s)-x%hCD4的最佳电压相同,汇总在表10中:表10发射通道(激光线)电压/VFSC370SSC478420/10(405)470460/22(405)421525/50(405)380615/24(405)471525/35(488)460593/52(488)424692/80(488)520750LP(488)630以上述最佳浓度和优化电压对表11的标签按一式三份进行测量:表11标签类型标签对照物BV421BV421-hCD4BV421-同种型NP(s)-0.5%NP(s)-0.5%hCD4NP(s)-0.5%同种型NP(s)-1%NP(s)-1%hCD4NP(s)-1%同种型NP(s)-5%NP(s)-5%hCD4NP(s)-5%同种型NP(s)-10%NP(s)-10%hCD4NP(s)-10%同种型还测量了未染色的细胞。图11和表12中示出了改变表面生物素基团的百分比对Cyto-Trol细胞染色的影响。对于所有的生物素浓度,阴性群体显示出可忽略不计的背景染色,相对于未染色细胞而言;除了1%生物素,这归因于与其他标签相比非常高的最佳染色浓度(250μg/mL)。从上述的链霉亲和素/中性亲和素比较实验中使用的NP(s)-1%hCD4可以看出这种高染色浓度的影响,该实验显示,在31.3μg/mL的低得多的最佳染色浓度下,阴性群体的染色可忽略不计。因此,可以得出结论,表面生物素浓度在0.5-10%之间变化不会增加所得标签与Cyto-Trol细胞的非特异性结合。表12这些数据证明,更多的表面生物素导致所得抗体缀合物的更高的染色指数,其中10wt%的生物素标签显示出比0.5wt%的生物素标签高1.9倍的染色指数。即使在0.5wt%生物素下,染色指数也超过了BV421-hCD4。使用链霉亲和素修饰的纳米颗粒的比较性间接染色流式细胞术实验如实施例1和2中所述形成用链霉亲和素官能化的前体发光纳米颗粒,即链霉亲和素不缀合到生物素化的抗体。在缀合到链霉亲和素之后,通过如下方式去除过量的链霉亲和素:以14000rpm离心3.5分钟并使用移液管仔细地除去上清液。为了储存,通过在含有1wt%BSA的磷酸盐缓冲盐水(pH7.4)中超声处理来重新悬浮球团化的NP-链霉亲和素前体纳米颗粒,从而得到10mg/mL的最终纳米颗粒浓度。通过以表13中所示的抗体浓度将100μL由BeckmanCoulter供应的CYTO-TROL细胞在4℃下培养30分钟来确定从Biolegend购买的生物素小鼠抗人类CD4(克隆SK3)的最佳着色浓度。此后,用细胞染色缓冲液清洗细胞两次,在4℃下以2000rpm离心3分钟,并丢弃上清液。在重新悬浮在100μL的细胞染色缓冲液中之后,使用500μg/mL的NP-链霉亲和素将细胞在4℃下培养30分钟,并如上所述清洗。在此之后,将细胞重新悬浮在200μL细胞染色试剂中用以分析。为了分析,使用0.5μL/秒的流速。对单个细胞进行数据选通(gate),并且对于每次测量在该选通中获取10000个事件。选择0.075μg/mL的生物素化抗体作为最佳抗体浓度,因为这为样品中的非CD4细胞产生最低的背景染色以及相对较高的染色指数(参见表13)。表13重复以上程序,但使用0.075μg/mL的固定的生物素化抗体浓度以及变化的NP-链霉亲和素浓度(如表14所示)。还使用表14中所示浓度的溶解的荧光聚合物BV421链霉亲和素进行并排比较实验。当获取所有流式细胞术实验的数据时,使用424V的PMT电压。对单个细胞进行数据选通,并且对于每次测量在该选通中获取10000个事件。表14中列出的数据表明,尽管在所有测量浓度下NP-链霉亲和素颗粒具有比BV421更高的[MFI1-MFI2]值,但是它们显著更高的背景结果限制了它们的染色指数。表14当前第1页12
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。