1.本发明属于生物催化治疗领域,具体涉及一种原子分散的钒掺杂二氧化钛及其制备方法和用途。
背景技术:
2.声动力治疗(sdt)是利用超声波(us)作为激发源触发声敏剂产生致命活性氧(ros),有效杀死肿瘤细胞和病原体的治疗方法。自上世纪90年代报道其用于抗肿瘤治疗以来,由于其深穿透性和无创性的特点,目前被认为是最有前途的治疗方法。然而,sdt目前仍处于起步阶段,由于缺乏理想的声敏剂阻碍了其实现临床转化。
3.声敏剂可分为有机声敏剂(例如卟啉及其衍生物、酞菁及其衍生物、玫瑰红等)和无机声敏剂(例如tio2、sio2、黑磷等)以及有机无机混合型声敏剂。然而,目前的有机声敏剂存在生物利用度低、靶向性不佳、疏水性强等问题,在一定程度上限制了其临床应用。与有机声敏剂相比,无机声敏剂由于具有优越的物理化学性质和较高的稳定性而受到了广泛的关注。在无机声敏剂中,tio2是目前公认并得到广泛应用的一种声敏剂,它能在超声波照射下产生包括超氧阴离子、单线态氧、羟基自由基等ros,从而达到治疗的目的。但是,由于电子(e-)和空穴(h
)快速结合(50
±
30ns),纯tio2在us辐照下产生ros的量很小。为了克服这一缺点,研究人员在tio2中加入活性金属(au、pt、fe、v等),使电子从tio2的高费米能级流向活性金属的低费米能级,形成微电流。这样可以限制电子(e-)和空穴(h
)的快速结合,提高ros生成量。
4.申请号为cn200810041664.7的中国专利申请公开了一种钒掺杂纳米二氧化钛催化剂的制备方法,该方法包括如下步骤:第一步,将钛的先驱物溶于无水乙醇中,添加冰醋酸抑制其水解,均匀搅拌成a液;第二步,以0.1%-1%的v/ti质量比称取钒酸盐,置于去离子水或硝酸或氨水中使其完全溶解,均匀搅拌组成b液;第三步,b液经恒压漏斗缓慢滴入剧烈搅拌的a液中搅拌形成溶胶;再将所得溶胶转入高压反应釜,并于烘箱中放置发生水热反应;第四步,将所得溶液干燥、研磨,得到粉体产物。该方法通过钒掺杂,可将纳米二氧化钛的禁带宽度降低到可见光范围的程度,提高产物的光催化活性。但是,该方法无法使钒以原子形式均匀分散在纳米二氧化钛中,所得钒掺杂纳米二氧化钛的活性有待进一步提高。
5.开发出一种原子分散的钒掺杂二氧化钛,对于提高其催化活性和抗肿瘤效果具有重要意义。
技术实现要素:
6.本发明的目的在于提供一种原子分散的钒掺杂二氧化钛及其制备方法和用途。
7.本发明提供了一种原子分散的钒掺杂二氧化钛,它是将金属有机框架材料v@ti-mof热处理后得到的,所述金属有机框架材料v@ti-mof是以钛酸酯类化合物、钒源和配位化合物为原料进行反应制得的。
8.进一步地,所述钛酸酯类化合物为钛酸四异丙酯,所述钒源为乙酰丙酮钒,所述配
位化合物为2-氨基对苯二甲酸。
9.进一步地,所述钛酸四异丙酯和乙酰丙酮钒的摩尔比为(2~10):1;
10.和/或,所述钛酸四异丙酯和2-氨基对苯二甲酸的摩尔比为(400~600):1;
11.和/或,所述热处理温度为200℃~800℃,热处理时间为1~3小时。
12.进一步地,所述钛酸四异丙酯和乙酰丙酮钒的摩尔比为(2~5):1,优选为2:1;
13.和/或,所述钛酸四异丙酯和2-氨基对苯二甲酸的摩尔比为500:1;
14.和/或,所述热处理温度为400℃,热处理时间为2小时。
15.进一步地,所述反应的溶剂为有机溶剂,温度为130~170℃,时间为12~36小时。
16.进一步地,所述有机溶剂为n,n-二甲基甲酰胺和甲醇的混合溶剂,温度为150℃,时间为24小时。
17.本发明还提供了一种制备上述原子分散的钒掺杂二氧化钛的方法,所述方法包括以下步骤:
18.(1)将钛酸酯类化合物、钒源和配位化合物在溶剂中反应,得到金属有机框架材料v@ti-mof;
19.(2)将金属有机框架材料v@ti-mof热处理,即得。
20.本发明还提供了一种药物组合物,它是以上述原子分散的钒掺杂二氧化钛为活性成分,加上药学上可接受的辅料制得的制剂。
21.本发明还提供了上述原子分散的钒掺杂二氧化钛在制备仿酶制剂中的用途。
22.进一步地,所述仿酶制剂为仿氧化酶制剂、仿过氧化物酶制剂或仿卤素过氧化物酶制剂。
23.本发明还提供了上述原子分散的钒掺杂二氧化钛在制备声敏剂中的用途。
24.本发明还提供了上述原子分散的钒掺杂二氧化钛在制备抗肿瘤药物中的用途。
25.本发明还提供了上述原子分散的钒掺杂二氧化钛在制备抗菌剂中的用途。
26.本发明通过简单的水热合成以及高温退火的方法,得到了原子分散的钒掺杂二氧化钛(v-tio2)。该原子分散的钒掺杂二氧化钛中分布均匀的单原子结构一方面促进了超声波辐射作用下tio2能带结构中电子(e-)和空穴(h
)的分离,增强了sdt的作用。另一方面,该原子分散的钒掺杂二氧化钛可在体内利用cl-氧化h2o2产生hclo,提高抗肿瘤和抗菌作用。
27.与商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5相比,本发明制得的原子分散的钒掺杂二氧化钛具有更优的仿氧化酶(oxd)活性、仿过氧化物酶(pod)活性和仿卤素过氧化物酶(hpo)活性,能够用来制备高催化活性的仿酶制剂。特别地,在制备本发明的原子分散的钒掺杂二氧化钛时,当控制原料中ti与v的摩尔比为2:1,高温处理温度为400℃时所得产品的催化性能最佳。
28.本发明制得的原子分散的钒掺杂二氧化钛不仅可以作为化疗药物,还能够作为声敏剂在超声辐照下被激活,提高1o2的产生。与商业二氧化钛(tio2(c))相比,本发明制得原子分散的钒掺杂二氧化钛具有更优的抗菌和抗肿瘤效果。
29.本发明原子分散的钒掺杂二氧化钛的制备方法简单,原料易得,成本较低,适合工业化生产。
30.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
31.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
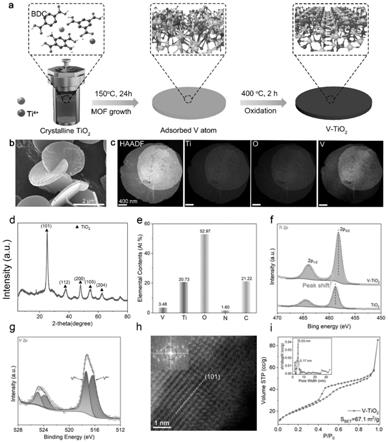
32.图1.实施例1原子分散的钒掺杂二氧化钛的制备示意图与结果表征。a:v-tio2的制备过程示意图;b:sem图片;c:mapping显示元素均匀分布;d:xrd显示以tio2的峰型为主;e:xps测得v-tio2的各元素比;f:xps显示v-tio2中ti的峰稍有偏移;g:v的分峰;h:球差电镜显示v为单原子掺杂;i:bet测得v-tio2的表面积和介孔结构。
33.图2.催化性能测试结果。a:紫外检测各组对tmb的催化作用;b:epr检测
·o2-;c:he检测
·o2-;d:epr检测在超声照射下产生1o2;e:sosg检测在超声照射下产生1o2;f:cb检测hpo酶活性。
34.图3.体内外抗菌性能测试结果。a:不同时期伤口的变化;b:tem分别检测tio2 us,v-tio2 us组细菌形貌变化;c:cd31和masson染色。
35.图4.体内外抗肿瘤测试结果。a:流式细胞计数显示各组细胞凋亡率;b:体内验证示意图;c:超声照射后各组的肿瘤体积大小以及超声图像;d:超声照射各组组织cd31,tunel,ki-67染色情况。
36.图5.sem图像:a)实施例2的原子分散的钒掺杂二氧化钛,b)实施例1的原子分散的钒掺杂二氧化钛,c)实施例3的原子分散的钒掺杂二氧化钛。
37.图6.ph=4.0时,实施例1~3不同比例v-ti样品的pod酶活性。
38.图7.ph=5.8时cb检测实施例1~3不同比例v-ti样品的hpo酶活性。
39.图8.实施例1、4~6在不同温度条件处理后样品在ph=4时pod酶活性。
40.图9.cb检测实施例1、4~6在不同温度条件处理后样品在ph=5.8时hpo酶活性。
41.图10.v-tio2在不同ph值条件下pod酶活性比较。
42.图11.取双倒数得到v-tio2(a),v2o5(b),tio2(c)(c),tio2(s)(d)在以h2o2为反应底物时的vmax和km值。
43.图12.取双倒数得到v-tio2(a),v2o5(b),tio2(c)(c),tio2(s)(d)在以tmb为反应底物的vmax和km值。
44.图13.ph=4时,检测各样品的oxd酶活性。
45.图14.v-tio2分别在通氧气,空气和氩气中的oxd酶活性。
46.图15.esr检测在没有超声照射时v-tio2,tio2(c),tio2(s)and v2o5产生单线态氧。
47.图16.sosg检测超声照射v-tio2单线态氧的产生。
48.图17.dpa检测超声照射下单线态氧的产生。
49.图18.cb检测不同ph值条件下次氯酸的产生。
50.图19.apf检测次氯酸的产生。
51.图20.传统平板计数的方法验证抗菌性能。
52.图21.活死荧光染色验证抗菌性能。
53.图22.活死荧光染色细菌存活率统计。
54.图23.通过流式细胞计数验证抗菌效果。
55.图24.sem观察各组细菌形貌变化。
56.图25.伤口及其周围组织切片he染色。
57.图26.calcein-am/pi荧光染色b16f10验证抗肿瘤效果。
58.图27.dcfh-da荧光染色b16f10细胞验证肿瘤细胞内ros水平
59.图28.apf染色b16f10细胞验证细胞内产生clo-水平
60.图29.不同条件处理后的b16f10细胞骨架,标尺50μm。
61.图30.治疗过程中各组小鼠体重的变化。
62.图31.治疗过程中各组小鼠肿瘤体积的变化统计分析。
63.图32.各组小鼠肿瘤组织he、cd31、tunel、ki-67染色。
64.图33.v-tio2对绵羊红细胞的溶血实验。
65.图34.活死细胞染色验证对脐静脉内皮细胞(huvecs)的毒性,标尺20μm。
具体实施方式
66.本发明所用原料与设备均为已知产品,通过购买市售产品所得。
67.实施例1制备原子分散的钒掺杂二氧化钛
68.按照图1a所示示意图制备原子分散的钒掺杂二氧化钛,具体操作如下:
69.(1)制备前驱体钒掺杂ti-mof
70.将830ul(2.5mmol)钛酸四异丙酯(c
12h28
o4ti)和1.014g(0.005mmol)2-氨基对苯二甲酸加入20ml n,n-二甲基甲酰胺和20ml甲醇的混合溶液中搅拌,再加入0.195g(0.5mmol)乙酰丙酮钒(c
15h21
o6v)超声处理30分钟(超声功率:10w)后,于150℃进行水热反应,水热反应24小时后过滤,水洗,收集固体,得到前驱体v掺杂ti-mof,简称v@ti-mof。
71.(2)制备原子分散的钒掺杂二氧化钛
72.将v@ti-mof置于瓷舟中,在400℃的空气中高温处理2h,然后自然冷却至室温,得到原子分散的钒掺杂二氧化钛,简称v-tio2。(图1a)。
73.实施例2制备原子分散的钒掺杂二氧化钛
74.参照实施例1的制备方法制得前驱体和原子分散的钒掺杂二氧化钛,区别仅在于控制乙酰丙酮钒的加入量,将步骤(1)原料中ti与v的摩尔比从5:1修改为10:1。
75.实施例3制备原子分散的钒掺杂二氧化钛
76.参照实施例1的制备方法制得前驱体和原子分散的钒掺杂二氧化钛,区别仅在于控制乙酰丙酮钒的加入量,将步骤(1)原料中ti与v的摩尔比从5:1修改为2:1。
77.实施例4制备原子分散的钒掺杂二氧化钛
78.参照实施例1的制备方法制得前驱体和原子分散的钒掺杂二氧化钛,区别仅在于将步骤(2)中的高温处理温度从400℃修改为200℃。
79.实施例5制备原子分散的钒掺杂二氧化钛
80.参照实施例1的制备方法制得前驱体和原子分散的钒掺杂二氧化钛,区别仅在于将步骤(2)中的高温处理温度从400℃修改为600℃。
81.实施例6制备原子分散的钒掺杂二氧化钛
82.参照实施例1的制备方法制得前驱体和原子分散的钒掺杂二氧化钛,区别仅在于将步骤(2)中的高温处理温度从400℃修改为800℃。
83.以下为对照样品的制备方法。
84.对照例1合成对照二氧化钛(tio2(s))
85.将830ul(2.5mmol)钛酸四异丙酯(c
12h28
o4ti)和1.014g(0.005mmol)2-氨基对苯二甲酸加入20ml n,n-二甲基甲酰胺和20ml甲醇的混合溶液中搅拌,超声处理30分钟(超声功率:10w)后,于150℃进行水热反应,水热反应24小时后得到前驱体ti-mof。
86.将前驱体ti-mof置于瓷舟中,在400℃的空气中高温处理2h,然后自然冷却至室温,得到合成二氧化钛(tio2(s))。
87.以下通过实验例证明本发明的有益效果。
88.实验例1本发明原子分散的钒掺杂二氧化钛的结构表征
89.1、实验方法
90.对实施例1制得的v-tio2进行结构表征。
91.2、实验结果
92.如图1b,c所示,sem和tem图像显示v-tio2为盘状形貌。eds图谱显示,元素v在整个域内分布均匀(图1c)。tem-eds映射结果进一步证实了v均匀分布于tio2(图1c)。图1d为v-tio2的x射线衍射(xrd)谱图,证明实施例1制得的v-tio2和tio2的xrd一致,即是tio2,v为单原子掺杂。此外,利用x射线光电子能谱(xps)对v-tio2的化学组成及其存在形式进行检测,由图1e可以看出v和ti的原子质量比大约为1:6,v的加入使ti的价态峰略有偏移(图1f),而在v-tio2中,v表现为 5价和 4价(图1g)。球差电镜显示为v元素作为单原子分布于tio2(图1h)。此外,根据bet结果,v-tio2拥有67.1m2/g的表面积,同时存在大量的介孔分布。
93.上述表征结果表明,本发明成功制得了原子分散的钒掺杂二氧化钛。
94.实验例2催化性能和声敏性能测试
95.1、测试样品
96.实施例1制得的v-tio2,以商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5作为对照。
97.2、实验方法
98.(1)仿过氧化物(peroxidase-like,pod)酶催化性能测试:
99.pod可以将人工底物3、3’,5、5'-四甲基联苯胺(3、3’,5、5'-tetramethylbenzidine,tmb)氧化成oxtmb,该氧化物在652nm处具有特征紫外线吸收峰。将待测催化剂溶液(2毫克/毫升,20微升)添加到naoac-hoac缓冲液中(100毫摩尔,ph值4.0,含有过氧化氢(0.1毫摩尔,20微升)和tmb(10mg ml-1 24微升)),得到2ml混合物。然后,取一部分混合物用于紫外线在652nm吸光度下的可见光谱测量。除非另有说明,pod活性是在空气饱和缓冲液中进行的。
100.(2)仿氧化(oxidate,oxd)酶催化性能测试
101.将待测催化剂溶液(2毫克/毫升,20微升)添加到naoac-hoac缓冲液中(100毫摩尔,ph值4.0,和tmb(10mg ml-1 24微升)),得到2ml混合物。然后,取一部分混合物用于紫外线在652nm吸光度下的可见光谱测量。除非另有说明,oxd活性是在空气饱和缓冲液中进行的。
102.(3)仿卤素过氧化物酶(hpo)催化性能测试
103.采用天青石蓝(cb)检测hpo活性,cb水溶液的特征吸收光谱在650nm处达到最大。
具体操作为:用ph5.8的pbs缓冲液200ml加入14.552mg cb制得200μm的cb溶液;所要测的催化剂样品配成:4mg/ml双氧水:0.1m1840μl cb 150μl v-tio2(4mg/ml) 10μl h2o2(0.1m);搅拌反应15min后紫外检测cb的吸光度。
104.(4)sosg法对1o2的定量分析:
105.一般情况下,允许单线态氧荧光探针sosg(5μm)和催化剂(20μg/ml)的混合物在不同的激发条件下发光。1o2的产生可以通过不同的辐照时间(1.0mhz,2.5w cm-2)来测量。
106.(5)he法检测超氧阴离子(
·o2-):
107.he(hydroethidine,氢乙二胺)是一个
·o2-特异性探针,能与
·o2-结合,在激发波长470nm,发射波长610nm时可产生荧光乙锭。首先,将1.5毫升100微克/毫升ph值4.0的v-tio
2-缓冲溶液(1.0摩尔每升)和1.5毫升100毫摩尔每升h2o2水溶液中混合,并在37摄氏度条件下反应40分钟。然后加入1.5毫升he-乙醇溶液(1毫克/毫升)。之后,将溶液旋涡并静置40分钟,然后进行荧光测量。
108.(6)epr检测
109.在500μldmso溶液中加入10μl催化体系溶液、10μl dmpo溶液和10μl 0.03%h2o2,通过bruker epr emx plus(bruker beijing science and technology ltd,usa)在9.8ghz(微波功率:1mw)频率下进行epr测量。
110.(7)超声辐照
111.本实验的超声辐照条件为:2w,2min。
112.3、实验结果
113.pod酶催化活性测试结果显示,与商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5相比,本发明实施例1制得的v-tio2在654nm的吸收峰明显更高(图2a)。从图10可以看出,本发明实施例1制得的v-tio2在酸性条件下表现出更高的催化活性。
114.为了量化v-tio2的催化速率,本发明分别验证了tmb和h2o2不同浓度对催化反应速率的影响。在一定tmb或h2o2浓度范围内,随着tmb或h2o2浓度的增加,催化反应速率也随之增加,v-tio2的催化反应速率高于tio2(c)、tio2(s)和v2o5。最大初速度(vmax)和michaelis-menten常数(km)的动力学参数显示无论以h2o2还是tmb作底物,相比tio2(c)、tio2(s)和v2o5,v-tio2的vmax最高,km最低(图11-12)。oxd酶催化活性测试结果显示,与商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5相比,本发明实施例1制得的v-tio2的活性更高;且在o2饱和条件下的oxd催化性能比空气饱和及ar2饱和条件下显著提高(图14)。
115.为了进一步测试催化性能,本发明采用电子自旋共振(esr)光谱法测定了ros的种类。在h2o2存在的情况下,dmpo做捕获剂在v-tio2,v2o5和tio2(s)三种催化反应中都能检测到
·o2-峰,且v-tio2的强度最强(图2b)。荧光酶标仪检测到v-tio2中
·o2-特异性探针he结合
·o2-的荧光强度强于其他对照组(图2c)。另外还可以看出,v-tio2与2,2,6,6-四甲基-4-哌啶酮(temp)(ph=4.0)孵育后可产生典型的1:1:1峰值信号,表明1o2的生成(图15)。
116.当加入次氯酸盐或次溴酸盐时,在650nm处的吸光度下降,同时在520nm处的较弱的吸收峰增加(图2f)。以520nm/650nm的比值作为判断hpo活性的指标。通过监测三种ph条件下(ph=4.0,5.8,7.4)hpo酶的活性来研究v-tio2生成hocl的效果(图18),可以看出,在弱酸性条件下(ph=5.8),hocl的生成速度更快。氨基苯基荧光素(apf)是另一种检测hpo酶活性的荧光测定试剂盒,apf可以选择性地检测次氯酸盐离子,以区别于其他羟基自由基。
如图19所示,与商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5相比,本发明实施例1制得的v-tio2在652nm处的特征吸收峰的相对荧光强度最高,说明本发明实施例1制得的v-tio2的hpo酶的活性最佳。
117.本发明进一步发现,与商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5相比,本发明实施例1制得的v-tio2在超声作用下可以增强sdt产生更多1o2(图2d,图2e,图16,图17)。通过常用的单线态氧荧光探针sosg(图2e和图16)和探针9,10-二苯蒽醌(dpa)(图17)评价v-tio2对sdt的增强作用。
118.上述实验结果表明,与商业二氧化钛(tio2(c))、合成二氧化钛(tio2(s))以及商业v2o5相比,本发明制得的v-tio2具有更优的仿氧化酶(oxd)活性、仿过氧化物酶(pod)活性和仿卤素过氧化物酶(hpo)活性,能够用来制备高催化活性的仿酶制剂。除了仿酶制剂之外,本发明的v-tio2还可以作为化疗药物以及声敏剂,在超声辐照下被激活,提高1o2的产生。
119.实验例3本发明原子分散的钒掺杂二氧化钛的催化性能对比
120.1、测试样品
121.实施例1~6制得的原子分散的钒掺杂二氧化钛。
122.2、实验方法
123.同实验例2。
124.3、实验结果
125.对于实施例1~3不同ti/v的原子分散的钒掺杂二氧化钛,从图6可以看出,ph=4.0时,v:ti=2:1的样品pod酶活性最优;从图7可以看出,ph=5.8时,v:ti=2:1的样品hpo酶活性最优。
126.对于实施例1、4~6不同高温处理温度的原子分散的钒掺杂二氧化钛,从图8可以看出,ph=4.0时,400℃下高温处理所得的样品pod酶活性最优;从图9可以看出,ph=5.8时,400℃下高温处理所得的样品hpo酶活性最优。
127.上述实验结果表明,在制备本发明的原子分散的钒掺杂二氧化钛时,当控制原料中ti与v的摩尔比为2:1,高温处理温度为400℃时所得产品的催化性能最佳。
128.实验例4体内外抗菌性能测试
129.1、测试样品
130.实施例1制得的v-tio2,以商业二氧化钛(tio2(c))作为对照。
131.2、实验方法
132.(1)体外抗菌实验:
133.以耐甲氧西林金黄色葡萄球菌(简称mrsa,atcc43300)为实验菌。分为不同的5组:(1)pbs组(对照组),(2)pbs us,(3)tio2(c),(4)tio2(c) us,(5)v-tio2,(6)v-tio2 us。催化剂200μl(2mg/ml),h2o
2 10μl(200μm/l),细菌取1.79ml(1x106cuf ml-1
),us条件为1.0mhz,1w/cm2,占空比30%,超声时间2min。将混合溶液放在37℃,180rpm的摇床上培育2小时后,将样品稀释1000倍后涂板,再放在37℃培育箱内培养24h后数菌落。该实验重复3次。并按照以下公式计算细菌生存率。细菌生存率=c/c0×
100%
134.其中,c为测试组细菌的菌落数,c0为该实验对照组的菌落数。
135.(2)体内抗菌实验:
136.选取雄性兔,麻醉后在背部用手术刀去除直径约1cm的皮肤组织,注入mrsa菌液
(剂量:100μl,浓度:1
×
108cfu
·
ml-1
)。1天后全层皮肤内形成严重感染创面,伤口周围组织红肿,有些伤口甚至渗出脓液。
137.将感染兔随机分为6组:对照组(pbs)、pbs us照射(pbs us)、tio2(c)、tio2(c) us照射(tio2(c) us)、v-tio2、v-tio2 us照射(v-tio2 us)。在本实验中使用的h2o2的终浓度为0.1mm,100μl v-tio2溶液(2mg
·
ml-1
),在给药5h后给予超声辐照,条件为:强度2.5w cm-2
,频率1mhz,占空比30%,照射时间5min。整个伤口愈合过程通过数码摄影拍摄,记录不同时期伤口的大小。每两天观察测量伤口大小,在第16天处死家兔并取伤口及周围组织做病理检测。
138.3、实验结果
139.传统的平板计数法显示在没有超声辐照的情况下,v-tio2组抑菌效果显著优于对照组和tio2(c)组。超声照射后各组抗菌性能均有增强。而且v-tio2 us组的抑菌率高于tio2(c) us组(图20)。活/死细菌染色实验得到的结果与前述抗菌效果一致(图21-22)。进一步对细菌体内活性氧(ros)水平进行检测,通过荧光染色显示us辐照组的荧光强度比未辐照组增加,v-tio2 us的强度高于tio2(c) us组。超声照射后v-tio2对mrsa细菌的损伤最大(死亡率为91.14%)。同样条件us照射tio2组中mrsa的pi内化率降至65.4%(图23)。v-tio2在sdt处理后,sem观察到大量细菌表面有很多塌陷(图24)。透射电镜(tem)可更详细观察到对细菌的破坏。更具体地说,在v-tio2 us组可观察到细菌的大部分细胞壁裂解,内部结构永久性损伤(图3b),tio2 us组细菌的损伤程度较v-tio2 us组轻,有的仅为细菌膜的变形而已。
140.通过mrsa诱导的家兔皮肤感染模型进一步测试体内抗菌效果。不同时期伤口的大小如图3a所示。在治疗结束后的第15天,pbs组和pbs us组创面仍有少量脓液渗出,而v-tio2 us组创面已明显较其他组结痂少,和正常组织几乎无明显差别。通过计算不同天数的伤口愈合率,以监测伤口愈合状态。v-tio2 us组和tio2 us组伤口愈合率显著高于其他各组,而v-tio2组伤口愈合速度也快于tio2组。取组织进行病理检测,he染色显示pbs和pbs us组出现大面积坏死的多形核白细胞(红色矩形标记)和碎片细胞(红色箭头标记)(图25)。v-tio2 us组白细胞数最少,这与外周血wbc和中性粒细胞百分率一致。cd31是早期血管生成中表达的跨膜蛋白,主要用于证明内皮细胞组织的存在,可用于评估血管生成,v-tio2 us组cd31表达最高(图3c)。胶原沉积也是表征创面愈合过程的重要指标之一。组织切片中胶原纤维用masson’s染色为蓝色,相对强度可表示胶原含量。胶原蛋白沉积在v-tio2 us组和tio2 us组仍明显高于其他组,此外,v-tio2 us组的胶原沉积相对于tio2 us更高(图3c)。masson’s染色和cd31染色表明v-tio2 us可促进伤口愈合。
141.上述实验结果表明,与商业二氧化钛(tio2(c))相比,本发明制得的原子分散的钒掺杂二氧化钛的具有更优的抗菌效果。
142.实验例5体内外抗肿瘤效果测试
143.1、测试样品
144.实施例1制得的v-tio2,以商业二氧化钛(tio2(c))作为对照。
145.2、实验方法
146.(1)体外抗肿瘤实验:
147.以黑色素瘤细胞(b16f10)为研究对象,分为6组:(1)空白对照组,(2)空白对照 us
组,(3)tio2(c)组,(4)tio2(c) us组,(5)v-tio2组,(6)v-tio2 us组。按照分组,将b16f10和生物催化材料(v-tio2或者对照物tio2(c))共孵育12h后,超声组给予超声辐照,辐照条件为(频率1mhz,强度1w cm-2
,占空比30%,辐照时间60s)。然后分别进行以下检测:活死染色、细胞凋亡、产ros检测、细胞骨架染色。
148.(2)体内抗肿瘤实验:
149.以balb/c小鼠作为研究对象。第一步造模:将100μl呈对数生长的b16f10细胞注入小鼠右侧腋部皮下,约3-5天在该处可见有150~200mm3肿瘤出现视为造模成功。将造模成功的小鼠随机分为6组:(1)pbs组,(2)pbs us组,(3)tio2(c)组,(4)tio2(c) us组,(5)v-tio2组,(6)v-tio2 us组,每组5只。每3天按照分组给予治疗(生物催化剂按10mg/kg给予,4h后进行超声辐照,辐照的条件:强度2.5w cm-2
,频率1mhz,占空比30%,辐照时间5min)。进行完6个治疗周期后处死所有小鼠,取下肿瘤组织进行病理检测(h&e,cd31,tunnel,ki67)。
150.3、实验结果
151.我们使用b16f10黑色素瘤细胞和携带黑色素瘤的小鼠来评估v-tio2化/声动力协同抗肿瘤治疗效果。将tio2(c)、v-tio2分别与b16f10细胞孵育4h,研究其化疗效果和化疗声动力效果。然后分别用us照射和不照射处理不同组细胞,再孵育20h后观察不同方案的治疗效果。处理后,死细胞和活细胞分别用碘化丙啶(pi)和钙绿素乙酰氧基甲酯(calcein-am)染色。如图26所示,在v-tio2 us组出现整个pi染色的红色荧光区域,说明v-tio2 us组化/声动力协同治疗效果最好。流式细胞术检测荧光异硫氰酸酯(annexinv-fitc)/碘化丙啶(pi)荧光染色证实了上述结果。v-tio2联合us处理的b16f10细胞凋亡率和坏死率最高(图4a)。接下来,细胞内ros探针2',7'二氯荧光素二乙酸(dcfh-da)检测了细胞内ros的产生水平。如图27所示,us辐照后,tio2组和v-tio2组均表现出绿色荧光,其中v-tio2组的荧光强度最强,再次证明声/化动力协同增强ros的产生。此外,apf可以选择性地检测hclo在细胞内产生绿色荧光。如图28所示,v-tio2组的荧光强度最高。细胞内过高的ros会损伤细胞,导致细胞骨架的破坏。因此,通过f-actin定位的变化来验证细胞骨架结构。从f-actin染色的免疫荧光图像可以观察到,v-tio2 us治疗可导致f-actin形成明显的损伤(图29),b16f10细胞边缘有较多毛刺,棘状丝状伪足较为明显。
152.本发实验还研究了v-tio2联合us治疗的体内抗肿瘤疗效。与对照组相比,v-tio2组和v-tio2 us组均能抑制肿瘤生长,且v-tio2 us组抑制肿瘤生长的效果最佳。图4c为治疗18天后解剖肿瘤的小鼠代表及肿瘤的超声图像。在治疗期间,所有小鼠在18天内的体重波动可以忽略不计(图30),说明注射剂量对小鼠总体健康的不良影响很小。每3天用卡钳测量各组肿瘤大小(图31)。肿瘤重量的大幅下降也表明v-tio2 us组声/化疗协同治疗具有有效的抗肿瘤作用。这与hexatoxylin and eosin(h&e)对肿瘤切片的染色结果一致(图32)。肿瘤血管用抗cd31抗体染色,v-tio2 us组比pbs组和tio2(c) us组棕色面积减少(图4d)。对肿瘤切片进行tunel和ki-67染色,分别研究肿瘤细胞凋亡和增殖水平,v-tio2 us组显示出比tio2(c) us组更多的凋亡细胞数量(图4d)。v-tio2 us组表达ki67的肿瘤细胞明显减少,表明治疗后肿瘤细胞扩散明显减少(图4d)。
153.上述实验结果表明,与商业二氧化钛(tio2(c))相比,本发明制得的原子分散的钒掺杂二氧化钛的具有更优的抗肿瘤效果。
154.实验例6生物相容性评价
155.1、测试样品
156.实施例1制得的v-tio2。
157.2、实验方法
158.(1)预热液体:将pbs液、超纯水、不同浓度v-tio2溶液(4mg/ml,2mg/ml,1mg/ml,0.5mg/ml,0.25mg/ml)放在37℃的水浴锅中预热30min以上。
159.(2)根据下列分组,将物质按对应的剂量取出后加入2ml的离心管中,每组实验重复3次:
160.实验组:2%绵羊红细胞0.5ml v-tio2溶液0.5ml,每个浓度重复3次;
161.阳性组:2%绵羊红细胞0.5ml 超纯水0.5ml;
162.阴性组:2%绵羊红细胞0.5ml pbs溶液0.5ml。
163.(3)将配好上述液体的离心管放置于37℃的水浴锅中保温3小时,将离心管取出离心(1000g、10min),然后取上清液测570nm处的吸光度。
164.(4)结果的判读:
①
将离心管按材料浓度顺序摆放对比拍照;
②
根据570nm处的吸光度计算溶血率:
165.溶血率=(样品od
570nm-阴性组od
570nm
)/(阳性组od
570nm-阴性组od
570nm
)。
166.3、实验结果
167.利用溶血试验研究v-tio2在血液中的生物相容性(图33)。结果表明,即使在绵羊红细胞中v-tio2的浓度高达4mg ml-1
,溶血率也低于5%。本实验还评价了v-tio2对人脐静脉内皮细胞(huvecs)的生物安全性,即使是在低浓度(1mm)h2o2存在时,也对该细胞表现出有限的毒性(图34)。苏木精-伊红(h&e)染色检查主要器官(心、肝、脾、肺和肾)没有明显的异常或损伤。
168.上述实验结果表明,本发明制得的原子分散的钒掺杂二氧化钛具有良好的生物安全性。
169.综上,本发明提供了一种原子分散的钒掺杂二氧化钛及其制备方法和用途。与商业二氧化钛、合成二氧化钛以及商业五氧化二钒相比,本发明原子分散的钒掺杂二氧化钛具有更优的仿氧化酶活性、仿过氧化物酶活性和仿卤素过氧化物酶活性,能够用来制备高催化活性的仿酶制剂。除此之外,与商业二氧化钛相比,本发明原子分散的钒掺杂二氧化钛还具有更优的抗菌和抗肿瘤效果。本发明原子分散的钒掺杂二氧化钛制备方法简单,在制备仿酶制剂、声敏剂、抗菌剂以及抗肿瘤药物中具有优良的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。