1.本发明属于药物检测技术领域,尤其涉及一种基于谱效关系的兽用双黄连口服液质量检测方法。
技术背景
2.兽用双黄连口服液由黄芩、金银花、连翘按1:1:2配伍而成。金银花为忍冬科植物忍冬的干燥花蕾或带初开的花,为组方中的君药,以绿原酸类化合物、挥发油、黄酮类等为主要活性物质,具有抗菌、抗炎、抗病毒、解热等功效;连翘为木犀科植物连翘的干燥果实,为组方中的臣药,以木脂体类如连翘苷、苯乙醇苷类连翘脂苷a、黄酮类芦丁等为主要化学成分,具有清热解毒,消肿散结,疏散风热的功效;黄芩为唇形科植物黄芩的干燥根,与连翘同为臣药,主要含有黄酮类成分,其中黄芩苷、黄芩素、汉黄芩苷、汉黄芩素为其特征化学成分,也是主要的活性成分,为临床疗效确切的传统常用中药。三者配伍的双黄连口服液具有辛凉解表,清热解毒的功效,兽医临床上主要用于预防和治疗宠物、畜禽感冒发热及呼吸道疾病等。在兽医临床中,双黄连口服液不仅用于禽病的呼吸道治疗,还用于猪病中的胃肠道疾病。作为常用的兽用中成药,已获取双黄连口服液有效批准文号的兽药企业高达479个,如何建立简单有效的质量监测技术,实现兽用双黄连口服液产品一致性的评价,对兽用双黄连口服液的质量控制具有重要的意义。
3.中药指纹图谱作为中药质量控制的关键技术,能够全面的反映出中药材中各种不同化学成分浓度分布的整体状况,是中药整体质量控制手段,中药生产工艺的改进和规范中药成品的质量控制产生深远的影响。另一方面,中药指纹图谱作为一种综合的、可量化的鉴别手段,在现阶段,通过指纹特征相似程度的比较,判断真伪、评价优劣、考察稳定性和一致性,是一种符合中药特色的质量控制模式之一。
4.目前,现行兽药典标准中采用两种方法分别实现双黄连口服液中三味药材主要成分黄芩苷、绿原酸和连翘苷的定量检测,方法复杂耗时;且有关于兽用双黄连口服液的谱效关系方面的研究较少,因此,对兽用双黄连口服液质量控制的研究方法有待进一步探索。
技术实现要素:
5.鉴于此,本发明提供了一种基于谱效关系的兽用双黄连口服液质量检测方法,本发明提供的hplc指纹图谱的检测方法可有效的同时定量检测绿原酸、咖啡酸、芦丁、黄芩苷和连翘苷;本发明质量检测方法具有方法简便、客观性强等优点,有利于对兽用双黄连口服液进行质量检测。
6.为了实现上述发明目的,本发明提供了以下技术方案:
7.一种兽用双黄连口服液的hplc检测方法,包括以下步骤:
8.(1)对照品溶液的制备:分别称取绿原酸、咖啡酸、芦丁、黄芩苷、连翘苷对照品,用50%甲醇/水分别稀释制得储备液;将各储备液混合制得对照品溶液;
9.(2)供试品溶液的制备:精密量取兽用双黄连口服液样品,加入50%甲醇/水溶液
稀释,超声,放至室温,补足余量,过滤,即得;
10.(3)分析检测:采用高效液相色谱-紫外检测进行分析;
11.(4)含量检测:主要检测成分包括绿原酸、咖啡酸、芦丁、黄芩苷、连翘苷。
12.进一步地,对照品的制备为取绿原酸对照品适量,精密称定,加50%甲醇/水制成每1ml含绿原酸100μg的储备液;取咖啡酸对照品适量,精密称定,加50%甲醇/水制成每1ml含咖啡酸200μg的储备液;取芦丁对照品适量,精密称定,加50%甲醇/水制成每1ml含芦丁200μg的储备液;取黄芩苷对照品适量,精密称定,加50%甲醇/水制成每1ml含黄芩苷2000μg的储备液;取连翘苷对照品适量,精密称定,加50%甲醇/水制成每1ml含连翘苷600μg的储备液。
13.混合标准品的制备:将各储备液混合,以50%甲醇/水稀释为绿原酸浓度10μg/ml、咖啡酸浓度20μg/ml、芦丁浓度20μg/ml、黄芩苷浓度200μg/ml、连翘苷浓度60μg/ml的混合标准品溶液。
14.进一步,供试品的制备,优选为,精密量取兽用双黄连口服液1ml置于50ml容量瓶中,加适量50%甲醇/水,超声20min,放置至室温,50%甲醇/水稀释至刻度,摇匀,0.45μm微孔滤膜过滤,即得。
15.分析检测:采用高效液相色谱-紫外检测进行分析。
16.色谱柱为cosmosil c18-5μm-250mm;柱温为35℃;流速为1.0ml/min;检测波长为277nm;以纯乙腈为流动相a,0.1%甲酸/水为流动相b,进行梯度洗脱。
17.洗脱条件为:0~15min,a由8%梯度变化至15%,b由92%梯度变化至85%;15~25min,a为15%,b为85%;25~45min,a由15%梯度变化至35%,b由85%梯度变化至65%;45~50min,a由35%梯度变化至80%,b由65%梯度变化中20%;50~60min,a为80%,b为80%。
18.含量检测主要是对绿原酸、咖啡酸、芦丁、黄芩苷和连翘苷均采用外标定量法进行定量检测。
19.流动相b所用体积比为0.1%的甲酸水溶液是采用质量比为85%甲酸溶液进行制备。
20.基于上述兽用双黄连口服液的hplc检测方法,本发明还提供了一种基于谱效关系的兽用双黄连口服液质量检测方法,包括以下步骤:
21.(1)基于上述兽用双黄连口服液的hplc检测方法,建立兽用双黄连口服液的hplc指纹图谱检测方法;
22.(2)提取特征色谱峰;
23.(3)测定兽用双黄连口服液的抗炎活性;
24.(4)将步骤(2)所识别特征峰的峰面积和步骤(3)所得的抗炎活性进行灰色关联度分析,并计算各特征峰与抗炎活性之间的关联度,评价特征峰的抗炎活性。
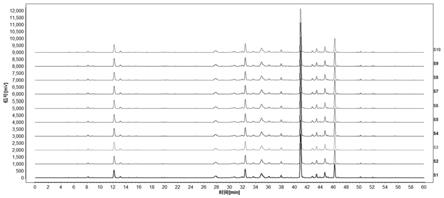
25.在本发明中,进行了10批相同厂家兽用双黄连口服液的hplc指纹图谱相似度评价。
26.本发明通过建立兽用双黄连口服液的hplc指纹图谱得到共有特征峰;通过建立细胞抗炎模型测定兽用双黄连口服液的抗炎因子指标;再根据hplc指纹图谱特征峰的峰面积和抗炎指标建立灰色关联度分析,并利用所建立的灰色关联度分析方法来评价特征峰与抗
炎活性的关联度大小。
27.步骤(2)中提取特征指纹峰的保留时间分别为:绿原酸12.059~12.371min、咖啡酸15.586~15.777min、芦丁31.098~31.244min、黄芩苷40.963~41.194min、连翘苷42.657~42.899min。
28.测定兽用双黄连口服液的抗炎活性步骤如下:
29.1)预防抗炎试验:将raw264.7细胞密接于96孔板,24h后加入兽用双黄连口服液的样品溶液培养,培养6h后弃去含药培养基,加入lps诱导细胞炎症,诱导24h后,测定细胞上清液中no释放量及il-6和tnf-α水平。
30.2)直接抗炎试验:将raw264.7细胞密接于96孔板,24h后加入lps诱导细胞炎症,同时将兽用双黄连口服液的样品溶液加入细胞中,作用24h后,测定no释放量及il-6和tnf-α水平。
31.灰色关联度分析步骤如下:
32.1)将各样品的抗炎活性指标组成参考数列,将各样品指纹图谱中的各特征峰峰面积组成比较数列;
33.2)对参考数列和比较数列采用均值化方法进行无量纲化处理;
34.3)根据步骤2)所得无量纲化处理的参考数列和比较数列,计算各特征峰与抗炎活性之间的关联度;
35.4)对步骤3)所得关联度进行排序,评价特征峰的抗炎活性。
36.本发明中,关联度的计算方法为:
37.采用下方公式计算关联度系数ζi(k):
[0038][0039]
其中,x0(k)表示参考数列,xi(k)表示比较数列,ρ为分辨系数,ρ值取0.5;
[0040]
然后再按照下方公式计算关联度ri:
[0041][0042]
均值化方法,通常是指将每一变量值除以该变量的平均值。该方法在消除量纲和数量级影响的同时,保留了个变量取值差异程度上的信息,也保留了数据的可比性。
[0043]
本发明的有益之处在于:
[0044]
1.采用的兽用双黄连口服液hplc指纹图谱可以通过色谱峰的保留时间对共有特征峰进行识别,从而保证了特征峰识别的准确性和重复性;可直接通过兽用双黄连口服液hplc指纹图谱预测其抗炎活性,对兽用双黄连口服液的优劣进行评价;且采用hplc指纹图谱与数学模型结合的方法可避免人为因素造成峰干扰。
[0045]
2.基于高效液相色谱-紫外检测技术建立了单波长指纹图谱质量控制办法,在一次分析中同时实现指纹图谱分析和多指标成分包括黄芩苷、绿原酸、连翘苷、咖啡酸和芦丁的定量检测,能够更加全面、准确地评价兽用双黄连的质量,实现对兽用双黄连口服液的全面控制,同时最大程度缩短了检测时间,较少了资源的耗费。
[0046]
3.通过采用本发明的方法,得知兽用双黄连口服液中连翘苷和绿原酸与预防抗炎效果中降低no释放量关联度高,黄芩苷、咖啡酸和芦丁与预防抗炎效果中降低il-6和tnf-α
水平关联度高;黄芩苷、咖啡酸和芦丁与直接抗炎效果中降低no释放量关联度高,黄芩苷与直接抗炎效果中降低il-6和tnf-α水平关联度高。本发明具有方法简便,客观性强等优点,有利于对兽用双黄连口服液进行质量控制。
附图说明
[0047]
图1为10批相同厂家兽用双黄连口服液的hplc指纹图谱;
[0048]
图2为兽用双黄连口服液的hplc指纹图谱对照图谱;
[0049]
图3为预防炎症试验中样品对no释放量测定结果;
[0050]
图4为预防炎症试验中样品对il-6水平测定结果;
[0051]
图5为预防炎症试验中样品对tnf-α水平测定结果;
[0052]
图6为直接抗炎试验中样品对no释放量测定结果;
[0053]
图7为直接抗炎试验中样品对il-6水平测定结果;
[0054]
图8为直接抗炎试验中样品对tnf-α水平测定结果。
具体实施方式
[0055]
下面结合实例,对本发明的技术方案进行进一步解释和说明。实例仅限于说明本发明,而非对本发明的限定。本发明中使用的化学品和仪器未做说明均为市售。
[0056]
本试验在具体实施例中可采用的试验材料和仪器的相关信息如下:
[0057]
仪器:waters alliance高效液相色谱仪(2695梯度泵,waters 2487紫外检测器,自动进样器,柱恒温系统,empower色谱工作站)、synergy htx多功能微孔板检测仪(美国biotek,紫外/可见吸收光)。
[0058]
试剂:乙腈(色谱纯,sigma-aldrich),甲醇(色谱纯,sigma-aldrich),实验水为mil-q纯水系统生成,其余试剂均为分析纯;lps(biosharp),dmem(gibco),胎牛血清(四季青);pbs 10
×
(biosharp)。
[0059]
对照品:供含量测定绿原酸(含量:99.3%;批号:110753-201716,中国食品药品检定所,供含测用);黄芩苷(含量:95.4%;批号:110715-201821,中国食品药品检定所,供含测用);连翘苷(含量:95.3%;批号:110821-201213,中国食品药品检定所,供含测用);咖啡酸(含量:99.7%;批号:110885-201703,中国食品药品检定研究院,供含测用),芦丁(含量:92.8%;批号:100080-201408,中国食品药品检定所,供含测用)。
[0060]
细胞株:raw264.7小鼠单核巨噬细胞白血病细胞,由天津中医药大学惠赠。
[0061]
试剂盒:no检测试剂盒、小鼠白细胞介素6(il-6)elisa试剂盒、小鼠肿瘤坏死因子α(tnf-α)elisa试剂盒。
[0062]
实施例1兽用双黄连口服液hplc指纹图谱的建立
[0063]
实施方法
[0064]
1.分析条件
[0065]
仪器:waters alliance高效液相色谱仪
[0066]
色谱柱:cosmosil c18-5μm-250mm
[0067]
流速:1.0ml/min
[0068]
柱温:35℃
[0069]
进样量:10μl
[0070]
波长采集范围:190nm~600nm
[0071]
波长:277nm
[0072]
流动相:a.乙腈:b.0.1%甲酸/水(v/v)
[0073]
梯度:
[0074]
时间(min)a(%)b(%)0~158
→
1592
→
8515~2515
→
1585
→
8525~4515
→
3585
→
6545~5035
→
8065
→
2050~6080
→
8020
→
20
[0075]
2.对照品的制备:取绿原酸对照品适量,精密称定,加50%甲醇/水制成每1ml含绿原酸100μg的储备液;取咖啡酸对照品适量,精密称定,加50%甲醇/水制成每1ml含咖啡酸200μg的储备液;取芦丁对照品适量,精密称定,加50%甲醇/水制成每1ml含芦丁200μg的储备液;取黄芩苷对照品适量,精密称定,加50%甲醇/水制成每1ml含黄芩苷2000μg的储备液;取连翘苷对照品适量,精密称定,加50%甲醇/水制成每1ml含连翘苷600μg的储备液。以上各储备液以50%甲醇/水稀释为绿原酸浓度10μg/ml、咖啡酸浓度20μg/ml、芦丁浓度20μg/ml、黄芩苷浓度200μg/ml、连翘苷浓度60μg/ml的混合标准品溶液。
[0076]
3.供试品溶液的制备:精密量取兽用双黄连口服液1ml置于50ml容量瓶中,加适量50%甲醇/水,超声20min,放置至室温,50%甲醇/水稀释至刻度,摇匀,0.45μm微孔滤膜过滤,即得。
[0077]
4.结果:经测定,该供试品中含绿原酸1.52mg/ml、咖啡酸0.89mg/ml、芦丁2.53mg/ml、黄芩苷17.36mg/ml、连翘苷2.03mg/ml。
[0078]
实施例2方法学验证
[0079]
1.仪器精密度验证
[0080]
依照实施例1样品制备方法及色谱条件,制备一份供试品溶液连续进样六次。以黄芩苷(峰4)为参照峰,考察特征峰(峰1:绿原酸;峰2:咖啡酸;峰3:芦丁;峰4:黄芩苷;峰5:连翘苷)与参照峰的相对保留时间(表1)和相对峰面积值(表2)。
[0081]
结果表明,兽用双黄连口服液同一供试品连续进样六针,各特征峰相对保留时间的rsd为0.093%~0.923%之间,相对峰面积的rsd为0.007%~0.015%之间,表明所用仪器精密度良好。
[0082]
表1:相对保留时间rsd(精密度考察)
[0083]
样品号峰1峰2峰3峰4峰510.2970.3790.7561.0001.04420.3020.3840.7621.0001.04330.2950.3790.7651.0001.04240.2980.3810.7611.0001.04250.3020.3810.7631.0001.04160.2980.3800.7561.0001.043
average0.2980.3810.7611.0001.043sd0.0030.0020.0040.0000.001rsd0.923%0.517%0.503%0.000%0.093%
[0084]
表2:相对峰面积rsd(精密度考察)
[0085]
样品号峰1峰2峰3峰4峰510.0820.0110.0371.0000.03220.0800.0100.0371.0000.03230.0800.0100.0371.0000.03240.0800.0100.0371.0000.03250.0810.0100.0361.0000.03160.0810.0100.0361.0000.031average0.0810.0100.0371.0000.032sd0.0010.0000.0010.0000.000rsd0.009%0.009%0.015%0.000%0.007%
[0086]
2.重复性验证
[0087]
依照实施例1样品制备方法及色谱条件,制备六分供试品溶液进行分析,以黄芩苷(峰4)为参照峰,考察特征峰(峰1:绿原酸;峰2:咖啡酸;峰3:芦丁;峰4:黄芩苷;峰5:连翘苷)与参照峰的相对保留时间(表3)和相对峰面积值(表4)。
[0088]
结果表明,兽用双黄连口服液同一供试品连续进样六针,各特征峰相对保留时间的rsd为0.228%~0.710%之间,相对峰面积的rsd为0.011%~0.040%之间,表明本方法重复性良好。
[0089]
表3:相对保留时间rsd(重复性考察)
[0090][0091][0092]
表4:相对峰面积rsd(重复性考察)
[0093]
样品号峰1峰2峰3峰4峰510.0820.0110.0371.0000.03220.0800.0100.0371.0000.03230.0800.0100.0371.0000.03240.0810.0100.0361.0000.031
50.0820.0100.0371.0000.03160.0810.0100.0361.0000.031average0.0810.0100.0371.0000.032sd0.0010.0000.0010.0000.001rsd0.011%0.040%0.014%0.000%0.017%
[0094]
3.稳定性验证
[0095]
依照实施例1样品制备方法及色谱条件,制备一份供试品溶液,分别在0h、4h、8h、12h、18h、24h进行分析,以黄芩苷(峰4)为参照峰,考察特征峰(峰1:绿原酸;峰2:咖啡酸;峰3:芦丁;峰4:黄芩苷;峰5:连翘苷)与参照峰的相对保留时间(表5)和相对峰面积值(表6)。
[0096]
结果表明,各特征峰相对保留时间的rsd为0.224%~0.816%之间,相对峰面积的rsd为0.879%~1.429%之间,表明24h内供试品溶液稳定性良好。
[0097]
表5:相对保留时间rsd(稳定性考察)
[0098]
样品号峰1峰2峰3峰4峰50h0.2970.3830.7611.0001.0434h0.2990.3820.7571.0001.0448h0.3000.3850.7611.0001.04312h0.2940.3800.7581.0001.04318h0.2960.3790.7601.0001.04424h0.3010.3800.7561.0001.038average0.2980.3810.7591.0001.042sd0.0020.0020.0020.0000.002rsd0.816%0.586%0.262%0.000%0.224%
[0099]
表6:相对峰面积rsd(稳定性考察)
[0100][0101][0102]
4.经本试验中各项验证,本发明建立的hplc指纹图谱方法可靠。
[0103]
实施例3hplc指纹图谱定量检测
[0104]
1.仪器精密度
[0105]
按照实施例1样品制备方法及色谱条件,制备一份供试品溶液连续进行六次分析。结果显示,绿原酸含量的rsd为0.513%、咖啡酸含量的rsd为0.533%、芦丁含量的rsd为0.354%、黄芩苷含量的rsd为0.156%,连翘苷含量的rsd为0.473%,rsd<3%,表明所用仪
器对兽用双黄连口服液供试品溶液定量检测的精密度良好。
[0106]
表7:绿原酸、咖啡酸、芦丁、黄芩苷、连翘苷含rsd(精密度考察)
[0107]
样品号峰1峰2峰3峰4峰511.5570.8852.54517.6252.04321.5560.8912.52517.6172.04031.5590.8962.54317.6172.02141.5640.8832.54317.6252.04151.5400.8872.53117.5692.04961.5570.8892.54717.5692.036average1.5550.8892.53917.6042.038sd0.0080.0050.0090.0270.010rsd0.513%0.533%0.354%0.156%0.473%
[0108]
2.重复性
[0109]
按照实施例1方法制备方法及色谱条件,制备六份供试品溶液进行分析。结果显示,绿原酸含量rsd为0.280%、咖啡酸含量的rsd为0.746%、芦丁含量的rsd为0.998%、黄芩苷含量的rsd为0.668%,连翘苷含量的rsd为0.573%,rsd<3%,表明本方法对兽用双黄连口服液供试品溶液定量检测的重复性较好。
[0110]
表8:绿原酸、咖啡酸、芦丁、黄芩苷、连翘苷含量rsd(重复性考察)
[0111][0112][0113]
3.稳定性
[0114]
按照实施例1方法制备方法及色谱条件,制备一份供试品溶液进行分析。分别统计0h、4h、8h、12h、18h、24h的色谱分析结果。结果显示,绿原酸含量rsd为0.667%、咖啡酸含量的rsd为0.834%、芦丁含量的rsd为1.000%、黄芩苷含量的rsd为0.741%,连翘苷含量的rsd为0.651%,rsd<3%,表明兽用双黄连口服液供试品溶液在24h内主要指标成分含量稳定。
[0115]
表9:绿原酸、咖啡酸、芦丁、黄芩苷、连翘苷含量rsd(稳定性考察)
[0116]
样品号峰1峰2峰3峰4峰50h1.5470.8832.52517.5692.0364h1.5640.8872.53617.5972.0438h1.5560.8892.51117.4932.019
12h1.5640.8852.53417.4942.04318h1.5470.8972.54517.6312.01924h1.5740.9022.47517.8462.051average1.5590.8912.52117.6052.035sd0.0110.0070.0250.1300.013rsd0.667%0.834%1.000%0.741%0.651%
[0117]
实施例4 10批相同厂家兽用双黄连口服液的hplc指纹图谱检测
[0118]
实施方法
[0119]
采用实施例3建立的定量指纹谱方法,对10批次相同厂家兽用双黄连口服液进行指纹图谱分析,记录色谱图,将色谱图导入中药色谱指纹图谱相似度评价系统进行色谱峰匹配(中药指纹图谱相似度评价系统2012.0版本),见图1,对照图谱见图2。
[0120]
经相似度计算结果显示,10批相同厂家兽用双黄连口服液相似度均大于0.999,见表10。
[0121]
表10:10批次相同厂家兽用双黄连口服液相似度评价结果
[0122]
序号s1s2s3s4s5s6s7s8s9s10相似度0.9990.9990.9990.9990.9990.9990.9990.9990.9990.999
[0123]
实施例5 10批不同厂家兽用双黄连口服液样品定量检测
[0124]
实施方法
[0125]
采用经实施例3验证后的hplc指纹图谱定量检测方法,对10批次不同厂家兽用双黄连口服液进行定量检测,定量检测结果见表11,特征峰保留时间见表12。
[0126]
表11:10批次不同厂家兽用双黄连口服液样品定量检测结果
[0127][0128]
表12:10批次不同厂家兽用双黄连口服液样品特征峰保留时间
[0129][0130]
经测定,在相同保留时间下,不同厂家兽用双黄连口服液有效成分含量存在一定的差距。
[0131]
实施例6体外预防炎症试验
[0132]
1.实施方法
[0133]
1)样品溶液的配制
[0134]
按兽用双黄连口服液生药量折算,配制成1mg/ml样品溶液。
[0135]
2)预防炎症模型的建立及给药方案
[0136]
将raw264.7细胞以1
×
105/ml密度接种于96孔板,24h后分组处理,给药组加入1.0mg/ml的10批样品溶液处理,6h后弃去含药培养基,加入无血清的dmem完全培养基培养,模型组及给药组加入2μg/ml的lps,放置于5%co2、37℃培养箱中诱导24h。
[0137]
3)各抗炎活性指标的测定
[0138]
a)no释放量试验
[0139]
给药结束后取细胞上清液,按照no检测试剂盒检测给药组和空白组、模型组中no的释放量。
[0140]
b)il-6水平试验
[0141]
给药结束后取细胞上清液,按照il-6检测试剂盒检测给药组和空白组、模型组中il-6的水平变化。
[0142]
c)tnf-α水平试验
[0143]
给药结束后取细胞上清液,按照tnf-α检测试剂盒检测给药组和空白组、模型组中tnf-α的水平变化。
[0144]
2.试验结果
[0145]
1)no释放量测定结果
[0146]
试验结果表明:与空白组相比,经lps诱导的raw264.7细胞,细胞上清液中no的释放量显著升高,具有极显著差异,p<0.01,表明造模成功。与lps模型组相比,各给药组中no的释放量均出现不同程度降低,除s2组外,其余各给药组具有极显著差异,p<0.01;s2组具有显著差异,0.01<p<0.05。结果见表13,图3。
[0147]
表13:no释放量测定结果
[0148]
组别no(μmol/ml)
空白组6.71
±
0.08lps模型组32.39
±
0.76
**
s110.95
±
0.10
##
s210.35
±
0.75
#
s39.60
±
0.09
##
s49.79
±
0.04
##
s59.80
±
0.26
##
s610.27
±
0.43
##
s710.52
±
0.24
##
s817.18
±
0.04
##
s917.47
±
0.23
##
s1017.24
±
0.21
##
[0149]
注:与空白组相比,
**
代表差异极显著(p<0.01);与模型组相比,
##
代表差异极显著(p<0.01),
#
代表差异显著(0.01<p<0.05)
[0150]
2)il-6水平测定结果
[0151]
试验结果表明:与空白组比较,经lps诱导的raw264.7细胞,细胞上清液中il-6水平显著升高,具有极显著差异,p<0.01,表明造模成功。与lps模型组比较,各药物组中il-6水平均出现不同程度降低,s2-s8组具有极显著差异,p<0.01;s1、s9、s10组具有显著差异,0.01<p<0.05。结果见表14,图4。
[0152]
表14:il-6水平测定结果
[0153]
组别il-6(pg/ml)空白组38.81
±
1.56lps模型组61.62
±
2.46
**
s147.05
±
1.04
#
s246.36
±
0.01
##
s345.57
±
0.23
##
s446.53
±
0.13
##
s541.81
±
0.35
##
s644.21
±
0.30
##
s745.14
±
1.22
##
s843.64
±
0.44
##
s946.84
±
1.12
#
s1045.28
±
1.81
#
[0154]
注:与空白组相比,
**
代表差异极显著(p<0.01);与模型组相比,
##
代表差异极显著(p<0.01),
#
代表差异显著(0.01<p<0.05)
[0155]
3)tnf-α水平测定结果
[0156]
试验结果表明:与空白组相比,经lps诱导的raw264.7细胞,细胞上清液中tnf-α水平显著升高,具有极显著差异,p<0.01,表明造模成功。与lps模型组相比,各给药组中tnf-α水平均出现不同程度降低,s5-s7组具有极显著差异,p<0.01;其余各给药组具有显著差
异,0.01<p<0.05。结果见表15,图5。
[0157]
表15:tnf-α水平测定结果
[0158]
组别tnf-α(pg/ml)空白组188.29
±
0.40lps模型组255.79
±
4.61
**
s1230.58
±
0.82
#
s2229.84
±
0.34
#
s3238.55
±
2.25
#
s4238.58
±
2.97
#
s5198.86
±
0.86
##
s6199.52
±
0.74
##
s7201.33
±
0.90
##
s8233.13
±
0.69
#
s9234.68
±
1.15
#
s10234.38
±
0.54
#
[0159]
注:与空白组相比,
**
代表差异极显著(p<0.01);与模型组相比,
##
代表差异极显著(p<0.01),
#
代表差异显著(0.01<p<0.05)
[0160]
经测定细胞上清液中no释放量和il-6、tnf-α的抗炎水平,本实施例中细胞炎症模型建立成功,空白组、给药组均与模型组的差异具有统计学意义。
[0161]
实施例7体外直接抗炎试验
[0162]
1.实施方法:
[0163]
1)样品溶液的配制:
[0164]
按兽用双黄连口服液生药量折算,配制成1mg/ml样品溶液。
[0165]
2)直接抗炎模型的建立及给药方案
[0166]
将处于对数生长期的raw264.7细胞以1
×
105/ml密度接种于96孔板中,24h后分组处理,空白组加入无血清的dmem完全培养基培养,模型组加入浓度为加入2μg/ml的lps,给药组同时加入2μg/ml的lps和1.0mg/ml的10批样品溶液,放置于5%co2、37℃培养箱中诱导24h。
[0167]
3)各抗炎指标的测定
[0168]
a)no释放量试验
[0169]
给药结束后取细胞上清液,按照no检测试剂盒检测给药组和空白组、模型组中no的释放量。
[0170]
b)il-6水平试验
[0171]
给药结束后取细胞上清液,按照il-6检测试剂盒检测给药组和空白组、模型组中il-6的水平变化。
[0172]
c)tnf-α水平试验
[0173]
给药结束后取细胞上清液,按照tnf-α检测试剂盒检测给药组和空白组、模型组中tnf-α的水平变化。
[0174]
2.试验结果
[0175]
1)no释放量测定结果
[0176]
试验结果表明:与空白组相比,经lps诱导的raw264.7细胞,细胞上清液中no的释放量显著升高,具有极显著差异,p<0.01,表明造模成功。与lps模型组相比,各给药组中no的释放量均出现显著降低,各给药组均具有极显著差异,p<0.01。结果见表16,图6。
[0177]
表16:no释放量测定结果
[0178][0179][0180]
注:与空白组相比,
**
代表差异极显著(p<0.01);与模型组相比,
##
代表差异极显著(p<0.01)
[0181]
2)il-6水平测定结果
[0182]
试验结果表明:与空白组相比,经lps诱导的raw264.7细胞,细胞上清液中il-6水平显著升高,具有极显著差异,p<0.01,表明造模成功。与lps模型组相比,各给药组中il-6水平均出现不同程度降低,s1-s5、s8、s9组具有极显著差异,p<0.01;s6、s7、s10组具有显著差异,0.01<p<0.05。结果见表17,图7。
[0183]
表17:il-6水平测定结果
[0184]
组别il-6(pg/ml)空白组35.37
±
0.64lps模型组52.93
±
0.83
**
s136.48
±
1.28
##
s235.80
±
0.25
##
s336.90
±
0.25
##
s437.91
±
1.33
##
s541.56
±
0.25
##
s647.17
±
0.87
#
s747.38
±
0.57
#
s836.52
±
0.15
##
s942.20
±
0.19
##
s1039.51
±
4.17
#
[0185]
注:与空白组相比,
**
代表差异极显著(p<0.01);与模型组相比,
##
代表差异极显著(p<0.01),
#
代表差异显著(0.01<p<0.05)
[0186]
3)tnf-α水平测定结果
[0187]
试验结果表明:与空白组相比,经lps诱导的raw264.7细胞,细胞上清液中tnf-α水平显著升高,具有极显著差异,p<0.01,表明造模成功。与lps模型组相比,各给药组中tnf-α水平均出现不同程度降低,s3-s10组具有极显著差异,p<0.01;s1、s2组具有显著差异,0.01<p<0.05。结果见表18,图8。
[0188]
表18:tnf-α水平测定结果
[0189]
组别tnf-α(pg/ml)空白组150.00
±
4.71lps模型组214.29
±
7.41
**
s1182.14
±
1.68
#
s2181.09
±
0.28
#
s3146.80
±
0.16
##
s4150.00
±
4.71
##
s5161.77
±
0.49
##
s6167.19
±
0.61
##
s7168.91
±
0.60
##
s8150.73
±
0.47
##
s9152.47
±
0.01
##
s10151.93
±
0.04
##
[0190]
注:与空白组相比,
**
代表差异极显著(p<0.01);与模型组相比,
##
代表差异极显著(p<0.01),
#
代表差异显著(0.01<p<0.05)
[0191]
经测定细胞上清液中no释放量和il-6、tnf-α的抗炎水平,本实施例中细胞炎症模型建立成功,空白组、给药组均与模型组的差异具有统计学意义。
[0192]
实施例8谱效关系分析
[0193]
本实施例采用灰色关联度分析的方法,揭示多个自变量与一个因变量之间的关系,关联度的大小用于判别变量对指标影响的大小。特征峰面积的无量纲化结果见表19,抗炎活性的无量纲化结果见表20。
[0194]
表19:10批样品指纹图谱特征峰面积的无量纲化处理结果
[0195][0196]
表20:10批样品抗炎活性的无量纲化处理结果
[0197][0198][0199]
1.实施方法
[0200]
(1)灰色关联分析
[0201]
灰色关联分析的基本步骤包括:
[0202]
1)以各样品的抗炎活性指标组成参考数列,以各样品指纹图谱中的特征峰峰面积组成比较数列;
[0203]
2)对参考数列和比较数列进行无量纲化处理;采用均值化方法进行处理;
[0204]
3)根据无量纲化的参考数列和比较数列,计算各特征峰与抗炎活性之间的关联度;
[0205]
4)对步骤3)所得关联度进行排序。
[0206]
在计算关联度过程中,可按照下方公式计算关联系数ζi(k):
[0207][0208]
其中,x0(k)表示参考数列,xi(k)表示比较数列,ρ为分辨系数,通常取0.5。
[0209]
然后再按照下面公式计算关联度ri:
[0210][0211]
所述均值化方法,通常是指将每一变量值除以该变量的平均值。该方法在消除量纲和数量级影响的同时,保留了个变量取值差异程度上的信息,也保留了数据的可比性。
[0212]
2.试验结果
[0213]
1)预防炎症试验
[0214]
a)no释放量
[0215]
进行灰色关联度分析
[0216]
从表21可得,各自变量所代表的化学物质与降低no释放量之间的关联度排序如下:连翘苷>绿原酸>黄芩苷>芦丁>咖啡酸
[0217]
其中连翘苷与降低no释放量之间的关联度最大,提示连翘苷与降低no释放量的关系最为密切。
[0218]
关联度大于0.7所对应的峰(绿原酸)对降低no释放量也起着一定的协同作用。
[0219]
表21:降低no释放量灰色关联度分析结果
[0220]
色谱峰tr/min关联度绿原酸12.7870.7166咖啡酸15.4970.5797芦丁31.0380.6635黄芩苷42.2570.6991连翘苷43.0560.7520
[0221]
b)il-6水平
[0222]
进行灰色关联度分析
[0223]
从表22可得,各自变量所代表的化学物质与降低il-6水平之间的关联度排序如下:黄芩苷>芦丁>咖啡酸>连翘苷>绿原酸
[0224]
其中黄芩苷与降低il-6水平之间的关联度最大,提示黄芩苷与降低il-6水平的关系最为密切。
[0225]
关联度大于0.7所对应的峰(咖啡酸、芦丁)对降低il-6水平也起着一定的协同作用。
[0226]
表22:降低il-6水平关联度分析结果
[0227]
色谱峰tr/min关联度绿原酸12.7870.5664咖啡酸15.4970.7338芦丁31.0380.7521黄芩苷42.2570.7873连翘苷43.0560.6870
[0228]
c)tnf-α水平
[0229]
进行灰色关联度分析
[0230]
从表23可得,各自变量所代表的化学物质与降低tnf-α水平之间的关联度排序如下:黄芩苷>芦丁>咖啡酸>连翘苷>绿原酸
[0231]
其中黄芩苷与降低tnf-α水平之间的关联度最大,提示黄芩苷与降低tnf-α水平的关系最为密切。
[0232]
关联度大于0.7所对应的峰(咖啡酸、芦丁)对降低tnf-α水平也起着一定的协同作用。
[0233]
表23:降低tnf-α水平关联度分析结果
[0234]
色谱峰tr/min关联度绿原酸12.7870.5557咖啡酸15.4970.7307芦丁31.0380.7785黄芩苷42.2570.7935连翘苷43.0560.6462
[0235]
2)直接抗炎试验
[0236]
a)no释放量
[0237]
进行灰色关联度分析
[0238]
从表24可得,各自变量所代表的化学物质与降低no释放量之间的关联度排序如下:黄芩苷>芦丁>咖啡酸>连翘苷>绿原酸
[0239]
其中黄芩苷与降低no释放量之间的关联度最大,提示黄芩苷与降低no释放量的关系最为密切。
[0240]
关联度大于0.7所对应的峰(咖啡酸、芦丁)对降低no释放量也起着一定的协同作用。
[0241]
表24:降低no释放量灰色关联度分析结果
[0242]
色谱峰tr/min关联度绿原酸12.7870.5452咖啡酸15.4970.7194芦丁31.0380.7254黄芩苷42.2570.7601连翘苷43.0560.6777
[0243]
b)il-6水平
[0244]
进行灰色关联度分析
[0245]
从表25可得,各自变量所代表的化学物质与降低il-6水平之间的关联度排序如下:黄芩苷>咖啡酸>芦丁>连翘苷>绿原酸
[0246]
其中黄芩苷与降低il-6水平之间的关联度最大,提示黄芩苷与降低il-6水平的关系最为密切。
[0247]
表25:降低il-6水平关联度分析结果
[0248][0249][0250]
c)tnf-α水平
[0251]
进行灰色关联度分析
[0252]
从表26可得,各自变量所代表的化学物质与降低tnf-α水平之间的关联度排序如下:黄芩苷>芦丁>咖啡酸>连翘苷>绿原酸。
[0253]
其中黄芩苷与降低tnf-α水平之间的关联度最大,提示黄芩苷与降低tnf-α水平的关系最为密切。
[0254]
表26:降低tnf-α水平关联度分析结果
[0255]
色谱峰tr/min关联度绿原酸12.7870.5703咖啡酸15.4970.6526芦丁31.0380.6754黄芩苷42.2570.7691连翘苷43.0560.5783
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
