1.本发明属于兽药抗生素制剂技术领域,具体涉及一种普拉沙星肠溶固体分散体与含有该固体分散体的制剂。
背景技术:
2.普拉沙星(pradofloxacin)是由拜耳公司研发的氟喹诺酮类的第3代增强光谱兽医抗生素,主要适用于治疗犬和猫细菌感染的处方药。与其他兽用氟喹诺酮类药物相比,它在体外对革兰氏阳性需氧菌和厌氧菌的活性提高。目前普拉沙星的剂型有2.5%(25mg/ml)的口服混悬液和规格为15~120mg的普拉沙星片剂上市,这些上市产品均非肠溶制剂。氟喹诺酮类药物的作用机制是主要抑制dna旋转chemicalbook酶(也称拓扑异构酶ⅱ)a亚单位,少数药物还作用于b亚基,从而破坏它的活性,使脱氧核糖核酸、核糖核酸及蛋白质的合成受干扰,使细菌不能再进行分裂,而起杀菌作用。
3.在文献《pradofloxacin:a novel veterinary fluoroquinolone for treatment of bacterial infections in cats hartmann》中,测定了普拉沙星在血清、泪液和唾液中的药代动力学参数。服用片剂后,吸收迅速,血药浓度在大约30分钟内达到峰值,普拉沙星的蛋白结合率较低(《30%),这意味着有大量的游离药物可用于穿透感染部位。普拉沙星的半衰期为9.8h,口服1h后,血清药物浓度达到峰值,生物利用度≥70%。有研究表明,普拉沙星口服后,在胃部被胃酸破坏,导致药物吸收利用度降低,同时避免药物对胃产生刺激引起不良反应,这极大地影响药物的临床效果。
4.因此,将普拉沙星做成肠溶制剂剂型,让药物在肠道弱碱性状态下快速溶解吸收,发挥药效,提高生物利用度,同时可以减少药物对胃部的刺激。本发明通过将普拉沙星与肠溶材料混合制成固体分散体,同时加入抑晶剂,能有效地提高药物稳定性,长期加速放置1年后,溶出度仍可保持在92%以上,其次本发明组方中加入矫味剂,提升了制剂的适口性,宠物的接受度更高。
技术实现要素:
5.基于上述原因,本发明提供了一种普拉沙星的肠溶固体分散体,并将该普拉沙星的肠溶固体分散体与辅料混合后制备成制剂,减少普拉沙星在胃中的释放量,降低药物对胃的刺激作用,克服药物在胃酸中不稳定的缺陷;还能使普拉沙星主要在肠中溶解和释放,延长药效,提高生物利用度。本发明提供的普拉沙星肠溶制剂,具有口感良好、崩解迅速、溶出快、服用方便等优点。
6.本发明第一方面,提供了一种普拉沙星的肠溶固体分散体,所述固体分散体由普拉沙星、肠溶载体组成;所述肠溶载体包括肠溶材料和抑晶剂。
7.所述普拉沙星与肠溶载体的用量比为1:2-3,优选为1:2-2.5;所述肠溶载体中肠溶材料和抑晶剂的用量比为5-8:1,优选为6:1。
8.所述肠溶材料为醋酸羟丙甲纤维素琥珀酸酯(hpmc-as)、羟丙基纤维素酞酸酯
(hpmcp)、丙烯酸树脂eudragit l100中的一种或一种以上组合;优选肠溶材料为醋酸羟丙甲纤维素琥珀酸酯。
9.所述抑晶剂为羟丙甲纤维素、羟丙纤维素、乙基纤维素、共聚维酮va64、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物中的一种或一种以上组合;优选抑晶剂为聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物。
10.本发明第二方面,提供了所述普拉沙星肠溶固体分散体的制备方法,具体步骤为:
11.(1)将普拉沙星、肠溶载体溶于有机溶剂中,超声至完全澄清,得混合溶液;
12.(2)将混合溶液加入喷雾干燥机内,经喷雾干燥处理,室温真空干燥,除去残留溶剂,过筛,即得。
13.步骤(1)中所述有机溶剂的体积量为普拉沙星原料和肠溶载体总质量的2~4倍。
14.步骤(1)中所述有机溶剂为甲醇、乙醇、异丙醇、二氯甲烷、丙酮、四氢呋喃、乙酸乙酯、氯仿、乙腈中的一种或一种以上组合,优选为二氯甲烷。
15.步骤(1)中所述普拉沙星为普拉沙星晶型,其xrd粉末衍射图谱如图1所示。
16.步骤(2)中所述喷雾干燥的操作参数包括:进口温度为50~80℃,出口温度为45~50℃,进样速度为5~10ml/min,雾化压力0.1~0.3mpa。
17.本发明第三方面,提供了一种普拉沙星肠溶制剂,所述普拉沙星肠溶制剂由普拉沙星的肠溶固体分散体与辅料混合后,制备成制剂使用。
18.所述普拉沙星肠溶制剂的制剂类型包括普拉沙星肠溶胶囊、普拉沙星肠溶颗粒、片剂等。
19.优选地,所述普拉沙星肠溶制剂为片剂,用量为每单位剂量15~120mg。
20.所述普拉沙星肠溶制剂中各组分及其所占重量百分比为:普拉沙星肠溶固体分散体30~60%、填充剂30~55%、崩解剂5~20%、矫味剂3~20%、润滑剂0.5~2%。
21.优选地,所述普拉沙星肠溶制剂中各组分及其所占重量百分比为:普拉沙星肠溶固体分散体30~40%、填充剂35~50%、崩解剂5~10%、矫味剂5~15%、润滑剂0.5~1.5%。
22.更优选地,所述普拉沙星肠溶制剂中各组分及其所占重量百分比为:普拉沙星固体分散体35%、填充剂45%、崩解剂6%、矫味剂13%、润滑剂1%。
23.所述填充剂选自玉米淀粉、预胶化淀粉、土豆淀粉、乳糖、蔗糖、微晶纤维素、糊精、倍他环糊精、硫酸钙、碳酸氢钙、磷酸氢钙中的一种或几种。优选地,所述填充剂选自玉米淀粉、预胶化淀粉、乳糖、微晶纤维素、倍他环糊精、碳酸氢钙中的一种或几种。更优选地,所述填充剂选自乳糖、微晶纤维素。
24.所述崩解剂选自交联聚维酮、低取代基羟丙基纤维素、羟丙基淀粉、羧甲基淀粉钠、交联羧甲基纤维素钠中的一种或几种。优选地,所述崩解剂选自交联羧甲基纤维素钠、交联聚维酮中的一种或几种。
25.所述矫味剂选自鸡肝粉、猪肝粉、大豆蛋白粉、牛肉味香精、犬用粉状风味剂、阿斯巴甜中的一种或几种。优选地,所述矫味剂选自鸡肝粉、大豆蛋白粉、牛肉味香精、犬用粉状风味剂、阿斯巴甜中的一种或几种。
26.所述润滑剂选自硬脂酸镁、氢化蓖麻油、滑石粉、聚乙二醇6000、山嵛酸甘油酯中的一种或一种以上组合。优选地,所述润滑剂选自硬脂酸镁、山嵛酸甘油酯、聚乙二醇6000、
滑石粉中的一种或几种。
27.本发明所述的普拉沙星肠溶制剂,可采用粉末直接压片法或干法制粒工艺制备。两种方法均可显著降低生产成本,大大提高溶出度,设备要求低,可实现工业化生产。
28.本发明具有以下突出的有益效果:
29.(1)本发明采用喷雾干燥技术制备肠溶性固体分散体,喷雾干燥技术工艺简单、效率高、混合均匀、分散效果好、回收率高,节省空间和降低成本,适用于工业化大规模生产。
30.(2)本发明在普拉沙星肠溶固体分散体的制备过程中,普拉沙星晶型原料转变成为无定型态,提高了普拉沙星的溶解度。通过加入抑晶剂,可以避免固体分散体在长期放置过程中存在由无定型态转变为晶体态,同时可以维持固体分散体溶液的过饱和状态,防止结晶析出,从而保证制剂的稳定性。
31.(3)本发明制备的普拉沙星肠溶固体分散体,药物在胃中少量释放,药物不经胃酸破坏,并且减小了药物对胃的刺激性,药物主要在肠道溶解和释放,延长药效,提高生物利用度。
附图说明
32.图1普拉沙星原料x-射线衍射图谱;
33.图2普拉沙星固体分散体(实施例1)x-射线衍射图谱。
具体实施方式
34.以下结合附图和实施例对本发明作进一步详细说明,但不应该将此理解为上述主题的范围仅限于以下实施例。凡基于本发明内容所实现的技术均属于范围内。
35.实施例1一种普拉沙星肠溶制剂及其制备方法
36.普拉沙星肠溶制剂含有的各成分的重量百分比为:
[0037][0038]
普拉沙星肠溶制剂的制备方法:
[0039]
(1)肠溶固体分散体的制备:将各原辅料过80筛,备用;称取处方量普拉沙星、醋酸羟丙甲纤维素琥珀酸酯、聚乙烯己内酰胺-聚乙酸乙烯酯-聚乙二醇接枝共聚物,溶于3倍量的二氯甲烷中,超声至完全澄清,得混合溶液;将混合溶液加入到喷雾干燥机内,经喷雾干燥处理,进口温度为70℃,出口温度为50℃,进样速度为5ml/min,雾化压力0.1mpa,得到的
产物经24h室温真空干燥,除去残留溶剂,过50目筛网,即得。
[0040]
(2)普拉沙星肠溶片的制备:将制得的肠溶固体分散体与乳糖、微晶纤维素、交联羧甲基纤维素钠、鸡肝粉、硬脂酸镁混合均匀,压片,即得。
[0041]
实施例2一种普拉沙星肠溶制剂及其制备方法
[0042]
普拉沙星肠溶制剂含有的各成分的重量百分比为:
[0043][0044]
普拉沙星肠溶制剂的制备方法:
[0045]
(1)肠溶固体分散体的制备:将各原辅料过80筛,备用;称取处方量普拉沙星和丙烯酸树脂eudragit l100和羟丙甲纤维素,溶于3倍量的二氯甲烷中,得混合溶液;将混合溶液加入到喷雾干燥机内,经喷雾干燥处理,进口温度为70℃,出口温度为50℃,进样速度为6ml/min,雾化压力0.1mpa,得到的产物经24h室温真空干燥,除去残留溶剂,过50目筛网,即得。
[0046]
(2)普拉沙星肠溶片的制备:将制得的肠溶固体分散体与玉米淀粉、交联聚维酮、大豆蛋白粉、牛肉味香精、山嵛酸甘油酯混合均匀,压片,即得。
[0047]
实施例3一种普拉沙星肠溶制剂及其制备方法
[0048]
普拉沙星肠溶制剂含有的各成分的重量百分比为:
[0049][0050]
普拉沙星肠溶制剂的制备方法:
[0051]
(1)肠溶固体分散体的制备:将各原辅料过80筛,备用;称取处方量普拉沙星、丙烯酸树脂eudragit l100、共聚维酮va64,溶于3倍量二氯甲烷中,得混合溶液;将混合溶液加
入到喷雾干燥机内,经喷雾干燥处理,进口温度为70℃,出口温度为50℃,进样速度为6ml/min,雾化压力0.1mpa,得到的产物经24h室温真空干燥,除去残留溶剂,过50目筛网,即得。
[0052]
(2)普拉沙星片的制备:将制得的肠溶固体分散体与预胶化淀粉、硫酸氢钙、交联聚维酮、犬用粉状风味剂、鸡肝粉和聚乙二醇6000混合均匀,压片,即得。
[0053]
实施例4一种普拉沙星肠溶制剂及其制备方法
[0054]
普拉沙星肠溶制剂含有的各成分的重量百分比为:
[0055][0056]
普拉沙星肠溶制剂的制备方法:
[0057]
(1)肠溶固体分散体的制备:将各原辅料过80筛,备用;称取处方量普拉沙星和羟丙基纤维素酞酸酯、共聚维酮va64,加入3倍量的二氯甲烷,得混合溶液;将混合溶液加入到喷雾干燥机内,经喷雾干燥处理,进口温度为70℃,出口温度为50℃,进样速度为5ml/min,雾化压力0.2mpa,得到的产物经24h室温真空干燥,除去残留溶剂,过50目筛网,即得。
[0058]
(2)普拉沙星肠溶颗粒的制备:将制得的肠溶固体分散体与预胶化淀粉、倍他环糊精、交联羧甲基纤维素钠、猪肝粉、阿斯巴甜、硬脂酸镁混合均匀后,经干法制粒机,进行成适宜大小的颗粒。
[0059]
实施例5一种普拉沙星肠溶制剂及其制备方法
[0060]
普拉沙星肠溶制剂含有的各成分的重量百分比为:
[0061][0062]
普拉沙星肠溶制剂的制备方法:
[0063]
(1)肠溶固体分散体的制备:将各原辅料过80筛,备用;称取处方量普拉沙星和醋酸羟丙甲纤维素琥珀酸酯、羟丙纤维素,加入3倍量的二氯甲烷,得混合溶液,将混合溶液加入到喷雾干燥机内,经喷雾干燥处理,进口温度为70℃,出口温度为50℃,进样速度为8ml/min,雾化压力0.2mpa,得到的产物经24h室温真空干燥,除去残留溶剂,过50目筛网,即得。
[0064]
(2)普拉沙星肠溶胶囊的制备:将制得的肠溶固体分散体与微晶纤维素、碳酸氢钙、交联羧甲基纤维素钠、猪肝粉、牛肉味香精、滑石粉混合均匀后,经干法制粒机,进行成适宜大小的颗粒。然后进行装囊得到胶囊。
[0065]
对比例1一种普拉沙星肠溶制剂
[0066]
普拉沙星肠溶制剂含有的各成分的重量百分比如下,制备方法如实施例3:
[0067][0068][0069]
对比例2一种普拉沙星肠溶制剂及其制备方法
[0070]
对比例2采用国外批准的处方,压片为普通片剂:
[0071][0072]
实施例6饱和溶解度测定
[0073]
参考《中华人民共和国兽药典》(2020年版)中溶解度的测定方法,配制磷酸缓冲液(ph=6.8),分别配制普拉沙星原料、实施例1-5、对比例1和对比例2的饱和溶液(5mg/ml),置于振荡器中分别振摇1h,6h,过滤取续滤液测定含量,计算溶解度。
[0074]
表1各实验组在磷酸缓冲液(ph=6.8)中的溶解度
[0075]
实验组1h溶解度(mg/ml)6h溶解度(mg/ml)普拉沙星0.0640.065实施例10.8570.849实施例20.6250.617
实施例30.5980.601实施例40.6210.614实施例50.5670.547对比例10.5870.143对比例20.0850.087
[0076]
结果分析:由表1可知,实施例1-5制备的固体分散体,相对于普拉沙星原料的溶解度均有不同程度的增加,增加倍数8.86~13.39倍,而对比例2制剂中普拉沙星的溶解度未见大幅度提高。说明本发明制备的固体分散体均起到了增加溶解度的作用。对比例1溶解度虽有大幅度提高,但继续振摇至6h时,溶解度下降,原因为对比例1中未添加抑晶剂,无法维持原料的过饱和状态,原料产生析晶,溶解度下降。
[0077]
实施例7普拉沙星肠溶制剂溶出量测定
[0078]
(1)酸中溶出量测定:参考《中华人民共和国兽药典》(2015年版)一部附录0931溶出量与释放度测定法第二法(浆法)肠溶制剂方法测定:取实施例1-5以及对比例1-2所制备的片剂,投入溶出仪内,以0.1mol/l盐酸溶液900ml为溶出介质,温度恒定于(37.0
±
0.5)℃,转速50r/min,依法操作。于5,15,30,45,60,90,120min时,取溶液10ml,过滤,取续滤液作为供试品溶液;同时取普拉沙星对照品,精密称定,加甲醇溶液并稀释制成每1ml含5μg的溶液,作为对照品溶液,检测波长290nm,用高效液相色谱法检测滤液中普拉沙星的溶出量。
[0079]
(2)缓冲液中溶出量测定:以磷酸缓冲液(ph=6.8)900ml为溶出介质,温度恒定于(37.0
±
0.5)℃,桨法,转速50r/min,同酸中溶出量测定操作。于5,15,30,45,60,90,120min时,取溶液10ml,过滤,取续滤液作为供试品溶液;同时取普拉沙星对照品,精密称定,加甲醇溶液并稀释制成每1ml含5μg的溶液,作为对照品溶液,检测波长290nm,用高效液相色谱法检测滤液中普拉沙星的溶出量。
[0080]
试验结果如表2、3所示。
[0081]
表2普拉沙星固体分散体在0.1mol/l盐酸溶液中的溶出度
[0082]
取样时间5min15min30min45min60min90min120min实施例13.22%4.06%6.42%7.55%8.12%8.16%8.21%实施例23.41%5.36%6.76%7.38%8.22%8.29%8.31%实施例33.06%3.84%6.11%7.08%7.96%7.95%8.05%实施例43.67%4.46%6.88%7.56%8.65%8.62%8.74%实施例54.80%5.73%6.12%7.01%8.12%9.43%9.54%对比例13.17%4.10%5.68%7.89%8.11%9.23%11.05%对比例238.9%54.7%68.98%72.30%74.82%72.92%75.11%
[0083]
表3普拉沙星固体分散体在磷酸缓冲液(ph=6.8)中的溶出百分数
[0084]
取样时间5min15min30min45min60min90min120min实施例17.76%22.42%62.30%92.65%92.72%97.16%99.45%实施例28.64%21.85%67.82%88.40%90.25%95.77%101.21%实施例39.28%23.26%64.52%82.18%94.62%97.28%100.33%实施例48.24%22.26%62.46%81.43%93.86%96.57%98.78%实施例57.89%19.38%62.33%85.45%89.76%95.74%98.66%
对比例110.12%25.41%58.74%81.23%91.56%87.24%74.57%对比例242.51%62.88%74.52%75.14%78.52%77.32%78.23%
[0085]
结果讨论:由表2、3可知,本发明普拉沙星固体分散体在0.1mol/l盐酸溶液中120min内的溶出百分比不超过10%,而对比例2在盐酸中快速溶出,可见所制备的固体分散体均可以起到防止药物在酸中溶出的作用。在磷酸缓冲液(ph=6.8)中60min的溶出百分比大于85%,符合中国药典附录肠溶制剂项下释放度的要求,且固体分散体制备的片剂,因增加了药物的溶解度,均达到了完全溶出,对比例1中,溶出曲线呈现“降落伞”式,可见处方中未加入抑晶剂,无法保障过饱和状态,原料产生析晶,溶出度下降。而对比例2中溶出度,因普拉沙星自身溶解度较低,未达到漏槽条件,因此均未完成溶出。
[0086]
实施例8稳定性考察
[0087]
长期加速考察:取实施例1、实施例2、实施例3和对比例1的肠溶片分别置于25℃,rh75%的条件下进行长期加速试验,其稳定性结果如下:
[0088]
表4长期加速稳定性试验结果
[0089][0090]
由表4可知,由于对比例1中没有添加抑晶剂,在长期稳定性考察中,溶出度有下降的趋势非常显著,原因可能是固体分散体中的普拉沙星由无定型态重新结晶,造成溶解度下降。而其他实施例中均添加了抑晶剂,其中实施例1、2效果佳,溶出度未见下降。
[0091]
实施例9x-射线衍射法(xrd)测定
[0092]
采用x-射线衍射法对普拉沙星原料和制备的普拉沙星固体分散体(实施例1)的晶型衍射峰进行测定,工作参数:扫描范围4-40℃,步长0.02
°
,扫描速度0.2s/step。结果如图1、图2所示。
[0093]
结果:可见制备的固体分散体中普拉沙星由结晶态转变为无定形态。
[0094]
实施例10普拉沙星固体分散体生物利用度
[0095]
比格犬12只(11~13月龄,体重10~12kg,雌雄各半),自由饮水、采食,临床观察1周后,做常规体检功能正常,临床健康者用于试验。随机分为2组,试验前16h起至给药后4h间禁食,仅自由饮水。
[0096]
6只比格犬以6mg/kg体重剂量,经口一次性内服给予药品实施例1的普拉沙星固体分散体片。另外6只以6mg/kg体重剂量给予对比例2的普拉沙星普通片,给药前及给药后分
别在0.25、0.5、1、1.5、2、2.5、3、4、5、6、8、10、12、24、36、48、60和72h,臂头静脉采血2.5ml。血样置于肝素抗凝的聚丙烯离心管中,3800rpm离心10min,吸取上层血清,-20℃保存。
[0097]
血浆样品处理300μl血浆加入15μl磷酸和60μl乙腈,2000rpm涡旋5min,15000rpm离心10min,吸取上清液,过0.22μm滤膜进样。色谱条件:c
18
色谱柱,250
×
4.6mm,流动相:1g庚烷磺酸钠和1g磷酸二氢钾溶于1l水中,用磷酸调节ph值至2.5,然后与乙腈配制成77:23的溶液,0.22μm滤膜滤过,超声脱气。检测波长290nm,进样量10μl。
[0098]
表5药代动力学试验结果
[0099]
参数实施例1普拉沙星固体分散体片对比例2普拉沙星普通片t
1/2d
(min)477
±
4.33335
±
1.28auc(μg
·
h/ml)5.16
±
1.022.35
±
1.65c
max
(μg/ml)4.50
±
0.863.22
±
0.88t
max
(min)118
±
1.2696
±
2.10mrt(h)10.32
±
1.048.63
±
1.05
[0100]
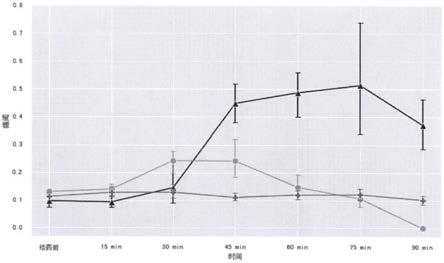
由表5数据可知,实施例1普拉沙星固体分散体片比对比例2普拉沙星普通片的生物利用度高约2.20倍,因此,普拉沙星固体分散体片与普拉沙星普通片相比,药时曲线下面积auc高,表明经过固体分散技术处理过后生物利用度提高。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。