1.本发明属于诊断领域,更具体地,本发明涉及用于诊断肝细胞癌易感性的试剂盒及其应用。
背景技术:
2.原发性肝细胞癌(hcc)是中国常见恶性肿瘤之一,为居民肿瘤死亡的第二位。乙肝病毒(hbv)慢性感染是导致中国肝癌高发的首要原因,中国hcc患者中90%以上有慢性乙肝史,hbv表面抗原(hbsag)阳性者罹患肝癌的风险是阴性者的12倍左右。hbv感染是严重的公共卫生问题,全球携带者达2.48亿。在中国,hbv感染的现况虽随乙肝疫苗的普遍接种已得到改善,但感染人数仍有7400万左右,高居中国法定传染病的首位。虽然这些人均为hcc的高危人员,但他们中间发生肝癌的风险度仍有差异。hbv基因型、hbv dna拷贝数、hbv突变等病因因素,与感染者发生hcc的风险存在着很大的关联度。
3.hbv是一种嗜肝dna病毒,基因组含4个开放读码区(open reading frame,orf),分别为前s/s区、p区、x区和前c/c区。除此之外还有多个基因表达调控序列,包括2个直接重复序列(dri、drii)、2个增强子(eni、enii)和4个启动子(sp1、sp2、xp和cp)。前s/s基因编码病毒包膜大蛋白、中蛋白和小蛋白;前c/c基因用于编码病毒的核心抗原(hbcag)和e抗原(hbeag);p和x区分别合成dna聚合酶和hbv x蛋白。由于hbv复制需要经过一特殊的逆转录过程,而其逆转录酶又缺乏校读功能,故较其它dna病毒hbv更易发生突变。一般认为活动性乙肝患者体内每天hbv基因组的点突变频率可高达10。前s区缺失突变、前s2终止密码子突变、hbv增强子ii(enhancer ii,enh ii)/基本核心启动子(basal core promoter,bcp)突变和前c区突变等与hcc的相关性,已受到了国内外学者的广泛研究,并被认为相关。然而迄今为止,对hbv p基因突变与肝癌发生的关系研究甚少。
4.p基因是最长的开放读框,与其他三个均有重叠,p基因的结构及其在hbv基因组中的相对位置见图1。p基因编码hbv聚合酶,全长2532个核苷酸,共编码843个氨基酸,是hbv进行正常病毒复制的物质基础,与其致病性密切相关,也是常用的核苷类似物抗病毒治疗的主要作用靶位。根据所编码的蛋白功能域的不同,p基因从5’端到3’端可分为4个区段,即末端蛋白(terminal protein,tp)区、间隔(spacer domain,sd)区、逆转录酶(reverse transcriptase,rt)区及核糖核酸酶(rnase h)区,分别编码多聚酶蛋白的末端蛋白、反转录酶/dna聚合酶及rn酶h。逆转录酶rt区具有反转录酶及dna聚合酶活性,是p蛋白的主要功能区。hbv rt区还可进一步划分为7个主要的功能域,即a-g区。目前关于p基因变异的报道多为临床上应用核苷类似物抗病毒后出现耐药突变的研究,主要见于rt片段(p蛋白347~690aa,或rt1~rt344),如在拉米夫定的抗病毒治疗中,最常见的是ymdd(酪氨酸-甲硫氨酸-天冬氨酸-天冬氨酸)变异,即由ymdd变异为yidd(rtm204i)或yvdd(rtm204v),并常伴随rtl180m变异。p基因变异与hcc相关性的报道仍极少。本发明人前期已经对hbv p基因与hcc的关系做了一定的研究,发现了一些与肝癌高发的突变位点,如a799g、a987g、g1229a、c1230g等(专利号:zl201310139142.1)。
5.但是,为了实现更为全面的检测,提高检测的查出率,本领域还需要针对病毒自然变异与肝癌发生的相关性进行深入的研究,进一步确定导致发病的新的因素或新的基因突变位点。
技术实现要素:
6.本发明的目的在于提供用于诊断肝癌易感性的试剂盒及其应用。
7.在本发明的第一方面,提供一种用于分析受试者肝癌易感性或用于诊断/预后的试剂盒,它包括:(1)扩增含有乙型肝炎病毒基因组第300位碱基序列的引物,或与乙型肝炎病毒基因组第300位为碱基“g”的序列结合的探针;和/或,(2)扩增含有乙型肝炎病毒基因组第2468位碱基序列的引物,或与乙型肝炎病毒基因组第2468位为碱基“c”的序列结合的探针。
8.在一个优选例中,(1)中所述的引物包括:seq id no:2、seq id no:3和seq id no:4所示序列的引物对,用于扩增含有乙型肝炎病毒基因组第300位碱基的序列。
9.在另一优选例中,(2)中所述的引物包括:seq id no:5、seq id no:6和seq id no:7所示序列的引物对,用于扩增含有乙型肝炎病毒基因组第2468位碱基的序列。
10.在另一优选例中,所述的探针连接有可检测信号;或所述探针被固定于芯片上。
11.在另一优选例中,所述的试剂盒中还包括:阳性控制探针。
12.在另一优选例中,所述的试剂盒中还包括:所述阳性控制探针是与乙型肝炎病毒基因组保守性序列结合的探针,待测样品中有乙型肝炎病毒的dna存在时呈现阳性。
13.在另一优选例中,所述的试剂盒中还包括:核酸提取试剂,dna聚合酶,pcr缓冲液。
14.在另一优选例中,所述的试剂盒中还包括:使用说明书。
15.在另一优选例中,所述的试剂盒为用于分析来自中国启东或其邻近地区的受试者的肝癌易感性或用于诊断/预后的试剂盒。
16.在本发明的另一方面,提供试剂组合的在制备用于分析受试者肝癌易感性或用于诊断/预后的试剂盒中的用途,其中,所述试剂组合为:(1)扩增含有乙型肝炎病毒基因组第300位碱基序列的引物,或与乙型肝炎病毒基因组第300位为碱基“g”的序列结合的探针;和,(2)扩增含有乙型肝炎病毒基因组第2468位碱基序列的引物,或与乙型肝炎病毒基因组第2468位为碱基“c”的序列结合的探针。
17.在一个优选例中,(1)中所述的引物包括:seq id no:2、seq id no:3和seq id no:4所示序列的引物对,用于扩增含有乙型肝炎病毒基因组第300位碱基的序列。
18.在另一优选例中,(2)中所述的引物包括:seq id no:5、seq id no:6和seq id no:7所示序列的引物对,用于扩增含有乙型肝炎病毒基因组第2468位碱基的序列。
19.在本发明的另一方面,提供一种体外检测乙型肝炎病毒基因组变异的方法,所述的方法包括以下步骤:检测该核酸样品的乙型肝炎病毒基因组,并与野生型的乙型肝炎病毒基因组比较,存在选自以下变异形式就表明该个体乙型肝炎病毒基因组存在核苷酸变异:乙型肝炎病毒基因组第300位,g
→
g;和/或,乙型肝炎病毒基因组第2468位,t
→
c。
20.在一个优选例中,利用选自下组的引物进行检测:seq id no:2、seq id no:3和seq id no:4所示序列的引物对,用于扩增含有乙型肝炎病毒基因组第300位碱基的序列。
21.在一个优选例中,利用选自下组的引物进行检测:seq id no:5、seq id no:6和
seq id no:7所示序列的引物对,用于扩增含有乙型肝炎病毒基因组第2468位碱基的序列。
22.在另一优选例中,所述的体外检测乙型肝炎病毒基因组变异的方法为不以获得疾病的状况为目的的方法,或为非诊断或治疗型的方法。
23.本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
24.图1、p基因的结构及其在hbv基因组中的相对位置。
25.图2、hbv p基因片段的pcr扩增。左图:a片段;右图:b片段。
26.图3、hbv p基因突变。
具体实施方式
27.本发明人致力于探索肝癌hbv变异位点与肝癌发生关系,通过对肝癌患者基因的测序分析筛选新的与肝癌发生密切相关的突变位点,为肝癌的高危筛选、预防和干预提供优化的选择。在本发明人之前的研究的基础上,本发明人进一步在乙型肝炎病毒基因组的p基因中发现了两个与hcc存在显著相关的基因突变,即c300g和t2468c(位点以病毒基因组序列计)。可将本发明揭示的新位点的变异作为肝癌易感性标志,设计特异性检测所述突变位点的试剂或试剂盒。在此基础上完成了本发明。
28.如本文所用,术语“乙型肝炎病毒p区”来自乙型肝炎病毒的一段多核苷酸,其野生型核苷酸序列为seq id no:8所示。
29.如本文所用,本发明感兴趣的“肝癌相关的乙型肝炎病毒p区变异”指乙型肝炎病毒基因组第300、2468位碱基突变;更具体的是第300位c
→
g(简写为c300g)、第2468位t
→
c突变(简写为t2468c);所述变异发生于p区,分别相应于p基因序列的第1209位、第162位。
30.应理解,所述的变异可以是一个位点的突变,也可以是2个位点的突变的组合。在本发明的尤其优选的方式中,以第300位和第2468位的碱基的变异情况作为联合用于诊断的靶点。
31.在本发明的进一步优选的方式中,在运用本发明优选的突变位点进行判断的情况下,还包括以选自g1899a、t1055a、a1479v、a799g、a799g、a987g、a904t、c955t、g2489a、c294a、t895a、g1229a、c1230g(位点以病毒基因组序列计)等的变异情况作为进一步与前述位点联合用于诊断的靶点,以进一步提高检测的准确性,避免漏检。
32.基于本发明人的新发现,可以将以上列举的乙型肝炎病毒p区碱基的相关突变作为标志,从而:从乙型肝炎病毒阳性的人群中分离出对于肝癌易感性的人群,或作为肝癌疾病的鉴别诊断、和/或易感性分析的辅助性工具;早期评估相关人群肝癌患病风险。
33.例如,可从乙型肝炎病毒阳性患者人群中分离出乙型肝炎病毒基因组第300位、第2468位碱基发生突变的人群,作为肝癌的高危人群,从而达到早期监测早期预防的目的。
34.此外,还可通过进一步检测乙型肝炎病毒p区其它位点的突变情况来评估肝癌易感性,包括进一步运用本发明实施例中所论证的一些位点以及现有已知的一些位点。所述突变在肝癌患者中的发生比例显著高于慢性肝炎患者中的比例。
35.基于本发明人的上述发现,可采用各种技术来检测乙型肝炎病毒基因组第300位、
第2468位碱基的突变情况,这些技术均包含在本发明中。例如,对相关位点进行序列测定,从而判断是否发生变异。
36.在检测相关位点的变异时,检测可以针对cdna,也可针对基因组dna。可用已有的技术如southern印迹法、dna序列分析、pcr和原位杂交检测突变。另外,突变有可能影响蛋白的表达,因此可用例如western印迹法间接判断基因有无突变。
37.此外,可用相关位点特异的引物进行聚合酶链反应(pcr)来进行体外鉴定;或者可根据相关位点设计可特异性结合的探针来进行体外鉴定;或者可利用特异性的限制性内切酶来进行体外鉴定。
38.作为一种优选的方式,利用特异性的探针可对扩增产物进行特异性检测。较佳地,所述的探针是带有可检测标记的探针,如荧光探针。例如,所述的探针是taqman mgb探针,从而便于实时荧光检测。taqman探针法的核心是利用taq酶的5
′→3′
外切核酸酶活性,切断探针,产生荧光信号。由于探针与模板是特异性结合,所以荧光信号的强弱就代表了模板的数量。taqman探针根据其3
′
端标记的荧光淬灭基团的不同可包括两种:普通的taqman探针和taqman mgb探针。taqman mgb探针的淬灭基团采用非荧光淬灭基团(non-fluorescent quencher),本身不产生荧光,可以大大降低本底信号的强度。同时探针上还连接有mgb(minor groove binder)修饰基团。例如,可以选择fam荧光信号或rox荧光信号。
39.作为一种可选的方式,还可采用基于pcr技术的单碱基延伸技术来检测变异位点,其原理是设计一条引物,位于待测变异位点的上游,并且该引物的3’端距离变异位点一个碱基。加入不同荧光标记的ddntp进行反应,只有当加入的ddntp与变异位点碱基互补时,引物才得以延伸。可通过检测延伸碱基所发出的荧光来判断变异的类型。
40.作为本发明的优选方式,可结合已知的pcr-斑点印迹杂交技术,建立一种能在较短时间内检测和分析hbv基因组p区基因突变的方法。
41.本发明还提供了用于在分析物中检测是否含有所述变异位点的试剂。所述的试剂例如是:对相关突变位点特异的引物;对相关突变位点特异的探针;或对相关突变位点特异的限制性内切酶。
42.本发明还提供了用于在分析物中检测是否含有所述变异位点的试剂盒,该试剂盒包括:
43.装在适当容器中的、用于扩增含有乙型肝炎病毒基因组第300位、第2468位碱基序列的引物。
44.作为本发明的优选方式,当应用探针进行检测时,可以在探针上设置可检测信号,从而便于进行扩增产物的识别,所述的可检测信号例如是荧光信号、染料信号、显色剂信号。作为本发明的一种实施方式,所述的可检测信号是生物素,基于生物素作为显色标记的原位杂交技术已经是本领域技术人员熟知的技术。
45.当所述试剂盒中含有针对多于一个位点变异情况的检测试剂时,检测或评估的准确性可能提高。
46.作为本发明的可选择的方式,所述的试剂盒中可包括:特异性与乙型肝炎病毒基因组第300位、第2468位碱基发生变异的基因产物结合且不结合于相关位点未突变的基因产物的抗体。更优选的,所述试剂盒中还包括常规的可用于检测抗原抗体结合状况的试剂。
47.在本发明的优选方式中,提供了优选的用于检测所述变异的检测试剂(引物)。本
发明所述的检测试剂,并不会因体系复杂而导致假阳性以及假阴性,特异性和灵敏度均非常理想。
48.本发明的引物和/或探针还可以用放射性同位素、生物素、酶、荧光素或其他化学发光物质进行标记。
49.此外,所述的试剂盒中还可包括其它用于鉴定的试剂,包括如(但不限于):
50.(a)各种pcr反应用试剂,例如但不限于:taq酶,pcr缓冲液,dntp,dna聚合酶等;或
51.(b)各种提取dna(即制备pcr反应模板)所需的试剂,例如但不限于:酚、氯仿、异戊醇、nacl等;或
52.(c)提取核酸的试剂盒。
53.此外,所述的试剂盒中还可包括鉴定所述突变位点的使用说明书和/或芯片图像分析软件等。
54.从应用角度看,乙型肝炎的感染是最常见的公共卫生问题之一,目前全球有近20亿人感染hbv,其中3.6亿人为慢性感染者。原发性肝细胞肝癌(以下简称肝癌)是一种死亡率居全球第三位的常见恶性肿瘤。调查数据显示,约75%~80%的肝癌发生与hbv感染有关。江苏启东地区是全球闻名的肝癌高发区之一,也是进行与肝癌高发相关因素研究的重要现场。通过对在启东地区建立的自然人群前瞻队列资料中,乙型肝炎表面抗原(hbsag)与肝癌关系进行的长期随访观察,发现男性hbsag( )者与(-)者肝癌的发生率分别为661.57/10万与53.78/10万,rr为12.30;而女性hbsag( )者与(-)者肝癌的发生率分别为183.25/10万与17.52/10万,rr为10.46,差异均有显著性,由此可见,在启东地区,hbv与肝癌发生也存在着很大的关联强度。日益增多的研究表明,hbv的生物学特性(包括基因型、血清型及基因变异等)与病毒感染后的临床进展密切相关。由于hbv复制需要经过一特殊的逆转录过程,而其逆转录酶(reverse transcriptase,rt)又缺乏校读功能,故较其它dna病毒hbv更易发生突变。一般认为活动性乙肝患者体内每天hbv基因组的点突变频率可高达10
10-11
。hbv dna序列的突变,可能会帮助病毒逃避宿主免疫系统清除而在宿主体内持续存在,导致hbv慢性感染,肝细胞损伤加重,甚至肝癌的发生。本发明对于突变位点的确定,有利于为研究肝癌发生发展提供有用的靶点,进一步研究针对本发明的突变相关的肝癌的治疗药物。
55.本发明的主要优点在于:
56.(1)通过大规模地对乙型肝炎或肝癌发病人群进行研究,发现并证实肝癌发生相关的新的变异位点,研究病例多,准确性高。
57.(2)首次针对新的变异位点,设计出特异性的检测试剂和试剂盒,为早期评估相关人群肝癌患病风险提供了新的途径。
58.(3)基于早期检测结果,对于携带新的变异位点的乙型肝炎病毒携带者个体,可采取加强随访和复查等手段,以便能够尽早确诊和治疗。并开发新的可用于肝癌预测以及早期(辅助性)诊断的检测试剂或试剂盒。
59.(4)本发明的技术方案通过多达超过20年的人群跟踪分析而获得,结果准确可靠。
60.(5)本发明的技术方案尤其对于特定人群,特别是中国江苏启东或邻近地区的人群具有诊断和预后的意义。
61.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条
件如j.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
62.基因信息
63.hbv基因组为环形,共3215个碱基。hbv基因组序列如下(seq id no:1):
64.[0065][0066]
p基因位于hbv基因组nt.2307-1623(hbv环形基因组共3215个碱基,p基因从2307位的atg开始,到了第3215位后继续再从第1位走到第1623位的tga结束),共2532个碱基。具体如下(seq id no:8):
[0067]
[0068][0069]
根据上述,突变位点c300g为根据病毒基因组序列计第300位(相应于p基因序列的第1209位);突变位点t2468c为根据病毒基因组计第2468位(相应于p基因序列的第162位)。
[0070]
实施例1、检测位点的确定及其检测方法和试剂
[0071]
1、病例
[0072]
用于病例-对照研究的血清来源于中国启东肝癌高发区1996年至2012年期间收集的样本,其中hcc患者血清229例,慢性乙肝对照血清235例。实验组合对照组的年龄、性别匹配,无统计学差异(p》0.05)。所有病例hbsag及hbv dna均为阳性,并无合并丙型肝炎病毒感染。肝癌的诊断符合中国《原发性肝癌诊疗规范》(2017年版)。研究经启东肝癌研究所伦理委员会通过。患者知情同意。
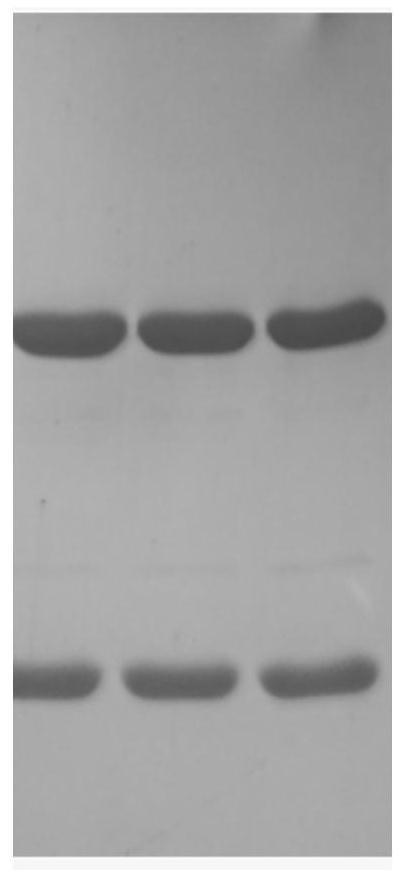
[0073]
2、血清hbv dna的提取
[0074]
通过蛋白酶k消化/酚-氯仿-异戊醇法抽提血清乙肝病毒dna的方法,具体如下:
[0075]
(1)吸取血清100μl,加入400μl血清裂解液(10mm tris-hcl,ph 8.0,1mm edta,100mm nacl,0.5%sds,120μg/ml蛋白酶k),颠倒混匀,于50℃水浴消化4小时。
[0076]
(2)加入等体积的酚/氯仿/异戊醇(体积比为25:24:1),颠倒混匀5min,室温8,000rpm离心15min,将上清转移至另一个eppendorf管中。
[0077]
(3)加入1/10体积的3m乙酸钠(ph 5.2)及2倍体积的无水乙醇,充分混匀后于-20℃放置过夜,沉淀dna。
[0078]
(4)4℃,12,000rpm离心10min,弃上清。
[0079]
(5)加入1ml 75%乙醇洗涤沉淀,4℃,12,000rpm离心15min,吸干离心管中液体,空气干燥至乙醇挥发。
[0080]
(6)加入25μl含20μg/ml rna酶a的去离子水,于37℃水浴30min,溶解沉淀并使rna降解。
[0081]
3、hbv p基因片段的pcr扩增
[0082]
本发明主要关注p基因的两个dna片段,即片段a:nt.3123-319,含p基因的spacer区3’端和rt区5’端的dna序列,同时也重叠为hbv前s/s序列;片段b:nt.2395-2834,含p基因tp序列,同时也重叠为c基因3’末端dna序列。
[0083]
(1)pcr扩增
[0084]
以提取好的hbv dna为模板,采用半巢式pcr的方法分别扩增hbv p基因的a和b两个片段。
[0085]
片段a引物:第一轮,正向引物为3123f(5
’-
tcctcctgcctccaccaat-3’(seq id no:2),nt.3123-3141),反向引物为449r(5
’-
ccagaagaaccaacaagaag-3’(seq id no:3),nt449-430);
[0086]
第二轮,正向引物序列与第一轮正向引物(seq id no:2)相同,反向引物为319r(5
’-
ggactgcgaattttggcca-3’(seq id no:4),nt.319-301)。
[0087]
片段b引物:第一轮,正向引物为2312f(5
’-
cctatcttatcaacacttccg-3’(seq id no:5),nt.2312-2332),反向引物为2834r(5
’-
ttcccaagaatatggtgacc-3’(seq id no:6),nt2834-2815);第二轮,正向引物为2395f(5
’-
acgaaggtctcaatcgccg-3’(seq id no:7),nt.2395-2413),反向引物序列与第一轮反向引物(seq id no:3)相同。
[0088]
①
pcr反应体积为25μl,各成分终浓度为:1
×
gotaq green master mix,正、反引物各0.4μmol/l,血清hbv dna 1μl。
②
半巢式pcr 2轮扩增条件相同,均采用热启动pcr,经预变性94℃3min后,进入循环程序:94℃30sec/每个循环65℃至61℃梯度退火30sec/72℃1min,共5个循环;94℃30sec/60℃30sec/72℃1min,共30个循环;最后72℃延伸7min,获得pcr产物。
[0089]
(2)pcr产物回收
[0090]
琼脂糖凝胶电泳后应用axygen试剂盒直接回收纯化pcr产物,具体操作如下:
①
在pcr产物中加入约3个体积的buffer pcr-a(若buffer pcr-a不足100ul,加至100ul);混匀后,转移至dna制备管中,将dna制备管置于2ml离心管(试剂盒内提供)中,室温12,000rpm离心1min,弃滤液。
②
将制备管置回2ml离心管,加700ul buffer w2,室温12,000rpm离心1min,弃滤液。
③
将制备管置回2ml离心管,加400ul buffer w2,室温12,000rpm离心1min。
④
将制备管置于洁净的1.5ml离心管(试剂盒内提供)中,在制备管膜中央加25-30ul去离子水,室温静置1min。室温12,000rpm离心1min洗脱dna。
[0091]
4、pcr产物测序及序列比对
[0092]
p基因pcr产物回收后,分别以引物3123f和引物2834r,对a片段和b片段进行测序(abi 3730自动测序仪)。
[0093]
将测序结果与genbank/ddbj/embl下载的hbv标准基因型/亚型序列用以bioedit软件进行突变分析。应用spss 19.0软件进行统计分析。率的比较采用卡方检验,t≤5时,用fisher精确概率法计算概率,p值小于0.05视为有统计学差异。
[0094]
实施例2、突变与hcc相关性的分析
[0095]
1.pcr扩增结果
[0096]
以患者血清dna为模板,分半巢式pcr扩增后,1%琼脂糖凝胶电泳观察扩增片段,结果如图2所示。
[0097]
根据图2,a片段目的条带符合预期的412bp、b片段符合预期的523bp,阴性对照中均无条带扩增。在229个hcc样本中,82个a片段阳性,123个b片段阳性;在238个非hcc样本中,86个a片段阳性,133个b片段阳性。
[0098]
2.dna测序结果及突变与hcc相关性的分析
[0099]
pcr产物测序后,a片段中在nt.300位置上发现有c
→
g的突变,b片段中在nt.2468位置上有t
→
c的突变(图3)。
[0100]
上述两种突变在hcc病例及非hcc对照中的发生状况表2。在82例扩增出片段a的hcc中,6例(7.3%)发生了c300g突变,而在86例扩增出片段a的非hcc对照中,没有一例发现有这一突变现象,两者间存在着显著的统计学差异(p《0.05)。在123例扩增出b片段的hcc中,有8例(6.5%)发生了t2468c突变,而在133例扩增出片段b的非hcc对照中,仅有1例(0.75%)发生了t2468c突变,显著低于hcc组的发生率(p《0.05)。
[0101]
表2、hbv p基因突变率与肝癌相关性分析
[0102][0103]
or:比数比;ci可信区间。
[0104]
以g1899a t1055a a1479v a799g四点突变检测(auc为0.7985),进一步检测上述c300g的检测,诊断hcc的auc高达0.8093。
[0105]
以g1899a t1055a a1479v a799g四点突变检测,进一步检测上述t2468c的检测,诊断hcc的auc高达0.8158。
[0106]
以g1899a t1055a a1479v a799g四点突变检测,进一步检测上述c300g t2468c的检测,诊断hcc的auc高达0.8201。
[0107]
讨论
[0108]
慢乙肝-肝硬化-肝癌“三步曲”是hbv感染的严重结局,如未经有效干预,约30%-40%男性,8%-10%女性感染者可进展为失代偿性肝硬化或肝癌。已实施的乙肝疫苗免疫及母婴阻断措施使hbv新发感染减少,儿童及青少年hbsag流行率显著下降。但目前中国成人基本未接种乙肝疫苗,hbsag阳性率高于5%。这些hbv感染者散在于社区“健康”人群中,知晓率低,就诊时已进入肝病末期,他们应该是肝硬化/肝癌发病的重点关注人群。对其及时发现并进行适时有效干预是降低中国整体乙肝相关疾病“两率”的重要举措之一。
[0109]
hbv相关参数,如hbeag状态、hbv-dna载量、基因型、基因突变与hcc的发生有密切关系,这些参数,结合感染者的性别、年龄、家族史、糖尿病史等所构建的模型,在hcc风险评估中发挥着重大的作用。如香港学者以性别、年龄、hbv dna载量、肝硬化、a1762t/g1764a突变等5个参数构建的评分系统,预测5年和10年发生hcc的准确性auc(area under the roc)分别高达0.88和0.89,这其中病毒突变是一至关重要的预测因子,缺乏病毒突变参数的预测模型,没有一个能达到如此精准的预测效果。在本发明人前期研究中,以g1899a t1055a a1479v a799g四点突变联合诊断hcc的auc达0.7985,在结合前s区缺失等另外突变组建的评分系统,诊断hcc的auc会更高,高于甲胎蛋白afp对肝癌诊断的敏感性。这些结果提示研究hbv突变,在hcc的预警预测、早诊早治等工作中,有重要意义。
[0110]
本次发现的两个hcc相关突变,均位于hbv p基因内。nt.300位置上c
→
g的突变,在p基因的orf内,这一突变为同义突变,也即不会改变多聚酶的蛋白序列。但由于这一区域同时重叠着hbv的s基因,c300g突变在s基因的orf中,能引起小s蛋白第49位氨基酸脯氨酸
→
精氨酸的改变。hbv的s蛋白构成病毒的包膜,在s蛋白中,最为引起关注的是发生在145位甘氨酸代替精氨酸的变异,该单一变异就能引起hbsag抗原性的改变,使其不被野生型抗原所诱生的抗体中和,从而可以逃逸免疫清除在体内持续存在。这类变异在接种hbv疫苗失败者中报道较多。有关s蛋白氨基端49位及其附近的变异报道较少,尤其是与hcc相关的报道迄今尚无。本发明发现c300g在肝癌中有7.3%的突变,而非肝癌的对照中为0,具有非常显著的差异,其在hcc预测或诊断中可作为一个辅助标志物具有良好的应用价值。同样,t2468c在p基因的orf内也为一同义突变,而该位置又不重叠其他基因读码框架,这一突变的生物
学意义值得深入研究。
[0111]
总之,本发明通过hbv p基因中两个片段的序列分析,筛选出了该区域中存在的新的与hcc发生相关两个突变位点,这将为日后更为精准的hcc预警模型的建立提供参数,使中国众多的hbv感染者受益与hcc早诊早治带来的生存时间延长。
[0112]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。