采用llp2a-二膦酸盐/酯偶联物和间充质干细胞治疗炎症
1.相关申请的交叉引用
2.本技术要求2013年10月4日提交的美国临时申请号61/887,275的优先权,其 全文通过引用纳入本文用于所有目的。
[0003][0004]
背景技术:
[0005]
类风湿性关节炎(ra)会导致关节肿胀和疼痛,长时间会导致关节功能损 伤。两百万美国人患有ra。ra炎症的全身与局部作用会导致显著的全身与局 部骨损失和软骨破坏,这归因于细胞因子的活化,例如肿瘤坏死因子α(tnfα)、 白介素和巨噬细胞集落刺激因子(m-csf),其提高破骨细胞活性(huizinga和 pincus,ann.intern.med.,2010,153:itc1-1-itc1-15;scott等,lancet,2010, 376:1094-1108)并抑制骨生成。tnfα通过诱导表达nf-κb配体的受体-活化剂 (rankl)来刺激骨诱裂发生和软骨损失,并且使破骨细胞前提对 rankl(mcinnes和schett,n.engl.j.med.,2011,365:2205-2219)和使软骨降 解的酶敏化。此外,tnfα通过称为smad泛素调节因子1(smurf1)的酶影响成骨 细胞,该酶进而下调对于骨形成而言极其重要的两种其它蛋白质,smad1和 runx2(guo等,j.biol.chem.,2008,283:23084-23092)。与ra相关联的骨损失 因糖皮质激素(gc)的应用而进一步严重化,糖皮质激素仍频繁用于ra治疗 (lane和yao,ann.n.y.acad.sci.,2010,1192:81-83;lane等,j.bone miner.res., 2006,21:466-76)。然而,gc的应用造成快速骨损失,其导致高发骨折事件的风 险。
[0006]
尽管传统ra药物如nsaid和gc能够治疗症状,并且新兴种类的tnfα阻断 剂(休米拉(humira)、英利昔(remicade)和依坦西普(enbrel))能逆转疾病进程,但 该种类的药物基于生物改造形式的蛋白质,并且生产成本昂贵(chimenti等, autoimmun.rev.,2011,10:636-40l marotte和miossec,biologics,2008,2:663-9; caramaschi等,rheumatol.iint.,2006,26:209-14)。针对ra的传统的药物疗法(包 括tnfα阻断剂)主要靶向炎症,并且降低骨吸收;然而,采用生物制剂(tnf、 il-6和b细胞消耗疗法,以及jak抑制剂)的ra患者中有接近40%的疼痛和关节 炎症未见显著缓解,导致持续的骨与软骨破坏。
[0007]
骨髓中的间充质干细胞(msc)具有多谱系潜能,并且代表着间充质源性细 胞类型(包括成骨细胞、软骨细胞和脂肪细胞)的前体的混合物(owen,m.等, ciba found symp,1988,136:第42-60页;bruder,s.p.等,j cell biochem,1994, 56(3):第283-94页;prockop,d.j.,science,1997,276(5309):第71-4页)。处于各 成熟阶段的骨细胞极其依赖于细胞基质和细胞-细胞相互作用(mukherjee,s.等, j clin invest,2008,118(2):第491-504页;grzesik,w.j.和p.g.robey,j boneminer res,1994,9(4):第487-96页;vukicevic,s.等,cell,1990,63(2):第437-45 页;mbalaviele,g.等,j bone miner res,2006,21(12):第1821-7页)。
[0008]
msc表达整合素α1、2、3、4、6、11、cd51(整合素αv)和cd29(整合素 β1)(brooke,g.
等,stem cell dev,2008).据报道,整合素α1β1、α2β1、αvβ1、αvβ5、 α5β1和α4β1在成骨细胞中表达(grzesik,w.j.和robey,p.g.,j bone miner res, 1994,9(4):第487-96页;gronthos,s.等,bone,2001,28(2):第174-81页; gronthos,s.等,j bone miner res,1997.12(8):第1189-97页;cowles,e.a.,l.l. brailey和g.a.gronowicz,j biomed mater res,2000,52(4):第725-37页)。已报 道,α4整合素在msc上的过表达会增强msc向骨寻靶(mukherjee,s.等,j clininvest,2008,118(2):第491-504页)。
[0009]
间充质干细胞还表达大量的趋化因子和细胞因子受体,并且能够抗击局部 组织中的炎症。趋化因子和细胞因子在炎症过程中释放,并且发动炎性响应。 这些相同的信号转导分子能够促进msc通过msc表面上的cxcr4受体或整合 素β1寻靶(例如,迁移)炎性位点。此外,msc能够通过信号转导将树突细胞靶 向至抗炎性t细胞应答或通过抑制天然杀伤细胞功能来调节先天性免疫应答。 msc还通过与cd4 t细胞的活化的直接相互作用来发挥免疫调节作用以影响 适应性免疫应答。已显示全身msc移植会诱导抗炎作用。然而,msc在进入发 炎组织方面趋于低效。
[0010]
ra或炎性关节炎的医药方面仍需要用于预防和/或治疗关节炎症以及与炎 性疾病相关联的免疫调节的组合物和方法。出乎意料的是,本发明满足了这些 及其他需求。
技术实现要素:
[0011]
一方面中,本发明涉及用于减少关节炎(例如,类风湿性关节炎或炎性关节 炎)疼痛的一种或多种迹象或症状的方法。在一些实施方式中,所述方法包括: 给予具有关节炎(例如,类风湿性关节炎或炎性关节炎)的对象包含llp2a拟肽 配体和二膦酸盐/酯(bisphosphonate)药物的偶联物的组合物。在一些实施方式 中,所述组合物包含llp2a和阿伦膦酸盐的偶联物("llp2a-ale")。在一些实施 方式中,所述方法还包括给予外源性间充质干细胞。
[0012]
在另一方面,本发明涉及用于减少、缓解或抑制由关节炎(例如,类风湿性 关节炎或炎性关节炎)中的炎症所致的软骨和骨破坏的方法。在一些实施方式 中,所述方法包括:给予具有关节炎(例如,类风湿性关节炎或炎性关节炎)的 对象包含llp2a拟肽配体和二膦酸盐/酯药物的偶联物的组合物。在一些实施方 式中,所述组合物包含llp2a和阿伦膦酸盐的偶联物("llp2a-ale")。在一些实 施方式中,所述方法还包括给予外源性间充质干细胞。
[0013]
在另一方面,本文提供一种治疗具有原发性(primary)炎性疾病或紊乱 的对象的方法,所述炎性疾病或紊乱选自:关节炎、炎性关节炎、类风湿性关 节炎、滑膜炎、青少年类风湿性关节炎、强直性脊柱炎、银屑病性关节炎、脊 椎关节炎和骨关节炎。所述方法包括:给予所述对象包含llp2a拟肽配体和二 膦酸盐/酯药物的偶联物的组合物,其中,该包含llp2a-二膦酸盐/酯偶联物的 组合物提高间充质干细胞向炎症位置的递送。
[0014]
在一些实施方式中,所述组合物包含llp2a和阿伦膦酸盐的偶联物 ("llp2a-ale")。在另一个实施方式中,所述方法还包括给予外源性间充质干细 胞。
[0015]
在一些实施方式中,所述组合物和所述间充质干细胞依次给予。在一些 实施方式中,所述组合物和所述间充质干细胞同时给予。
[0016]
在一些实施方式中,所述组合物和所述间充质干细胞之一或两者在炎症位 置局部给予。在一些示例中,所述炎症位置是关节。
[0017]
在一些实施方式中,所述组合物和所述间充质干细胞之一或两者通过注射 给予。
[0018]
在一些实施方式中,全身给予所述组合物和所述间充质干细胞之一或两 者。在其它实施方式中,静脉内给予所述组合物和所述间充质干细胞之一或两 者。
[0019]
在一些实施方式中,所述对象患有类风湿性关节炎或滑膜炎。
[0020]
在第二方面,本文提供一种减少有需求的对象中的炎症的方法,所述方法 包括共同给予所述对象:(a)包含llp2a拟肽配体和二膦酸盐/酯药物的偶联物的 组合物,和(b)间充质干细胞,其中,该包含llp2a-二膦酸盐/酯偶联物的组合 物提高所述间充质干细胞向所述炎症位置的递送。
[0021]
在一些实施方式中,所述组合物包含llp2a和阿伦膦酸盐的偶联物 ("llp2a-ale")。在另一个实施方式中,所述方法还包括给予外源性间充质干细 胞。
[0022]
在一些实施方式中,所述组合物和所述间充质干细胞依次给予。在一些实 施方式中,所述组合物和所述间充质干细胞同时给予。
[0023]
在一些实施方式中,所述组合物和所述间充质干细胞之一或两者在炎症位 置局部给予。在一些示例中,所述炎症位置是关节。
[0024]
在一些实施方式中,通过注射给予所述组合物和所述间充质干细胞之一或 两者。
[0025]
在一些实施方式中,全身给予所述组合物和所述间充质干细胞之一或两 者。在其它实施方式中,静脉内给予所述组合物和所述间充质干细胞之一或两 者。
[0026]
在一些实施方式中,所述组合物和所述间充质干细胞之一或两者以亚治疗 剂量给予。在一些实施方式中,给予的间充质干细胞的量不多于单独给予时产 生显著治疗效果的间充质干细胞的量的70%。
[0027]
在一些实施方式中,所述组合物和所述间充质干细胞以数日或数周的时间 间隔分开的系列剂量给予。
[0028]
在一个实施方式中,有治疗需求的对象具有炎性疾病或紊乱。
[0029]
在第三方面,本文提供一种治疗具有炎性疾病或紊乱的患者的方法,所述 方法包括:共同给予所述对象(a)包含llp2a拟肽配体和二膦酸盐/酯药物的偶 联物的组合物,和(b)间充质干细胞,其中,给予的间充质干细胞的量是亚治 疗剂量。
[0030]
在一些实施方式中,所述炎性疾病或紊乱选自:关节炎、类风湿性关节炎、 滑膜炎、青少年类风湿性关节炎、强直性脊柱炎、银屑病性关节炎、脊椎关节 炎和骨关节炎。在一些示例中,所述炎性疾病或紊乱是类风湿性关节炎或滑膜 炎。
[0031]
在一些实施方式中,所述组合物和所述间充质干细胞依次给予。在一些实 施方式中,所述组合物和所述间充质干细胞同时给予。
[0032]
在一些实施方式中,所述组合物和所述间充质干细胞之一或两者在炎症位 置局部给予。在一些示例中,所述炎症位置是关节。
[0033]
在一些实施方式中,通过注射给予所述组合物和所述间充质干细胞之一或 两者。
[0034]
在一些实施方式中,全身给予所述组合物和所述间充质干细胞之一或两 者。在其它实施方式中,静脉内给予所述组合物和所述间充质干细胞之一或两 者。
[0035]
在一些实施方式中,给予的间充质干细胞的量不多于单独给予时产生显著 治疗效果的间充质干细胞的量的70%。
[0036]
在一些实施方式中,所述组合物和所述间充质干细胞以数日或数周的时间 间隔
分开的系列剂量给予。
[0037]
在第四方面,本文提供一种用于增强间充质干细胞的抗炎性或免疫调节性 质的方法,所述方法包括:给予对象包含llp2a拟肽配体和二膦酸盐/酯药物的 偶联物的组合物和所述间充质干细胞。
[0038]
在一些实施方式中,所述炎性疾病或紊乱选自:关节炎、类风湿性关节炎、 滑膜炎、青少年类风湿性关节炎、强直性脊柱炎、银屑病性关节炎、脊椎关节 炎和骨关节炎。在一些示例中,所述炎性疾病或紊乱是类风湿性关节炎或滑膜 炎。
[0039]
在一些实施方式中,所述间充质干细胞以在包含llp2a-二膦酸盐/酯偶联 物的组合物不存在的情况下施予了间充质干细胞的对象中不足以显著减少炎 症或不具有显著免疫调节作用的量给予。
[0040]
在一些实施方式中,所述组合物和所述间充质干细胞依次给予。在一些实 施方式中,所述组合物和所述间充质干细胞同时给予。
[0041]
在一些实施方式中,所述组合物和所述间充质干细胞之一或两者在炎症位 置局部给予。在一些示例中,所述炎症位置是关节。
[0042]
在一些实施方式中,通过注射给予所述组合物和所述间充质干细胞之一或 两者。
[0043]
在一些实施方式中,全身给予所述组合物和所述间充质干细胞之一或两 者。在其它实施方式中,静脉内给予所述组合物和所述间充质干细胞之一或两 者。
[0044]
在一些实施方式中,所述组合物和所述间充质干细胞以数日或数周的时间 间隔分开的系列剂量给予。
[0045]
通过以下详细说明和附图,本领域技术人员能明白本发明的其它目的、特 征和优点。
[0046]
附图的简要说明
[0047]
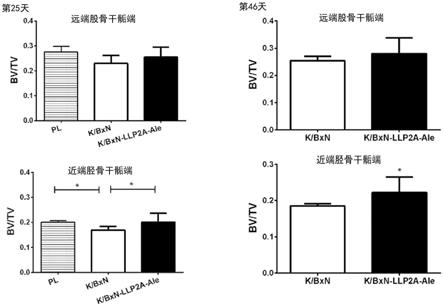
图1a-b.llp2a-ale预防与类风湿性关节炎相关联的关节周围区域和胫骨 骨小梁中的骨损失。(a)左栏:对于k/bxn血清或k/bxn血清和llp2a-ale(100 μg/kg,iv第4天),在第25天(左栏)或第46天(右栏),于远端股骨(上图)或近端胫 骨(下图)检测的,骨体积/组织体积分数。(b)对于k/bxn血清(左栏)或k/bxn血 清和llp2a-ale(100μg/kg,iv第4天)(右栏),在第25天(上图)或第46天(下图), 远端股骨-膝关节-近端胫骨的代表性的微ct图像。
[0048]
图2a-b.用安慰剂或llp2a-ale处理的类风湿性关节炎诱导型(“k/bxn”) 小鼠在第25天的骨髓(a)或血清(b)的细胞因子水平。
[0049]
图3a-b.用安慰剂或llp2a-ale处理的类风湿性关节炎诱导型(“k/bxn”) 小鼠在第46天的骨髓(a)或血清(b)的细胞因子水平。两次的每月进行的 llp2a-ale注射减少了k/bxn血清转移ra模型中的细胞因子活化。
[0050]
发明详述
[0051]
i.引言
[0052]
本发明涉及如下惊人发现:拟肽配体(例如,llp2a)与二膦酸盐/酯(例如, 阿仑膦酸盐)偶联的化合物和药物组合物,显示免疫调节作用并有利于减少或预 防炎症。不受具体理论限制,据信所述偶联物能够将干细胞(例如,间充质干细 胞)导向至炎症位置,其中所述干细胞发挥免疫调节或免疫抑制作用。因此,本 文所述的偶联物,单独给予或与间充质干细胞联用时,能够提高间充质干细胞 在诱导炎性或免疫调节作用中的功效。
[0053]
如本文所述,一方面,拟肽配体-二膦酸盐/酯(例如,llp2a-阿仑膦酸盐) 偶联物,单独地或与间充质干细胞联用,可用于治疗炎症,例如原发性炎性疾 病或紊乱,例如但不限于:关节炎、炎性关节炎、类风湿性关节炎、滑膜炎、 青少年类风湿性关节炎、强直性脊柱炎、银屑病性关节炎、脊椎关节炎和骨关 节炎。在另一方面,发炎的骨、关节或骨相关组织中(例如,患有滑膜炎的关节 中)的炎症的治疗还能减缓或预防因炎症所致的对骨、关节或组织的破坏。
[0054]
ii.定义
[0055]
本文所用的缩写具有其在化学和生物领域中的传统涵义。除非另有说明, 本文所用的以下术语具有属于它们自身的涵义。
[0056]
本文中述及取代基的基团或"取代基"时,本文所用的术语"一个"或"一种" 指至少一个或一种。例如,当化合物被"一个"烷基或芳基取代时,该化合物任 选地被至少一个烷基和/或至少一个芳基取代,其中各烷基和/或芳基任选是不 同的。在另一示例中,当化合物被"一个"取代基取代时,该化合物被至少一个 取代基取代,其中各取代基任选是不同的。
[0057]
本发明的化合物的描述受到本领域技术人员已知的化学成键原理的限制。 因此,当某一基团可被一种或多种取代基取代时,这类取代基的选择应符合化 学成键原理并生成非内在不稳定的化合物,和/或本领域普通技术人员不会已知 其在环境条件(如水性、中性或生理条件)下是不稳定的化合物。
[0058]
本文所用的术语"ale"或"alen"指的是阿仑膦酸盐。
[0059]
本文所用的术语"肽"指的是由d-或l-氨基酸单链或d-和l-氨基酸经肽键接 合的混合物组成的化合物。一般而言,肽的长度是约2至约50个氨基酸。优选 地,本发明的肽的长度是约2至约25个氨基酸,更优选长度是3至20个氨基酸, 且最优选长度是3至10个氨基酸。
[0060]
本文所用的术语"氨基酸"指的是天然产生的、非天然的,和合成的氨基酸, 以及作用方式与天然产生的氨基酸相似的氨基酸类似物和拟氨基酸。在本文 中,氨基酸可用iupac-iub生物化学命名委员会推荐的通用三字母代号或单字 母代号表示。同样,核苷酸可指其普遍接受的单字母代码。
[0061]
本文所用的术语"盐"指的是本发明方法中所用的化合物的酸或碱盐。药学 上可接受的盐的说明性示例有:无机酸(盐酸、氢溴酸、磷酸等)盐、有机羧酸(乙 酸、丙酸、谷氨酸、柠檬酸等)、有机磺酸(甲磺酸)、盐、季铵(甲基碘、乙基碘 等)盐。应理解,药学上可接受的盐是无毒的。关于适合的药学上可接受的盐的 其他信息可参见remington's pharmaceutical sciences(《雷明顿药物科学》),第 17版,马克出版公司(mack publishing company),宾西马尼亚州伊斯顿,1985, 其通过引用纳入本文。
[0062]
本发明的酸性化合物的药学上可接受的盐包括:采用碱形成的盐,即阳离 子盐,例如,碱金属和碱土金属盐,例如钠、锂、钾、钙、镁,以及铵盐,例 如铵、三甲基铵、二乙基铵,和三(羟基甲基)-甲基-铵盐。
[0063]
本文所用的术语"水合物"指的是与至少一个水分子复合的化合物。本发明 的化合物可与1至10个水分子复合。
[0064]
本文所用的术语"药学上可接受的赋形剂"和"药学上可接受的载体"指的是 协助
活性剂的给予和对象的吸收的物质。"药学上可接受的赋形剂"指的是能够 被包含在本发明组合物中的赋形剂,且其不对患者造成显著负面毒理学作用。 药学上可接受的赋形剂的非限制性示例包括水、nacl、生理盐水、乳酸林格溶 液、正常蔗糖、正常葡萄糖、粘结剂、填充剂、崩解剂、润滑剂、包衣剂、甜 味剂、调味剂和着色剂等。本领域技术人员应理解,本发明中可采用其它药物 赋形剂。
[0065]
本文所用的术语"异构体"指具有相同化学式但在结构上可以区分的化合 物。
[0066]
本文所用的术语"间充质干细胞"指的是多能干细胞(即,能够分化成子细胞 类型的细胞),其能够分化成多种细胞类型,包括成骨细胞、软骨细胞和脂肪细 胞。间充质干细胞可获自多种组织,包括但不限于,骨髓组织、脂肪组织、肌 肉组织、生育组织(例如,羊膜、羊水或脐带组织)、皮肤组织、骨组织,和齿 组织。
[0067]
本文中所用的"免疫调节"和"免疫调节"指,造成免疫应答的可检测变化或 具有造成免疫应答的可检测变化的能力,和能够造成免疫应答的可检测变化。
[0068]
本文所用的术语"患者"和"对象"可互换地指患有或倾向于发生可通过给予 本文所述的药物组合物来治疗的病症的活生物体。非限制性示例包括人、其它 哺乳动物和其它非哺乳动物类型的动物。
[0069]
本文所用的术语"治疗有效量"指的是有用于治疗或改善鉴定的疾病或病 症或有用于显示可检测的治疗或抑制作用的药物组合物(例如,本文所述的偶联 物和/或干细胞)的量。效果可通过本领域已知的任何试验方法检测。
[0070]
本文所用的术语"亚治疗剂量"指的是低于当单独给予组合物时对于对象提 供显著的希望的临床益处(例如,抗炎性或免疫调节作用)所需的药物组合物(例 如,本文所述的偶联物和/或干细胞)的量。
[0071]
本文所述的术语“治疗”和“处理”指损伤、病变或病症的治疗或缓解过程中 任何成功的迹象,包括任何客观或主观参数,如消除、缓解、症状的消除或使 损伤、病变或病症对患者而言更耐受、减慢退化或衰退的速率、使退化的终点 更不衰弱,和/或改善患者的身体或精神健康。症状的治疗或缓解可基于客观或 主观参数,包括身体检查、神经精神检查和/或精神评价的结果。
[0072]
iii.用于治疗炎症和炎性疾病的组合物
[0073]
一方面中,本发明涉及与二膦酸盐/酯(例如,阿仑膦酸盐)偶联的拟肽配体 (例如,llp2a),单独地或与间充质干细胞联用用于治疗炎症的应用。在另一 方面,本发明涉及与二膦酸盐/酯(例如,阿仑膦酸盐)偶联的拟肽配体(例如, llp2a),单独地或与间充质干细胞联用用于增强间充质干细胞的抗炎性或免疫 调节性质的应用。
[0074]
llp2a-二膦酸盐/酯偶联物
[0075]
在一些实施方式中,本发明涉及llp2a化合物偶联至二膦酸盐/酯药物:
[0076][0077]
二膦酸盐/酯广泛用于治疗骨质疏松。该类药物还被用作"载剂",用于以前 药形式基于其双膦酸部分将骨靶向药物递送至骨组织。二膦酸盐/酯已被用于将 缓释双氯芬酸(其为一种非甾族抗炎性药物)递送至大鼠的骨(hirabayashi,h.等, j control release,2001,70(1-2):第183-91页)。用于该药物递送目的所需的二 膦酸盐/酯剂量通常比治疗骨质疏松、低钙血症、佩吉特病或转移性骨癌要低 10-100倍。可配合本发明使用的二膦酸盐/酯药物包括任何合适的二膦酸盐/酯化 合物。示例性的二膦酸盐/酯药物包括但不限于,依替膦酸盐(didronel)、氯屈 膦酸盐(bonefos、loron)、替鲁膦酸盐(skelid)、帕米膦酸盐(apd、aredia)、奈 立膦酸盐、奥帕膦酸盐、阿伦膦酸盐(fosamax)、伊班膦酸盐(boniva)、利塞膦 酸盐(actonel)和唑来膦酸盐(zometa)。其它二膦酸盐/酯在下文中详述。本领域 技术人员应理解,本发明可采用其它二膦酸盐/酯。在一些实施方式中,所述二 膦酸盐/酯是阿仑膦酸盐。
[0078]
在一些实施方式中,本发明提供式i化合物(例如,llp2a-ale):
[0079][0080]
在一些实施方式中,提供偶联至二膦酸盐/酯药物(例如,式i化合物)的 llp2a化合物的盐、水合物、溶剂化物、前药形式、异构体和代谢物。
[0081]
盐包括但不限于:硫酸盐、柠檬酸盐、乙酸盐、草酸盐、氯化物、溴化物、 碘化物、硝酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、膦酸盐、异烟酸盐、乳酸 盐、水杨酸盐、酸性柠檬酸盐、酒石酸盐、油酸盐、丹宁酸盐、泛酸盐、酒石 酸氢盐、抗坏血酸盐、琥珀酸盐、马来酸盐、龙胆酸盐、延胡索酸盐、葡糖酸 盐、葡糖醛酸盐、糖酸盐、甲酸盐、苯甲酸盐、谷氨酸盐、甲磺酸盐、乙磺酸 盐、苯磺酸盐、对甲苯磺酸盐和扑酸盐(即1,1
’‑
亚甲基-双(2-羟基-3-萘甲酸)盐)。 其他盐包括但不限于无机碱盐,包括碱金属盐(如钠盐、锂盐和钾盐)、碱土金 属盐(如钙盐和镁盐)、铝盐和铵盐(例如铵、三甲基铵、二乙基铵和三(羟甲基)
‑ꢀ
甲基-铵盐)。其他有机碱盐包括二乙胺盐、二乙醇胺盐、葡甲胺盐和n,n'-二苯 基乙二胺盐。
[0082]
酸加成盐,例如无机酸、有机羧酸和有机磺酸,例如,盐酸、甲磺酸、马 来酸,也可
提供碱性基团,例如吡啶基,组成结构的部分。
[0083]
所述化合物的中性形式可通过使盐与碱或酸接触并以传统方式将母体化 合物分离来再生。所述化合物的母体形式的某些物理性质(例如,在极性溶剂中 的溶解度)与众多盐形式不同,但其它情况下所述盐等同于用于本发明目的的化 合物的母体形式。
[0084]
本发明的某些化合物可以非溶剂合形式以及溶剂合形式(包括水合形式)存 在。一般而言,溶剂化物形式等同于非溶剂化物形式,并涵盖在本发明范围内。 本发明的某些化合物可以多晶或无定形形式存在。通常,在本发明所考虑的应 用中所有物理形式是等同的,且这些物理形式均应在本发明范围内。
[0085]
本发明的某些化合物具有不对称碳原子(光学中心)或双键;可按绝对立 体化学定义为(r)-或(s)-或者对于氨基酸定义为(d)-或(l)-的对映异构体、 外消旋物、非对映异构体、互变异构体、几何异构体、立体异构体形式和单个 异构体均包括在本发明的范围内。本发明的化合物不包括本领域已知的过于不 稳定而无法合成和/或分离的那些。本发明意在包括外消旋和光学纯形式的化合 物。光学活性的(r)-和(s)-或者(d)-和(l)-异构体可使用手性合成子或手性试剂 制备,或使用常规技术解析。
[0086]
本发明还提供前药形式的化合物。本文所述的化合物的前药是在生理条件 下易于经历化学变化以提供本发明化合物的那些化合物。此外,前药可通过化 学或生化方法在体外环境中转化成本发明化合物。例如,放置在含有合适酶或 化学试剂的透皮贴片贮器中时,前药可缓慢转变为本发明的化合物。
[0087]
本发明的化合物可以通过本领域技术人员已知的各种方法(参见 comprehensive organic transformations(《综合有机转化》),richard c.larock, 1989)或通过通常熟知的合成方法的适当组合来合成。可用于合成本发明化合 物的技术是相关领域技术人员显见且掌握的。提供了以下讨论以说明可用于组 装本发明的化合物的多种方法中的某些。然而,该讨论不是旨在定义用于制备 本发明的化合物的反应或反应顺序的范围。本领域技术人员应理解,用于制备 所述化合物的其它方法也可用于本发明。
[0088]
例如,llp2a-阿伦膦酸盐(llp2a-ale)可通过将llp2a-lys(d-cys)的硫氢 基基团偶联加成至阿仑膦酸盐-马来酰亚胺(ale-mal)来制备,其中后者可由阿伦 膦酸盐和磺基琥珀酰亚胺基-4-(n-马来酰亚胺甲基)环己烷-1-羧酸酯(磺基
ꢀ‑
smcc)原位制备。llp2a-lys(d-cys)可通过将若干市售可得的起始材料和一 种经表征的中间体4-[(n
’‑
2-甲基苯基)脲基]苯乙酸(upa)固相合成来制备,该中 间体也可由市售可得的起始材料制备。制备偶联至二膦酸盐/酯药物的llp2a化 合物的方法,包括对合成llp2a-ale的详细描述,可见于,例如,国际申请公 开号wo 2012/031228和wo 2013/032527,其公开内容通过引用其全文纳入本文 用于所有目的。
[0089]
间充质干细胞
[0090]
在一些实施方式中,包含llp2a拟肽配体和二膦酸盐/酯药物的偶联物的组 合物(例如,llp2a-ale)与间充质干细胞(msc)共同给予,以体内调节免疫应答 或调节一种或多种类型的众多免疫细胞的活性。不受具体理论限制,据信所述 偶联物将间充质干细胞导向炎症位置,其中所述间充质干细胞发挥免疫调节或 免疫抑制作用。在一些实施方式中,所述偶联物将对象中的内源性间充质干细 胞招募至炎症位置。
[0091]
给予的间充质干细胞可以是同质组合物或可以是包含msc或富含msc的 混合的细
胞群。合适的msc可获自或源自,例如,从骨髓吸出物收集的骨髓单 核细胞。在一些实施方式中,同质间充质干细胞组合物通过将贴壁髓细胞或骨 膜细胞培养在合适的培养基中获得,而间充质干细胞组合物可通过培养贴壁髓 细胞或骨膜细胞以获得扩增的msc群来获得。msc可利用独特的单克隆抗体鉴 定特定的细胞表面标志物来鉴定。用于获得富含间充质干细胞的细胞群的方法 描述于,例如,美国专利号5,486,359,其通过引用纳入本文。间充质干细胞的 来源包括但不限于,骨髓、肌肉、脂肪、胎盘组织、脐带组织、牙髓、皮肤组 织、外周血和滑液膜。间充质干细胞(msc)可采用本领域已知方法纯化(参见, 例如,wakitani等,1995;fukuda和yuasa,2006;woodbury等,2000;deng 等,2001;kim等,2006;mareschi等,2006;krampera等,2007)。
[0092]
富含msc的组合物(例如,具有多于约95%,一般多于约98%的间充质干细 胞)可采用本领域已知的间充质干细胞的分离、纯化和培养扩增技术来获得。作 为一个非限制性示例,通过对表达的表面抗原进行流式细胞术分析,分离、培 养的间充质干细胞可包含单一表型群(例如,至少约95%或约98%同质)。所述组 合物中的所需细胞经鉴定为表达该细胞表型的一种或多种细胞表面标志物(例 如,cd73或cd105)。
[0093]
间充质干细胞可通过多种方式给予。在一些实施方式中,全身给予间充质 干细胞,例如,通过静脉内、动脉内或腹膜内给予途径。
[0094]
所述间充质干细胞可来自多种来源,包括自体同源、同种异体或异种来源。
[0095]
在一个实施方式中,间充质干细胞以约1
×
104细胞/kg至约1
×
108细胞/kg体重 (例如,约1
×
104细胞/kg、约1
×
105细胞/kg、约1
×
106细胞/kg、约1
×
107细胞/kg或 约1
×
108细胞/kg)的量给予。待给予的间充质干细胞的量取决于多种因素,包括 患者的年龄、体重和性别,待治疗的自体免疫疾病,及其严重程度。
[0096]
间充质干细胞可联合可接受的药物载体给予。例如,间充质干细胞可以用 于注射或局部施用的药学上可接受的液体培养基或凝胶中的细胞悬液的形式 给予。在一个实施方式中,所述药学上可接受的液体培养基是盐水溶液。所述 盐水溶液可包含其它物质例如二甲亚砜(dmso)和人血清白蛋白。
[0097]
iv.配制和给予
[0098]
本发明组合物(例如,llp2a-阿仑膦酸盐偶联物和/或间充质干细胞)可以众 多的口服、胃肠外和局部剂型制备和给予。口服制剂包括片剂、丸剂、粉末、 糖锭剂、胶囊、液体、胶质软糖、扁囊剂、凝胶、糖浆、糊剂、悬液等,其适 于患者消化。药物组合物可配制用于任何合适的给予方式,包括,例如,局部、 口服、鼻部、鞘内、直肠、阴道、舌下或胃肠外给予,包括皮下、静脉内、肌 内、胸骨内、海绵窦内、耳道内或尿道内注射或输注。在一些实施方式中,给 予通过注射进行,即,静脉内、肌内、皮内、皮下、十二指肠内或腹膜内注射。 因此,本发明还提供药物组合物,所述药物组合物包含药学上可接受的载体或 赋形剂,以及本发明的化合物或本发明的化合物的药学上可接受的盐。
[0099]
本发明的制剂还适于在所有体间隙/体腔中给予,包括但不限于,胸膜、腹 膜、头骨、纵隔、心包膜、滑囊或囊、硬膜外、鞘内、眼内、关节内、中室内、 髓内、脊周等。
[0100]
对于从本发明的化合物制备药物组合物,药学上可接受的运载体可为固体 或液体。固体形式制品包括粉末、片剂、丸剂、胶囊、扁囊剂、栓剂和可分散的 粒剂。固体运载体可为一种或多种还能用作稀释剂、调味剂、粘合剂、防腐剂、 片剂崩解剂、或包封材料的物
质。关于制剂和给药的技术细节在科学和专利文献 中有良好地描述,参见例如最新版本的remington's pharmaceutical sciences(《雷 明顿药物科学》),宾夕法尼亚州伊斯顿的麦克出版公司(maack publishing co)。
[0101]
在粉末剂中,运载体是细碎的固体,其与细碎的活性组分混合。在片剂中, 活性组分与具有所需粘合性质的载体以合适比例混合并压制为所需的形状和 大小。所述粉末和片剂优选地包含5%或10%至70%的活性化合物。
[0102]
一般而言,载体的类型基于给予方式选择。药物组合物(例如,用于经口给 予或通过注射递送)可以是液体形式(例如,酏剂、糖浆、溶液、乳液或悬液)。 液体药物组合物可包含例如,以下一种或多种物质:无菌稀释剂如注射用水, 盐水溶液,优选生理盐水,林格氏溶液等张氯化钠,可用作溶剂或悬浮介质的 非挥发油,聚乙二醇,甘油,聚丙二醇或其他溶剂;抗菌剂;抗氧化剂;螯合 剂;缓冲剂如乙酸盐、柠檬酸盐或磷酸盐和用于调节张力的试剂如氯化钠或右 旋糖。胃肠道外制剂可封装在安瓿、一次性注射器或由玻璃或塑料制成的多剂 量小瓶中。优选使用生理盐水,且可注射药物组合物优选是无菌的。
[0103]
所述组合物通常包括常规的药物载体或赋形剂并可另外包括其它药用试 剂、载体、佐剂、稀释剂、组织渗透促进剂、增溶剂等。在一些实施方式中, 所述组合物将包含约0.01%至约90%,例如,约0.1%至约75%,约0.1%至50%或 约0.1%至10%重量的偶联物和/或间充质干细胞,剩余部分由合适的药物载体和 /或赋形剂组成。可用本领域熟知方法对具体组合物和给药途径调整合适的赋形 剂(参见例如,《雷明顿药物科学》,同上)。
[0104]
合适的固体赋形剂包括但不限于,碳酸镁;硬脂酸镁;磷酸钙;硅酸钙; 滑石;果胶;右旋糖酐、糊精,和环糊精包合物;低熔蜡;可可油;碳水化合 物;糖,包括但不限于,乳糖、右旋糖、蔗糖、甘露醇或山梨醇;淀粉,包括 但不限于,来自玉米、小麦、稻米、马铃薯或其它植物的淀粉;纤维素,例如, 甲基纤维素、羟丙基甲基-纤维素或羧甲基纤维素钠;和树胶,包括阿拉伯胶、 黄蓍胶,和阿拉伯树胶;以及蛋白质,包括但不限于,明胶、胶原;微晶纤维 素、水、盐水、糖浆、乙基纤维素,和聚丙烯酸,例如聚羧乙烯(carbopols), 例如,carbopol 941、carbopol 980、carbopol 981等;润滑剂;矿物油;润湿 剂;乳化剂;悬浮剂;防腐剂,例如,羟基-苯甲酸甲酯、羟基-苯甲酸乙酯和 羟基-苯甲酸丙酯(即,对羟基苯甲酸酯类);ph调节剂,例如无机和有机酸与碱; 甜味剂;和调味剂;生物可降解聚合物珠。必要时,可添加崩解剂或增溶剂, 例如交联聚乙烯吡咯烷酮、琼脂、褐藻酸、海藻酸盐,或其盐,例如海藻酸钠。
[0105]
药学上可接受的载体可包括,例如,作用以使本发明化合物稳定或调节其 吸收的生理学上可接受的化合物,或所需的其它赋形剂。生理学上可接受的化 合物包括,例如,碳水化合物、例如葡萄糖、蔗糖或右旋糖、抗氧化剂,例如 抗坏血酸或谷胱甘肽、螯合剂、低分子量蛋白质或其它稳定剂或赋形剂。本领 域技术人员应知晓,药学上可接受的载体(包括生理学上可接受的化合物)的选 择取决于,例如,本发明化合物的给予途径,以及本发明化合物的具体理化特 点。
[0106]
一般而言,所述载体的应用剂量和浓度应对受者无毒性。通常,所述组合 物制剂需要使治疗剂与以下物质联用:缓冲剂、抗氧化剂例如抗坏血酸、低分 子量(少于约10个残基)多肽、蛋白质、氨基酸、碳水化合物包括葡萄糖、麦芽 糖、蔗糖或糊精、螯合剂如edta、谷胱甘肽和其它稳定剂与赋形剂。中性缓 冲盐水或与非特异性血清白蛋白混合的盐水是示
例性适当的稀释剂。
[0107]
为糖衣剂芯体提供合适的包衣剂,如浓缩糖溶液,其中还可包含阿拉伯胶、 滑石粉、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇和/或二氧化钛、漆溶液和合 适的有机溶剂或溶剂混合物。可将染料或颜料加入片剂或糖衣剂包衣中,用于 产品标示或表征活性化合物的量(即剂量)。本发明的药物制剂还可口服使用, 使用例如明胶制成的压接(push-fit)胶囊以及明胶和包衣剂(如甘油或山梨糖醇) 制成的软、密封的胶囊。压接胶囊可含有与填充剂或粘合剂(如乳糖或淀粉)、 润滑剂(如滑石粉或硬脂酸镁)以及可选的稳定剂混合的本发明的化合物。软 胶囊中,本发明化合物可溶解或悬浮于合适的液体中,例如含有或不含稳定剂 的液体聚乙二醇、脂肪油或液体石蜡。
[0108]
液体形式制剂包括溶液剂、混悬剂和乳剂,例如水或水/丙二醇溶液剂。液 体组合物的制备可通过将偶联物和任选的一种或多种药学上可接受佐剂溶解 或悬浮于载体例如盐水(如,0.9%w/v的氯化钠)、右旋糖水溶液、甘油、乙醇 等,以形成溶液或悬浮液,例如用于口服、局部或静脉内给药。对于胃肠道外 注射,液体制剂可以溶于水性聚乙二醇溶液的溶液形式进行配制。
[0109]
适于口服使用的水溶液可通过将活性组分溶解于水中并如需要添加合适 的着色剂、调味剂、稳定剂和增稠剂来制备。适用于口服应用的水性悬液可通 过将细分活性组分分散在具有粘性材料的水中来制备,所述粘性材料例如,天 然或合成的树胶、树脂、甲基纤维素、羧甲基纤维素钠、羟丙基甲基纤维素、 海藻酸钠、聚乙烯吡咯烷酮、西黄蓍胶和阿拉伯胶;分散剂或润湿剂,例如天 然来源的磷脂(例如卵磷脂)、环氧烷与脂肪酸的缩合产物(例如聚氧乙烯硬脂酸 酯)、环氧乙烷与长链脂肪醇的缩合产物(例如,十七碳亚乙基氧基鲸蜡醇)、环 氧乙烷与源自脂肪酸和己糖醇酐的偏酯形成的缩合产物(例如,聚氧乙烯山梨糖 醇酐单油酸酯)。水性混悬剂也可含有一种或多种防腐剂,如对羟基苯甲酸乙酯 或者对羟基苯甲酸正丙酯,一种或多种着色剂,一种或多种调味剂以及一种或 多种甜味剂,如蔗糖、阿斯帕甜或糖精。制剂可以调节渗透压。
[0110]
可通过将本发明的化合物悬浮在植物油(如花生油、橄榄油、芝麻油或椰子 油)或矿物油(如液体石蜡)或其混合物中来配制油性悬浮剂。油性混悬剂可含有 增稠剂,如蜂蜡、硬石蜡或鲸蜡醇。可加入甜味剂以提供可口的口服制剂,例 如甘油、山梨糖醇或蔗糖。可通过加入抗氧化剂如抗坏血酸保存这些制剂。作 为可注射油性运载剂的一个示例,参见minto,j.pharmacol.exp.ther. 281:93-102,1997。本发明的药物制剂也可以是水包油乳剂的形式。油相可以是 植物油或矿物油,如上所述,或者它们的混合物。合适的乳化剂包括:天然产 生的树胶,例如阿拉伯树胶和黄蓍胶、天然产生的磷脂,例如大豆卵磷脂、源 自脂肪酸和己糖醇酐的酯或偏酯,例如去水山梨糖醇单油酸酯,以及这些偏酯 与环氧乙烷的缩合产物,例如聚氧乙烯去水山梨糖醇单油酸酯。作为糖浆剂和 酏剂中一样,乳剂也可包含甜味剂和调味剂。这类制剂也可含有缓和剂、防腐 剂、或着色剂。
[0111]
还包括旨在临使用前转变为液体形式制剂以口服给药的固体形式制剂。液 体形式包括溶液、悬液和乳液。除活性组分外,这些制剂可包含着色剂、调味 剂、稳定剂、缓冲剂、人工和天然甜味剂、分散剂、增稠剂、增溶剂等。
[0112]
对于口服给药,组合物可以是片剂、囊剂、乳剂、悬浮剂、溶液剂、糖浆 剂、喷剂、锭剂、粉剂和缓释制剂的形式。用于经口给予的合适的赋形剂包括 制药级别的甘露糖、乳糖、
淀粉、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、 明胶、蔗糖、碳酸镁等。
[0113]
在一些实施方式中,所述药物组合物可具有如下形式:丸剂、片剂或胶囊, 因此,所述组合物中,伴随所述偶联物和/或间充质干细胞可包含如下任何物质: 稀释剂,例如乳糖、蔗糖、磷酸二钙等;崩解剂,例如淀粉或其衍生物;润滑 剂,例如硬脂酸镁等;和粘合剂,例如淀粉、阿拉伯胶、聚乙烯吡咯烷酮、明 胶、纤维素及其衍生物。所述偶联物和/或间充质干细胞还可被配制成例如,聚 乙二醇(peg)载体中的栓剂。
[0114]
对于局部给药,本发明的组合物可以是乳剂、洗剂、凝胶剂、乳膏剂、胶 冻剂、溶液剂、悬浮剂、油膏剂和透皮贴剂的形式。对于吸入递送,所述组合 物可以干粉或液体形式通过喷雾器递送。对于肠胃外给药,所述组合物可以是 无菌可注射溶液和无菌包装粉剂的形式。优选地,可注射的溶液以约4.5至约7.5 的ph配制。
[0115]
本发明组合物还可以冻干形式提供。此类组合物可包括缓冲液,例如碳酸 氢盐,用于在给药前重建,或者所述缓冲液可以包括在冻干组合物中,用于采 用例如水来重建。所述冻干组合物还可包含适当的血管收缩剂,例如肾上腺素。 所述冻干组合物可以在注射器中提供,可选与重建的缓冲液联合包装,使得重 建组合物可以立即给予患者。
[0116]
在一些实施方式中,所述药物组合物是缓释制剂。缓释实施方式包括可生 物降解和/或缓慢溶解的聚合物质。所述聚合物质包括聚乙烯吡咯烷酮、低分子 量和中等分子量羟丙基纤维素和羟丙基甲基纤维素、交联的羧甲基纤维素钠、 羧甲基淀粉、甲基丙烯酸钾二乙烯基苯共聚物、聚乙烯醇、淀粉、淀粉衍生物、 微晶纤维素、乙基纤维素、甲基纤维素,和纤维素衍生物、β-环糊精、聚(甲基 乙烯醚/马来酐)、葡聚糖、塞罗糖(scierozlucans),甘露聚糖、黄原胶、褐藻酸 及其衍生物、糊精衍生物、单硬脂酸甘油酯,半合成的甘油酯、棕榈酰硬脂酸 甘油酯、山嵛酸甘油酯、聚乙烯吡咯烷酮、明胶、硬脂酸镁、硬脂酸、硬脂酸 钠、滑石、苯甲酸钠、硼酸,和硅胶。
[0117]
本发明的缓释剂还可包括佐剂,例如淀粉、预胶化淀粉、磷酸钙甘露醇、 乳糖、蔗糖、葡萄糖、山梨醇、微晶纤维素、明胶、聚乙烯吡咯烷酮、甲基纤 维素、淀粉溶液、乙基纤维素、阿拉伯胶、黄蓍胶、硬脂酸镁、硬脂酸、硅胶、 单硬脂酸甘油酯、氢化蓖麻油、蜡和单取代、二取代和三取代的甘油酯。缓释 剂还可按照wo94/06416的一般描述制备。
[0118]
所述药物制剂优选是单位剂型形式。术语“单位剂型”指适合作为单一剂量 用于人对象或其它哺乳动物(例如狗)的物理离散单位(例如,安瓿),每个单位包 含预定量的活性物质和合适的药用赋形剂,所述预定量经计算能产生所需的起 始反应、耐受性和/或治疗效果。此外,可制备更浓缩的组合物,然后可由此产 生更稀释的单位剂量组合物。因此,所述更浓缩的组合物将包含显著多于,例 如,至少1、2、3、4、5、6、7、8、9、10倍或更多倍的llp2a-二膦酸盐/酯偶 联物和/或间充质干细胞的量。在这些形式中,制剂细分成含有适量活性组分的 单位剂量。单位剂型可为包装的制剂,所述包装包含不连续量的制剂,如小瓶 或安瓿瓶中的小包装片剂、胶囊剂和粉末剂。另外,所述单位剂型本身可为胶 囊剂、片剂、扁囊剂或锭剂或其可为包装形式的适当数量的胶囊剂、片剂、扁 囊剂或锭剂中任一种。必要时,所述组合物还可包含其它相容的治疗剂。优选 的药物制剂能够在缓释制剂中递送本发明化合物。
[0119]
用于制备此类剂型的方法是本领域技术人员已知的(参见例如,《雷明顿药 物科学》(remington's pharmaceutical sciences),同上。当按照本发明的教导给 予时,待给
予的组合物以药学上有效的量包含一定量的llp2a-二膦酸盐/酯偶 联物和/或间充质干细胞,供于缓解待治疗的病症。此外,本发明的偶联物的药 学上可接受的盐(例如,酸加成盐)可采用合成有机化学领域技术人员已知的标 准方法制备并包含在组合物中,所述方法可见述于,例如,j.march,《高等 有机化学:反应、机理和结构》(advanced organic chemistry:reactions, mechanisms and structure),第4版,(纽约:韦利科学公司(wiley-interscience), 1992)。
[0120]
一般而言,给予的剂量会将皮摩尔至微摩尔浓度的llp2a-二膦酸盐/酯偶 联物和/或间充质干细胞有效递送至一个或多个合适的位置。然而,本领域普通 技术人员应理解,给予的剂量将视多种因素而定,包括但不限于,待给予的具 体偶联物、给予模式、应用类型(例如,成像、治疗)、患者年龄和患者的身体 状况。优选地,应采用产生希望效果所需的最小剂量和浓度。剂量应适于给予 儿童、老年人、体弱患者,和患有心脏病和/或肝疾病的患者。进一步指导可采 用用于评估剂量的实验动物模型通过本领域已知的研究获得。
[0121]
在一些实施方式中,所述偶联物(例如,llp2a-ale)和间充质干细胞之一 或两者的剂量是亚治疗剂量。在一些实施方式中,所述偶联物(例如,llp2a-ale) 和/或间充质干细胞的亚治疗剂量不多于单独给予时产生显著治疗作用的偶联 物和/或间充质干细胞的量的70%、60%、50%、40%、30%或20%。
[0122]
在一些实施方式中,间充质干细胞的剂量是,在没有llp2a-二膦酸盐/酯 偶联物的情况下给予时,不足以显著减少对象中炎症的量,或在对象中不具有 显著免疫调节作用的量。在一些实施方式中,不足以显著减少炎症或不具有显 著免疫调节作用的间充质干细胞的剂量通过下述过程确定:在没有给予llp2a
‑ꢀ
二膦酸盐/酯偶联物的情况下,将不同剂量的间充质干细胞给予对象,并检测间 充质干细胞的给予对于炎症或免疫调节的疗效。在一些实施方式中,如果免疫 调节作用的变化或炎症的减少相较于基线或对照(例如,相较于在给予间充质干 细胞之前对象中的免疫调节作用或炎症的水平)而言少于10%或少于5%,则所述 免疫调节作用或炎症的减少是不"显著的"。炎症的减少可通过如下方式确定, 例如,通过检测一种或多种炎症标志物的水平,例如但不限于c-反应性蛋白质、 肿瘤坏死因子α(tnf-α)、核因子κ-b(nf-κb)、白介素(例如,il6和可溶性il-2r)、 针对瓜氨酸修饰的蛋白质(抗-ccp)的抗体,或类风湿因子。炎症的减少还可通 过如下方式确定,例如,通过检测来自对象的血液样品中的红细胞沉降率 (esr)。
[0123]
在一些实施方式中,llp2a-二膦酸盐/酯偶联物和间充质干细胞的共同给 予会增强治疗作用,从而llp2a-二膦酸盐/酯偶联物和间充质干细胞之一或两 者的给予可以相较于单独给予llp2a-二膦酸盐/酯偶联物或间充质干细胞时产 生治疗作用所需的量和/或频率而言减少的量或减少的频率来给予。例如,在一 些实施方式中,llp2a-二膦酸盐/酯偶联物和间充质干细胞之一或两者能够以 比单独给予时少10%、20%、30%、40%、50%、60%或70%的频率给予。在一 些实施方式中,llp2a-二膦酸盐/酯偶联物和间充质干细胞能够以比单独给予 所述llp2a-二膦酸盐/酯偶联物或所述间充质干细胞时产生治疗作用所需的量 少约10%、20%、30%、40%、50%、60%或70%的量给予。
[0124]
在本发明方法的实践中,药物组合物可单独应用,或与其它治疗或诊断剂 联用。联合本发明方案使用的其它药物可分开给予,或者,用于该联合方案中 的一种或多种药物可一同给予,例如以掺混物形式给予。当一种或多种药物分 开给予时,给药物给予的时刻
和进度可不同。其它治疗或诊断剂可与本发明化 合物同时、分开或在不同时间给予。
[0125]
在一些实施方式中,多种本文所述的组合物(例如,llp2a-ale偶联物和间 充质干细胞)彼此联合给予以治疗炎性疾病或紊乱,减少炎症的迹象或症状,或 促进或增强间充质干细胞的抗炎性或免疫调节性质。在一些实施方式中,所述 多种组合物的共同给予包括在一种组合物给予0.5、1、2、4、6、8、10、12、 16、20或24小时内给予第二组合物。在一些实施方式中,两种组合物同时、大 约同时(例如,彼此相隔约1、5、10、15、20或30分钟之内)或以任何顺序依次 给予。在一些实施方式中,共同给予可通过共同配制完成,即,制备同时包含 llp2a-ale偶联物和间充质干细胞的单一药物组合物。在其它实施方式中,所 述组合物可分开配制。
[0126]
本发明化合物与合适的药物赋形剂的给予可通过任何可接受的给予模式 进行。因此,给予可以通过,例如,静脉内、局部、皮下、经皮、透皮、肌内、 经口、关节内、胃肠外、小动脉内、皮内、心室内、颅内、腹膜内、病灶内、 鼻内、直肠、阴道或通过吸入给予。在一些实施方式中,llp2a-二膦酸盐/酯 偶联物和间充质干细胞之一或两者在炎症位置(例如,关节)局部给予。在一些 实施方式中,全身给予llp2a-二膦酸盐/酯偶联物和间充质干细胞之一或两者。
[0127]
v.治疗炎症的方法
[0128]
本文所述的偶联物(例如,llp2a-ale)可单独地或与间充质干细胞联用用 于,例如,在有需求的对象的炎症位置,治疗炎症或促进抗炎性或免疫调节作 用。在一些实施方式中,本文提供的化合物能够促进间充质干细胞迁移至患有 炎性疾病的个体中的骨附近的炎症位置,例如,炎性滑膜。在一些实施方式中, 本发明提供用于预防和/或治疗骨相关或关节相关的炎性疾病的方法,其中所述 方法包括:给予有此需求的对象治疗有效量的llp2a-二膦酸盐/酯偶联物(例如, 式i化合物),和,任选地与间充质干细胞联合给予。
[0129]
在一些实施方式中,本发明方法通过给予llp2a-二膦酸盐/酯偶联物(例 如,式i化合物)促进抗炎性应答。给予本文所述的化合物能够促进局部抗炎性 应答和/或全身抗炎性应答。在一些实施方式中,给予所述化合物,任选地与间 充质干细胞联合给予,能促进全身抗炎性应答。在其它实施方式中,所述化合 物任选联合间充质干细胞的局部应用能实现局部抗炎性应答(例如,炎症位置)。
[0130]
在一些其它实施方式中,本发明方法通过给予llp2a-二膦酸盐/酯偶联物 (例如,式i化合物)来促进免疫应答。给予本文所述的化合物能够促进局部免疫 应答和/或全身免疫应答。在一些实施方式中,所述化合物任选联合间充质干细 胞的给予能促进全身免疫应答。在其它实施方式中,所述化合物任选联合间充 质干细胞的局部应用能实现局部免疫应答(例如,炎症位置)。
[0131]
在一些实施方式中,本发明方法通过给予llp2a-二膦酸盐/酯偶联物(例 如,式i化合物)来增强间充质干细胞(例如,对象的内源性间充质干细胞或给予 对象的外源性间充质干细胞)的抗炎性或免疫调节性质。在一些实施方式中,本 文所述的化合物任选联合间充质干细胞的给予能促进间充质干细胞抗炎性或 一种或多种免疫调节性质的全身性增强。在其它实施方式中,所述化合物任选 联合间充质干细胞的局部应用能实现间充质干细胞抗炎性或一种或多种免疫 调节性质(例如,在炎症位置)的局部增强。
[0132]
在一些实施方式中,本发明方法通过给予llp2a-二膦酸盐/酯偶联物(例 如,式i
化合物)减少关节炎疼痛(例如,类风湿性关节炎或炎性关节炎中)的一种 或多种迹象或症状。在一些实施方式中,所述化合物与间充质干细胞联合给予。 在一些实施方式中,减少的关节炎疼痛的迹象或症状包括但不限于,一个或多 个关节的炎症、肿胀、僵硬或压痛,所述一个或多个关节例如,手、手腕、肘、 踝、趾、膝盖或颈部,或导致麻木或麻刺感的神经附近的结缔组织的炎症。
[0133]
在一些实施方式中,本发明方法能够通过给予llp2a-二膦酸盐/酯偶联物 (例如,式i化合物)来减少、缓解或抑制由关节炎中的炎症所致的结构退化,例 如,软骨和骨损失,所述关节炎或炎症例如,类风湿性关节炎或炎性关节炎。 在一些实施方式中,所述化合物与间充质干细胞联合给予。在一些实施方式中, 本发明方法使关节炎中的炎症所致的软骨或骨损失相对于对照对象(例如,未经 治疗的患有关节炎的对象)减少至少10%、20%、30%、40%、50%或更多。在一 些实施方式中,本发明方法使由关节炎中的炎症所致的软骨或骨损失相对于对 照对象(例如,未经治疗的患有关节炎的对象)延迟数月或数年。
[0134]
待采用本发明方法治疗的个体可以是任何哺乳动物。所述个体包括狗、猫、 马、奶牛或山羊,具体是商业上重要的动物或家养动物,更具体地是人。在一 些实施方式中,由本发明方法治疗需要的对象是已被诊断患有或疑似患有炎性 病症、疾病或紊乱的对象。
[0135]
炎性病症、疾病和紊乱
[0136]
在一些实施方式中,所述炎性病症、疾病或紊乱是原发性炎性疾病或紊乱。 在一些实施方式中,所述炎性病症、疾病或紊乱是原发性炎性骨疾病。在一些 实施方式中,原发性炎性病症、疾病或紊乱选自:关节炎、炎性关节炎、类风 湿性关节炎、滑膜炎、青少年类风湿性关节炎、强直性脊柱炎、银屑病性关节 炎、脊椎关节炎和骨关节炎。在一些实施方式中,所述炎性病症、疾病或紊乱 是类风湿性关节炎。在一些实施方式中,所述炎性病症、疾病或紊乱是滑膜炎。
[0137]
在一些实施方式中,所述炎性病症、疾病或紊乱位于骨、关节或骨相关组 织。在一些实施方式中,所述炎性病症、疾病或紊乱位于一个或多个关节,例 如,滑液关节(例如,膝盖、臀部、肘或腕)。
vi.实施例
[0138]
提供以下实施例,以说明而非限制所要求保护的发明。
[0139]
该实施例说明llp2a-ale在减少炎症和减少免疫系统活性和治疗与炎性疾 病相关联的骨损失中的应用。
[0140]
为了分析llp2a-ale对类风湿性关节炎(包括抗炎性作用和与类风湿性关 节炎相关联的骨损失)的治疗作用,研究类风湿性关节炎的动物模型。模型 "k/bxn"通过将krn tcr转基因c57bl/6小鼠与nod小鼠杂交获得。该血清
‑ꢀ
转移-诱导的关节炎(k/bxn模型)通过针对葡萄糖-6-磷酸异构酶(gpi)的抗体诱 导,并且与人ra共有多项特征,包括自体抗体生成、滑膜炎、白细胞侵入、关 节翳形成、软骨损伤和骨侵蚀。此外,血清-转移诱导的关节炎的特征在于破骨 细胞生成增加和连续的局部与全身骨损失。
[0141]
评估在患有ra的小鼠在接受血清或llp2a-ale治疗之后的骨体积。 c57bl/6小鼠接受k/bxn血清(100μl/小鼠iv,在第0天和第1天)和安慰剂(例如, 载剂)或k/bxn血清(100μl/小鼠iv,在第0天和第1天)和llp2a-ale(100μg/kg, 在第4天通过iv给予)。来自两组的
小鼠在第25天或第46天处死,并通过微ct在 远端股骨和近端胫骨检测骨体积/组织体积分数。在已接受k/bxn血清(100μl/ 小鼠iv,在第0天和第1天)的小鼠中,关节肿胀和小梁骨损失从第7天开始显著, 并在第25天于远端股骨和近端胫骨分别降低22%和19%。参见,图1a。然而, 在接受llp2a-ale治疗的小鼠中未检测到骨损失(图1a-b)。这些结果显示, llp2a-ale的给予预防了骨损失。
[0142]
为了分析llp2a-ale对细胞因子生成的作用,将来自k/bxn llp2a-ale
‑ꢀ
治疗的小鼠的骨髓细胞的细胞因子概况与来自k/bxn 安慰剂-治疗的小鼠的 那些做比较。两月龄的c57bl/6小鼠接受k/bxn血清(100μl/小鼠iv,在第0天和 第2天)和安慰剂(例如,载剂)或k/bxn血清(100μl/小鼠iv,在第0天和第2天)和 llp2a-ale(100μg/kg,在第3天通过iv给予)。小鼠在第25天或第36天处死。在 第25天,对将在第46天处死的小鼠给予第二剂量的llp2a-ale(100μg/kg,通过 iv给予)。在第25天(图2a-b)或第46天(图3a-b)从左大腿骨和胫骨提取骨髓细 胞,并取血清以通过多重(emd密理博(millipore))检测细胞因子(例如,g-csf、 嗜伊红粒细胞趋化蛋白、gm-csf、ifnγ、il-1a、il-1β、il-2、il-4、il-3、il-5、 il-6、il-7、il-9、il-10、il-12(p40)、il-12(p70)、lif、il-13、lix、il-15、 il-17、ip-10kc、mcp-1、mip-1α、mip-1β、m-csf、mip-2、mig、rantes、 vegf和tnfα)概况。在第46天,用lpp2a-ale治疗的k/bxn小鼠中的细胞因子 水平显著低于对照(图3a-b)。llp2a-ale治疗的小鼠中的细胞因子活化的较低 水平能够调节骨形成和骨吸收,由此维持健康的骨稳态。
[0143]
虽然通过阐述和举例的方式详细描述了上述发明以清晰理解,但本发明技 术人员应理解可在所附权利要求书范围内实施某些改变和修改。此外,本文提 供的各参考文献通过引用全文纳入本文,就如同各参考文献单独通过引用纳入 本文。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。