1.本发明属于生物技术领域,涉及一种基于黑猩猩腺病毒表达spike蛋白的新型冠状病毒疫苗。
背景技术:
2.腺病毒由于转导效率高、可携带外源基因,易于扩增及纯化,能够激起针对外源基因有效的t细胞免疫反应,被视为优良的疫苗载体,广泛应用于各种传染病疫苗的研究,包括hiv、流感、埃博拉、疟疾、狂犬病等。其中最常见的是人血清5型腺病毒adhu5。然而,由于75-80%的个体中存在抗adhu5的预存中和抗体,以adhu5为载体的疫苗,其免疫效果受预存中和抗体的影响,不仅削弱其免疫效果,而且可能增强副反应。
技术实现要素:
3.本发明的目的是提供一种基于黑猩猩腺病毒表达spike蛋白的新型冠状病毒疫苗。
4.本发明提供了一种重组腺病毒,是将含有sars-cov-2的spike蛋白的编码基因的 dna分子插入黑猩猩型腺病毒adc6的基因组dna得到的,表达sars-cov-2的spike 蛋白的重组腺病毒。所述插入为广义插入,既可以为插入两个相邻核苷酸之间,也可以为插入不相邻核苷酸之间(即替换部分核苷酸)。含有sars-cov-2的spike蛋白的编码基因的dna分子具体可为用于表达sars-cov-2的spike蛋白的表达框。
5.本发明还保护一种重组腺病毒,其基因组dna自上游至下游依次包括如下三个区段:序列表的序列3中第1-589位核苷酸所示的dna区段、特定表达框、序列表的序列 3中第721-30394位核苷酸所示的dna区段;所述特定表达框为用于表达sars-cov-2 的spike蛋白的表达框。具体来说,所述重组腺病毒的基因组dna由所述三个区段组成。
6.本发明还保护一种重组腺病毒,其制备方法包括如下步骤:
7.(1)以adc6-δe1-δe3-e4(orf6hu5)为出发载体,插入特定表达框,得到重组腺病毒质粒;所述特定表达框为用于表达sars-cov-2的spike蛋白的表达框;
8.(2)将所述重组腺病毒质粒转染腺病毒包装细胞,然后进行细胞培养,得到重组腺病毒。
9.所述插入为广义插入,既可以为插入两个相邻核苷酸之间,也可以为插入不相邻核苷酸之间(即替换部分核苷酸)。
10.所述特定位点为δe1区域中的任意位点或δe3区域中的任意位点。
11.所述重组腺病毒质粒具体可为:用所述特定表达框取代腺病毒质粒 padc6-δe1-δe3-e4(orf6hu5)中的小区段(该小区段即序列表的序列3中第590-720 位核苷酸),得到的重组腺病毒质粒padc6-cov19。
12.本发明还保护一种产品,其活性成分为以上任一所述重组腺病毒;
13.所述产品的用途为如下(c1)或(c2):
14.(c1)作为新型冠状病毒疫苗;
15.(c2)作为抗新型冠状病毒药物。
16.本发明还保护以上任一所述重组腺病毒的应用,为如下(d1)或(d2)或(d3) 或(d4):
17.(d1)制备新型冠状病毒疫苗;
18.(d2)制备抗新型冠状病毒药物;
19.(d3)作为新型冠状病毒疫苗;
20.(d4)作为抗新型冠状病毒药物。
21.本发明还保护一种重组腺病毒质粒,其制备方法包括如下步骤:以 adc6-δe1-δe3-e4(orf6hu5)为出发载体,插入特定表达框,得到重组腺病毒质粒;所述特定表达框为用于表达sars-cov-2的spike蛋白的表达框。
22.所述插入为广义插入,既可以为插入两个相邻核苷酸之间,也可以为插入不相邻核苷酸之间(即替换部分核苷酸)。
23.所述特定位点为δe1区域中的任意位点或δe3区域中的任意位点。
24.所述重组腺病毒质粒具体可为:用所述特定表达框取代腺病毒质粒 padc6-δe1-δe3-e4(orf6hu5)中的小区段(该小区段即序列表的序列3中第590-720 位核苷酸),得到的重组腺病毒质粒padc6-cov19。
25.本发明还保护所述重组腺病毒质粒的应用,为如下(e1)或(e2):
26.(e1)制备新型冠状病毒疫苗;
27.(e2)制备抗新型冠状病毒药物。
28.以上任一所述疫苗为治疗性和/或预防性疫苗。
29.以上任一所述sars-cov-2的spike蛋白为如下(a1)或(a2)或(a3):
30.(a1)序列表中序列1所示的蛋白质;
31.(a2)将(a1)经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与其具有相同功能的蛋白质;
32.(a3)来源于sars-cov-2且与(a1)具有98%以上同一性且与其具有相同功能的蛋白质。
33.以上任一所述sars-cov-2的spike蛋白的编码基因为如下(b1)或(b2)或(b3):
34.(b1)编码区如序列表中序列2中第705-4526位核苷酸所示的dna分子;
35.(b2)在严格条件下与(b1)杂交且编码所述蛋白质的dna分子;
36.(b3)来源于sars-cov-2且与(b1)限定的dna分子至少具有70%、至少具有 75%、至少具有80%、至少具有85%、至少具有90%、至少具有95%、至少具有96%、至少具有97%、至少具有98%或至少具有99%同源性且编码所述蛋白质的dna分子。
37.所述严格条件可为如下:50℃,在7%十二烷基硫酸钠(sds)、0.5m na3po4和1mmedta的混合溶液中杂交,在50℃,2
×
ssc,0.1%sds中漂洗;还可为:50℃,在7% sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃,1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta的混合溶液中杂交,在50℃, 0.5
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、0.5m na3po4和1mm edta 的混合溶液中杂交,在50℃,0.1
×
ssc,0.1%sds中漂洗;还可为:50℃,在7%sds、 0.5m na3po4和1mm edta的混合溶液中杂交,在
65℃,0.1
×
ssc,0.1%sds中漂洗;也可为:在6
×
ssc,0.5%sds的溶液中,在65℃下杂交,然后用2
×
ssc,0.1%sds 和1
×
ssc,0.1%sds各洗膜一次。
38.以上任一所述特定表达框包括如下区段:启动子、sars-cov-2的spike蛋白的编码基因、终止子。所述启动子具体可为cmv启动子。所述终止子具体可为bghploya。
39.以上任一所述特定表达框具体可为如下(f1)或(f2):
40.(f1)序列表中序列2中第12-4768位核苷酸所示的dna分子;
41.(f2)序列表中序列2所示的dna分子。
42.以上任一所述δe1区域具体可为序列表的序列3中的“taactataacggtcctaaggtagcgagagacccaagctggctagcgtttaaacgggccctctagactcgagc ggccgccactgtgctggatgatccgagctcggtaccaagcttaagtttaaaccgctgatcaatctatgtcgggt gcggagaaagaggtaatgaaatggca”。
43.以上任一所述δe3区域具体可为序列表的序列3中的“atttaaatcagtcagctaatgcgatttaaat”。
44.具体的,腺病毒质粒padc6-δe1-δe3-e4(orf6hu5)如序列表的序列3所示。
45.以上任一所述腺病毒包装细胞具体可为hek 293细胞。
46.本发明中,以腺病毒质粒padc6-δe1-δe3-e4(orf6hu5)为出发载体,在其δe1 区域插入sars-cov-2的全长spike基因,得到了重组腺病毒质粒padc6-cov19,进一步的将重组腺病毒质粒padc6-cov19转染细胞,得到了重组腺病毒adc6-cov19。本发明的重组腺病毒adc6-cov19中,黑猩猩型腺病毒adc6作为载体表达sars-cov-2的 spike蛋白。黑猩猩型腺病毒adc6在人群中预存中和抗体较低,仅为3%-21%。本发明的重组腺病毒adc6-cov19作为疫苗,可以引起特异性免疫反应。
47.本发明对于covid-19的防控具有重大的应用推广价值。
附图说明
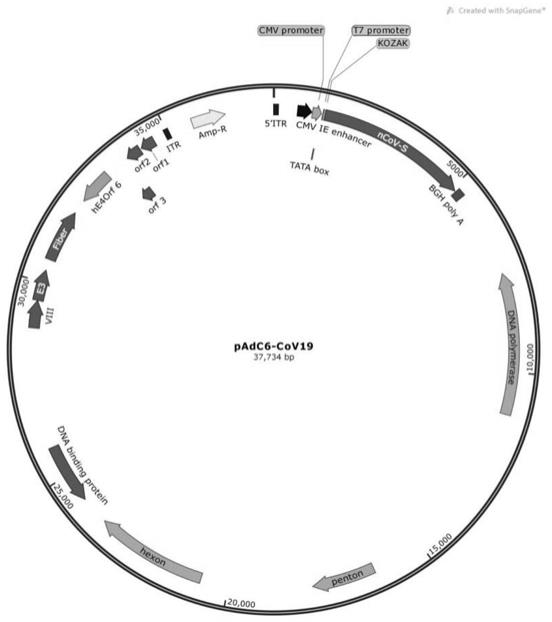
48.图1为重组腺病毒质粒padc6-cov19的结构示意图。
49.图2为重组腺病毒质粒padc6-cov19的酶切产物电泳图。
50.图3为重组腺病毒adc6-cov19的酶切产物电泳图。
51.图4为实施例1中western blot的结果图。
52.图5为实施例2中elisa检测抗原特异性结合抗体的结果图。
53.图6为实施例2中中和抗体检测的结果图。
54.图7为实施例2中流式细胞术检测cd8 tnf-α 的表达的统计结果。
55.图8为实施例2中elispot检测ifn-γ的表达的结果照片。
56.图9为实施例2中斑点形成细胞(sfc)所占比例的统计结果。
具体实施方式
57.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
58.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所
描述的技术或条件或者按照产品说明书进行。如无特殊说明,实施例中的细胞培养条件均为:37℃、5%co2。如无特殊说明,实施例中的细胞培养均采用含10%胎牛血清的高糖dmem培养基。如无特殊说明,以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。hek 293细胞:中国科学院上海细胞库。c57 bl/6雌鼠:斯贝福(北京) 生物技术有限公司。
59.实施例1、重组腺病毒的制备和鉴定
60.一、重组腺病毒质粒padc6-cov19的构建
61.腺病毒质粒padc6-δe1-δe3-e4(orf6hu5)如序列表的序列3所示(环形质粒)。
62.spike表达框如序列表的序列2所示。序列2中,第12-613位核苷酸组成cmv启动子,第705-4526位核苷酸组成sars-cov-2的spike基因(编码序列表的序列1所示的spike蛋白),第4553-4768位核苷酸组成bghploya。
63.用spike表达框取代腺病毒质粒padc6-δe1-δe3-e4(orf6hu5)中的小区段(该小区段即序列表的序列3中第590-720位核苷酸),得到重组腺病毒质粒padc6-cov19。已进行测序验证。
64.重组腺病毒质粒padc6-cov19的结构示意图见图1。
65.取重组腺病毒质粒padc6-cov19,采用限制性内切酶apai、bglⅱ、xhoi分别进行酶切鉴定。酶切产物电泳图见图2。与酶切图谱片段大小分析相同,证明重组腺病毒载体构建成功。
66.二、重组腺病毒的制备
67.1、取重组腺病毒质粒padc6-cov19,采用限制性内切酶pac i进行酶切,使其线性化,得到线性化质粒。
68.2、借助lipofectatime
tm 3000(按说明书操作)将步骤1得到的线性化质粒转染 hek 293细胞,培养细胞,第5天时可观察到细胞出现明显噬斑,第9天时可以观察到细胞变圆、悬浮,此时收集细胞,反复冻融三次,收集上清液。
69.3、取步骤2得到的上清液,感染hek 293细胞,24小时后可以观察到细胞变圆、悬浮,完全病变,此时收集细胞,反复冻融三次,收集上清液。可按照本步骤的方法多次扩繁。
70.4、取步骤3得到的上清液,利用氯化铯密度梯度离心法进行病毒纯化,得到含有重组腺病毒的病毒液。
71.5、取步骤4得到的病毒液,加入甘油并使其在体系中的浓度为10g/100ml,-80℃保存。
72.6、取步骤4得到的病毒液,提取基因组dna,采用限制性内切酶apai、bglⅱ、 xhoi分别进行酶切鉴定。酶切产物电泳图见图3。显示酶切片段正确,表明重组腺病毒包装正确,在扩增过程中无片段丢失或插入。
73.7、取步骤4得到的病毒液,采用吸光光度值法检测病毒液的滴度。
74.病毒液的滴度=od260
×
稀释倍数
×
1.1
×
10
12
。
75.病毒液的滴度的单位为病毒颗粒数/毫升(vp/ml)。
76.步骤4得到的病毒液的滴度为8.2
×
10
12
vp/ml。
77.将步骤二得到的重组腺病毒命名为重组腺病毒adc6-cov19。
78.重组腺病毒adc6-cov19的全基因组dna自上游至下游依次由如下三个区段组成:
序列表的序列3中第1-589位核苷酸所示的dna区段、序列表的序列2所示的dna区段、序列表的序列3中第721-30394位核苷酸所示的dna区段。
79.三、对照腺病毒的制备
80.用腺病毒质粒padc6-δe1-δe3-e4(orf6hu5)代替重组腺病毒质粒padc6-cov19,按照步骤二操作,得到对照腺病毒,命名为对照腺病毒adc6-empty。
81.四、目的蛋白表达的检测
82.1、取6孔细胞培养板,接种hek 293细胞(5
×
105/孔),培养过夜。
83.2、取完成步骤1的细胞培养板,感染步骤二制备的重组腺病毒adc6-cov19(设置三个感染剂量,分别为:108vp/孔、109vp/孔、10
10
vp/孔)或者步骤三制备的对照腺病毒adc6-empty(感染剂量为10
10
vp/孔),然后培养24小时。
84.3、完成步骤2后,弃上清,用pbs缓冲液洗涤细胞沉淀,然后将每孔得到的细胞沉淀与200μl ripa裂解液混合,冰上裂解10min,得到裂解液。
85.4、取步骤3得到的裂解液,进行western blot。western blot采用的一抗为 anti-sars-cov-2(2019-ncov)spike rbd antibody(义翘神州,40592-t62)。westernblot检测中,采用α-tubulin作为内参蛋白。
86.结果图见图4。adc6-cov19成功表达spike蛋白,且表达量与重组腺病毒感染量呈剂量依赖性,随病毒量的增大而增强。
87.实施例2、重组腺病毒作为疫苗的效果
88.一、分组免疫
89.6-8周龄c57 bl/6雌鼠,分为两组,每组5只。
90.对照组:每只小鼠肌肉免疫2
×
10
10
vp实施例1的步骤三制备的对照腺病毒 adc6-empty;
91.实验组:每只小鼠肌肉免疫2
×
10
10
vp实施例1的步骤二制备的重组腺病毒 adc6-cov19。
92.二、elisa检测抗原特异性结合抗体
93.步骤一中,免疫后2周、4周、6周、8周和10周,分别通过脸颊取血,分离血清。
94.采用无菌pbs缓冲液梯度稀释血清,得到不同浓度的血清稀释液。
95.采用elisa检测血清稀释液中的抗原特异性结合抗体。抗原特异性结合抗体包括总lgg及其分型(lgg1、lgg2a、lgg2b)。
96.以200ng/孔sars-cov-2spike蛋白(义翘神州,40589-v08b1)包被酶标板。一抗采用:血清稀释液。二抗分别采用:anti-mouse igg hrp(abcam,ab6789)、anti-mouseigg1-hrp(southernbiotech,1144-05)、anti-mouse igg2a-hrp(southernbiotech, 1155-05)、anti-mouse igg2b-hrp(southernbiotech,1186-05)。
97.结果见图5。图5的a为总lgg的检测结果。图5的b为免疫后2周lgg1、lgg2a、 lgg2b的检测结果。免疫后2周,实验组小鼠针对spike蛋白的特异性总lgg的终点效价达到了39810,且在免疫后8周仍没有下降趋势。进一步检测结合抗体分型发现,重组腺病毒疫苗主要引起的是lgg2型抗体反应。
98.三、中和抗体检测
99.1、制备sars-cov-2假病毒
100.表达全长sars-cov-2spike蛋白的质粒和骨架质粒pnl4-3.luc-r-e共转染293t 细胞,孵育后能够得到具有感染性但没有复制能力的sars-cov-2假型病毒,其感染性同活病毒相似。
101.将sars-cov-2spike基因(序列表的序列2中第699-4526位核苷酸所示的dna 分子)插入到pcdna3.1( )载体的nhei和ecorv酶切位点之间,得到重组质粒 pcdna3.1-spike。
102.将重组质粒pcdna3.1-spike与骨架质粒pnl4-3.luc-r-e共转染293t细胞,培养48小时,收集上清液,采用peg8000进行纯化浓缩,得到病毒液,即为含有sars-cov-2 假病毒的病毒液。
103.2、制备血清稀释液
104.步骤一中,免疫后2周、4周和6周,分别脸颊取血,分离血清。采用无菌pbs 缓冲液梯度稀释血清,得到不同浓度的血清稀释液。
105.3、中和抗体检测
106.(1)取细胞培养板,接种hek 293t细胞,培养至细胞汇合度达80%。
107.(2)将人ace2基因(序列表的序列4所示的dna分子)插入到 plvx-ires-puro-3xflag载体的xbai和xhoi酶切位点之间,得到重组质粒 plvx-ace2-puro。已进行测序验证。
108.(3)借助lipofectatimetm 3000(按说明书操作)将重组质粒plvx-ace2-puro 导入完成步骤(1)的hek 293t细胞,培养7小时,得到ace2
hek 293t细胞。
109.(4)将步骤(3)得到的ace2
hek 293t细胞用0.25%胰酶消化,然后接种于96 孔细胞培养板(每孔100μl,约含2
×
104个细胞),然后加入每孔加入100μl混合液,孵育48小时。
110.混合液:50μl步骤1制备的含有sars-cov-2假病毒的病毒液(病毒含量为100 tcid50)和50μl步骤2制备的血清稀释液混匀,得到100μl混合液。
111.设置用等体积无菌pbs缓冲液代替血清稀释液的空白对照,设置3个复孔。
112.每种血清稀释液处理设置3个复孔。结果取平均值。
113.(5)完成步骤(4)后,采用luciferase检测试剂盒(promega,e2550)并按说明书进行操作,检测荧光素酶活性。
114.中和活性=(空白对照组的荧光强度-加入血清稀释液的实验组的荧光强度)/空白对照组的荧光强度
×
100%。中和活性为50%时对应的血清稀释倍数即为ic
50
值。
115.结果见图6。免疫后2周中和抗体水平达到200,第4周升高至631,第6周仍维持在该水平。
116.四、细胞免疫反应的检测
117.sars-cov-2spike subpool1(序列1所示spike蛋白的前1-643氨基酸)和 sars-cov-2spike subpool2(序列1所示spike蛋白的633-1273氨基酸),均为同一试剂盒的组件,该试剂盒为南京金斯瑞产品,货号为rp30020。
118.1、步骤一中免疫后10周,颈椎脱臼法处死小鼠,取脾脏,分离脾细胞。
119.2、取脾细胞,用1.25μg/ml的sars-cov-2spike subpool1或sars-cov-2spikesubpool2刺激5.5小时,然后流式细胞术检测相关细胞因子表达cd8 tnf-α 的表达。其中,使用的抗体信息如下:ms cd3e percp-cy5.5 145-2c11(551163),ms cd8a pe-cy7 (bd,
552877),ms tnf bv421(bd,563387),cd16/cd32 monoclonal antibody (ebioscience,16-0161-82)。
120.流式细胞术检测cd8 tnf-α 的表达的统计结果见图7。
121.3、取脾细胞,采用elispot试剂盒(mabtech,3321-2h)并按说明书操作,检测 ifn-γ的表达。
122.elispot检测ifn-γ的表达的结果照片见图8,斑点形成细胞(sfc)所占比例的统计结果见图9。
123.结果表明,重组腺病毒疫苗可以刺激小鼠引起th1细胞免疫反应,产生针对 sars-cov-2spike subpool1的tnf-α和ifn-γ,而针对sars-cov-2spike subpool 2的t细胞反应不明显。
124.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。