表征和利用药剂-凝聚物相互作用的方法
1.相关申请
2.本技术要求2019年5月15日提交的美国临时申请序列第62/848,539号、和2019年10月28日提交的美国临时申请序列第62/927,073号的权益,所述临时申请的内容据此以引用的方式整体并入。
3.政府支持
4.本发明是在国家卫生研究院(the national institutes of health)授予的gm123511、ca213333和ca155258、以及国家科学基金会(the national science foundation)授予的phy1743900的政府支持下进行的。政府对本发明具有一定权利。
背景技术:
5.占据超级增强子的转录因子和辅助因子形成液体样凝聚物,其在关键细胞身份基因处区室化和聚集转录装置。肿瘤细胞获取在驱动器癌基因(driver oncogene)处的很大的超级增强子,因而促成转录失调,这是癌症的标志。
技术实现要素:
6.本文中显示转录凝聚物参与驱动肿瘤发生并为癌症治疗中的新进入点提供框架。对转录机器关键的多种蛋白质存在于这些结构内的发现可能使得以前不能药物控制的靶标(由于它们的无序性质)作为药物靶标具有吸引力。出乎意料地,本文中显示一些药剂(例如小分子)独立于药剂靶标的存在进入转录凝聚物。本文所公开的测量药剂可以进入凝聚物的程度和药剂对不同类型的凝聚物(例如,转录凝聚物、异染色质或阻抑凝聚物、剪接斑点凝聚物、核仁、染色质凝聚物、多梳凝聚物、dna损伤修复凝聚物)具有的特异性的方法提供了关于药物暴露和脱靶效应的有价值的信息。本文所公开的方法可以确定有多少药物被分配到凝聚物中以及有多少被分配在凝聚物外部以帮助确定候选物在细胞或生物体中的功效。还提供了经由调节在药剂或凝聚物组分上的芳香族侧链的数目来调节药剂在凝聚物中的掺入的方法。此外,确定药物在凝聚物中如何起作用可以使得能够采用已知的药物用于新的目的。
7.本发明的一些方面涉及表征药剂的方法,所述方法包括使所述药剂与包含具有至少一种组分的凝聚物的组合物接触,以及测量所述药剂在所述凝聚物中的掺入。在一些实施方案中,在没有在药剂上使用可检测标签的情况下检测所述药剂在所述凝聚物中的掺入。在一些实施方案中,使用拉曼光谱法、分光光度法和定量相位显微术或旋转沉降测定(spin down assay)来检测药剂在凝聚物中的掺入。在一些实施方案中,所述药剂包含可检测标签。在一些实施方案中,所述组分或凝聚物包含可检测标签。在一些实施方案中,所述可检测标签是荧光标签。
8.在一些实施方案中,所述方法包括使具有可检测标签的药剂与所述包含凝聚物的组合物接触,测量所述具有可检测标签的药剂在所述凝聚物中的掺入,使所述包含凝聚物的组合物和所述具有可检测标签的药剂与不具有可检测标签的对照药剂接触,以及再次测
量所述具有可检测标签的药剂在所述凝聚物中的掺入。
9.在一些实施方案中,所述方法包括使所述药剂与具有一种或多种不同组分的多种凝聚物接触。在一些实施方案中,所述方法包括使所述药剂与各自包含具有至少一种不同组分的凝聚物的多种组合物接触。在一些实施方案中,所述方法包括使多种药剂与各自包含具有相同组分的凝聚物的多种组合物接触。
10.在一些实施方案中,所述至少一种组分是转录凝聚物组分、异染色质凝聚物组分、与mrna起始物理地相关的凝聚物组分、与mrna延伸物理地相关的凝聚物组分、染色质凝聚物组分、多梳凝聚物组分或dna损伤修复凝聚物组分。在一些实施方案中,所述至少一种组分是介体、介体组分、med1、brd4、polii(即,pol2)、srsf2、fib1、npm1、hp1α、组蛋白、组蛋白尾部部分、多梳阻抑复合物1(prc1)组分(例如cbx2)或53bp1。在一些实施方案中,所述至少一种组分是超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物的组分或其功能部分。在一些实施方案中,所述组分包含固有无序区(idr)。
11.在一些实施方案中,所述组分包含与所述药剂不同的可检测标签。在一些实施方案中,相对于对照测量了所述药剂的掺入。在一些实施方案中,测量多种药剂的掺入并彼此进行比较。
12.在一些实施方案中,所述药剂能够结合靶标。在一些实施方案中,凝聚物不包含靶标。在一些实施方案中,靶标主要存在于凝聚物外部。在一些实施方案中,靶标主要存在于凝聚物中。在一些实施方案中,靶标是治疗靶标。在一些实施方案中,靶标是酶、受体、配体、癌基因、癌基因产物或转录因子。在一些实施方案中,靶标是基因组dna。在一些实施方案中,组合物包含靶标。
13.在一些实施方案中,测量掺入凝聚物中或未掺入凝聚物中的药剂的相对量。在一些实施方案中,凝聚物与dna物理地缔合。
14.在一些实施方案中,凝聚物在细胞中。在一些实施方案中,细胞是患病细胞。在一些实施方案中,凝聚物在体外。在一些实施方案中,药剂是小分子、多肽或核酸。在一些实施方案中,药剂是已知的化学治疗剂。在一些实施方案中,药剂是候选化学治疗剂。在一些实施方案中,药剂是或包含顺铂或其衍生物。在一些实施方案中,药剂是或包含jq1((s)-叔-丁基2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂卓-6-基)乙酸酯)或其衍生物。在一些实施方案中,药剂是或包含他莫昔芬或其衍生物。
[0015]
本发明的一些方面涉及表征第一药剂的方法,所述方法包括使所述第一药剂与包含具有至少一种组分的凝聚物的组合物接触,其中所述凝聚物含有至少第二药剂,并且测量所述第一药剂从所述凝聚物中逐出所述第二药剂的能力。在一些实施方案中,所述第二药剂包含可检测标签。在一些实施方案中,所述可检测标签是荧光标签。在一些实施方案中,所述凝聚物组分是第二药剂的靶标。
[0016]
本发明的一些方面涉及包含凝聚物和具有治疗靶标的药剂的组合物,其中所述凝聚物不包含所述治疗靶标。在一些实施方案中,所述治疗靶是基因组dna。
[0017]
如下文实施例中所示,不优先分配到凝聚物中的染料可以通过与药剂或部分偶联而被修饰以优先分配到凝聚物中。本发明的一些方面涉及调节第一药剂向凝聚物中的分配
的方法,所述方法包括将所述第一药剂与第二药剂偶联,从而调节所述第一药剂向所述凝聚物中的分配。在一些实施方案中,所述凝聚物选自超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物或核仁。在一些实施方案中,增加了所述第一药剂向所述凝聚物中的分配。在一些实施方案中,减少了所述第一药剂向所述凝聚物中的分配。在一些实施方案中,与未偶联的第一药剂相比,所述偶联的第一药剂的治疗功效增加了。在一些实施方案中,与未偶联的第一药剂相比,所述偶联的第一药剂的不良反应减少了。
[0018]
还如下文实施例中所示,增加药剂的芳香族侧链含量增加了药剂在med1体外凝聚物(即液滴)中的分配。本发明的一些方面涉及通过修饰药剂以增加或减少芳香族侧链的数目来调节药剂向凝聚物中的分配的方法。在一些实施方案中,与未经修饰的药剂相比,经修饰的药剂向凝聚物中的分配增加了。在一些实施方案中,与未经修饰的药剂相比,经修饰的药剂的分配减少了。
[0019]
本公开的一些方面涉及筛选具有调节的凝聚物分配的候选药剂的方法,所述方法包括修饰具有凝聚物分配系数的药剂并且测量经修饰的药剂的凝聚物分配系数,其中如果经修饰的药剂具有与所述药剂不同的分配系数,则将经修饰的药剂鉴定为具有调节的凝聚物分配的候选药剂。在一些实施方案中,在体外凝聚物中测量经修饰的药剂的凝聚物分配系数。在一些实施方案中,在细胞中的凝聚物中测量经修饰的药剂的凝聚物分配系数。在一些实施方案中,如果候选药剂已经增加向具有候选药剂的治疗靶标的凝聚物中的分配,则将所述候选药剂鉴定为改进的候选药剂。在一些实施方案中,如果候选药剂已经减少向不具有候选药剂的治疗靶标的凝聚物中的分配,则将所述候选药剂鉴定为改进的候选药剂。在一些实施方案中,具有调节的凝聚物分配的候选药剂是化学治疗剂。在一些实施方案中,所述修饰包括增加或减少所述药剂的芳香族侧链的数目。
[0020]
本发明的一些方面涉及减少癌基因的转录的方法,所述方法包括通过使与所述癌基因相关的转录凝聚物与药剂接触来调节所述转录凝聚物的组成、溶解或解离。
[0021]
在一些实施方案中,所述药剂溶解所述转录凝聚物,引起所述转录凝聚物与包含所述癌基因的基因组dna解偶联,或逐出所述转录凝聚物的一种或多种组分。在一些实施方案中,所述药剂是抑制剂、嵌入剂或细胞周期蛋白依赖性激酶抑制剂。在一些实施方案中,所述药剂与所述转录凝聚物的组分结合。在一些实施方案中,所述药剂优先聚集在所述转录凝聚物中。在一些实施方案中,所述凝聚物位于细胞中。在一些实施方案中,所述细胞是癌细胞。
[0022]
在一些实施方案中,向患有癌症的受试者施用所述药剂。在一些实施方案中,所述癌症是结肠癌、淋巴瘤、多发性骨髓瘤、前列腺癌或乳腺癌。
[0023]
本发明的一些方面涉及治疗需要治疗以癌基因的转录为特征的癌症的受试者的方法,所述方法包括向所述受试者施用调节与所述癌基因相关的转录凝聚物的组成、溶解或解离的药剂。在一些实施方案中,所述药剂是抑制剂、嵌入剂或细胞周期蛋白依赖性激酶抑制剂。在一些实施方案中,所述药剂与所述转录凝聚物的组分结合。在一些实施方案中,所述药剂优先聚集在所述转录凝聚物中。在一些实施方案中,所述癌症是结肠癌、淋巴瘤、多发性骨髓瘤、前列腺癌或乳腺癌。
[0024]
在一些实施方案中,所述受试者是人。在一些实施方案中,所述药剂经口、皮下、局部或静脉内施用于所述受试者。在一些实施方案中,药剂是小分子、多肽或核酸。
[0025]
本公开的一些方面涉及抑制与转录凝聚物相关的转录的方法,所述方法包括抑制与所述转录凝聚物相关的核受体结合具有lxxll结构域的辅助因子,其中通过使所述凝聚物与结合所述lxxll结构域的肽接触来抑制所述结合。
[0026]
在一些实施方案中,核受体是核激素受体、雌激素受体或视黄酸受体α。在一些实施方案中,辅助因子是med1。在一些实施方案中,癌基因的转录被抑制。在一些实施方案中,转录凝聚物位于细胞中。在一些实施方案中,所述细胞是癌细胞。在一些实施方案中,将肽施用于受试者。在一些实施方案中,所述受试者患有癌症。
[0027]
本发明的一些方面涉及抑制与转录凝聚物相关的转录的方法,所述方法包括抑制具有lxxll结合结构域并且与转录凝聚物相关的核受体结合具有lxxll结构域的辅助因子,其中通过使所述凝聚物与结合所述lxxll结构域的肽接触来抑制所述结合。
[0028]
在一些实施方案中,核受体是核激素受体、雌激素受体或视黄酸受体α。在一些实施方案中,辅助因子是med1。在一些实施方案中,癌基因的转录被抑制。在一些实施方案中,转录凝聚物位于细胞中。在一些实施方案中,所述细胞是癌细胞。在一些实施方案中,将肽施用于受试者。在一些实施方案中,所述受试者患有癌症。
[0029]
本发明的一些方面涉及包含细胞的组合物,所述细胞包含具有第一可检测标记的第一凝聚物和具有不同的第二可检测标记的第二凝聚物,其中所述第一凝聚物和所述第二凝聚物是选自超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物的不同凝聚物类型。在一些实施方案中,组合物还包含与细胞接触的药剂。在一些实施方案中,所述药剂是已知的治疗剂。在一些实施方案中,所述药剂是候选治疗剂。在一些实施方案中,所述第二可检测标记与所述第一可检测标记可检测区分。
[0030]
本发明的一些方面涉及组合物,所述组合物包含第一体外凝聚物、第二体外凝聚物以及与所述第一体外凝聚物和所述第二体外凝聚物接触的药剂。在一些实施方案中,所述第一体外凝聚物、所述第二体外凝聚物和所述药剂中的至少一者包含可检测标记。在一些实施方案中,所述组合物还包含各自与所述药剂接触的第三体外凝聚物和任选的第四体外凝聚物。在一些实施方案中,所述体外凝聚物中的至少一种包含转录凝聚物、超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物的组分或其功能片段。一些实施方案涉及制品,所述制品包含与药剂接触的第一体外凝聚物、与相同药剂接触的第二体外凝聚物、以及将所述第一体外凝聚物和所述第二体外凝聚物分离到单独的孔中的多孔板。在一些实施方案中,所述制品还包含与所述药剂接触的至少第三体外凝聚物。在一些实施方案中,所述制品还包含与所述药剂接触的至少第四体外凝聚物。所述第一体外凝聚物、所述第二体外凝聚物、所述第三体外凝聚物和所述第四体外凝聚物可以各自包含不同凝聚物(例如,超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物)的组分或其功能片段。所述第一体外凝聚物、所述第二体外凝聚物、所述第三体外凝聚物和所述第四体外凝聚物可以各自包含不同的可检测标记。
[0031]
本发明的一些方面涉及评估对药剂有抗性的细胞对一种或多种凝聚物组分的差异表达是否引起或促成所述抗性的方法,所述方法包括提供药剂抗性细胞,使所述药剂抗性细胞与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。
[0032]
本发明的一些方面涉及评估对药剂有抗性的细胞对一种或多种凝聚物组分的差异表达是否引起或促成所述抗性的方法,所述方法包括提供从药剂抗性细胞中分离的凝聚物,使所述凝聚物与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。
[0033]
本发明的一些方面涉及评估对药剂有抗性的细胞对一种或多种凝聚物组分的差异表达是否引起或促成所述抗性的方法,所述方法包括提供包含差异量的在药剂抗性细胞中差异地表达的凝聚物组分或其片段的体外凝聚物(例如液滴),使所述凝聚物与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。
[0034]
本发明的一些方面涉及评估对药剂有抗性的细胞对一种或多种凝聚物组分的差异表达是否引起或促成所述抗性的方法,所述方法包括提供包含与药剂抗性细胞中的突变凝聚物组分对应的突变凝聚物组分或其片段的体外凝聚物(例如液滴),使所述凝聚物与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。
[0035]
本发明的一些方面涉及表征药剂抗性凝聚物的方法,所述方法包括使所述凝聚物与一种或多种第二药剂接触,并且评估药剂定位、浓度或治疗活性和/或凝聚物形态、稳定性或溶解度中的至少一种。在一些实施方案中,使所述第二药剂与包含所述药剂抗性凝聚物的细胞接触。在一些实施方案中,凝聚物已经从细胞中分离。在一些实施方案中,凝聚物是体外凝聚物(例如液滴)。在一些实施方案中,凝聚物包含与对药剂的抗性相关的凝聚物组分或其片段的突变形式。
附图说明
[0036]
该专利或申请文件含有至少一张以彩色完成的附图。具有彩色附图的本专利或专利申请公开的副本将由办公室在请求和支付必要费用后提供。
[0037]
图1是显示转录装置的改变是癌症的标志的示意图。改编自bradner,hnisz and young,cell 2017。
[0038]
图2显示了鉴定超级增强子的chip-seq数据。超级增强子是调控在细胞身份中具有突出作用的基因的增强子大簇,其被异常高密度的富含固有无序结构域的蛋白质和高水平的erna占据。改编自hnisz et al.,cell(2013)。
[0039]
图3显示了肿瘤细胞获取可以通过dna中的小变化成核的在驱动器癌基因处的异常大的超级增强子,并且对转录药物特别敏感。插图改编自mansour等人science(2014)以及loven等人cell(2013)。
[0040]
图4显示了转录因子和介体共活化剂有助于在超级增强子处形成凝聚物。参见sabari,dall’agnese等人,science 2018;cho,spille等人,science 2018;以及boija,klein等人,cell 2018。
[0041]
图5显示了可以通过相分离生产生物分子凝聚物。改编自brangwynne cp.jcb 2013。
[0042]
图6显示了转录凝聚物参与癌基因表达并且是可利用的治疗靶标。txex-转录酶;tf-转录因子;coa-共活化剂;se驱动的癌基因-超级增强子驱动的癌基因。
[0043]
图7a-7c显示了含有驱动器转录因子(tf)和介体的med1亚基的转录凝聚物在人肿瘤组织中的myc癌基因处发生。图7a显示了癌乳腺癌、以及er 乳腺癌的h&e染色。图7b显示
了使用抗med1的抗体(med1 if)或抗雌激素受体的抗体(er if)、随后使用myc rna fish对er 乳腺癌组织的免疫荧光显微术。右上图(合并变焦)显示med1和myc转录共定位于凝聚物中。右下图显示雌激素受体和myc转录共定位于凝聚物中。图7c显示了使用抗med1的抗体(med1 if)或抗雌激素受体的抗体(er if)、随后使用myc dna fish对er 乳腺癌组织的免疫荧光显微术。右上图(合并变焦)显示med1和myc基因共定位于凝聚物中。右下图显示雌激素受体和myc基因共定位于凝聚物中。
[0044]
图8显示介体凝聚物存在于多种癌细胞类型中的myc上。
[0045]
图9显示了er结合的dna促进med1凝聚物形成。在存在具有er结合位点的dna、但不存在对照dna或不存在dna的情况下,med1和er在体外液滴测定中形成液滴。所有测试均在雌激素的存在下进行。
[0046]
图10a-10d显示了配体依赖性凝聚物形成将相分离与癌基因表达联系起来。图10a显示了在雌激素的存在下而不是在不存在雌激素的情况下或在雌激素和他莫昔芬的存在下med1与myc dna一起共定位于凝聚物中。图10b显示了在雌激素的存在下myc表达增加,而在雌激素和他莫昔芬的存在下降低至组成型水平。图10c显示了在雌激素的存在下er被掺入到凝聚物中,但在雌激素和他莫昔芬的存在下不被掺入到凝聚物中。在顶行描绘了er液滴,在中间行描绘了med1液滴,并且在底行描绘了er和med1液滴的合并。图10d显示了在雌激素的存在下在med1凝聚物中er的富集比率显著增加。
[0047]
图11显示了转录凝聚物是多组分结构。使用if和myc fish,证实了brd4、p300、cdk7、cdk6、蛋白体和拓扑异构酶与myc转录的凝聚物中的共定位。在卵巢癌细胞中检测到p300和cdk7。在乳腺癌细胞系mcf7中检测到所有其它组分。
[0048]
图12显示了转录凝聚物是多组分结构。
[0049]
图13显示了用于测定小分子对转录凝聚物的影响的工具。用med1-gfp、brd4-gfp、pol2-gfp或hp1a-gfp(模拟物)内源性地标记的hct116结肠癌细胞系全部都在细胞核中形成凝聚物。
[0050]
图14a-14d显示了jq1溶解基因组转录凝聚物。图14a显示了jq1减少med1、brd4和pol2凝聚物的数量或消除med1、brd4和pol2凝聚物。图14b显示了用荧光标记的brd4进行光致漂白后荧光恢复(fluorescence recovery after photobleaching,frap)测定的结果。jq1的存在显著增加了光照射的凝聚物中brd4周转的速率,经由用发荧光的brd4替换光致漂白的brd4导致显著更快的(10s对120s)回收。图14c显示了在超级增强子(se)处比在典型增强子(te)处更高水平的brd4。图14d(左图)显示了与典型增强子相比通过超级增强子的基因表达对jq1抑制更为敏感。图14d(右图)显示了jq1以比典型增强子更大的程度降低超级增强子中的brd4基因组占据。
[0051]
图15显示了抗代谢药对转录凝聚物没有影响。具体地,5um 5-fu和5um 5-aza对med1、brd4或pol2凝聚物都没有可检测的影响。
[0052]
图16显示了各种抑制剂对用med1-gfp、brd4-gfp和pol2-gfp内源性地标记的hct116结肠癌细胞系中的med1、brd4和pol2凝聚物的影响。
[0053]
图17显示了各种嵌入剂对用med1-gfp、brd4-gfp和pol2-gfp内源性地标记的hct116结肠癌细胞系中的med1、brd4和pol2凝聚物的影响。
[0054]
图18显示了各种cdk抑制剂对用med1-gfp、brd4-gfp和pol2-gfp内源性地标记的
hct116结肠癌细胞系中的含med1、brd4和pol2的凝聚物的影响。
[0055]
图19提供了药物对转录凝聚物的影响的模型。硼替佐米、米托蒽醌、柔红霉素、thz1和迪那西利(dinaciclib)引起凝聚物的完全溶解。参见图16-18。长时间暴露(例如,24小时)于jq1以及暴露于a485和哌柏西利(palbociclib)引起凝聚物的基因组释放和固结。参见图14、16和18。短时间暴露(例如,5分钟)于jq1以及暴露于u0216引起一些凝聚物组分的逐出(即,选择性逐出)。参见图14和16。
[0056]
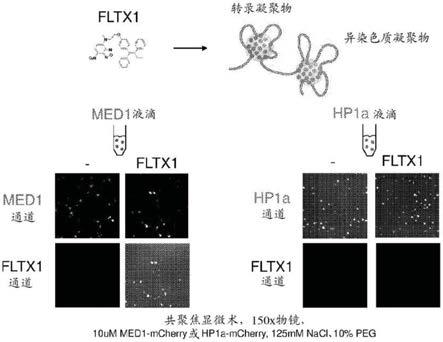
图20a-20b显示了小分子在体外接近凝聚物。图20a(左图)显示了雌激素受体(er)(绿色)和med1(红色)在雌激素的存在下共定位于体外液滴中,而雌激素受体在雌激素和他莫昔芬的存在下不掺入凝聚物中。图20a:右列顶部,显示了具有附着er的lac阵列的细胞在他莫昔芬的存在下具有减少的含er(绿色)和med1(红色)的凝聚物。右列底部,显示了在存在和不存在他莫昔芬的情况下er和med1的相对荧光强度。图20b(顶部)显示了具有相似分子量的荧光标记的他莫昔芬(fltx1)和cy5染料的结构。图20b(底部)显示了fltx1掺入含med1的凝聚物中,而类似大小的cy5染料未掺入。
[0057]
图21显示了他莫昔芬从med1液滴中“追逐”荧光他莫昔芬。顶行显示了med1液滴不受fltx1、或fltx1和他莫昔芬的添加的影响。底行显示了fltx1被掺入med1液滴中,但通过加入10倍过量的他莫昔芬被稀释出,证实了fltx1和他莫昔芬具有类似的凝聚物掺入特性。
[0058]
图22显示了荧光他莫昔芬特异性地富集在med1凝聚物中。左下图显示了fltx1掺入med1液滴中。med1是转录凝聚物的组分。右下图显示了fltx1不掺入异染色质蛋白质1(hp1a)液滴中。hp1a是异染色质凝聚物的组分。值得注意的是,fltx1在不存在其靶标雌激素受体的情况下被掺入med1液滴中。
[0059]
图23显示了凝聚物溶解药物富集在med1凝聚物中。米托蒽醌、姜黄素和柔红霉素各自具有荧光活性并引起凝聚物溶解。图23(底图)显示了这些药物立即掺入med1液滴中。
[0060]
图24示出了与荧光肽接触的er/med1液滴(左侧)。在雌激素暴露后,雌激素受体经历了允许其与med1 lxxll结构域(右侧)相互作用的构象变化。
[0061]
图25显示了在将lxxll肽(qnpiltsllqitg;seq id no:1)添加到er/med1液滴中后,所述肽被掺入med1液滴中,从而导致er向med1液滴中的分配的减少。
[0062]
图26显示了在雌激素的存在下将肽掺入med1/er液滴中。聚脯氨酸(poly p)和rna聚合酶ii ctd重复ysptsps肽(ctd)对er/med1液滴形成没有影响,而聚谷氨酸(poly-e)肽(酸性)和聚赖氨酸(poly-k)肽(碱性)消除了med1/er液滴形成。
[0063]
图27显示了具有hiv-tat标记的细胞穿透性lxxll肽掺入到u2os细胞中,证明了肽可以在活细胞中可视化。
[0064]
图28a-28e显示了在人组织中和在体外的核凝聚物。图28a显示了说明小分子在核凝聚物中的潜在行为的模型。图28b-28c显示了在荧光共聚焦显微镜上以100x成像的、在用hoechst染色的细胞核中的、在来自良性和恶性人乳腺(图28b)以及良性和恶性结肠组织(图28c)的组织活检中的各种核凝聚物的支架蛋白的免疫荧光。图28d显示了测量小分子向核凝聚物中的分配的体外液滴形成测定的示意图。图28e显示了在共聚焦荧光显微镜上以150x成像的、显示了在用10μm蛋白质和5μm荧光素的情况下在125mm nacl和10%peg中形成的六种蛋白质凝聚物的存在下荧光素染料的行为的体外液滴测定。对药物富集的定量显示在右侧,误差条代表sem。
[0065]
图29a-29e显示了在液滴测定中小分子药物在核凝聚物中的分配行为。在共聚焦荧光显微镜上以150x成像的、在用10μm蛋白质的情况下在125mm nacl和10%peg中形成的六种核凝聚物,所述蛋白质用(图29a)5μm顺铂-tmr、(图29b)50μm米托蒽醌、(图29c)100μmfltx1、(图29d)5μm thz1-tmr或(图29e)1μm jq1-rox进行处理。在液滴内的药物富集的定量显示在每个图的右侧,误差条代表sem。
[0066]
图30a-3f显示了在凝聚物内的小分子浓度会影响药物活性。图30a显示了在共聚焦荧光显微镜上以150x成像的、在125mm nacl和10%peg、5nm的450bp dna、10μm med1和5μm顺铂-tr中形成的med1和hp1α凝聚物的体外液滴测定。图30b显示了暴露于所示浓度的顺铂的med1或hp1α液滴中所含的dna的生物分析仪示踪。图30c显示了(顶部)确定铂化dna相对于各种核凝聚物的位置的测定的示意图。(底部)在用50μm顺铂处理6小时的hct116细胞中铂化dna和所示蛋白质的共免疫荧光。在共聚焦荧光显微镜上以100x成像。重叠的定量示于右侧。图30d显示了(顶部)活细胞凝聚物溶解测定的示意图。(底部)用50μm顺铂处理12小时的带有内源性megfp标记的med1、hp1α或fib1的hct116细胞。med1、hp1α或fib1凝聚物得分的定量显示在右侧。图30e显示了用媒介物或50μm顺铂处理6小时的hct116细胞中的med1 chip-seq。(左)绘制的是超级增强子和典型增强子处med1的平均读取密度(误差条显示最小值和最大值)和(右)在myc超级增强子和aqpep典型增强子处的med1 chip的基因示踪。图30f显示了比较超级增强子和典型增强子的在顺铂处理的hela细胞中顺铂-dna-seq的荟萃图(metaplot)。
[0067]
图31a-31f显示了他莫昔芬在med1凝聚物中的作用和抗性。图31a显示了乳腺癌中er突变和med1过表达对他莫昔芬抗性的示意图。图31b显示了在雌激素 /-100μm他莫昔芬的存在下gfp标记的er的所示形式的体外液滴测定。在使用10μm每种蛋白质和100μm雌激素的情况下在125mm nacl和10%peg中形成液滴。图31c显示了在共聚焦荧光显微镜上以100x成像的在他莫昔芬敏感(mcf7)和抗性(tamr7)er 乳腺癌细胞系中的med1的(左)免疫荧光。(右上)对乳腺癌细胞中的med1凝聚物大小的定量。(右下)通过western印迹测得的med1在所示乳腺癌细胞系中的相对量,误差条显示sem。图31d显示在5μm(低)或20μm(高)med1的情况下在100μm雌激素、 /-100μm他莫昔芬和er的存在下的体外液滴测定。在共聚焦荧光显微镜上以150x成像的在125mm nacl和10%peg中在用5μm er的情况下形成液滴,误差条是sem。图31e显示了在用5μm(低)或20μm(高)med1与100μm fltx1的情况下在125mm nacl和10%peg中的体外液滴测定,误差条为sd。图31f显示了由于改变的药物亲和力(经由er突变)或浓度(经由med1过表达)引起的他莫昔芬抗性的模型。
[0068]
图32a-332c显示了在细胞系和人肿瘤组织中的核凝聚物。图32a显示了内源性地表达megfp标记的蛋白(med1、brd4、srsf2)、mcherry标记的蛋白(hp1α)或用表达gfp标记的蛋白(npm1、fib1)的构建体转染的小鼠胚胎干细胞通过共聚焦荧光显微术成像。图32b显示了活检的乳腺癌和结肠癌标本的临床数据。图32c显示了er阳性乳腺癌和结肠腺癌的h&e染色。
[0069]
图33a-33c显示了在正常和肿瘤组织中的核凝聚物的体积和数量。图33a显示了在正常和恶性乳腺组织中(上部)以及在正常和恶性结肠组织中(下部)的核凝聚物的体积。值表示核体积百分比和标准偏差。在正常和恶性状态下的单个核凝聚物之间没有显著差异。图33b是显示在正常和恶性组织中的核凝聚物的平均体积的表格。图33c是显示在正常和恶
性组织中的核凝聚物的平均数的表格。
[0070]
图34a-34b显示了核凝聚物形成的蛋白质。图34a显示了用于纯化核凝聚物蛋白质的构建体的示意性代表图。将单独的idr(固有无序区)用于med1和brd4蛋白,并且将全长用于hp1α、srsf2、npm1和fib1蛋白。图34b显示了(上部)在idr和全长蛋白质中疏水性氨基酸苯丙氨酸(f)、色氨酸(w)和酪氨酸(y)的数目。med1 idr具有最高数目的疏水性残基。(下部)idr或全长核凝聚物蛋白质的带正电荷相互作用元件(cie )和带负电荷相互作用元件(cie-)的表格。这些结果表明med1蛋白可能参与由π系统支配的相互作用。
[0071]
图35a-35b显示了凝聚物形成的蛋白质的体外液滴。图35a显示了在125mm nacl和10%peg中的所示的gfp标记的蛋白质的体外液滴形成测定的共聚焦显微术。med1和brd4蛋白仅是idr部分。图35b显示了med1、brd4、srsf2、hp1α、fib1和npm1核凝聚物在所示浓度(125mm、350mm、650mm、1000mm nacl)下的共聚焦显微术图像,实验在10%peg中用10μm蛋白质进行。
[0072]
图36显示了富集比计算的示意性代表图。将液滴限定在蛋白质通道中并且在该区域中测量药物的最大强度以获得药物
进入
(左图),在含有蛋白质但不含药物的体外液滴反应中在由蛋白质通道所限定的区域中的药物通道中测量背景(中图),并且在没有蛋白质的液滴反应中测量药物
扩散
强度(右图)。
[0073]
图37a-37d显示了小分子在核凝聚物中的分配。图37a显示了在没有向反应中添加任何蛋白质的情况下单独的所示小分子(4.4kda葡聚糖、荧光素和hoechst)的体外液滴形成测定的共聚焦显微术。所有小分子单独显示出扩散荧光信号,表明所述分子单独不形成液滴。图37b-37c显示了共聚焦显微术图像,示出了在125mm nacl和10%peg中hoechst(图37b)和4.4kda葡聚糖(图37c)相对于在体外形成的六种核凝聚物的行为。定量示于右侧,误差条代表sem。hoechst和葡聚糖两者都自由地扩散通过所测试的凝聚物而不被排除或聚集。测定的示意图示于顶部。图37d显示了荧光标记的4.4kda、10kda、40kda和70kda葡聚糖在med1凝聚物中的共聚焦显微术图像。在125mm盐和16%蔗聚糖中用10μm蛋白质和0.1mg/ml tritc标记的葡聚糖进行实验。较小尺寸的葡聚糖(4.4kda和10kda)能够自由地扩散通过凝聚物,而较大尺寸的葡聚糖(40kda和70kda)部分地从med1凝聚物中排除。这表明所研究的凝聚物的有效孔径为至少10kda。
[0074]
图38a-38d显示了小分子药物的特性而不是它们的荧光部分支配分配到凝聚物中。图38a显示了在没有向反应中添加任何蛋白质的情况下单独的所示小分子药物(顺铂、fltx1、thz1、米托蒽醌和jq1)的体外液滴形成测定的共聚焦显微术。所有小分子药物单独显示出扩散荧光信号,表明所示分子单独不形成液滴。图38b显示了通过共聚焦显微术测量的在125mm nacl和10%peg中形成的med1液滴中的rox和德克萨斯红(texas red)富集。用于可视化药物的两种染料都不被富集在med1凝聚物中。图38c显示了体外液滴药物逐出实验的示意图。将标记的顺铂添加到med1液滴中以形成聚集有顺铂-tr的med1液滴。将未标记的反式铂或未标记的顺铂添加到液滴混合物中,并在逐出之后测量液滴中剩余的标记的顺铂-tr的量。反式铂是临床上无效的顺铂反式异构体,不能逐出顺铂-tr,而高浓度的未标记的顺铂能逐出顺铂-tr。图38d显示了体外液滴药物逐出实验的示意图。显示通过共聚焦显微术测量的在添加他莫昔芬后fltx1在med1液滴中富集的图。他莫昔芬能够从med1液滴中逐出fltx1。所显示的所有误差条代表sem。
[0075]
图39a-39c显示了小分子药物可以以100倍聚集在med1凝聚物中。图39a显示了在125mm nacl和10%peg中形成的med1液滴的定量相位显微术。彩色条表示光学相时延以度为单位。从相图像上,计算出单个凝聚物中的平均med1浓度。图39b显示了示出在不添加药物、添加5μm顺铂或50μm米托蒽醌后在体外液滴中的med1浓度的图。数据点是群体平均值(对于每种条件,n=272、115和85个单独的凝聚物)。误差条表示标准偏差。图39c显示了向med1液滴中添加不同浓度的顺铂或米托蒽醌,并且通过紫外(uv)光谱法测量在溶液中剩余的药物的浓度。将光谱测量与从(图39b)中的测量结果获得的med1凝聚物相的总体积的估计相结合,估计顺铂的分配比高达600倍,而米托蒽醌的分配比为大约100倍。
[0076]
图40a-40b显示了药物靶标与转录凝聚物的缔合。图40a显示了med1、hp1α、cdk7、er和brd4连同myc rna fish的免疫荧光。与以下发现一致:med1(转录凝聚物的标志物)存在于myc癌基因的刻点中,并且cdk7、er和brd4也存在于myc的刻点中。这些结果反映了通过chip-seq在此基因座处获得的那些结果。相比之下,在myc中没有发现hp1α(异染色质凝聚物的标志物)的信号。平均和随机图像分析示于右侧。图40b显示了(顶部)体外液滴测定的示意图,其示出了将核凝聚物蛋白质(med1或hp1α)与各种药物靶蛋白(cdk7、er或brd4)混合,其中通过共聚焦显微术测量分配到核凝聚物中。(中间)用10μm的med1、er、hp1α和brd4、200nm的cdk7进行体外液滴测定。在125mm nacl、10%peg和液滴形成缓冲液中形成液滴。所测试的所有药物靶标都聚集在med1凝聚物中。发现er被聚集在med1和hp1α凝聚物两者中,这与先前的报道及其与共活化剂和共阻抑剂缔合的能力一致。(底部)对靶蛋白质在所示凝聚物中的富集的定量,误差条代表sem。
[0077]
图41显示了各种小分子药物在整个介体复合物中的分配行为。药物(thz1、米托蒽醌、顺铂、fltx1、荧光素和4.4kda葡聚糖)在整个介体复合凝聚物中的共聚焦显微术图像。将介体在明视野中成像,而将小分子通过其发荧光的通道成像。在10%peg和125mm nacl中进行实验。各种小分子药物在整个介体复合物中的分配行为再现了药物在med1凝聚物中的分配行为。富集的定量示于右侧,误差条代表sem。
[0078]
图42显示了各种小分子药物在形成于蔗聚糖中的med1凝聚物中的分配行为。在125mm nacl和20%蔗聚糖的存在下在med1凝聚物中的小分子药物(thz1、米托蒽醌、顺铂、fltx1、荧光素和jq1)聚集行为的共聚焦显微术图像。小分子的分配行为是类似的,与用于形成med1液滴的拥挤物(crowder)无关。富集的定量示于右侧,误差条代表sem。
[0079]
图43a-43b显示了顺铂分子在med1液滴中是高度可移动的。图43a显示了共聚焦显微术图像,显示出了在用5μm tr-顺铂和10μm蛋白质的情况下在125mm nacl和10%peg的存在下形成的凝聚物中,在tr-顺铂和med1的光致漂白(frap)后的荧光恢复。图43b显示了frap的定量(误差条代表sem)。
[0080]
图44a-44d显示了特定化学部分支配在med1凝聚物中的浓度。图44a是小分子硼-二吡咯甲烯基(bodipy)文库的描绘。图44b显示了通过共聚焦显微术测量的在med1液滴中的探针文库的荧光强度。在用10μm med1和1μm小分子的情况下在125mm nacl和10%peg中进行实验。bodipy的荧光单独的分子以红色突出显示。图44c显示了从没有med1蛋白质的文库中随机选择的18种探针的荧光强度,证明它们具有相似的荧光强度。图44d显示了按荧光强度排序的顶部5(左)和底部5(右)、r2和r1侧链。
[0081]
图45a-45e显示了med1的芳香族残基有助于小分子分配到med1凝聚物中,但对于
凝聚物形成是可有可无的。图45a显示了在125mm nacl和10%peg中与在med1凝聚物内的荧光强度排序最高的5μm小分子探针一起形成的med1、brd4、srsf2、hp1α、fib1和npm1核凝聚物的共聚焦显微术图像。探针特异性地聚集成med1凝聚物,表明探针的化学特征选择性地与med1凝聚物的化学特征相互作用。聚集在med1凝聚物中的排序最高的探针显示出用芳香族环修饰的bodipy分子优先。这表明π系统可能有助于在小分子和med1之间的相互作用。图45b显示了med1 idr突变蛋白的示意图。π系统支配超分子组装体的相互作用,其中π-π或π-极性相互作用发挥显著作用。为了测试这些相互作用是否支配小分子分配到med1凝聚物中,并且受到观察结果med1 idr相对于本文研究的其他蛋白质富集了芳香族和碱性氨基酸残基两者的鼓励,产生了芳香族med1 idr突变体(所有30个芳香族残基变为丙氨酸)和碱性med1 idr突变体(所有114个碱性残基变为丙氨酸)。在图45c中,在125mm nacl和10%peg的存在下使用med1野生型、med1碱性突变体(所有碱性氨基酸被丙氨酸置换)和med1芳香族突变体(所有芳香族氨基酸被丙氨酸置换)通过共聚焦显微术测试了med1突变体形成液滴的能力。med1碱性突变体显示出在体外形成液滴的能力受损,表明med1的碱性残基是支配液滴形成的同型相互作用所必需的。med1芳香族突变体形成与med1野生型蛋白质类似的液滴。图45d显示了med1芳香族残基在掺入芳香族小分子探针中的作用。最高命中的bodipy探针连同med1或med1芳香族突变体的共聚焦显微术图像及其定量,其显示芳香族探针在med1芳香族突变体液滴中的分配行为显著降低。在用10μm蛋白质和5μm小分子的情况下在10%peg和125mm nacl中进行实验。图45e显示了顺铂连同med1或med1芳香族突变体的共聚焦显微术图像及其定量,其显示了顺铂在med1芳香族突变体液滴中的分配行为显著降低。实验在用10μm蛋白质和5μm顺铂-tr的情况下在10%peg和125mm nacl中进行。总之,这些结果表明π系统有助于小分子分配到med1凝聚物中。所有误差条代表sem。
[0082]
图46显示了dna可以被区室化并聚集在核凝聚物中。(顶部)液滴测定的示意图,其示出了蛋白质、dna和顺铂在液滴形成条件下混合,然后离心以将液滴相与稀释相分离。随后使用bioanalyzer测量在两个相中的dna量。与med1和hp1α稀释相(右)相比,dna在med1和hp1α液滴相(左)中富集。
[0083]
图47a-47d显示了小分子在特定凝聚物中的浓度可能影响靶标接合。图47a显示了用dmso或50μm顺铂处理hct116细胞6小时,随后进行顺铂免疫荧光。抗体仅识别用顺铂处理的细胞中的铂化dna,支持了抗体特异性。图47b显示了用jq1处理24小时的(左)megfp-med1标记的hct116细胞导致med1凝聚物减少。(右侧)med1 chip-seq在dmso与jq1处理的hct116细胞中的荟萃图。图47c显示了用jq1处理以及然后用顺铂处理细胞,以确定med1凝聚物的减少是否导致myc基因座处的dna铂化减少。myc dna fish和med1免疫荧光显示在jq1处理之后铂化dna的信号损失,表明med1凝聚物的存在有助于此基因座处的dna铂化。图47d显示了(左)在dmso或jq1处理的hct116细胞中在myc处的med1 chip-seq示踪,示出了在jq1处理之后med1负载的损失。(右)对在用dmso或jq1处理的hct116细胞中的myc dna fish焦点处的顺铂if信号的定量,误差条代表sem。
[0084]
图48a-48g显示了内源性地标记的细胞系的基因分型。显示在hct116结肠癌细胞中的megfp标记的(图48a)med1、(图48b)hp1α、(图48c)fib1、(图48d)npm1、(图48f)brd4和(图48g)srsf2的示意性图像和基因分型琼脂糖凝胶。图48e是fib1和npm1表达的琼脂糖凝胶。
[0085]
图49a-49b显示了细胞中的核凝聚物是高度动态的。megfp标记的(图49a)med1和(图49b)hp1α在hct116细胞系中的frap(误差条代表sem)(n=7)。
[0086]
图50a-50b显示了在延长的顺铂处理后med1凝聚物在细胞中的溶解。图50a显示了用dmf或50μm顺铂处理3、6或12小时的内源性地表达gfp标记的med1的hct116细胞。定量示于右侧,误差条为sd。图50b显示了用dmf或50μm顺铂处理12小时的表达gfp-med1的hct116细胞的细胞活力测定。
[0087]
图51展示了顺铂对各种核凝聚物的作用。图24显示了用50μm顺铂处理12小时的携带内源性gfp标记的med1、brd4、hp1α、fib1、npm1或srsf2的hct116细胞。顺铂特异性地破坏med1和brd4凝聚物,这与顺铂和brd4选择性地聚集在med1凝聚物中一致。
[0088]
图52显示了在顺铂治疗后med1基因组占据减少。该图显示了在dmso或50μm顺铂处理6小时之后的med1 chip-seq,在顺铂处理之后med1基因组水平降低。
[0089]
图53a-53d显示了对在mcf7细胞中的med1凝聚物的表征。图53a显示了在用med1-megfp慢病毒载体感染的mcf7细胞和mcf细胞中的med1的western印迹。图53b显示了通过慢病毒载体表达此融合蛋白的mcf7细胞中的med1-megfp的frap。定量示于右侧,黑条代表最佳拟合线的95%置信区间。图53c显示了表达med1-megfp的mcf7细胞在无雌激素条件下生长,然后用100nm雌激素刺激15分钟并在共聚焦荧光显微镜下成像4分钟。图53d显示了在(图53c)中所示的融合med1凝聚物的大小和强度的定量。
[0090]
图54a-54b显示了在myc癌基因处雌激素和他莫昔芬依赖性med1凝聚物的形成。图54a显示了在用100nm雌激素或100nm雌激素和5μm他莫昔芬处理24小时的雌激素饥饿的mcf7细胞中的dna fish和免疫荧光。平均图像分析和随机图像分析示于右侧。图54b显示了rt-qpcr,其示出了在雌激素饥饿的、雌激素刺激的、或雌激素和他莫昔芬处理的mcf7细胞中的相对myc rna表达,误差条代表sem。
[0091]
图55显示了fltx1聚集在细胞中的med1凝聚物中。(左)在产生med1或hp1α凝聚物的u2os细胞中的与lac阵列栓系的med1或hp1α的示意图。(中间)具有暴露于fltx1的与lac阵列栓系的med1或hp1α的分离的u2os细胞核的代表性图像。lac阵列的变焦图像显示在插图中,合并图像显示在右侧。(右)对与med1或hp1α栓系的lac阵列上的fltx1富集的定量,误差条代表sem。esr1在此骨肉瘤细胞系中不表达。
[0092]
图56显示了esr1的患者衍生的激素疗法抗性突变。源自cbioportal数据库的220名患者集的er突变频率图显示了在537和538处具有热点的er点突变的位置。
[0093]
图57a-57b显示了在med1液滴中er和er突变体的富集比。图57a显示了在雌激素或雌激素和他莫昔芬的存在下在med1液滴中er或er突变体富集比的定量。图57b显示了(左)er突变体在med1液滴中分配的代表性图像,右侧显示了富集比。在125mm nacl、10%peg、10μm每种蛋白质、100μm雌激素(含或不含100μm所示配体)中进行(图57a)和(图57b)两者的实验。所有误差条代表sd。
[0094]
图58a-58c显示了在他莫昔芬抗性乳腺癌细胞中的med1过表达。图58a显示了展示通过支架蛋白过表达增加凝聚物体积后在凝聚物中的药物浓度的示意图。假定系统中的药物有限,预期med1液滴中的药物浓度在凝集物体积膨胀后降低(图58b),在mcf7细胞(对他莫昔芬敏感)和tamr7细胞(mcf7的他莫昔芬抗性衍生物)中的med1和肌动蛋白的western印迹显示med1水平在tamr7细胞中更高。来自western印迹的定量如下所示,其为3次实验的平
laboratory manual,cold spring harbor laboratory press,cold spring harbor,1988;freshney,r.i.,“culture of animal cells,a manual of basic technique”,第5版,john wiley&sons,hoboken,nj,2005。关于治疗剂和人类疾病的非限制性信息可见于goodman和gilman的the pharmacological basis of therapeutics,第11版,mcgraw hill,2005,katzung,b.(编辑)basic and clinical pharmacology,mcgraw-hill/appleton&lange;第10版(2006)或第11版(2009年7月)。关于基因和遗传病症的非限制性信息可见于mckusick,v.a.:mendelian inheritance in man.a catalog of human genes and genetic disorders.baltimore:johns hopkins university press,1998(第12版)或更近的在线数据库:online mendelian inheritance in man,omim
tm
.mckusick-nathans institute of genetic medicine,johns hopkins university(baltimore,md)和national center for biotechnology information,national library of medicine(bethesda,md),截至2010年5月1日,ncbi.nlm.nih.gov/omim/以及online mendelian inheritance in animals(omia)(其是在动物物种(除人和小鼠外)中的基因、遗传病症和性状的数据库),访问于omia.angis.org.au/contact.shtml。本文中提及的所有专利、专利申请和其他出版物(例如,科学文章、书籍、网站和数据库)以引用的方式整体并入。在说明书和任何并入的参考文献之间存在冲突的情况下,应以本说明书(包括其任何修改,其可能基于并入的参考文献)为准。除非另外指明,否则本文中使用术语的标准技术接受的含义。本文中使用各种术语的标准缩写。
[0099]
本发明人惊奇地发现,一些药剂被掺入不具有所述药剂的靶标的凝聚物中。参见例如图22。这对于药物功效具有重要的分支。例如,如果药物被隔离在凝聚物中,则药物的有效性可能较低,从而阻止与靶标的相互作用。可替代地,如果凝聚物抑制药物接近靶标,则药物的有效性可能较低。这种现象可以帮助解释为什么一些候选药剂在体外对治疗靶标显示出高活性,但在细胞或生物体中不显示相同的活性。这也可以解释令人惊讶的观察结果,即抑制全局基因调节剂诸如brd4或cdk7可以对具有获得性大超级增强子的癌基因具有选择性作用;将抑制剂如jq1和thz1选择性分配到超级增强子凝聚物中将优先破坏那些基因座处的转录。本发明人还惊奇地发现,凝聚物聚集了一些临床上重要的小分子癌症治疗剂,使得它们的药效学特性被改变。因此,凝聚物可以聚集小分子,从而引导它们的生物活性。
[0100]
因此,本发明的一些方面涉及表征药剂的方法,所述方法包括使所述药剂与包含具有至少一种组分的凝聚物的组合物(例如溶液)接触,并且测量所述药剂在所述凝聚物中的掺入。在一些实施方案中,所述方法还包括基于在适当的细胞中靶标和药剂在凝聚物中或在凝聚物外部是否都处于有效的浓度来确定所述药剂是否是可能的治疗剂。在一些实施方案中,所述方法还包括表征多种药剂(例如,药物候选物)并选择一种或多种具有所需或最佳凝聚物分配谱的先导药剂(例如,当药剂的靶标存在于凝聚物中时,聚集在适当细胞的凝聚物中,或当药剂的靶标存在于凝聚物外部时,聚集在凝聚物外部)。如本文所用的术语“药剂”是指任何化合物或物质,诸如但不限于小分子、核酸、多肽、肽、药物、离子等。“药剂”可以是任何化学品、实体或部分,包括但不限于合成和天然存在的蛋白质和非蛋白质实体。在一些实施方案中,药剂是核酸;核酸类似物;蛋白质;抗体;肽;适体;核酸、氨基酸或碳水化合物的寡聚物,包括但不限于蛋白质、寡核苷酸、核酶、dna酶、糖蛋白、sirna、脂蛋白、适
体以及它们的修饰物和组合等。在一些实施方案中,药剂选自核酸、小分子、多肽和肽。在某些实施方案中,药剂是具有化学部分的小分子。例如,化学部分包括未经取代的或经取代的烷基、芳香族或杂环基部分,包括大环内酯、来普霉素和相关的天然产物或其类似物。已知化合物可以具有期望的活性和/或特性,或者可以选自不同化合物的文库。在一些实施方案中,药剂足够小以扩散到凝聚物中。在一些实施方案中,药剂小于约4.4kda。在一些实施方案中,药剂具有至少100、150、200、300、350、400、450、500、550、600、650、700或更大的本文所述的凝聚物的分配系数。在一些实施方案中,药剂具有小于约10、20、50、100、150、200、300、350、400、450、500、550或600的本文所述的凝聚物的分配系数。
[0101]
在一些实施方案中,药剂是小分子。术语“小分子”是指质量小于约2千道尔顿(kda)的有机分子。在一些实施方案中,小分子小于约1.5kda,或小于约1kda。在一些实施方案中,小分子小于约800道尔顿(da)、600da、500da、400da、300da、200da或100da。通常,小分子具有至少50da的质量。在一些实施方案中,小分子是非聚合的。在一些实施方案中,小分子不是氨基酸。在一些实施方案中,小分子不是核苷酸。在一些实施方案中,小分子不是糖。在一些实施方案中,小分子含有多个碳-碳键并且可以包含对于与蛋白质进行结构相互作用(例如氢键合)重要的一个或多个杂原子和/或一个或多个官能团,例如胺、羰基、羟基或羧基基团,并且在一些实施方案中至少两个官能团。小分子通常包含一个或多个环碳或杂环结构和/或芳香族或多芳香族结构,任选地被一个或多个上述官能团取代。在一些实施方案中,小分子包含至少一个、至少两个、至少三个或更多个芳香族侧链。
[0102]
在一些实施方案中,药剂是蛋白质或多肽。术语“多肽”是指通过肽键连接的氨基酸的聚合物。蛋白质是包含一个或多个多肽的分子。肽是相对短的多肽,通常长度在约2个和100个氨基酸(aa)之间,例如在4个和60个aa之间;在8个和40个aa之间;在10个和30个aa之间。术语“蛋白质”、“多肽”和“肽”可以互换使用。一般而言,在各种实施方案中,多肽可以仅含有标准氨基酸或者可以包含一个或多个非标准氨基酸(其可以是天然存在的或非天然存在的氨基酸)和/或氨基酸类似物。“标准氨基酸”是通常用于哺乳动物的蛋白质合成并由遗传密码编码的20种l氨基酸中的任一种。“非标准氨基酸”是在哺乳动物的蛋白质合成中不常用的氨基酸。非标准氨基酸包括天然存在的氨基酸(除20种标准氨基酸之外)和非天然存在的氨基酸。氨基酸(例如多肽中的一个或多个氨基酸)可以例如通过添加(例如共价连接)诸如烷基基团、链烷酰基基团、碳水化合物基、磷酸基、脂质、多糖、卤素、用于缀合的接头、保护基团、小分子(诸如荧光团)等部分来修饰。在一些实施方案中,药剂是包含至少5个、至少10个、至少15个、至少20个、至少25个、至少30个或更多个芳香族氨基酸的蛋白质或多肽。
[0103]
在一些实施方案中,药剂包含dna或rna或由其组成。
[0104]
在一些实施方案中,药剂是肽模拟物。术语“模拟物”、“肽模拟物”和“素拟肽”在本文中可互换使用,并且通常是指模拟选定的天然肽或蛋白质功能结构域(例如结合基序或活性部位)的三级结合结构或活性的肽、部分肽或非肽分子。这些肽模拟物包括重组或化学修饰的肽、以及非肽药剂诸如小分子药物模拟物。
[0105]
药剂可以是已知的药物。药物的类型不限于可以作为任何合适的药物的任何一种。在一些实施方案中,药剂可以是抗癌药物。在一些实施方案中,已知药物将用于治疗人类疾病或病症。
[0106]
在一些实施方案中,药剂是化学治疗剂或其衍生物。在一些实施方案中,化学治疗剂选自放线菌素d、阿地白介素、阿利维a酸、全反式视黄酸/atra、六甲蜜胺、amascrine、天冬酰胺酶、阿扎胞苷、硫唑嘌呤、卡介苗(bacillus calmette-guerin)/bcg、苯达莫司汀盐酸盐、贝沙罗汀、比卡鲁胺、博来霉素、硼替佐米、白消安、卡培他滨、卡铂、卡非佐米、卡莫司汀、苯丁酸氮芥、顺铂(cisplatin/cisplatinum)、克拉屈滨、环磷酰胺(cyclophosphamide/cytophosphane)、cytabarine、达卡巴嗪、柔红霉素/道诺霉素、地尼白介素、右雷佐生、多西紫杉醇、多柔比星、表柔比星、依托泊苷、氟达拉滨、氟尿嘧啶(5-fu)、吉西他滨、戈舍瑞林、氢化可的松、羟基脲、伊达比星、异环磷酰胺、干扰素α、伊立替康cpt-11、拉帕替尼、来那度胺、亮丙瑞林、氮芥(mechlorethamine)/甲川氯/氮芥(mustine)/hn2、巯基嘌呤、甲氨蝶呤、甲泼尼龙、丝裂霉素、米托坦、米托蒽醌、奥曲肽、奥普瑞白介素、奥沙利铂、紫杉醇、帕玛二磷酸、培门冬酶、培非司亭、peg干扰素、培美曲塞、喷司他丁、苯丙氨酸氮芥、普利霉素/光神霉素、泼尼松、泼尼松龙、丙卡巴肼、雷洛昔芬、罗米司亭、沙格司亭、链脲菌素、他莫西芬、替莫唑胺、坦西莫司、替尼泊苷、沙立度胺、硫鸟嘌呤、硫代磷酰胺/噻替派、噻替派、托泊替坎盐酸盐、托瑞米芬、维甲酸、戊柔比星、长春碱、长春新碱、长春地辛、长春瑞滨、伏力诺他、唑来膦酸以及它们的组合。在一些实施方案中,药剂是或包含顺铂或其衍生物。在一些实施方案中,药剂是或包含jq1((s)-叔-丁基2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂卓-6-基)乙酸酯)或其衍生物。在一些实施方案中,药剂是或包含他莫昔芬或其衍生物。
[0107]
在一些实施方案中,药剂包含蛋白质转导结构域(ptd)。ptd或细胞穿透肽(cpp)是可以穿过许多(如果不是全部的话)哺乳动物细胞的质膜的肽或类肽。ptd可以增强其所附接或其存在的部分的摄取。这些肽通常富含精氨酸。例如,人免疫缺陷病毒1型和2型(hiv-1和hiv-2)的tat蛋白的ptd已被广泛研究并用于将货物转运到哺乳动物细胞中。参见例如,fonseca sb等人,adv drug deliv rev.,61(11):953-64,2009;heitz f等人,br j pharmacol.,157(2):195-206,2009,以及任何前述中的参考文献,所述参考文献以引用的方式并入本文。在一些实施方案中,所述细胞穿透肽是hiv-tat。
[0108]
在一些实施方案中,所述药剂能够结合靶标。在一些实施方案中,所述靶标存在于包含凝聚物的组合物中。在一些实施方案中,所述靶标主要存在(例如,至少51%、至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%、至少99.5%、至少99.9%、至少99.99%或更多)于凝聚物外部。在一些实施方案中,在凝聚物外部的靶标的浓度是在凝聚物内部的靶标的浓度的至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍或更多。在一些实施方案中,所述靶标主要存在(例如,至少51%、至少60%、至少70%、至少80%、至少90%、至少95%、至少97%、至少99%、至少99.5%、至少99.9%、至少99.99%或更多)于凝聚物中。在一些实施方案中,在凝聚物中的靶标的浓度是在凝聚物外部的靶标的浓度的至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍或更多。
[0109]
在一些实施方案中,所述药剂是如本文所述的候选药剂。在一些实施方案中,所述药剂是由已经被修饰以调节掺入感兴趣的凝聚物中的药剂产生的。在一些实施方案中,所述药剂是由如本文所述的第一药剂和第二药剂的偶联或连接产生的。
[0110]
如下文实施例所示,发现具有芳香族环的分子优先聚集在med1凝聚物中。因此,在一些实施方案中,所述药剂被修饰以增加或减少芳香族环的数目。在一些实施方案中,将药剂修饰以使芳香族环数目增加至少约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、35、40、45、50或更多。在一些实施方案中,所述药剂(例如,由小分子组成或包含小分子)被修饰以包含至少一个或至少两个芳香族环或更多个芳香族环,如图44a中提供的基团r1和r2中所示。在一些实施方案中,所述药剂(例如,由小分子组成或包含小分子)被修饰以包含选自如图44a中所示的成分m66、k19、m101、m195、k18、m103和m66的至少一个或至少两个芳香族环或更多个芳香族环。在一些实施方案中,所述药剂(例如,由小分子组成或包含小分子)被修饰以包含至少两个或三个结构,如图44d中提供的“排序最高的5种探针”下方的每一行中所示。
[0111]
在一些实施方案中,所述药剂由肽、多肽或蛋白质组成或包含肽、多肽或蛋白质,并且通过用芳香族氨基酸残基(例如,苯丙氨酸、色氨酸、酪氨酸和/或组氨酸)置换一个或多个非芳香族氨基酸残基来增加芳香族环的数目。在一些实施方案中,所述药剂由肽、多肽或蛋白质组成或包含肽、多肽或蛋白质,并且通过添加一个或多个芳香族氨基酸来增加芳香族环的数目。在一些实施方案中,芳香族氨基酸残基不是组氨酸。在一些实施方案中,芳香族氨基酸残基是苯丙氨酸。在一些实施方案中,芳香族氨基酸残基是非天然存在的氨基酸残基或非标准氨基酸残基(例如,l-dopa(l-3,4-二羟基苯基丙氨酸))。
[0112]
在一些实施方案中,所述药剂由肽、多肽或蛋白质组成或包含肽、多肽或蛋白质,并且通过用非芳香族氨基酸(例如,丙氨酸)置换一个或多个芳香族氨基酸来减少芳香族环的数目。在一些实施方案中,通过缺失或修饰一个或多个芳香族氨基酸来减少芳香族环的数目。
[0113]
在一些实施方案中,通过缺失、修饰和/或置换两个或更多个芳香族氨基酸来减少芳香族环的数目。
[0114]
在一些实施方案中,经修饰的药剂对凝聚物(例如,转录凝聚物、异染色质凝聚物、剪接斑点凝聚物、核仁、染色质凝聚物、多梳凝聚物、dna损伤修复凝聚物、或与mrna起始或延伸复合物物理地缔合的凝聚物)具有增加的亲和力。在一些实施方案中,经修饰的药剂对包含特定凝聚物组分(例如,介体、介体组分、med1、brd4、polii、srsf2、fib1、npm1或hp1α)的凝聚物具有增加的亲和力。在一些实施方案中,经修饰的药剂对包含一种或多种特定介体组分(例如,med1)的凝聚物具有增加的亲和力。在一些实施方案中,凝聚物包含具有一个或多个芳香族侧环的凝聚物组分(例如,med1)。在一些实施方案中,经修饰的药剂对凝聚物的亲和力比相应的未经修饰的药剂高至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。
[0115]
在一些实施方案中,经修饰的药剂对凝聚物(例如,转录凝聚物、异染色质凝聚物、剪接斑点凝聚物、核仁、染色质凝聚物、多梳凝聚物、dna损伤修复凝聚物、或与mrna起始或延伸复合物物理地缔合的凝聚物)具有降低的亲和力。在一些实施方案中,经修饰的药剂对包含特定凝聚物组分(例如,介体、介体组分、med1、brd4、polii、srsf2、fib1、npm1或hp1α)的凝聚物具有降低的亲和力。在一些实施方案中,经修饰的药剂对包含一种或多种特定介体组分(例如,med1)的凝聚物具有降低的亲和力。在一些实施方案中,凝聚物包含具有一个或多个芳香族侧环的凝聚物组分。在一些实施方案中,经修饰的药剂对凝聚物的亲和力比
相应的未经修饰的药剂低至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。
[0116]
在一些实施方案中,经修饰的药剂对第二药剂具有亲和力。在一些实施方案中,与在不存在经修饰的药剂的情况下的凝聚物中的第二药剂的浓度或量相比,经修饰的药剂能够使凝聚物中的第二药剂的浓度或量增加至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍或更多。在一些实施方案中,与在不存在经修饰的药剂的情况下的凝聚物中的第二药剂的浓度或量相比,经修饰的药剂能够使凝聚物中的第二药剂的浓度或量降低至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍或更多。
[0117]
靶标不受限制。在一些实施方案中,靶标是抗癌靶标。在一些实施方案中,靶标是酶(例如,氧化还原酶、转移酶、水解酶、裂解酶、异构酶、连接酶、激酶、细胞周期蛋白依赖性激酶、mapk、磷脂酰肌醇激酶、鞘氨醇激酶、碳水化合物激酶、核苷-磷酸激酶、核苷-二磷酸激酶)、受体(例如,核受体)、癌基因、转录因子或信号传导因子。在一些实施方案中,靶标是基因组dna。在一些实施方案中,靶标是本文所描述的任何组分。
[0118]
如本文所用,凝聚物是指相分离的多分子组装体。在一些实施方案中,凝聚物是指体外凝聚物(有时在本文中被称为“液滴”)。在一些实施方案中,体外凝聚物用在溶液中的一种或多种凝聚物组分人工地产生。在一些实施方案中,体外凝聚物包含模拟在细胞中发现的凝聚物的组分。在一些实施方案中,体外凝聚物分离自细胞。
[0119]
本文涵盖从细胞或组合物中分离凝聚物的任何合适的手段。在一些实施方案中,凝聚物是化学或免疫学沉淀的。在一些实施方案中,凝聚物是通过离心(例如,在约5,000xg、10,000xg、15,000xg下持续约5-15分钟;在约10.000xg下持续约10分钟)分离的。通过用均化器(即dounce均化器)在合适的缓冲液条件下裂解细胞核,然后离心和/或过滤以分离凝聚物,可以从细胞中分离凝聚物。
[0120]
在一些实施方案中,凝聚物存在于细胞中。凝聚物可以是天然存在的凝聚物。在其它实施方案中,凝聚物可以出现在转基因细胞或其它操作细胞中。在一些实施方案中,凝聚物可以包含可检测标签。在一些实施方案中,可检测标签存在于凝聚物组分上。在一些实施方案中,将可检测标签掺入凝聚物中。可检测标记(本文中有时也称为可检测标记)不受限制并且可以是本文所述的任何可检测标记。在其中存在多个可检测标签的一些实施方案中,可检测标签可以是可不同地检测的。
[0121]
在一些实施方案中,凝聚物可以是转录凝聚物、异染色质凝聚物、剪接斑点凝聚物、核仁、染色质凝聚物、多梳凝聚物、dna损伤修复凝聚物、或与mrna起始或延伸复合物物理地缔合的凝聚物。在一些实施方案中,凝聚物可以是体外凝聚物,其具有转录凝聚物、异染色质凝聚物、剪接斑点凝聚物、核仁、染色质凝聚物、多梳凝聚物、dna损伤修复凝聚物或与mrna起始或延伸复合物物理地缔合的凝聚物中的一种或多种组分。在一些实施方案中,凝聚物与dna(例如,基因组dna、细胞中的基因组dna)物理地缔合。在一些实施方案中,凝聚物、凝聚物的组分、药剂或评估凝聚物特性的方法是在2019年3月22日提交的pct/us2019/023694(其以引用的方式整体并入本文)中所描述的那些。在一些实施方案中,凝聚物(例如,体内凝聚物、离体凝聚物、体外凝聚物或液滴)包含在对抗癌剂有抗性的癌细胞中过表
达的凝聚物组分,其中所述过表达与对所述抗癌剂的抗性相关。在一些实施方案中,在对抗癌剂有抗性的癌细胞中过表达的凝聚物组分的量在凝聚物中比在来自不过表达所述凝聚物组分的癌细胞的凝聚物中存在的量更大。在一些实施方案中,包含在对抗癌剂有抗性的癌细胞中过表达的凝聚物组分的凝聚物的体积大于在不过度表达凝聚物组分的癌细胞中发现的凝聚物的体积。
[0122]
在一些实施方案中,所述凝聚物的至少一种组分是介体、介体组分、med1、brd4、polii、srsf2、fib1、npm1或hp1α。在一些实施方案中,所述至少一种组分是核凝聚物的组分。在一些实施方案中,所述至少一种组分是超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、剪接斑点凝聚物、核仁、染色质凝聚物、多梳凝聚物、dna损伤修复凝聚物的组分、或此类组分的功能片段。在一些实施方案中,至少一种组分是位于细胞核中的凝聚物的组分或其功能片段。在一些实施方案中,凝聚物的至少一种组分包含固有无序区(idr)。
[0123]
如本文所用,“转录凝聚物”是发生在转录位点处的相分离的多分子组装体,并且是可能包括转录因子、辅助因子(例如共活化剂)、染色质调节剂、dna、非编码rna、新生rna、rna聚合酶ii、激酶、蛋白酶体、拓扑异构酶和/或增强子的多种组分的高密度协同组装体(参见例如图4、图11和图12)。如本文所用,“超级增强子凝聚物”是出现在超级增强子处的转录凝聚物。超级增强子是本领域已知的。参见例如,美国专利申请公开第20140287932a1号,其以引用的方式并入本文。如本文所用,“异染色质凝聚物”是与异染色质物理地缔合(例如,出现在异染色质上)的相分离的多分子组装体。异染色质凝聚物已经显示与基因转录的阻抑相关。如本文所用,与mrna起始或延伸复合物物理地缔合的凝聚物是在相关复合物处出现的相分离的多分子组装体。在一些实施方案中,与延伸复合物物理地缔合的凝聚物包含剪接因子。
[0124]
在一些实施方案中,与延伸复合物物理地缔合的凝聚物是剪接斑点。如本文所用,“剪接斑点”(有时也称为细胞核斑点或染色质间颗粒簇)是富含剪接因子的凝聚物。参见例如,y.chen,a.s.belmont,genome organization around nuclear speckles.curr.opin.genet.dev.55,91
–
99(2019),其以引用的方式并入本文。如本文所用,“核仁”或“核仁”(复数形式)是在细胞核中出现的包含rna和蛋白质的凝聚物。参见例如,m.feric等人,coexisting liquid phases underlie nucleolar subcompartments.cell.165,1686
–
1697(2016),其以引用的方式并入本文。如本文所用,“染色质凝聚物”是相分离的多分子组装体,其与染色质物理地缔合。参见gibson等人,organization of chromatin by intrinsic and regulated phase separation,cell(2019),其以引用的方式并入本文。如本文所用,“多梳凝聚物”是与染色质物理地缔合并且可以抑制基因转录的相分离的多分子组装体。参见plys等人,phase separation of polycomb-repressive complex 1is governed by a charged disordered region of cbx2,genes dev.2019年7月1日;33(13-14):799-813,其以引用的方式并入本文。如本文所用,“dna损伤修复凝聚物”是与双链dna断裂物理地缔合的相分离的多分子组装体。参见pessina等人,functional transcription promoters at dna double-strand breaks mediate rna-driven phase separation of damage-response factors,nature cell biology第21卷,第1286-1299页(2019),其以引用的方式并入本文。
[0125]
在本文所公开方法的一些优选实施方案中,凝聚物是转录凝聚物或包含转录凝聚
物的一种或多种组分的体外凝聚物。在本文所公开方法的一些优选实施方案中,凝聚物是超级增强子凝聚物或包含超级增强子凝聚物的一种或多种组分的体外凝聚物。在本文所公开方法的一些优选实施方案中,凝聚物是剪接斑点凝聚物或包含剪接斑点凝聚物的一种或多种组分的体外凝聚物。在本文所公开的方法的一些优选实施方案中,凝聚物是异染色质凝聚物或包含异染色质凝聚物的一种或多种组分的体外凝聚物。在本文所公开的方法的一些优选实施方案中,凝聚物是异染色质凝聚物或包含异染色质凝聚物的一种或多种组分的体外凝聚物。在本文所公开方法的一些优选实施方案中,凝聚物是核仁或包含核仁的一种或多种组分的体外凝聚物。在本文所公开的方法的一些优选实施方案中,凝聚物是染色质凝聚物或包含染色质凝聚物的一种或多种组分的体外凝聚物。在本文所公开的方法的一些优选实施方案中,凝聚物是多梳凝聚物或包含多梳凝聚物的一种或多种组分的体外凝聚物。在本文所公开的方法的一些优选实施方案中,凝聚物是dna损伤修复凝聚物或包含dna损伤修复凝聚物的一种或多种组分的体外凝聚物。
[0126]
如本文所用,短语“凝聚物组分”等是指作为凝聚物的一部分或具有作为凝聚物(例如转录凝聚物、超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物)的一部分的能力的肽、蛋白质、核酸、信号传导分子、脂质等。在一些实施方案中,所述组分在凝聚物内。在一些实施方案中,所述组分对于凝聚物形成或稳定性是必需的。在一些实施方案中,所述组分对于凝聚物形成或稳定性不是必需的。在一些实施方案中,所述组分是蛋白质或肽并且包含一个或多个固有有序结构域(例如,转录因子的活化结构域的idr、与转录因子的活化结构域的idr相互作用的idr、信号传导因子的idr、甲基-dna结合蛋白的idr、基因沉默因子的idr、聚合酶的idr、剪接因子的idr、核仁小核核糖核蛋白的idr、核磷蛋白的idr、组蛋白的idr、cbx2的idr、53bp1的idr)。在一些实施方案中,所述组分是凝聚物的非结构元件(例如,对于凝聚物完整性不是必需的)。在一些实施方案中,凝聚物包含1种、2种、3种、4种、5种、6种、7种、8种、9种、10种或更多种组分,由其组成或基本上由其组成。在一些实施方案中,凝聚物(例如,体外凝聚物)不包含核酸。在一些实施方案中,凝聚物(例如,体外凝聚物)不包含rna。在一些实施方案中,所述组分是蛋白质或核酸的片段。
[0127]
如以下实施例所示,用丙氨酸置换med1中的碱性氨基酸削弱了突变体med1在溶液中形成液滴(即,体外凝聚物)的能力。因此,在一些实施方案中,凝聚物组分是已经被修饰以增加或减少碱性氨基酸残基的数目并且由此调节凝聚物组分形成凝聚物(例如液滴)的能力的天然存在的蛋白质或多肽。在一些实施方案中,至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或所有碱性氨基酸残基已经被非碱性氨基酸残基(例如,丙氨酸或其它中性氨基酸,例如天冬酰胺、半胱氨酸、谷氨酰胺、甘氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸等)置换。在一些实施方案中,至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、或更多个碱性氨基酸残基被非碱性氨基酸残基置换。在一些实施方案中,至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、35个、40个、45个、50个或更多个碱性氨基酸残基被添加到凝聚物组分中。
[0128]
在一些实施方案中,与未经修饰的凝聚物组分相比,经修饰的凝聚物组分形成凝聚物(例如液滴)的能力被减少了约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.5倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。在一些实施方案中,与未经修饰的凝聚物组分相比,经修饰的凝聚物组分形成凝聚物(例如液滴)的能力被增加了约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.5倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。
[0129]
如下文实施例所示,用丙氨酸置换med1中的芳香族氨基酸损害了包含芳香族取代基的药剂掺入经修饰的med1液滴中的能力。因此,在一些实施方案中,凝聚物组分是已经被修饰以增加或减少芳香族氨基酸残基的数目并且由此调节向包含凝聚物组分的凝聚物中掺入包含芳香族取代基的药剂的能力的天然存在的蛋白质或多肽。在一些实施方案中,至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或所有芳香族氨基酸残基已经被非芳香族氨基酸残基(例如,丙氨酸或其它中性氨基酸,例如天冬酰胺、半胱氨酸、谷氨酰胺、甘氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、缬氨酸等)置换。在一些实施方案中,至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个或更多个芳香族氨基酸残基被非芳香族氨基酸残基置换。在一些实施方案中,至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、35个、40个、45个、50个或更多个芳香族氨基酸残基被添加到凝聚物组分中。
[0130]
在一些实施方案中,与包含未经修饰的凝聚物组分的相应凝聚物相比,向包含经修饰的凝聚物组分的凝聚物中掺入包含芳香族取代基的药剂的能力被降低了约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.5倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。在一些实施方案中,与包含未经修饰的凝聚物组分的相应凝聚物相比,向包含经修饰的凝聚物组分的凝聚物中掺入包含芳香族取代基的药剂的能力被增加了约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、fold、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.5倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。
[0131]
在一些具体实施方案中,本文提供了用于获得具有所需分配系数的药剂的方法,所述方法包括(a)提供具有一个分配系数的第一药剂和至少第二药剂,所述第二药剂除了一个或多个非芳香族氨基酸被芳香族氨基酸置换和/或添加了一个或多个芳香族氨基酸之外与所述第一药剂相同,和(b)测量所述第二药剂的分配系数,从而获得具有所需分配系数的药剂。在一些具体实施方案中,本文提供了用于获得具有所需分配系数的药剂的方法,所述方法包括(a)提供具有一个分配系数的第一药剂和至少第二药剂,所述第二药剂除了一个或多个芳香族氨基酸被非芳香族氨基酸置换和/或去除了一个或多个芳香族氨基酸之外与所述第一药剂相同,和(b)测量所述第二药剂的分配系数,从而获得具有所需分配系数的药剂。
[0132]
固有无序区(也称为固有(或固有地)无序区(idr)或固有(或固有地)无序结构域)可以在许多蛋白质凝聚物组分中发现。这些术语中的每一个在整个本公开中可互换使用。idr缺乏稳定的二级和三级结构。在一些实施方案中,idr可以通过在以下文献中所公开的方法来鉴定:ali,m.和ivarsson,y.(2018).high-throughput discovery of functional disordered regions.molecular systems biology,14(5),e8377.idr是本领域已知的,并且可以使用任何合适的方法来鉴定idr。
[0133]
在一些实施方案中,所述组分是信号传导因子、甲基-dna结合蛋白、brd4、介体、介体组分、med1、med15、转录因子、rna聚合酶、dna序列(例如,增强子dna序列、甲基化dna序列、超级增强子dna序列、转录基因的3'端、信号应答元件、激素应答元件、癌基因或其部分)、基因沉默因子、剪接因子、延伸因子、起始因子、组蛋白(例如,经修饰的组蛋白)、辅助因子、rna(例如,ncrna)、介体、rna聚合酶(例如,rna聚合酶ii)、激酶(例如,细胞周期蛋白依赖性激酶、cdk7、cdk8)、蛋白酶体或拓扑异构酶。在一些实施方案中,所述组分是med1、brd4、polii、srsf2、fib1、npm1、组蛋白、cbx2、53bp1或hp1α、或其功能片段(例如,包含idr的片段)。在一些实施方案中,辅助因子包含lxxll基序。在一些实施方案中,辅助因子包含lxxll基序,并且当与配体(例如,同源配体、天然存在的配体、合成配体)结合时具有增加的tf(例如,核受体、主转录因子)化合价。具有lxxll基序的辅助因子是本领域已知的。在一些实施方案中,所述组分是包含idr和lxxll基序的辅助因子的片段。在一些实施方案中,所述组分是蛋白质或核酸。所述组分不受限制并且可以是本领域中鉴定的任何凝聚物组分。
[0134]
如本文所用,“介体组分”包含其氨基酸序列与天然存在的介体复合物多肽的氨基酸序列相同的多肽或由其氨基酸序列与天然存在的介体复合物多肽的氨基酸序列相同的多肽组成。天然存在的介体复合物多肽可以是例如在细胞中出现的或从细胞中纯化的介体复合物中发现的大约30种多肽中的任一种(参见例如conaway等人,2005;kornberg,2005;malik和roeder,2005)。在一些实施方案中,天然存在的介体组分是med1
–
med 31中的任一种或本领域已知的任何天然存在的介体多肽。例如,天然存在的介体复合物多肽可以是med6、med7、med10、med12、med14、med15、med17、med21、med24、med27、med28或med30。在一些实施方案中,介体多肽是在med11、med17、med20、med22、med 8、med 18、med 19、med 6、med 30、med 21、med4、med 7、med 31、med 10、med 1、med 27、med 26、med14、med15复合物中发现的亚基。在一些实施方案中,介体多肽是在med12/med13/cdk8/细胞周期蛋白复合物中发现的亚基。在pct国际申请第wo 2011/100374号(其教导以引用的方式整体并入本文)中进一步详细描述了介体。
[0135]
在一些实施方案中,凝聚物的组分是选自tcf7l2、tcf7、tcf7l1、lef1、β-连环蛋白、smad2、smad3、smad4、stat1、stat2、stat3、stat4、stat5a、stat5b、stat6和nf-κb的信号传导因子。在一些实施方案中,信号传导因子包含一个或多个固有无序结构域。在一些实施方案中,凝聚物包含主转录因子。
[0136]
在一些实施方案中,凝聚物的组分是优先结合甲基化dna的甲基-dna结合蛋白。在一些实施方案中,甲基-dna结合蛋白是mecp2、mbd1、mbd2、mbd3或mbd4。在一些实施方案中,甲基-dna结合蛋白与基因沉默相关。在一些实施方案中,所述组分是与异染色质相关的抑制剂。在一些实施方案中,甲基-dna结合蛋白是hp1α、tbl1r(转导素β样蛋白)、hdac3(组蛋白脱乙酰酶3)或smrt(视黄酸和甲状腺受体的沉默介体)。
[0137]
在一些实施方案中,凝聚物的组分是与mrna起始和延伸相关的rna聚合酶。在一些实施方案中,rna聚合酶是rna聚合酶ii或rna聚合酶ii c末端区域。在一些实施方案中,rna聚合酶ii c末端区域包含固有无序区(idr)。在一些实施方案中,idr包含磷酸化位点。在一些实施方案中,所述组分是选自srsf2、srrm1或srsf1的剪接因子。
[0138]
在一些实施方案中,凝聚物的组分是转录因子。在一些实施方案中,转录因子是oct4、p53、myc或gcn4、nanog、myod、klf4、sox家族转录因子、gata家族转录因子或核受体(例如,核激素受体、雌激素受体、视黄酸受体α)。
[0139]
在一些实施方案中,核受体(nr)是核受体亚家族0成员、核受体亚家族1成员、核受体亚家族2成员、核受体亚家族3成员、核受体亚家族4成员、核受体亚家族5成员或核受体亚家族6成员。在一些实施方案中,核受体是nr1d1(核受体亚家族1d组成员1)、nr1d2(核受体亚家族1d组成员2)、nr1h2(核受体亚家族1h组成员2;同义词:肝x受体β)、nr1h3(核受体亚家族1h组成员3;同义词:肝x受体α)、nr1h4(核受体亚家族1h组成员4)、nr1i2(核受体亚家族1i组成员2;同义词:孕烷x受体)、nr1i3(核受体亚家族1i组成员3;同义词:组成型雄甾烷受体)、nr1i4(核受体亚家族1i组成员4)、nr2c1(核受体亚家族2c组成员1)、nr2c2(核受体亚家族2c组成员2)、nr2e1(核受体亚家族2e组成员1)、nr2e3(核受体亚家族2e组成员3)、nr2f1(核受体亚家族2f组成员1)、nr2f2(核受体亚家族2f组成员2)、nr2f6(核受体亚家族2f组成员6)、nr3c1(核受体亚家族3c组成员1;同义词:糖皮质激素受体)、nr3c2(核受体亚家族3c组成员2;同义词:醛固酮受体、盐皮质激素受体)、nr4a1(核受体亚家族4a组成员1)、nr4a2(核受体亚家族4a组成员2)、nr4a3(核受体亚家族4a组成员3)、nr5a1(核受体亚家族5a组成员1)、nr5a2(核受体亚家族5a组成员2)、nr6a1(核受体亚家族6a组,成员1)、nr0b1(核受体亚家族0b组成员1)、nr0b2(核受体亚家族0b组成员2)、rara(视黄酸受体,α)、rarb(视黄酸受体,β)、rarg(视黄酸受体,γ)、rxra(类视黄醇x受体,α;同义词:核受体亚家族2b族成员1)、rxrb(类视黄醇x受体,β;同义词:核受体亚家族2b组成员2)、rxrg(类视黄醇x受体,γ;同义词:核受体亚家族2b族成员3)、thra(甲状腺激素受体,α)、thrb(甲状腺激素受体,β)、ar(雄激素受体)、esr1(雌激素受体1)、esr2(雌激素受体2;同义词:erβ)、esrra(雌激素相关受体α)、esrrb(雌激素相关受体β)、esrrg(雌激素相关受体γ)、pgr(孕酮受体)、ppara(过氧化物酶体增殖物活化受体α)、ppard(过氧化物酶体增殖物活化受体δ)、pparg(过氧化物酶体增殖物活化受体γ)或vdr(维生素d(1,25-二羟基维生素d3)受体)。
[0140]
在一些实施方案中,核受体是通过蛋白水解切割产生的核受体的天然存在的截短形式,诸如截短的rxrα或截短的雌激素受体。在一些实施方案中,核受体是hsp70客户(client)。例如,雄激素受体(ar)和糖皮质激素受体(gr)是hsp70客户。关于nr的广泛信息可见于germain,p.等人,pharmacological reviews,58:685-704,2006(其提供了对核受体命名和结构的综述)以及与关于nr亚家族的综述的pharmacological reviews同一期中的其它文章。在一些实施方案中,hsp90a客户是类固醇激素受体(例如,雌激素、孕酮、糖皮质激素、盐皮质激素或雄激素受体)、pparα或pxr。在一些实施方案中,核受体(nr)是配体依赖性nr。配体依赖性nr的特征在于配体与nr的结合调节nr的活性。在一些实施方案中,配体与配体依赖性nf的结合引起nr的构象变化,这导致例如nr的核易位、一种或多种蛋白质从nr的解离、nr的活化或nr的阻抑。在一些实施方案中,nr是在配体结合后缺乏野生型nr的一种或多种活性(例如,nr的核易位、一种或多种蛋白质从nr的解离、nr的活化或nr的阻抑)的突
变体。在一些实施方案中,nr是具有配体结合非依赖性活性(例如,nr的核易位、一种或多种蛋白质从nr的解离、nr的活化或nr的阻抑)的突变体,所述配体结合非依赖性活性在野生型nr中为配体依赖性的。在一些实施方案中,当与同源配体结合时,核受体活化转录。在一些实施方案中,核受体是在不存在同源配体的情况下活化转录的突变的核受体。
[0141]
在本文所公开方法的一些实施方案中,转录因子是在以下文献中所鉴定的人转录因子:lambert等人,cell.2018年2月8日;172(4):650-665。在一些实施方案中,当与同源配体结合时,核受体活化转录。在一些实施方案中,核受体是在不存在同源配体的情况下活化转录的突变的核受体,或与在存在天然配体(例如,同源配体)的情况下的野生型核受体相比在不存在同源配体的情况下具有更高水平的转录活性(例如,至少1.5倍、至少2倍、至少3倍或更多)。在一些实施方案中,核受体是在存在同源配体的情况下以与野生型核受体不同的程度调节转录的突变的核转录因子。在一些实施方案中,转录因子是融合致癌转录因子。在一些实施方案中,所述融合致癌转录因子选自mll-重排物、ews-fli、ets融合物、brd4-nut和nup98融合物。致癌转录因子可以是本领域中鉴定的任何致癌转录因子。
[0142]
在一些实施方案中,凝聚物的组分是在转录凝聚物中发现的组分。在一些实施方案中,转录凝聚物组分包含转录因子、辅助因子、染色质调节剂、dna、非编码rna、新生rna、rna聚合酶ii、激酶、蛋白酶体、拓扑异构酶和/或增强子。在一些实施方案中,转录因子是例如oct4、p53、myc、gcn4、nanog、myod、klf4、sox家族转录因子、gata家族转录因子、核受体或融合致癌转录因子。
[0143]
在一些实施方案中,凝聚物的组分是在核仁中发现的组分。在一些实施方案中,核仁组分是rrna加工因子、pol1、fib1、核磷蛋白、核糖体dna基因簇和/或polr1e。
[0144]
在一些实施方案中,在不使用可检测标签的情况下检测药剂在凝聚物中的掺入。在一些实施方案中,所述药剂自然地发荧光。在一些实施方案中,所述药剂具有使其区别于凝聚物和/或区别于凝聚物外部的背景或区域的颜色。在一些实施方案中,通过拉曼光谱法检测药剂的掺入(参见例如,smith等人,analyst,2016,141,第3590-3600页)。在一些实施方案中,通过核磁共振(nmr)检测药剂的掺入。在一些实施方案中,通过质谱法检测药剂的掺入。在一些实施方案中,通过分光光度法和定量相位显微术检测药剂的掺入。在一些实施方案中,通过相干控制全息显微术(coherence-controlled holographic microscopy)检测药剂的掺入。在一些实施方案中,通过旋转沉降测定检测药剂的掺入。还应当理解的是,可以通过检测没有掺入凝聚物中的药剂的量或比例来检测药剂在凝聚物中的掺入。
[0145]
在一些实施方案中,通过将凝聚物与未掺入凝聚物中的药剂分离并且然后测量凝聚物中剩余的药剂来检测药剂在凝聚物中的掺入。可以使用任何合适的分离凝聚物的方法并且不受限制。在一些实施方案中,通过从具有凝聚物的细胞中除去凝聚物来分离凝聚物。在一些实施方案中,通过从包含凝聚物的体外组合物(例如溶液)中除去凝聚物来分离凝聚物。在一些实施方案中,凝聚物被交联以有助于凝聚物的分离。在一些实施方案中,分离的凝聚物被破坏并测量了药剂的量或比例。可以使用任何合适的破坏方法,包括物理和/或化学手段。在一些实施方案中,可以通过增加或降低溶液中盐或拥挤药剂(crowding agent)的浓度来破坏凝聚物。在一些实施方案中,可以通过超声处理、离心或通过改变温度来破坏凝聚物。在一些实施方案中,通过色谱法(例如,hplc)测量来自破坏的凝聚物的药剂。
[0146]
在一些实施方案中,相对于对照测量药剂在凝聚物中的掺入。对照可以是已知在
适当的生理条件下掺入凝聚物中的化合物。对照也可以是具有与药剂相似的物理或化学性质并具有已知的在凝聚物中的掺入特征的化合物。在一些实施方案中,确定了药剂的富集比或分配系数(即,药剂在凝聚物中和外部的相对浓度)。在一些实施方案中,通过测量在凝聚物中和在凝聚物外部两者的药剂上的荧光标签的荧光来确定富集比。在一些实施方案中,通过在实施例部分中所描述的方法检测富集比。确定富集比和分配系数的方法是本领域已知的并且不受限制。在一些实施方案中,确定了被分配到凝聚物中的药剂的量。在一些实施方案中,所述药剂包含可检测标签。在一些实施方案中,使用可检测标签测量药剂在凝聚物中的掺入。如本文所用的术语“可检测标签”或“可检测标记”包括但不限于可检测标记,诸如荧光团、放射性同位素、比色底物或酶;针对其的特异性抗体可商购获得的异源表位,例如flag标签;作为可商购获得的结合蛋白的配体的异源氨基酸序列例如strep标签,生物素;通常与在其他多肽上的荧光标签结合使用的荧光淬灭剂;以及互补的生物发光或荧光多肽片段。可以直接测量作为可检测标记或互补生物发光或荧光多肽片段的标签(例如,通过测量如与不相关多肽相比相关多肽的荧光或放射性,或与适当的底物或酶一起孵育以产生与不相关多肽相比相关多肽的分光光度法可检测的颜色变化)。作为异源表位或配体的标签通常用与其结合的第二组分(例如,抗体或结合蛋白)检测,其中第二组分与可检测标记缔合。在一些实施方案中,所述可检测标签是荧光标签。在一些实施方案中,凝聚物组分和药剂两者都包含可检测标签。在一些实施方案中,所述组分包含与所述药剂不同的可检测标签。
[0147]
计算药剂在凝聚物中的掺入的方法不受限制,并且可以是本领域已知的任何方法。在一些实施方案中,通过图36中所示的方法确定药剂的富集比。在一些实施方案中,药剂(例如,具有可检测标签的药剂或具有可检测特性的药剂)对特定凝聚物的富集比通过以下方式来确定:在具有所述药剂的溶液中提供所述凝聚物并且通过共聚焦显微术检测所述凝聚物中所述药剂的强度以获得药物
进入
值;在不具有所述药剂的溶液中提供所述凝聚物并且检测所述凝聚物内的背景强度以获得背景值;并且在不具有所述凝聚物的溶液中提供所述药剂并且检测所述药剂的强度以获得药物
扩散
值;其中所述富集比等于(药物进入-背景)/(药物
扩散
)。在一些实施方案中,可以通过分光光度法和定量相位显微术以实验方式确定药剂分配。在一些实施方案中,考虑由两个共存相(即稀释相和凝聚相)构成的样品,其中体积分数φ稀释相和φ凝聚相=1。如果药剂也以c总计的平均浓度存在于样品中,则质量守恒要求
[0148]c总计
=c
稀释相
φ
稀释相
c
凝聚相
φ
凝聚相
,
ꢀꢀ
(1)
[0149]
其中c
稀释相
和c
凝聚相
分别是药剂在稀释相和凝聚相中的浓度。对于在凝聚相中的药剂的分配系数被定义为p=c
凝聚相
/c
稀释相
。根据该定义和相体积分数和为1的要求,eq 1可以写为
[0150]c总计
=c
稀释相
(1-φ
凝聚相
) c
稀释相
pφ
凝聚相
,
ꢀꢀ
(2)
[0151]
其可以被简化和重新整理以产生
[0152][0153]
如下文所述,从荧光光谱法测量结果中估计c
总计
/c
稀释相
的比率,而φ
凝聚相
,其从杠杆法则中如下推断出来(m.rubinstein,r.h.colby,polymer phyics(oxford university press,2003)):将凝聚物蛋白质(例如med1)的浓度用s表示,质量守恒给出s总计=s
稀释相
φ
稀释相
s
凝聚相
φ
凝聚相
,与eq.1类似。再次,使用共存相的体积分数总和为1的要求,这可以被重新整理以产生
[0154][0155]
其中s
总计
和s
稀释相
由例如在280nm处的光学吸光度以分光光度法测量,并且s
凝聚相
由使用例如相干控制全息显微镜的定量相位显微术测量。
[0156]
紫外-可见光谱法可以用于使用eq 5的比尔-朗伯定律(beer-lambert law)估计溶液中药剂的绝对浓度,
[0157]
a=log10(10/i)=εcl
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(5)
[0158]
其中a是所测量的吸光度(以吸光度单位(au)计),i0是在给定波长处的入射光的强度,i是透射强度,l是通过样品的路径长度,并且c是吸收物质的浓度。对于每种物质和波长,ε是称为摩尔吸光系数或消光系数的常数。该常数是在特定温度和压力下在给定溶剂中的基本分子特性,并且具有1/m*cm的单位。
[0159]
在一些实施方案中,可以通过使用旋转沉降测定来测量所分配的药剂的量。具体地,将已知浓度的药剂与凝聚物组分一起添加,并允许形成液滴。然后将混合物离心以沉淀液滴,收集上清液,并测量上清液中药剂的浓度。然后可以通过从所添加的药物的总已知浓度中减去上清液中药剂的浓度来确定所分配的药剂的量。
[0160]
在一些实施方案中,可以使用相干控制全息显微镜来进行定量相测量,例如,如下文实施例中所详述的。软件可以用于从所获取的全息图构造补偿相图像。在一些实施方案中,每个相图像基于强度被空间分段,并且含有每个分段对象的窗口被拟合为该形式的空间函数
[0161][0162]
其中是在像素位置(x,y)处的相强度;λ是照射波长,δn是在凝聚物与周围稀释相之间的折射率差,并且h(x,y|r)是半径r的球体的投影高度。eq.6中的拟合参数是δn和r。假设没有peg分配到凝聚物中,并且将每种过滤的凝聚物中的平均支架浓度计算为
[0163][0164]
这里n0是在不存在支架和peg的情况下缓冲液的折射率,n
稀释相
是稀释相的折射率,并且两者都使用数字折射计进行测量。凝聚物蛋白质的折射率增量dn/ds可以从氨基酸组成进行估计。
[0165]
在一些实施方案中,可以对在凝聚物的存在下的药剂-靶标相互作用建模。可以将这样的建模例如用于确定对靶标治疗有效的药剂的有效分配系数和/或浓度。在一些实施方案中,建模可以是如本文实施例中所示的简化模型。开发了在凝聚物的存在下的药物-靶相互作用的此简化模型。相关物质是药物(d)(即,药剂)、靶标(t)和药物-靶标复合物(d-t)。假定仅存在2种类型的相,即本体/稀释核相(n)和凝聚物相(c),其以体积分数f=v
凝聚物
/v
细胞核
存在。在平衡时,遵循以下分配条件:
[0166][0167]
其中pd、p
t
是药物和靶标的分配系数。[d]c代表物质d在凝聚物相中的浓度(并且类似地对于其它组分/相)。在此模型中,药物和靶标复合物具有kd的独立于相的解离常数。
[0168][0169][0170]
为了求解以总水平[d]0、[t]0存在的各种物质的平衡浓度,物质平衡被写为:
[0171]
f([d]c [d-t]c) (1-f)([d]n [d-t]n)=[d]0[0172]
f([t]c [d-t]c) (1-f)([t]n [d-t]n)=[dt]0[0173]
这6个浓度用2个方程和4个约束(2个来自分配,以及2个来自反应平衡)求解。在图61a-61d中,结合靶标的级分被定义为:
[0174][0175]
类似的表达用于在核(本体或稀释)相中结合靶标的级分。在绘制对照的情况下,当仅存在1个相(f=0)时绘制绘图级分。
[0176]
在一些情况下,可检测标签在药剂上的存在可能改变药剂在凝聚物中的掺入活性。然而,如果标记的药剂被掺入可以用过量的未标记的药剂冲洗掉的凝聚物中,则标记的药剂在凝聚物中的掺入不是由标记介导的。因此,在一些实施方案中,本文所公开的方法包括使具有可检测标签的药剂与所述包含凝聚物的组合物接触,测量所述具有可检测标签的药剂在所述凝聚物中的掺入,使所述包含凝聚物的组合物(例如,溶液)和所述具有可检测标签的药剂与不具有可检测标签的对照药剂(即,不具有可检测标签的相同药剂)接触,以及再次测量所述具有可检测标签的药剂在所述凝聚物中的掺入。在一些实施方案中,接触至少相等浓度的对照药剂。在一些实施方案中,接触过量的对照药剂(例如对照药剂的至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍或更多)。在一些实施方案中,使掺入标记的药剂的凝聚物与增加梯度的对照药剂接触,并且连续或以离散间隔测量标记的药剂的损失。在一些实施方案中,所述方法还可以包括使凝聚物(例如,液滴)与对于所述凝聚物标记的药剂和所述药剂的具有较低的分配系数的异构体接触。在一些实施方案中,所述药剂的异构体没有可检测地分配到凝聚物中。在一些实施方案中,标记的药剂在与凝聚物中的靶标接触时引起靶标从凝聚物中排出。在一些实施方案中,与在不存在异构体的情况下的标记的靶标相比,凝聚物与标记的药剂和所述标记的药剂的不明显分配到凝聚物中的异构体的接触不减少在与标记的靶标结合后排出的靶标的量。在一些实施方案中,所述异构体是反式铂,其是顺铂的异构体,所述标记的药剂是标记的顺铂并且所述靶标是雌激素受体。
[0177]
在一些实施方案中,凝聚物的组分包含可检测标签。在一些实施方案中,所述药剂和所述凝聚物的组分两者均包含可检测标签。可检测标签不受限制并且可以是本文所公开的任何可检测标签。在一些实施方案中,掺入凝聚物中或与凝聚物缔合的dna或rna包含可检测标签。
[0178]
表征如本文所公开的药剂的一些具体实施方案如下:
[0179]
逐出/竞争液滴测定:
[0180]
在一些实施方案中,本文提供了用于确定第一药剂是否调节第二药剂在凝聚物中的掺入的方法,所述方法包括:(a)测量在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入;并且(b)将在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入与参照进行比较,从而确定所述第一药剂是否调节所述第二药剂在所述凝聚物中的掺入。在一些实施方案中,所述参照是基于在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入。所述第一药剂和所述第二药剂可以是本文所述的任何药剂并且不受限制。在一些实施方案中,至少所述第一药剂或所述第二药剂是如本文所述的小分子。
[0181]
在一些实施方案中,本文提供了用于确定第一药剂是否调节第二药剂在凝聚物中的掺入的方法,所述方法包括:(a)测量在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入;(b)测量在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入;并且(c)将在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入与在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入进行比较,从而确定所述第一药剂是否调节所述第二药剂在所述凝聚物中的掺入。
[0182]
在一些实施方案中,本文提供了用于确定第一药剂是否调节第二药剂在凝聚物中的掺入的方法,所述方法包括:(a)将凝聚物和第二药剂混合以形成反应组合物,其中所述凝聚物组分包含第一可检测标签,其中所述第二药剂包含第二可检测标签,并且其中所述第一可检测标签和所述第二可检测标签的信号是可区分的;(b)测量在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入;(c)将所述第一药剂混入所述反应组合物中;(d)测量在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入;并且(e)将在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入与在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入进行比较,从而确定所述第一药剂是否调节所述第二药剂在所述凝聚物中的掺入。
[0183]
在一些实施方案中,本文提供了用于确定第一药剂是否调节第二药剂在凝聚物中的掺入的方法,所述方法包括:(a)将包含所述凝聚物的组分的组合物与第二药剂混合以形成反应组合物并引起在所述反应组合物中形成所述凝聚物,其中所述凝聚物组分包含第一可检测标签,其中所述第二药剂包含第二可检测标签,并且其中所述第一可检测标签和所述第二可检测标签的信号是可区分的;(b)测量在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入;(c)将所述第一药剂混入所述反应组合物中;(d)测量在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入;并且(e)将在不存在所述第一药剂的情况下所述第二药剂在所述凝聚物中的掺入与在所述第一药剂的存在下所述第二药剂在所述凝聚物中的掺入进行比较,从而确定所述第一药剂是否调节所述第二药剂在所述凝聚物中的掺入。在一些实施方案中,测量药剂在凝聚物中的掺入包括使用包括拉曼光谱法、分光光度法、定量相位显微术、荧光显微术(包括定量荧光显微术)和/或旋转沉降测定
在内的技术。在一些实施方案中,第一药剂和/或第二药剂包含可检测标签,例如荧光标签或标记。在一些实施方案中,凝聚物包含含有可检测标签(例如,荧光标签或标记)的组分。在一些实施方案中,第一药剂是未标记的,并且第二药剂包含可检测标签,诸如荧光标记。在一些实施方案中,第二药剂包含第一药剂和可检测标签,诸如荧光标记。在一些实施方案中,测量药剂在凝聚物中的掺入包括定量药剂在一种或多种凝聚物的边界范围内的信号强度,其中所述一种或多种凝聚物的边界范围基于所述凝聚物的标记的组分,诸如在本文所公开的测量技术中所描述的和/或如本文所附的附图中所示的。
[0184]
在一些实施方案中,本文提供了用于确定药剂是否调节在凝聚物中凝聚物组分的掺入的方法,所述方法包括:(a)在所述药剂的存在下测量在所述凝聚物中所述凝聚物组分的掺入;并且(b)将所述药剂的存在下在所述凝聚物中所述凝聚物组分的掺入与参照进行比较,从而确定所述药剂是否调节在所述凝聚物中所述凝聚物组分的掺入。在一些实施方案中,所述参照是基于在不存在所述药剂的情况下在所述凝聚物中所述凝聚物组分的掺入。在一些实施方案中,凝聚物包含多于一种凝聚物组分,例如第一组分和第二组分。在一些实施方案中,本文提供了用于确定药剂是否调节在凝聚物中第一凝聚物组分的掺入的方法,其中,当不存在所述药剂时,所述凝聚物包含所述第一凝聚物组分和第二凝聚物组分,所述方法包括:(a)测量在不存在所述药剂的情况下在所述凝聚物中所述第一凝聚物组分的掺入;(b)测量在所述药剂的存在下在所述凝聚物中所述第一凝聚物组分的掺入;并且(c)将在不存在所述药剂的情况下在所述凝聚物中所述第一凝聚物组分的掺入与在所述药剂的存在下在所述凝聚物中所述第一凝聚物组分的掺入进行比较,从而确定所述药剂是否调节在所述凝聚物中所述第一凝聚物组分的掺入。在一些实施方案中,测量在凝聚物中药剂和/或凝聚物组分的掺入包括使用包括拉曼光谱法、分光光度法、定量相位显微术、荧光显微术(包括定量荧光显微术)和/或旋转沉降测定在内的技术。在一些实施方案中,所述药剂包含可检测标签,例如荧光标签或标记。在一些实施方案中,一种或多种凝聚物组分包含可检测标签,例如荧光标签或标记。在一些实施方案中,第一凝聚物组分包含第一可检测标签,并且第二凝聚物组分包含第二可检测标签,其中所述第一可检测标签和所述第二可检测标签是可区分的,例如在不同波长下发荧光。在一些实施方案中,测量在凝聚物中凝聚物组分的掺入包括定量所述凝聚物组分在一种或多种凝聚物的边界范围内的信号强度,其中所述一种或多种凝聚物的边界范围基于所述凝聚物的标记的组分,诸如在本文所公开的测量技术中所描述的和/或在附图中所示的。
[0185]
鉴定具有所需凝聚物系数的药剂
[0186]
在一些实施方案中,本文提供了用于鉴定具有所需凝聚物分配系数的药剂的方法。在一些实施方案中,本文提供了用于鉴定具有所需凝聚物分配系数的药剂的方法,所述方法包括:(a)测量所述药剂的凝聚物分配系数;并且(b)将所述药剂的凝聚物分配系数与参照进行比较,从而鉴定具有所需凝聚物分配系数的药剂。所述药剂可以是本文所述的任何药剂并且不受限制。在一些实施方案中,所述药剂是如本文所述的小分子。
[0187]
在一些实施方案中,将用于鉴定具有所需凝聚物分配系数的药剂的方法用于筛选多种药剂和/或选择具有所需凝聚物分配系数的某些药剂。在一些实施方案中,在不存在第二药剂的情况下测量第一药剂的凝聚物分配系数。例如,在一些实施方案中,本文提供了用于从多种药剂中鉴定具有所需凝聚物分配系数的一种或多种药剂的方法,其中所述多种药
剂包括第一药剂和第二药剂,所述方法包括:(a)测量所述第一药剂的凝聚物分配系数;(b)测量所述第二药剂的凝聚物分配系数;并且(c)将所述第一药剂的凝聚物分配系数与所述第二药剂的凝聚物分配系数进行比较,从而从所述多种药剂中鉴定出具有所需凝聚物分配系数的一种或多种药剂。所述第一药剂和所述第二药剂可以是本文所述的任何药剂并且不受限制。在一些实施方案中,至少所述第一药剂或所述第二药剂是如本文所述的小分子。
[0188]
在一些实施方案中,在第二药剂的存在下测量凝聚物中第一药剂的凝聚物分配系数,例如竞争测定。例如,在一些实施方案中,本文提供了用于从多种药剂中鉴定具有所需凝聚物分配系数的一种或多种药剂的方法,其中所述多种药剂包括第一药剂和第二药剂,所述方法包括:(a)测量在不存在所述第二药剂的情况下的所述第一药剂的凝聚物分配系数;(b)测量在所述第二药剂的存在下的所述第一药剂的凝聚物分配系数;并且(c)将在不存在所述第二药剂的情况下的所述第一药剂的凝聚物分配系数与在所述第二药剂的存在下的所述第一药剂的凝聚物分配系数进行比较,由此从所述多种药剂中鉴定出具有所需凝聚物分配系数的一种或多种药剂。在一些实施方案中,测量药剂在凝聚物中的凝聚物分配系数包括使用包括拉曼光谱法、分光光度法、定量相位显微术、荧光显微术(包括定量荧光显微术)和/或旋转沉降测定在内的技术。在一些实施方案中,第一药剂和/或第二药剂包含可检测标签,例如荧光标签或标记。在一些实施方案中,凝聚物包含含有可检测标签(例如,荧光标签或标记)的组分。在一些实施方案中,测量药剂在凝聚物中的凝聚物分配系数包括定量药剂在一种或多种凝聚物的边界范围内的信号强度,其中所述一种或多种凝聚物的边界范围基于所述凝聚物的标记的组分,诸如在本文所公开的测量技术中所描述的和/或在附图中所示的。
[0189]
异构体
[0190]
在一些实施方案中,第一药剂和第二药剂是彼此的异构体(例如顺铂和反式铂),诸如任何结构异构体、立体异构体、对映异构体、非对映异构体、顺式/反式异构体、构象异构体或旋转异构体,并且可以将本文所述的方法用于通过筛选多种异构体来鉴定具有所需凝聚物分配系数的一种或多种异构体。
[0191]
例如,在一些实施方案中,本文提供了用于鉴定具有所需凝聚物分配系数的一种或多种异构体的方法,所述方法包括:(a)测量第一异构体药剂的凝聚物分配系数;(b)测量第二异构体药剂的凝聚物分配系数;并且(c)将所述第一异构体药剂的凝聚物分配系数与所述第二异构体药剂的凝聚物分配系数进行比较,从而鉴定出具有所需凝聚物分配系数的一种或多种异构体。在一些实施方案中,所述第一异构体药剂和所述第二异构体药剂是彼此的异构体。在一些实施方案中,所述第一异构体药剂和所述第二异构体药剂是小分子。异构体药剂不受限制并且可以是本文所述的任何药剂。
[0192]
在一些实施方案中,本文提供了用于鉴定具有所需凝聚物分配系数的一种或多种异构体的方法,所述方法包括:(a)测量在不存在第二异构体药剂的情况下的第一异构体药剂的凝聚物分配系数;(b)测量在所述第二异构体药剂的存在下的所述第一异构体药剂的凝聚物分配系数;并且(c)将在不存在所述第二异构体药剂的情况下的所述第一异构体药剂的凝聚物分配系数与在所述第二异构体药剂的存在下的所述第一异构体药剂的凝聚物分配系数进行比较,由此鉴定出具有所需凝聚物分配系数的一种或多种异构体。
[0193]
在一些实施方案中,所公开的用于鉴定具有所需凝聚物分配系数的一种或多种异
构体的方法可以包括参照包含不同异构体的混合物(诸如异构体的外消旋混合物)的组合物。例如,在一些实施方案中,提供了用于鉴定具有所需凝聚物分配系数的异构体的方法,所述方法包括:(a)测量第一异构体药剂的凝聚物分配系数;并且(b)比较包含所述第一异构体药剂的外消旋混合物的凝聚物分配系数,从而鉴定出具有所需凝聚物分配系数的异构体。在一些实施方案中,外消旋混合物是已知的治疗剂(例如抗癌剂)。在一些实施方案中,与药剂的其它异构体形式相比,药剂的特定异构体将具有所需的凝聚物分配系数。因此,在一些方面,本文提供了具有所需凝聚物分配系数的纯的异构体组合物,以及制备所述纯的异构体组合物的方法,所述方法包括根据本文所公开的方法鉴定具有所需凝聚物分配系数的异构体药剂。
[0194]
标记的核酸
[0195]
在一些实施方案中,本文提供了使具有核酸凝聚物组分和/或含有核酸的凝聚物(例如液滴)与能够将部分添加到核酸上的药剂接触并且检测所述部分的添加的方法。在一些实施方案中,将所添加的部分的量与对照或参考水平进行比较。在一些实施方案中,所述药剂是通过本文所公开的方法修饰的药剂,并且所述对照或参考水平是通过未经修饰的药剂添加的部分的量。在一些实施方案中,所述部分是或包含用于检测所述部分的添加的可检测标签。在一些实施方案中,所述部分的添加调节与所述核酸相关的基因产物的表达,并且所述基因产物的表达用于检测所述部分的添加。在一些实施方案中,所述部分是铂化(plantination)部分。在一些实施方案中,在与药剂接触之后,通过hplc测量部分的添加。
[0196]
在一些实施方案中,本文提供了使具有核酸凝聚物组分和/或含有核酸的凝聚物(例如液滴)与能够将部分从核酸上去除的药剂接触并且检测所述部分的去除的方法。在一些实施方案中,将所去除的部分的量与对照或参考水平进行比较。在一些实施方案中,所述药剂是通过本文所公开的方法修饰的药剂,并且所述对照或参考水平是通过未经修饰的药剂去除的部分的量。在一些实施方案中,所述部分是或包含用于检测所述部分的去除或保留在核酸上的部分的可检测标签。在一些实施方案中,所述部分的去除调节与所述核酸相关的基因产物的表达,并且所述基因产物的表达用于检测所述部分的去除。在一些实施方案中,所述部分是甲基化的。在一些实施方案中,在与所述药剂接触之后,通过hplc测量部分的去除。
[0197]
栓系的凝聚物组分测定
[0198]
在一些实施方案中,本文提供了表征药剂的方法,所述方法包括提供融合构建体,所述融合构建体包含凝聚物组分或其功能片段和与核酸接触的核酸结合结构域,所述核酸能够结合所述核酸结合结构域并且使所述融合构建体与所述药剂接触,从而表征所述药剂。在一些实施方案中,融合构建体将包含凝聚物组分或功能片段的凝聚物锚定到核酸上,并且药剂与所述凝聚物接触。在一些实施方案中,药剂与融合构建体连同能够与融合构建体形成凝聚物的一种或多种凝聚物组分接触。
[0199]
在一些实施方案中,所述融合构建体包含med1或med1的idr。在一些实施方案中,融合构建体包含hp1α或hp1α的idr。在一些实施方案中,融合构建体包含esr1或esr1的活化结构域。在一些实施方案中,能够与融合构建体形成凝聚物的一种或多种凝聚物组分包含与所述融合构建体的凝聚物组分相同的凝聚物组分。在一些实施方案中,所述融合构建体包含med1的idr,并且所述一种或多种凝聚物组分包含med1。在一些实施方案中,所述融合
构建体包含hp1α的idr,并且所述一种或多种凝聚物组分包含hp1α。在一些实施方案中,所述融合构建体包含hp1αesr1的活化结构域,并且所述一种或多种凝聚物组分包含med1。
[0200]
在一些实施方案中,核酸结合结构域是laci并且核酸包含lac操纵子序列(例如,lac阵列)。
[0201]
在一些实施方案中,融合构建体还包含可检测标签。可检测标签不受限制并且可以是本文所公开的任何可检测标签。在一些实施方案中,可检测标签是荧光标签。在一些实施方案中,除了融合构建体凝聚物组分或功能片段以外的凝聚物组分包含可检测标签。可检测标签不受限制并且可以是本文所公开的任何可检测标签。在一些实施方案中,所述可检测标签是荧光标签。在一些实施方案中,融合构建体和除了融合构建体凝聚物组分或其功能片段以外的凝聚物组分两者各自均包含可检测标签。在一些实施方案中,融合构建体和除了融合构建体凝聚物组分或其功能片段以外的凝聚物组分各自包含可检测标签,并且通过检测各个可检测标签的共定位来测量药剂调节与融合构建体缔合的凝聚物组分的量的能力。
[0202]
在一些实施方案中,融合构建体还包含在核酸结合结构域和凝聚物组分或功能片段之间的接头。接头不受限制并且可以是本文所述的任何接头。在一些实施方案中,所述接头是gapgsagsaaggsg(seq id no:16)。
[0203]
药剂抗性凝聚物
[0204]
本公开的一些方面涉及评估对药剂有抗性的细胞差异表达一种或多种凝聚物组分是否引起或促成抗性的方法。
[0205]
在一些实施方案中,所述方法包括提供药剂抗性细胞,使所述药剂抗性细胞与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。在一些实施方案中,所述对照包含相应的非抗性细胞。在一些实施方案中,所述细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述细胞是乳腺癌细胞。评估所述药剂的定位、浓度和/或治疗活性的方法不受限制并且可以包括本文所公开的任何方法。在一些实施方案中,所述细胞包含具有可检测标记的凝聚物。在一些实施方案中,与细胞接触的药剂包含可检测标记。在一些实施方案中,细胞中的凝聚物和药剂两者都包含可检测标记。所述药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述药剂是小分子。
[0206]
在一些实施方案中,所述方法包括提供从药剂抗性细胞中分离的凝聚物,使所述凝聚物与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。在一些实施方案中,所述对照包含来自非抗性细胞的相应的凝聚物。在一些实施方案中,所述细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述细胞是乳腺癌细胞。评估所述药剂的定位、浓度和/或治疗活性的方法不受限制并且可以包括本文所公开的任何方法。在一些实施方案中,所述凝聚物包含可检测标记。在一些实施方案中,所述药剂包含可检测标记。在一些实施方案中,所述凝聚物和所述药剂两者都包含可检测标记。所述药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述药剂是小分子。
[0207]
在一些实施方案中,所述方法包括提供包含在药剂抗性细胞中差异表达的差异量的凝聚物组分或其片段的体外凝聚物(例如,液滴),使所述凝聚物与所述药剂接触,以及评
估与对照相比所述药剂的定位、浓度和/或治疗活性。在一些实施方案中,所述对照包含不含有差异量的凝聚物组分或其片段的相应的凝聚物。在一些实施方案中,所述药剂抗性细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述药剂抗性细胞是乳腺癌细胞。评估所述药剂的定位、浓度和/或治疗活性的方法不受限制并且可以包括本文所公开的任何方法。在一些实施方案中,所述凝聚物包含可检测标记。在一些实施方案中,所述药剂包含可检测标记。在一些实施方案中,所述凝聚物和所述药剂两者都包含可检测标记。所述药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述药剂是小分子。在一些实施方案中,所述凝聚物组分是介体、med1、brd4、srsf2、hp1α、fib1、npm1或其包含idr的功能片段。在一些实施方案中,所述差异量的凝聚物组分是在非抗性细胞中的凝聚物中发现的凝聚物组分的至少1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍或更多。在一些实施方案中,所述差异量的凝聚物组分比在非抗性细胞中的凝聚物中发现的凝聚物组分的量少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍或更多。
[0208]
在一些实施方案中,所述方法包括提供包含与在药剂抗性细胞中的突变体凝聚物组分对应的突变体凝聚物组分或其片段的体外凝聚物(例如,液滴),使所述凝聚物与所述药剂接触,以及评估与对照相比所述药剂的定位、浓度和/或治疗活性。在一些实施方案中,所述对照包含相应的凝聚物,所述相应的凝聚物包含所述凝聚物组分的非突变形式或其片段。在一些实施方案中,药剂抗性细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述药剂抗性细胞是乳腺癌细胞。评估所述药剂的定位、浓度和/或治疗活性的方法不受限制并且可以包括本文所公开的任何方法。在一些实施方案中,所述凝聚物包含可检测标记。在一些实施方案中,所述药剂包含可检测标记。在一些实施方案中,所述凝聚物和所述药剂两者都包含可检测标记。所述药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述药剂是小分子。在一些实施方案中,所述突变体凝聚物组分是包含idr并且具有所述突变的介体、med1、brd4、srsf2、hp1α、fib1、npm1或其功能片段。
[0209]
本公开的一些方面涉及表征药剂抗性凝聚物,所述表征包括使所述凝聚物与一种或多种第二药剂接触,并且评估药剂定位、浓度或治疗活性和/或凝聚物形态、稳定性或溶解度中的至少一种。在一些实施方案中,所述方法包括确定所述第二药剂是否抵消由所述第一药剂引起的对药剂的抗性(例如,药物抗性)的影响(例如,确定与所述第二药剂的接触是否减小凝聚物的尺寸或消除凝聚物)。
[0210]
在一些实施方案中,所述方法包括提供药剂抗性细胞,使所述药剂抗性细胞与所述第二药剂接触,以及评估第二药剂定位、浓度或治疗活性和/或凝聚物形态、稳定性或溶解度中的至少一种。在一些实施方案中,所述细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述细胞是乳腺癌细胞。在一些实施方案中,所述细胞包含具有可检测标记的凝聚物。在一些实施方案中,与细胞接触的药剂包含可检测标记。在一些实施方案中,细胞中的凝聚物和所述第二药剂两者均包含可检测标记。所述第二药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述第二药剂是小分子。在一些实施方案中,使细胞与所述第二药剂和所述细胞对其具有抗性的药剂两者接触。在一些实施方案中,细胞对其具有抗性的药剂具有可检测标记。在一些实施方案
中,评估与对照相比凝聚物的尺寸或溶解度。在一些实施方案中,所述方法包括确定所述第二药剂是否抵消由所述第一药剂引起的对药剂的抗性(例如,药物抗性)的影响(例如,确定与所述第二药剂的接触是否减小凝聚物的尺寸或消除凝聚物)。
[0211]
在一些实施方案中,所述方法包括提供从药剂抗性细胞中分离的凝聚物,使所述凝聚物与所述第二药剂接触,以及评估第二药剂定位、浓度或治疗活性和/或凝聚物形态、稳定性或溶解度中的至少一种。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述细胞是乳腺癌细胞。在一些实施方案中,所述凝聚物包含可检测标记。在一些实施方案中,所述第二药剂包含可检测标记。在一些实施方案中,所述凝聚物和所述第二药剂两者都包含可检测标记。所述第二药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述第二药剂是小分子。在一些实施方案中,使凝聚物与所述第二药剂和所述细胞对其具有抗性的药剂两者接触。在一些实施方案中,细胞对其具有抗性的药剂具有可检测标记。在一些实施方案中,评估与对照相比凝聚物的尺寸或溶解度。在一些实施方案中,所述方法包括确定所述第二药剂是否抵消由所述第一药剂引起的对药剂的抗性(例如,药物抗性)的影响(例如,确定与所述第二药剂的接触是否减小凝聚物的尺寸或消除凝聚物)。
[0212]
在一些实施方案中,所述方法包括提供包含在药剂抗性细胞中差异表达的差异量的凝聚物组分或其片段的体外凝聚物(例如,液滴),使所述凝聚物与第二药剂接触,以及评估第二药剂定位、浓度或治疗活性和/或凝聚物形态、稳定性或溶解度中的至少一种。在一些实施方案中,所述药剂抗性细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述药剂抗性细胞是乳腺癌细胞。在一些实施方案中,所述凝聚物包含可检测标记。在一些实施方案中,所述第二药剂包含可检测标记。在一些实施方案中,所述凝聚物和所述第二药剂两者都包含可检测标记。所述第二药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述第二药剂是小分子。在一些实施方案中,使凝聚物与所述第二药剂和所述细胞对其具有抗性的药剂两者接触。在一些实施方案中,细胞对其具有抗性的药剂具有可检测标记。在一些实施方案中,所述凝聚物组分是介体、med1、brd4、srsf2、hp1α、fib1、npm1或其包含idr的功能片段。在一些实施方案中,所述差异量的凝聚物组分是在非抗性细胞中的凝聚物中发现的凝聚物组分的至少1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍或更多。在一些实施方案中,所述差异量的凝聚物组分比在非抗性细胞中的凝聚物中发现的凝聚物组分的量少约1.5倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、50倍或更多。在一些实施方案中,评估与对照相比凝聚物的尺寸或溶解度。在一些实施方案中,所述方法包括确定所述第二药剂是否抵消由所述第一药剂引起的对药剂的抗性(例如,药物抗性)的影响(例如,确定与所述第二药剂的接触是否减小凝聚物的尺寸或消除凝聚物)。
[0213]
在一些实施方案中,所述方法包括提供包含与在药剂抗性细胞中的突变体凝聚物组分对应的突变体凝聚物组分或其片段的体外凝聚物(例如,液滴),使所述凝聚物与第二药剂接触,以及评估第二药剂定位、浓度或治疗活性和/或凝聚物形态、稳定性或溶解度中的至少一种。在一些实施方案中,所述对照包含相应的凝聚物,所述相应的凝聚物包含所述凝聚物组分的非突变形式或或其片段。在一些实施方案中,所述药剂抗性细胞是癌细胞。所述癌症不受限制并且可以是本文所公开的任何癌症。在一些实施方案中,所述药剂抗性细
胞是乳腺癌细胞。在一些实施方案中,所述凝聚物包含可检测标记。在一些实施方案中,所述第二药剂包含可检测标记。在一些实施方案中,所述凝聚物和所述第二药剂两者都包含可检测标记。所述第二药剂不受限制并且可以是本文所公开的任何药剂。在一些实施方案中,所述第二药剂是小分子。在一些实施方案中,使凝聚物与所述第二药剂和所述细胞对其具有抗性的药剂两者接触。在一些实施方案中,细胞对其具有抗性的药剂具有可检测标记。在一些实施方案中,所述突变体凝聚物组分是包含idr并且具有所述突变的介体、med1、brd4、srsf2、hp1α、fib1、npm1或其功能片段。在一些实施方案中,评估与对照相比凝聚物的尺寸或溶解度。在一些实施方案中,评估了所述第二药剂是否抵消对药剂的药物抗性的影响(例如,与第二药剂接触减小凝聚物的尺寸或消除凝聚物)。
[0214]
高通量筛选
[0215]
在一些实施方案中,进行高通量筛选(hts)以表征多种药剂和/或多种不同的凝聚物(例如,超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物中的两种或更多种;或包含超级增强子凝聚物组分、剪接斑点凝聚物组分、异染色质凝聚物组分、核仁组分、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物)的两种或更多种体外凝聚物类型。高通量筛选可以利用无细胞或基于细胞的测定(例如,如本文所述的含有凝聚物的细胞、体外凝聚物)。高通量筛选通常涉及以高效率,例如平行地测试大量的化合物。例如,可以在短时间段内(例如数小时至数天内)筛选成千上万种化合物。通常,这种筛选在含有至少96孔的多孔板或在基质中存在多个物理上分离的空腔或凹陷的其它容器中进行。高通量筛选通常涉及自动化的使用,例如,用于液体处理、成像、数据获取和处理等。可以应用于本发明的hts的实施方案中的某些一般原理和技术在以下文献中有描述:macarr
ó
n r和hertzberg rp.design and implementation of high-throughput screening assays.methods mol biol.,565:1-32,2009,和/或an wf和tolliday nj.,introduction:cell-based assays for high-throughput screening.methods mol biol.486:1-12,2009,和/或这些文献中任一者中的参考文献。在以下文献中还公开了有用的方法:william p.janzen的methods and protocols(methods in molecular biology)(2002)以及jorg的high-throughput screening in drug discovery(methods and principles in medicinal chemistry)(2006)。
[0216]
在本文所公开的方法的一些实施方案中,将多种药剂(例如,10种、50种、100种、1000种、10,000种、100,000种或更多种)各自与凝聚物接触,以及测量或确定所述药剂在所述凝聚物中的掺入。在一些实施方案中,与所述多种药剂接触的凝聚物包含相同的组分。在一些实施方案中,所述凝聚物中的至少一些包含不同的组分。
[0217]
在本文所公开方法的一些实施方案中,药剂与多种组合物接触(依次地或更优选平行地),所述多种组合物每种具有含有至少一种不同组分的凝聚物。在一些实施方案中,所述多种组合物中的每一种包含在单独的容器(例如,多壁板的单独的孔)中。
[0218]
在一些实施方案中,使多种不同的药剂与各自具有相同组分的凝聚物接触。在一些实施方案中,比较了所述多种不同的药剂的掺入。在一些实施方案中,所述不同的药剂各自包含递增的差异,因此使得能够鉴定调节凝聚物掺入的药剂的重要特性。
[0219]
在本文所公开方法的一些实施方案中,使药剂与包含多种凝聚物的组合物(例如溶液)接触,所述多种凝聚物具有不同的组分。在一些实施方案中,用不同的可检测标签鉴
定具有不同组分的凝聚物。在一些实施方案中,所述凝聚物包含核酸。在一些实施方案中,所述核酸是dna或rna。在一些实施方案中,所述核酸包含可检测标签(例如,荧光标签)。
[0220]
在一些实施方案中,所述药剂与凝聚物接触1分钟至48小时。在一些实施方案中,所述药剂与凝聚物接触约1分钟、约5分钟、约10分钟、约15分钟、约30分钟、约45分钟、约1小时、约2小时、约3小时、约5小时、约8小时、约10小时、约12小时、约18小时、约24小时、约36小时、约48小时或更长时间。在一些实施方案中,在如本文所述的多个时间点评价或连续监测中或连续(例如,持续接触后至多48小时或更长,持续前5分钟、前10分钟或前1小时)监测药剂在凝聚物中的掺入。对于本领域技术人员显而易见的是,药剂在凝聚物中的掺入和药剂对凝聚物的影响可能包括快速阶段和长期阶段两者。
[0221]
本发明的一些方面涉及调节第一药剂向凝聚物中的分配的方法,所述方法包括将所述第一药剂与第二药剂偶联,从而调节所述第一药剂向所述凝聚物中的分配。在一些实施方案中,所述凝聚物是转录凝聚物。在一些实施方案中,所述凝聚物选自超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物。将药剂与第二药剂偶联的方法不受限制并且可以是本领域中所公开的任何合适的方法。在一些实施方案中,所述第一药剂和所述第二药剂以共价键偶联。在一些实施方案中,所述第一药剂和所述第二药剂以非共价键或离子键偶联。在一些实施方案中,所述第一药剂和所述第二药剂经由接头偶联。在一些实施方案中,所述第一药剂和所述第二药剂缀合在一起。在一些实施方案中,所述第一药剂具有治疗活性。
[0222]
如本文所用的术语“接头”是指共价连接第一药剂和第二药剂的化学基团或分子。在一些实施方案中,接头位于两个基团、分子或部分之间或侧翼,并且通过共价键与每个基团、分子或部分连接,从而连接两个药剂。在一些实施方案中,接头是氨基酸或多个氨基酸。在一些实施方案中,接头是有机分子、基团或化学部分。在一些实施方案中,接头包含多肽或由其组成。在一些实施方案中,接头可以包含或由一个或多个甘氨酸残基组成,并且在一些实施方案中,包含或由一个或多个丝氨酸和/或苏氨酸残基组成。在一些实施方案中,接头包含1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18、19个、20个或多于20个氨基酸。在一些实施方案中,接头包含寡甘氨酸序列。可以使用本领域已知的任何合适的接头并且不受限制。例如,在一些实施方案中,如果所述第一药剂和所述第二药剂是蛋白质,则接头可以是多肽(例如,将一种药剂的c末端与另一种药剂的n末端连接的多肽)。
[0223]
在一些实施方案中,第一药剂在凝聚物中的分配(例如,分配系数)通过与第二药剂偶联而增加。在一些实施方案中,与未偶联的药剂相比,分配系数增加了约至少1.1倍、至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2倍、至少2.5倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。如本文所用,分配系数或富集比为化合物(例如药剂)在感兴趣的凝聚物中和在感兴趣的凝聚物外部(例如周围溶液)的浓度比。在一些实施方案中,未偶联的药剂的分配系数为小于约5、小于约2、约1、小于约1、小于约0.5或小于约0.1。在一些实施方案中,偶联的第一药剂的分配系数为大于1、大于约1.5、大于约2、大于约3、大于约4、大于约5、大于约10、大于约20、大于约50或大于约100。在一些实施方案中,与未偶联的药剂相比,偶联的药剂的分配系数增加了约5%、10%、15%、20%、25%、30%、
35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更多。在一些实施方案中,凝聚物包含第一药剂的治疗靶标。
[0224]
在一些实施方案中,第一药剂在凝聚物中的分配(例如,分配系数)被降低。在一些实施方案中,与未偶联的药剂相比,分配系数降低了约至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。在一些实施方案中,与未偶联的药剂相比,分配系数降低了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更多。在一些实施方案中,未偶联的药剂的分配系数为约10或更大、约5或更大、约2或更大、约1或更大、或约0.5或更大。在一些实施方案中,偶联的第一药剂的分配系数为小于约10、小于约5、小于约2、小于约1、小于约0.5、小于约0.1、或小于约0.01。在一些实施方案中,凝聚物不包含第一药剂的治疗靶标。
[0225]
在一些实施方案中,未偶联的第二药剂优先分配到感兴趣的凝聚物中。在一些实施方案中,未偶联的第二药剂具有大于1、大于约1.5、大于约2、大于约3、大于约4、大于约5、大于约10、大于约20、大于约50或大于约100的分配系数。在一些实施方案中,第二药剂具有比第一药剂高至少2倍、至少5倍、至少10倍、至少15倍、至少20倍、至少50倍、至少100倍或至少400倍的关于感兴趣的凝聚物的分配系数。在一些实施方案中,第二药剂具有比第一药剂低至少2倍、至少5倍、至少10倍、至少15倍、至少20倍、至少50倍、至少100倍或至少400倍的关于感兴趣的凝聚物的分配系数。在一些实施方案中,第二药剂是对于感兴趣的凝聚物具有高分配系数的小分子。在一些实施方案中,第二药剂是对于感兴趣的凝聚物具有大于10、大于20、大于30、大于50或大于100的分配系数的小分子。
[0226]
在一些实施方案中,优先将未偶联的第二药剂从感兴趣的凝聚物中排除。在一些实施方案中,未偶联的第二药剂具有小于0.9、0.8、0.5、0.1、0.05或0.01的分配系数。在一些实施方案中,第二药剂是对于感兴趣的凝聚物具有低分配系数的小分子。在一些实施方案中,第二药剂是对于感兴趣的凝聚物具有小于0.5、小于0.1、小于0.05或小于0.01的分配系数的小分子。用于引起附接于其上的第一药剂聚集在感兴趣的凝聚物中或从感兴趣的凝聚物中排出的第二药剂可以是对施用其的受试者是无毒的并且在一些实施方案中其本身不具有显著的生物活性的小分子。第二药剂(例如小分子)可以包含一个或多个官能团,所述一个或多个官能团适合于与第二官能团反应以便附接感兴趣的药剂,从而改变感兴趣的药剂关于一种或多种凝聚物的分配行为。
[0227]
在一些实施方案中,与未偶联的第一药剂相比,偶联的第一药剂的治疗功效增加。在一些实施方案中,与未偶联的第一药剂相比,偶联的第一药剂的治疗有效剂量减少了约至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍。在一些实施方案中,与未偶联的第一药剂相比,偶联的第一药剂的治疗有效剂量减少了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更多。
[0228]
在一些实施方案中,与未偶联的第一药剂相比,偶联的第一药剂的一种或多种副作用减少(例如,在严重性或持续时间方面减少,或被消除)。在一些实施方案中,与未偶联的药剂相比,偶联的第一药剂具有增加的治疗功效和减少的副作用。
[0229]
本公开的一些方面涉及筛选具有调节的凝聚物分配的候选药剂的方法,所述方法
包括修饰具有凝聚物分配系数的药剂并且测量经修饰的药剂的凝聚物分配系数,其中如果经修饰的药剂具有与所述药剂不同的分配系数,则将经修饰的药剂鉴定为具有调节的凝聚物分配的候选药剂。修饰可以通过熟知的药物化学操作和修饰进行。在一些实施方案中,修饰会增加或降低药剂的溶解度。在一些实施方案中,修饰会调节药剂的静电性质。在一些实施方案中,修饰是优先分配到期望的凝聚物中的部分或第二药剂的偶联。在一些实施方案中,修饰是优先不分配到一种或多种凝聚物类型(例如,超级增强子凝聚物、核仁等)中的部分或第二药剂的偶联。
[0230]
在一些实施方案中,在体外凝聚物中测量经修饰的药剂的凝聚物分配系数。在一些实施方案中,在细胞中的凝聚物中测量经修饰的药剂的凝聚物分配系数。
[0231]
在一些实施方案中,如果候选药剂已经增加向具有候选药剂的治疗靶标的凝聚物中的分配,则将所述候选药剂鉴定为改进的候选药剂。在一些实施方案中,如果与未经修饰的药剂相比,分配增加了约至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍,则将候选药剂鉴定为改进的候选药剂。在一些实施方案中,如果与未经修饰的药剂相比,分配增加了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更多,则将候选药剂鉴定为改进的候选药剂。
[0232]
在一些实施方案中,如果候选药剂已经减少向不具有候选药剂的治疗靶标的凝聚物中的分配,则将所述候选药剂鉴定为改进的候选药剂。在一些实施方案中,如果与未经修饰的药剂相比,分配减少了约至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少20倍、至少50倍、至少100倍,则将候选药剂鉴定为改进的候选药剂。在一些实施方案中,如果与未经修饰的药剂相比,分配减少了约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更多,则将候选药剂鉴定为改进的候选药剂。
[0233]
在一些实施方案中,如果与未经修饰的药剂相比,在感兴趣的凝聚物中调节候选药剂的量(例如,候选药剂的分子总数、候选药剂的浓度),则将候选药剂鉴定为改进的候选药剂。在一些实施方案中,在感兴趣的凝聚物中增加候选药剂的量。在一些实施方案中,该增加对应于在感兴趣的凝聚物中的分配系数的增加。然而,该增加也可能是由于增加了用于掺入凝聚物中的候选药剂的可用性。例如,候选药剂可能在不感兴趣的凝聚物中具有减少的分配,使其可用于掺入感兴趣的凝聚物中。在一些实施方案中,在感兴趣的凝聚物中减少候选药剂的量。
[0234]
在一些实施方案中,调节第一药剂在凝聚物中的分配(例如,通过修饰第一药剂,例如将第一药剂与第二药剂偶联-从而产生候选药剂)导致相对于未经修饰/未偶联的第一药剂将存在于凝聚物中的浓度,经修饰或偶联的第一药剂在凝聚物中的浓度增加。在一些实施方案中,修饰或偶联第一药剂会增加第一药剂在凝聚物中的分配系数。在一些实施方案中,修饰或偶联第一药剂引起第一药剂向以其它方式将聚集在其中的不同的凝聚物(例如不感兴趣的凝聚物)中的分配减少。在一些实施方案中,修饰或偶联第一药剂会降低第一药剂在凝聚物中的分配系数。在一些实施方案中,修饰或偶联第一药剂引起第一药剂向以其它方式将聚集在其中的不同的凝聚物(例如不感兴趣的凝聚物)中的分配增加。
[0235]
在一些实施方案中,具有调节的凝聚物分配的候选药剂是化学治疗剂。
[0236]
本发明的一些方面涉及包含细胞的组合物,所述细胞具有包含第一可检测标记的第一凝聚物和具有不同的第二可检测标记的第二凝聚物。在一些实施方案中,第一凝聚物和第二凝聚物是选自超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物的不同凝聚物类型。在一些实施方案中,凝聚物中的至少一种是转录凝聚物。在一些实施方案中,组合物还包含与细胞接触的药剂。在一些实施方案中,所述药剂是已知的治疗剂。在一些实施方案中,所述药剂是候选治疗剂。
[0237]
本发明的一些方面涉及组合物,所述组合物包含第一体外凝聚物、第二体外凝聚物以及与所述第一体外凝聚物和所述第二体外凝聚物接触的药剂。在一些实施方案中,所述第一体外凝聚物和所述第二体外凝聚物彼此分离。在一些实施方案中,所述第一体外凝聚物、所述第二体外凝聚物和所述药剂中的至少一者包含可检测标记。在一些实施方案中,所述组合物还包含各自与所述药剂接触的第三体外凝聚物和任选的第四体外凝聚物。在一些实施方案中,体外凝聚物中的至少一种包含超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物的组分。在一些实施方案中,本文公开了具有与药剂接触的第一体外凝聚物和与相同药剂接触的第二体外凝聚物的多孔板等(例如96孔板),其中所述第一体外凝聚物和所述第二体外凝聚物各自包含不同组分的组分,并且其中所述第一体外凝聚物和所述第二体外凝聚物在多孔板的不同孔中。
[0238]
一些实施方案涉及制品,所述制品包含与药剂接触的第一体外凝聚物、与相同药剂接触的第二体外凝聚物、以及将所述第一体外凝聚物和所述第二体外凝聚物分离到单独的孔中的多孔板。在一些实施方案中,所述制品还包含与所述药剂接触的至少第三体外凝聚物。在一些实施方案中,所述制品还包含与所述药剂接触的至少第四体外凝聚物。所述第一体外凝聚物、所述第二体外凝聚物、所述第三体外凝聚物和所述第四体外凝聚物可以各自包含不同凝聚物(例如,超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物)的组分。所述第一体外凝聚物、所述第二体外凝聚物、所述第三体外凝聚物和所述第四体外凝聚物可以各自包含不同的可检测标记。
[0239]
在一些实施方案中,本文所公开的药剂与总浓度在约1nm和500μm之间的凝聚物接触。例如,可以向包含凝聚物的溶液中添加药剂以提供在溶液中的在约1nm和500μm之间的总浓度。在一些实施方案中,所述药剂以在10nm和100nm之间、在10nm和1μm之间、在1μm和10μm之间、在10μm和100μm之间、或在100μm和500μm之间的总浓度与凝聚物接触。在一些实施方案中,向包含凝聚物的组合物(例如溶液)中添加药剂以提供在约1nm和500μm之间的总浓度。在一些实施方案中,向包含凝聚物的组合物中添加药剂以提供在10nm和100nm之间、在10nm和1μm之间、在1μm和10μm之间、在10μm和100μm之间、或在100μm和500μm之间的总浓度。
[0240]
在一些实施方案中,凝聚物是在细胞中。细胞的类型不受限制。
[0241]
在一些实施方案中,细胞是哺乳动物细胞,例如人或小鼠细胞。在一些实施方案中,细胞是体细胞。在一些实施方案中,细胞是多能干细胞。在一些实施方案中,细胞是生殖细胞、干细胞或合子。在一些实施方案中,细胞是原代细胞。在一些实施方案中,细胞是患病细胞。
[0242]
在一些实施方案中,细胞是癌细胞。在一些实施方案中,细胞是白细胞或成纤维细胞。在一些实施方案中,细胞是已经从胚胎中分离的细胞。
[0243]
在一些实施方案中,所述细胞是从患有疾病、障碍或病症的患者中分离的细胞。在
一些实施方案中,细胞来源于患有疾病、障碍或病症的患者的细胞。在一些实施方案中,细胞是从患有疾病、障碍或病症的患者的细胞来源的诱导多能干细胞的分化细胞。在一些实施方案中,细胞是从患有疾病、障碍或病症的患者的细胞来源的诱导多能干细胞。在一些实施方案中,细胞是表达一种或多种具有可检测标记的凝聚物组分的遗传修饰的细胞。在一些实施方案中,遗传修饰的细胞表达至少两种具有不同可检测标记和/或彼此可检测区分的标记的不同的凝聚物组分。在一些实施方案中,遗传修饰的细胞表达至少三种具有不同可检测标记和/或彼此可检测区分的标记的不同的凝聚物组分。在一些实施方案中,遗传修饰的细胞表达至少四种具有不同可检测标记和/或彼此可检测区分的标记的不同的凝聚物组分。在一些实施方案中,每种类型的标记的凝聚物组分是不同凝聚物(例如,超级增强子凝聚物、剪接斑点凝聚物、异染色质凝聚物、核仁、染色质凝聚物、多梳凝聚物或dna损伤修复凝聚物)的组分。在一些实施方案中,遗传修饰的细胞表达标记的超级增强子组分和标记的核仁组分。在一些实施方案中,不同凝聚物组分的标记彼此可检测区分。
[0244]
术语“疾病”、“障碍”或“病症”可互换使用,并且可以是指生物体的健康状态和/或正常功能的任何改变,例如,引起受累个体的疼痛、不适、功能障碍、痛苦、衰退或死亡的身体或精神异常。疾病包括本领域普通技术人员已知的任何疾病。在一些实施方案中,疾病是慢性疾病,例如,其通常持续或已经持续至少3-6个月或更长时间,例如1年、2年、3年、5年、10年或更多年、或无限期。疾病可以具有在患有所述疾病的个体中常见的一组特征性症状和/或体征。疾病及其诊断和治疗方法在标准医学教科书中进行了描述,所述标准医学教科书诸如longo,d.等人(编辑),harrison's principles of internal medicine,第18版;mcgraw-hill professional,2011,和/或goldman's cecil medicine,saunders;24版(2011年8月5日)。在某些实施方案中,疾病是多基因障碍(也称为复杂、多因素或多基因障碍)。此类疾病可能与多种基因的影响相关,有时与环境因素(例如暴露于特定物理或化学剂或生物剂(诸如病毒)、生活方式因素(诸如饮食、吸烟等))结合。多基因障碍可以是已知或怀疑多个基因(例如,此类基因的特定等位基因、此类基因中的特定多态性)可能促成发展疾病的风险和/或可能促成疾病显现的方式(例如,其严重性、发病年龄、进展速率等)的任何疾病。在一些实施方案中,多基因疾病是具有如通过家族性聚集(在某些家族中比在一般群体中更常出现)所示的遗传组分但不遵循孟德尔遗传定律(例如,所述疾病不清楚地遵循显性、隐性、x连锁或y连锁遗传模式)的疾病。在一些实施方案中,多基因疾病是通常不由单个基因中的大效应的变体(如孟德尔障碍就是该情况)控制的一种疾病。在一些实施方案中,多基因疾病可能以家族形式和偶发性地发生。实例包括例如帕金森病、阿尔茨海默病和各种类型的癌症。多基因疾病的实例包括许多常见疾病,诸如高血压、糖尿病(例如,ii型糖尿病)、心血管疾病、癌症和中风(缺血性、出血性)。在一些实施方案中,疾病(例如多基因疾病)是精神性、神经性、神经发育性疾病;神经退行性疾病;心血管疾病;自身免疫性疾病;癌症;代谢疾病;或呼吸系统疾病。在一些实施方案中,至少一个基因与家族形式的多基因疾病有关。
[0245]
在一些实施方案中,疾病是癌症,该术语通常可互换使用,是指特征在于一种或多种肿瘤(例如一种或多种恶性或潜在恶性肿瘤)的疾病。如本文所用的术语“肿瘤”涵盖异常生长,其包括异常增殖的细胞。如本领域已知的,肿瘤通常特征在于不受适当调节(例如,对通常限制增殖的生理影响和信号没有正常响应)的过度细胞增殖,并且可能表现出以下特
性中的一种或多种:发育异常(例如,缺乏正常细胞分化、导致未成熟细胞的数目或比例增加);退行性发育(例如,更多的分化丧失、更多的结构组织丧失、细胞多形性、异常诸如大的过染色的细胞核、高的核质比率、非典型有丝分裂等);邻近组织的侵入(例如,破坏基底膜);和/或转移灶。恶性肿瘤具有持续生长的趋势和扩散(例如,局部侵入和/或局部转移和/或扩散到远处部位)的能力,然而良性肿瘤通常保持定位于起源部位并且通常在生长方面是自限性的。术语“肿瘤”包括恶性实体瘤,例如癌(起于上皮细胞的癌症)、肉瘤(起于间充质起源的细胞的癌症)和其中可能没有可检测的实体瘤块的恶性生长(例如某些血液恶性肿瘤)。癌症包括但不限于:乳腺癌;胆道癌;膀胱癌;脑癌(例如,胶质母细胞瘤、髓母细胞瘤);宫颈癌;绒毛膜癌;结肠癌;子宫内膜癌;食管癌;胃癌;血液肿瘤,包括急性淋巴细胞性白血病和急性髓细胞性白血病;t细胞急性成淋巴细胞性白血病/淋巴瘤;毛细胞白血病;慢性淋巴细胞性白血病、慢性髓细胞性白血病、多发性骨髓瘤;成人t细胞白血病/淋巴瘤;上皮内肿瘤,包括博文氏病和佩吉特病;肝癌;肺癌;淋巴瘤,包括霍奇金病和淋巴细胞性淋巴瘤;神经母细胞瘤;黑素瘤、口腔癌(包括鳞状细胞癌);卵巢癌,包括起于上皮细胞、基质细胞、生殖细胞和间充质细胞的卵巢癌;神经母细胞瘤、胰腺癌;前列腺癌;直肠癌;肉瘤,包括血管肉瘤、胃肠道间质瘤、平滑肌肉瘤、横纹肌肉瘤、脂肪肉瘤、纤维肉瘤和骨肉瘤;肾癌,包括肾细胞癌和肾母细胞瘤(wilms tumor);皮肤癌,包括基底细胞癌和鳞状细胞癌;睾丸癌,包括生殖肿瘤,诸如精原细胞瘤、非精原细胞瘤(畸胎瘤、绒毛膜癌)、基质肿瘤和生殖细胞肿瘤;甲状腺癌,包括甲状腺腺癌和髓样癌。应当理解,在某些器官中可以出现多种不同的肿瘤类型,其可以在例如临床和/或病理学特征和/或分子标记方面不同。在以下文献中讨论了在多种不同器官中出现的肿瘤:例如,国际癌症研究机构(international agency for research on cancer,iarc),who肿瘤分类系列(who classification of tumours series),第4版或第3版(肿瘤的病理学和遗传学系列(pathology and genetics of tumours series)),瑞士日内瓦的who出版社(who press,geneva,switzerland),其所有卷以引用的方式并入本文。在一些实施方案中,癌症是已知或怀疑特定基因的突变或过表达在癌症的发展、进展、复发等中起作用的一种癌症。在一些实施方案中,此类基因是根据本文所述的方法进行遗传修饰的靶标。在一些实施方案中,基因是癌基因、原癌基因或肿瘤抑制基因。术语“癌基因”涵盖当表达时可以增加癌症开始或进展的可能性或促成癌症开始或进展的核酸。正常细胞序列(“原癌基因”)可以通过突变和/或异常表达被活化变成癌基因(有时称为“活化的癌基因”)。在各种实施方案中,癌基因可以包含基因产物的完整编码序列或至少部分地维持完整序列或编码融合蛋白的序列的致癌潜力的部分。致癌突变可以导致例如蛋白质活性改变(例如增加)、适当调节的丧失、或r a或蛋白质水平的改变(例如增加)。异常表达可能例如由于导致与调控元件诸如增强子并置的染色体重排、表观遗传机制或者由于扩增而发生,并且可能导致原癌基因产物的量增加或在不适当的细胞类型中产生。原癌基因通常编码控制或参与细胞增殖、分化和/或凋亡的蛋白质。这些蛋白质包括例如各种转录因子、染色质重塑剂、生长因子、生长因子受体、信号转导子和凋亡调节剂。tsg可以是任何基因,其中基因的表达产物的功能丧失或降低可以增加癌症开始或进展的可能性或促成癌症开始或进展。功能的丧失或降低可以例如由于突变或表观遗传机制而发生。许多tsg编码蛋白质,其通常发挥抑制或负调节细胞增殖和/或促进细胞凋亡的功能。本文所公开的方法的示例性癌基因包括例如myc、src、fos、jun、myb、ras、raf、abl、alk、akt、
trk、bcl2、wnt、her2/neu、egfr、mapk、erk、mdm2、cdk4、gli1、gli2、igf2、tp53等。示例性tsg包括例如rb、tp53、apc、nf1、brca1、brca2、pten、cdk抑制蛋白(例如pl6、p21)、ptch、wt1等。应当理解,许多这些癌基因和tsg名称涵盖多个家族成员,并且许多其它tsg是已知的。在一些实施方案中,癌症是乳腺癌。在一些实施方案中,所述乳腺癌是er 乳腺癌。在一些实施方案中,所述乳腺癌对他莫昔芬具有抗性并且包含er突变。在一些实施方案中,所述乳腺癌对他莫昔芬具有抗性并且过表达凝聚物组分。
[0246]
在一些实施方案中,疾病是心血管疾病,例如动脉粥样硬化性心脏病或血管疾病、充血性心力衰竭、心肌梗塞、脑血管疾病、外周动脉疾病、心肌病。
[0247]
在一些实施方案中,疾病是精神性、神经性或神经发育性疾病,例如精神分裂症、抑郁症、双相型障碍、癫痫、孤独症、成瘾。神经退行性疾病包括例如阿尔茨海默病、帕金森病、肌萎缩性侧索硬化症、额颞叶痴呆。
[0248]
在一些实施方案中,疾病是自身免疫性疾病、例如急性播散性脑脊髓炎、斑秃、抗磷脂综合征、自身免疫性肝炎、自身免疫性心肌炎、自身免疫性胰腺炎、自身免疫性多内分泌腺综合征、自身免疫性葡萄膜炎、炎性肠病(克罗恩病、溃疡性结肠炎)、i型糖尿病(例如,幼年型糖尿病)、多发性硬化症、硬皮病、强直性脊柱炎、结节病、寻常型天疱疮、类天疱疮、银屑病、重症肌无力、系统性红斑狼疮、类风湿性关节炎、幼年型关节炎、银屑病性关节炎、狐惑病(behcet's syndrome)、莱特尔氏病、伯格氏病(berger's disease)、皮肌炎、多肌炎、抗中性粒细胞胞质抗体相关血管炎(例如肉芽肿病伴多血管炎(也称为韦格纳氏肉芽肿病(wegener's granulomatosis))、显微镜可见的多血管炎和丘斯综合征(churg-strauss syndrome))、硬皮病、舍格伦综合征、抗肾小球基底膜病(包括肺出血肾炎综合征(goodpasture's syndrome))、扩张型心肌病、原发性胆汁性肝硬变、甲状腺炎(例如,桥本甲状腺炎、格雷夫斯病(graves'disease))、横贯性脊髓炎和guillane-barre综合征。
[0249]
在一些实施方案中,疾病是呼吸系统疾病,例如影响呼吸系统的过敏症、哮喘、慢性阻塞性肺病、肺动脉高压、肺纤维化和肉瘤样病。
[0250]
在一些实施方案中,疾病是肾病,例如多囊肾病,狼疮,肾病变(肾病或肾炎)或肾小球肾炎(任何类型的)。
[0251]
在一些实施方案中,疾病是例如与高龄相关的视力丧失或听力丧失。
[0252]
在一些实施方案中,疾病是感染性疾病,例如由病毒、细菌、真菌或寄生虫引起的任何疾病。
[0253]
在一些实施方案中,疾病表现出在基因组序列中的超甲基化(例如异常超甲基化)或未甲基化(例如异常未甲基化)。例如,脆性x综合征表现出fmr-1的超甲基化。在一些实施方案中,本文所述的方法可以用于治疗或预防表现出异常甲基化(例如,超甲基化或未甲基化)的疾病或障碍。在一些实施方案中,本文所公开的药剂优先掺入与异常甲基化相关的凝聚物。例如,凝聚物(例如转录凝聚物)可以在与异常未甲基化或低甲基化位点相关的区域中形成,导致异常的基因转录。在一些实施方案中,本文所述的药剂优先掺入此类凝聚物中并调节(例如减少)异常的基因转录。在一些实施方案中,未甲基化或低甲基化位点与癌基因相关。在其它实施方案中,凝聚物(例如,剪接斑点凝聚物、异染色质凝聚物)可以在与异常超甲基化相关的区域中形成,导致异常的基因转录。在一些实施方案中,本文所述的药剂优先掺入此类凝聚物中并调节异常的基因转录。
[0254]
应当理解,本文中疾病的分类不旨在是限制性的。本领域普通技术人员将理解,可以将各种疾病适当地分类成多个不同的组。
[0255]
在一些实施方案中,所述方法还包括表征用于例如先导优化、体内毒理学或功效研究或i期临床研究的多种药剂(例如,可能的药物候选物、来自具有不同结构特征的家族的可能的药物候选物)的凝聚物掺入(例如,富集比)。在一些实施方案中,包括以下步骤:针对一种凝聚物或一组凝聚物对药物候选物进行概况分析,以及(1)选择不被不期望地隔离在不是预期靶标存在或有活性的位点的凝聚物中的候选物,或(2)选择聚集在是预期靶标存在或有活性的位点的凝聚物中或至少不从是预期靶标存在或有活性的位点的凝聚物中排出的候选物。如果人们正在优化先导化合物并具有许多不同的优化候选物以从中选择,则此方法可能有助于避免选择具有比其它候选物更高的倾向被聚集在不含靶标的凝聚物中的候选物(或选择具有比其它候选物更高的倾向被聚集在一定含有靶标的凝聚物中的候选物)。
[0256]
本发明的一些方面涉及表征第一药剂的方法,所述方法包括使所述第一药剂与包含具有至少一种组分的凝聚物的组合物接触,其中所述凝聚物含有至少一种第二药剂,并且测量所述第一药剂从所述凝聚物中逐出所述第二药剂的能力。这种方法可以用于例如鉴定从凝聚物中释放所述第二药剂的药剂(第一药剂)。例如,如果所述第二药剂的治疗靶标不在凝聚物中,则药剂从凝聚物中的释放可以增强药剂的治疗活性。此外,这种方法可以用于鉴定与第二药剂相比对凝聚物中的靶标具有更高亲和力的第一药剂。
[0257]
在一些实施方案中,测量所述第一药剂从所述凝聚物中逐出所述第二药剂的能力包括测量所述第二药剂从所述凝聚物中的损失(例如,通过测量所述第二药剂在凝聚物中或在凝聚物外部的量、浓度或比例的变化)。可以通过本文所述的任何方法(例如,经由第二药剂的天然荧光或颜色、拉曼光谱法、nmr、质谱法、色谱法等)进行测量。在一些实施方案中,第二药剂具有可检测标签。在一些实施方案中,经由可检测标签测量第二药剂。
[0258]
第一药剂和第二药剂不受限制并且可以是本文所述的任何药剂。凝聚物组分也不受限制并且可以是本文所述的任何凝聚物组分。在一些实施方案中,凝聚物组分是转录凝聚物组分。在一些实施方案中,凝聚物组分位于细胞中。细胞不受限制并且可以是本文所述的任何细胞。在一些实施方案中,凝聚物是体外凝聚物。
[0259]
在一些实施方案中,凝聚物组分是第二药剂的靶标(例如,第二药剂特异性地结合凝聚物组分)。在一些实施方案中,第一药剂从靶标置换第二药剂(例如,从凝聚物置换第二药剂)。
[0260]
本公开的一些方面涉及组合物,所述组合物包含凝聚物和具有治疗靶标的药剂,其中所述凝聚物不包含或优先不包含所述治疗靶标。在一些实施方案中,凝聚物包含可检测标签(例如,凝聚物包含具有可检测标签的组分)。在一些实施方案中,所述药剂具有可检测标签。在一些实施方案中,所述药剂和所述凝聚物两者均具有可检测标签(例如,不同的可检测标签)。
[0261]
破坏癌基因
[0262]
本发明人在本文中首次显示了在原发性乳腺癌的myc rna转录位点处存在含有med1和er的凝聚物。参见例如图7。med1在myc rna位点处的凝聚物中的存在在结肠癌、伯基特淋巴瘤、多发性骨髓瘤、前列腺癌和乳腺癌细胞系中也证实了转录。参见例如图8-9。还已
在myc rna转录位点处的凝聚物中发现了包括拓扑异构酶、蛋白体、cdk6、cdk7、p300和brd4的其它凝聚物组分。参见图11。使用结肠癌细胞系和gfp标记的med1、brd4或pol2,各种抑制剂、嵌入剂和细胞周期蛋白依赖性激酶抑制剂显示出溶解,引起基因组释放,或选择性地从myc rna转录位点处的凝聚物中逐出组分。参见图14和图16-19。最后,本文中显示er在他莫昔芬的存在下不掺入凝聚物中,并且凝聚物溶解药物在溶解凝聚物之前富集在凝聚物中。参见图20、图22和图24。
[0263]
因此,本发明的一些方面涉及减少癌基因的转录的方法,所述方法包括调节与所述癌基因相关的转录凝聚物的组成、溶解或解离。在一些实施方案中,通过使转录凝聚物与药剂接触来调节转录凝聚物。在一些实施方案中,所述药剂溶解所述转录凝聚物,引起所述转录凝聚物与包含所述癌基因的基因组dna解偶联,或逐出所述转录凝聚物的一种或多种组分。
[0264]
所述药剂不受限制并且可以是本文所述的任何药剂。在一些实施方案中,所述药剂是抑制剂、嵌入剂或细胞周期蛋白依赖性激酶抑制剂。在一些实施方案中,所述药剂与所述转录凝聚物的组分结合。在一些实施方案中,所述组分是brd4、p300、cdk7、cdk6、蛋白体、拓扑异构酶、转录因子(例如,核受体、雌激素受体)、介体、介体组分或增强子。在一些实施方案中,所述药剂与转录凝聚物的组分结合并溶解所述转录凝聚物,引起所述转录凝聚物与包含癌基因的基因组dna解偶联,或逐出所述转录凝聚物的一种或多种组分(例如,逐出药剂已结合的组分或作为药剂已结合的组分的结合配偶体的组分)。
[0265]
在一些实施方案中,所述药剂优先溶解转录凝聚物,引起所述转录凝聚物与包含癌基因的基因组dna解偶联,或者当所述凝聚物包含一种或多种特定凝聚物组分时,逐出所述转录凝聚物的一种或多种组分。所述组分可以是本文所述的任何组分并且不受限制。在一些实施方案中,所述组分是brd4、p300、cdk7、cdk6、蛋白体、拓扑异构酶、转录因子(例如,核受体、雌激素受体)、介体、介体组分或增强子。
[0266]
在一些实施方案中,所述凝聚物是如本文所述的体外凝聚物。在一些实施方案中,所述凝聚物可以在细胞中。细胞不受限制并且可以是本文所述的任何细胞。在一些实施方案中,所述细胞是癌细胞。在一些实施方案中,所述细胞是结肠癌细胞、淋巴瘤细胞、多发性骨髓瘤细胞、前列腺癌细胞或乳腺癌细胞。
[0267]
在一些实施方案中,所述细胞在受试者中。在一些实施方案中,受试者是哺乳动物(例如人、非人灵长类动物、啮齿类动物、犬科动物、猫科动物、牛族动物)。在一些实施方案中,受试者是患有癌症的人。癌症不受限制并且可以是本文所述的任何癌症。在一些实施方案中,癌症具有失调的myc基因表达。在一些实施方案中,所述药剂将受试者的癌细胞中的myc癌基因的转录降低至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、99%或更多。在一些在实施方案中,所述癌症具有失调的癌基因,所述失调的癌基因选自src、fos、jun、myb、ras、abl、hoxi1、hoxi1 1l2、tal1/scl、lmo1、lmo2、egfr、mycn、mdm2、cdk4、gli1、igf2、活化的egfr、突变的基因(诸如flt3-itd)、tp53的突变形式、pax3、pax7、bcr/abl、her2/neu、flt3r、flt6-itd、src、abl、tan1、ptc、b-raf、pml-rar-α、e2a-prx1和npm-alk、以及pax和fkhr基因家族成员的融合物。在一些实施方案中,所述药剂将所述癌基因在受试者的癌细胞中的转录降低至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、
75%、80%、85%、90%、95%、99%或更多。
[0268]
在一些实施方案中,向患有癌症的受试者施用所述药剂,从而治疗所述癌症。如本文所用的“治疗”涵盖对哺乳动物(特别是人)的疾病或病症(例如癌症)的任何治疗,并且包括:(a)预防所述疾病或病症(例如癌症)的症状在可能易患所述疾病或病症但尚未开始经历症状的受试者中发生;(b)抑制疾病或病症(例如,阻止其发展);或(c)缓解疾病或病症(例如,引起疾病或病症消退,提供一种或多种症状的改善)。施用方法不受限制并且可以是任何合适的施用方法。
[0269]
所述药剂可以在药学上可接受的溶液中施用,所述药学上可接受的溶液可以常规地含有药学上可接受浓度的盐、缓冲剂、防腐剂、相容的载剂、佐剂和任选地其它治疗成分。
[0270]
可以将所述药剂配制为呈固体、半固体、液体或气体形式(诸如片剂、胶囊、散剂、颗粒剂、软膏、溶液、助存剂(depositories)、吸入剂和注射剂)以及按常用的口服、肠胃外或手术施用方式的配制品。本发明还包括配制用于局部施用(诸如通过植入物)的药物组合物。
[0271]
适合用于口服施用的组合物可以作为离散单元(诸如胶囊、片剂、锭剂,各自含有预定量的活性剂)存在。其它组合物包括在水性液体或非水性液体中的悬浮液,诸如糖浆、酏剂或乳液。
[0272]
在一些实施方案中,可以将药剂直接施用至组织。直接组织施用可以通过直接注射来实现。可以将所述药剂施用一次,或者可替代地,可以将它们以多次施用的方式来施用。如果施用多次,肽可以经由不同的途径施用。例如,第一次(或前几次)施用可以直接施用至受影响的组织中,而随后的施用可以是全身的。
[0273]
对于口服施用,组合物可以容易地通过将药剂与本领域熟知的药学上可接受的载剂组合来配制。此类载剂使得药剂能够被配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液、悬浮液等,用于被待治疗的受试者口服摄入。用于口服使用的药物制剂可以作为固体赋形剂获得,任选地研磨所得混合物,并且如果需要在添加合适的助剂之后加工颗粒混合物,以获得片剂或糖衣丸芯。合适的赋形剂特别是填充剂,诸如糖,包括乳糖、蔗糖、甘露醇或山梨醇;纤维素制剂,例如玉米淀粉、小麦淀粉、稻米淀粉、马铃薯淀粉、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(pvp)。如果需要的话,可以添加崩解剂,诸如交联聚乙烯吡咯烷酮、琼脂、褐藻酸或其盐(诸如褐藻酸钠)。任选地,口服配制品也可以在盐水或缓冲液中配制用于中和内部酸性条件或可以在没有任何载剂的情况下施用。
[0274]
糖衣丸芯提供有合适的包衣。出于这个目的,可以使用浓缩糖溶液,其可以任选地含有阿拉伯树胶、滑石、聚乙烯吡咯烷酮、卡波姆凝胶、聚乙二醇和/或二氧化钛、漆溶液以及合适的有机溶剂或溶剂混合物。可以将染料或颜料添加到片剂或糖衣丸包衣中,用于鉴定或表征不同的活性化合物剂量组合。
[0275]
可以口服使用的药物制剂包括由明胶制成的硬胶囊(push fit capsule)、以及由明胶和增塑剂诸如甘油或山梨醇制成的密封软胶囊。硬胶囊可以含有与填充剂(诸如乳糖)、粘合剂(诸如淀粉)和/或润滑剂(诸如滑石或硬脂酸镁)以及任选地稳定剂混合的活性成分。在软胶囊中,活性化合物可以溶解或悬浮在合适的液体(诸如脂肪油、液体石蜡或液体聚乙二醇)中。此外,可以添加到稳定剂。也可以使用配制用于口服施用的微球。此类微球
在本领域中已经被明确地定义。用于口服施用的所有配制品都应该是适合于这种施用的剂量。对于经颊施用,组合物可以采用以常规方式配制的片剂或锭剂的形式。
[0276]
当希望全身递送时,可以将化合物配制成用于通过注射(例如通过推注注射或连续输注)的肠胃外施用。注射用制剂可以单位剂量呈现,例如在安瓿中或在多剂量容器中,并加有防腐剂。所述组合物可采用诸如在油性或水性媒剂中的混悬剂、溶液剂或乳剂的形式,且可含有诸如悬浮剂、稳定剂和/或分散剂的配制剂。
[0277]
用于肠胃外施用的制剂包括无菌水性或非水性溶液、悬浮液和乳液。非水性溶剂的实例是丙二醇、聚乙二醇、植物油(诸如橄榄油)和可注射的有机酯(诸如油酸乙酯)。水性载剂包括水、醇/水溶液、乳液或悬浮液,包括盐水和缓冲介质。肠胃外媒介物包括氯化钠溶液、林格氏葡萄糖、葡萄糖和氯化钠、乳酸盐林格氏或不挥发性油。静脉内媒介物包括液体和营养补充剂、电解质补充剂(诸如基于林格氏葡萄糖的那些)等。还可能存在防腐剂和其它添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。在所施用的初始剂量下受试者的反应不足的情况下,可以在患者耐受性允许的程度下采用较高剂量(或通过不同的更局部的递送途径的有效较高剂量)。在一些实施方案中,考虑每天多次剂量以实现化合物的适当全身水平。在一些实施方案中,所述方法还包括向受试者施用有效量的至少一种化学治疗剂。化学治疗剂不受限制,并且可以是本领域已知的任何合适的化学治疗剂。
[0278]
本发明的一些方面涉及治疗需要治疗以癌基因转录为特征的癌症的受试者的方法,所述方法包括向所述受试者施用调节与癌基因相关的转录凝聚物的组成、溶解或解离的药剂。
[0279]
所述药剂不受限制并且可以是本文所述的任何药剂。在一些实施方案中,药剂是小分子、多肽或核酸。在一些实施方案中,所述药剂是显示优先隔离在与癌基因相关的转录凝聚物中或具有与癌基因相关的转录凝聚物的组分的药剂。在一些实施方案中,所述药剂是抑制剂、嵌入剂或细胞周期蛋白依赖性激酶抑制剂。在一些实施方案中,所述药剂与所述转录凝聚物的组分结合。所述组分不受限制并且可以是本文所述的任何转录凝聚物组分(例如,介体组分,med1)。在一些实施方案中,所述药剂优先聚集在所述转录凝聚物中。
[0280]
癌症不受限制并且可以是本文所述的任何癌症。在一些实施方案中,所述癌症是结肠癌、淋巴瘤、多发性骨髓瘤、前列腺癌或乳腺癌。
[0281]
受试者不受限制并且可以是本文所述的任何受试者。在一些实施方案中,受试者是人。
[0282]
药剂可以在组合物中。组合物不受限制并且可以是本文所述的任何组合物。药剂的施用方法也不受限制并且可以是本文所述的任何施用方法。在一些实施方案中,所述药剂经口、皮下、局部或静脉内施用于所述受试者。
[0283]
抑制核受体介导的转录
[0284]
本发明的一些方面涉及抑制与转录凝聚物相关的转录的方法,所述方法包括通过使所述凝聚物与结合核受体的lxxll结合结构域的肽接触来抑制具有与转录凝聚物相关的lxxll结合结构域的核受体与具有lxxll结构域的辅助因子的结合。
[0285]
核受体不受限制,只要其至少在与其配体结合时能够与具有lxxll结构域的辅助因子结合即可。在一些实施方案中,核受体是核激素受体、雌激素受体或视黄酸受体α。辅助因子不受限制,只要辅助因子具有lxxll结构域即可。具有lxxll基序的辅助因子是本领域
已知的。在一些实施方案中,辅助因子是med1。
[0286]
在一些实施方案中,与参考水平(例如,未处理的对照细胞或凝聚物)相比,核受体与辅助因子的结合被抑制了至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%、99.5%、99.9%或更多。在一些实施方案中,与参考水平(例如,未处理的对照细胞或凝聚物)相比,与转录凝聚物相关的转录被抑制了至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%、99.5%、99.9%或更多。在一些实施方案中,癌基因的转录被抑制。癌基因不受限制并且可以是本文所述的任何癌基因。在一些实施方案中,癌基因是myc。
[0287]
在一些实施方案中,转录凝聚物是体外转录凝聚物。在一些实施方案中,转录凝聚物在细胞中。细胞不受限制并且可以是本文所述的任何细胞。在一些实施方案中,所述细胞是癌细胞。癌症不受限制并且可以是本文所述的任何癌症。在一些实施方案中,本文所公开的方法可以用于治疗与异常核受体活性或表达相关的疾病或病症。所述疾病或病症可以是本文所述的任何疾病或病症。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述疾病是er 乳腺癌。
[0288]
肽不受限制,只要其与lxxll结合结构域结合即可。在一些实施方案中,所述肽包含肽序列qnpiltsllqitg(seq id no:1),由其组成或基本上由其组成。在一些实施方案中,肽包含酸性残基(例如聚谷氨酸)或碱性残基(例如聚赖氨酸),由其组成或基本上由其组成。
[0289]
在一些实施方案中,所述肽包含蛋白转导结构域(ptd)。ptd不受限制并且可以是本文所述的任何ptd。在一些实施方案中,所述ptd是hiv-tat。
[0290]
在一些实施方案中,将肽施用于受试者以治疗与异常核受体活性或表达相关的疾病或病症。所述疾病或病症可以是本文所述的任何疾病或病症。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述疾病是er 乳腺癌。施用方法不受限制并且可以是如本文所述的药剂的任何施用方法。在一些实施方案中,将肽作为组合物施用。组合物不受限制并且可以是本文所述的用于施用药剂的任何组合物。
[0291]
本发明的一些方面涉及抑制与转录凝聚物相关的转录的方法,所述方法包括抑制具有lxxll结合结构域并且与转录凝聚物相关的核受体结合具有lxxll结构域的辅助因子,其中所述结合通过使所述凝聚物与结合所述辅助因子的所述lxxll结构域的肽接触来抑制。
[0292]
在一些实施方案中,与参考水平(例如,未处理的对照细胞或凝聚物)相比,核受体与辅助因子的结合被抑制了至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%、99.5%、99.9%或更多。在一些实施方案中,与参考水平(例如,未处理的对照细胞或凝聚物)相比,与转录凝聚物相关的转录被抑制了至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%、99%、99.5%、99.9%或更多。在一些实施方案中,癌基因的转录被抑制。癌基因不受限制并且可以是本文所述的任何癌基因。在一些实施方案中,癌基因是myc。
[0293]
在一些实施方案中,转录凝聚物是体外转录凝聚物。在一些实施方案中,转录凝聚
物在细胞中。细胞不受限制并且可以是本文所述的任何细胞。在一些实施方案中,所述细胞是癌细胞。癌症不受限制并且可以是本文所述的任何癌症。在一些实施方案中,本文所公开的方法可以用于治疗与异常核受体活性或表达相关的疾病或病症。所述疾病或病症可以是本文所述的任何疾病或病症。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述疾病是er 乳腺癌。
[0294]
肽不受限制,只要其结合lxxll结构域即可。在一些实施方案中,所述肽包含蛋白转导结构域(ptd)。ptd不受限制并且可以是本文所述的任何ptd。在一些实施方案中,所述ptd是hiv-tat。
[0295]
在一些实施方案中,将肽施用于受试者以治疗与异常核受体活性或表达相关的疾病或病症。所述疾病或病症可以是本文所述的任何疾病或病症。在一些实施方案中,所述疾病是癌症。在一些实施方案中,所述疾病是er 乳腺癌。施用方法不受限制并且可以是如本文所述的药剂的任何施用方法。在一些实施方案中,将肽作为组合物施用。组合物不受限制并且可以是本文所述的用于施用药剂的任何组合物。
[0296]
抑制与凝聚物组分的过表达相关的转录
[0297]
如下文实施例中所示,过表达med1的他莫昔芬抗性er 乳腺癌细胞系中所含的含有med1的凝聚物具有比在不过度表达med1的乳腺癌细胞中所含的含有med1的凝聚物更大的体积。此外,实施例显示当他莫昔芬与med1水平增加4倍的med1体外凝聚物(例如液滴)接触时,所述凝聚物具有低得多的他莫昔芬浓度。
[0298]
因此,本发明的一些方面涉及抑制癌细胞生长或增殖的方法,所述癌细胞过表达凝聚物组分(例如med1)并且对抗癌剂(例如他莫昔芬)具有抗性。在一些实施方案中,所述方法包括抑制所述凝聚物组分的表达或凝聚物形成活性。在一些实施方案中,所述方法包括使所述凝聚物与经修饰的凝聚物组分接触,所述经修饰的凝聚物组分增加所述抗癌剂在所述凝聚物中的分配。例如,在一些实施方案中,可以对凝聚物组分进行修饰以增加芳香族侧链的含量,并且由此增加包含经修饰组分的凝聚物对具有芳香族侧链的药剂的亲和力。在一些实施方案中,可以使具有增加水平的凝聚物组分的凝聚物与对抗癌剂和所述凝聚物具有亲和力的药剂接触,从而增加抗癌剂在凝聚物中的浓度。在一些实施方案中,可以修饰所述抗癌剂以增加其在凝聚物中的分配。例如,在一些实施方案中,可以修饰抗癌剂(例如他莫昔芬)以增加芳香族侧链的数目,并且由此增加其在包含具有芳香族侧链的凝聚物组分的凝聚物中的分配。
[0299]
本发明的其它方面包括确定过表达基因并对抗癌剂具有抗性的癌症是否包含比不过度表达所述基因的癌症中的相应凝聚物更大的凝聚物。在一些实施方案中,所述过表达的基因与对抗癌剂的抗性相关。在一些实施方案中,将来自抗性癌症的增大的凝聚物中的抗癌剂的浓度与不过度表达所述基因的非抗性癌症中的抗癌剂的浓度进行比较。
[0300]
一些实施方案还包括提供来自抗性癌症的增大的凝聚物或包含过表达的基因产物的体外凝聚物(例如液滴)。在一些实施方案中,使增大的凝聚物或体外凝聚物与一种或多种经修饰的抗癌剂接触,并确定经修饰的抗癌剂在所接触的凝聚物中的浓度。在一些实施方案中,使经修饰的抗癌剂的文库与凝聚物接触并确定经修饰的抗癌剂的浓度以便筛选对抗性癌症有效的经修饰的抗癌剂。
[0301]
***
[0302]
本公开的实施方案的描述并非旨在穷举或将本公开限制为所公开的精确形式。尽管出于说明的目的在本文中描述了本公开的具体实施方案和实施例,但是如相关领域中的技术人员将认识到,在本公开的范围内各种等效修改是可能的。例如,虽然方法步骤或功能以给定的顺序呈现,但是替代性实施方案可以以不同的顺序执行功能,或者功能可以基本上同时执行。本文中提供的本公开的教导可以酌情应用于其它程序或方法。可以组合本文所述的各种实施方案以提供另外的实施方案。如果需要,可以修改本公开的方面以采用上述参考文献和申请的组合物、功能和概念来提供本公开的又另外的实施方案。可以根据详细描述对本公开进行这些和其它改变。
[0303]
任何前述实施方案的具体要素可以进行组合或替代其它实施方案中的要素。此外,虽然已经在这些实施方案的上下文中描述了与本公开的某些实施方案相关的优点,但是其它实施方案也可以表现出此类优点,并且并非所有实施方案都必须表现出此类优点以落入本公开的范围内。
[0304]
所鉴定的所有专利和其它出版物出于描述和公开例如在此类出版物中所描述的可能与本发明结合使用的方法的目的以引用的方式明确地并入本文。提供这些出版物仅仅是因为其公开在本技术的提交日期之前。在这方面,不应将其解释为承认本发明人由于在先发明或在先公开或由于任何其它原因而无权先于此类公开。关于日期的所有陈述或关于这些文件的内容的表达是基于本技术人可获得的信息,并且不构成关于这些文件的日期或内容的正确性的任何认可。
[0305]
本领域技术人员容易地理解,本发明很好地适于实现所述目的并获得所提及的目标和优点以及其中固有的那些。本文的描述和实施例的细节是某些实施方案的代表,是示例性的,并且不旨在限制本发明的范围。本领域技术人员将想到其中的修改和其它用途。这些修改涵盖在本发明的精神内。对于本领域技术人员而言将显而易见的是,可以在不背离本发明的范围和精神的情况下对本文公开的发明进行各种替代和修改。
[0306]
除非明确指出相反,否则如本文在说明书和权利要求中所用的冠词“一个”和“一种”应该理解为包括复数指代物。在组的一个或多个成员之间包括“或”的权利要求或描述应当被视为是满足以下情况,即组成员中的一个、多于一个或全部存在于、被应用于给定的产品或方法中,或以其他方式与给定的产品或方法相关,除非指出相反或根据上下文明显不同。本发明包括这样的实施方案,其中组中的一个确切成员存在于、被应用于给定的产品或方法中,或以其他方式与给定的产品或方法相关。本发明还包括这样的实施方案,其中多于一个组成员或全部组成员存在于、被应用于给定的产品或方法中,或以其他方式与给定的产品或方法相关。此外,应当理解,本发明提供所有的变化、组合和置换,其中来自一条或多条所列权利要求的一个或多个限制、要素、条款、描述性用语等被引入从属于同一基础权利要求的另一个权利要求(或者相关的任何其他权利要求)中,除非另外指明或除非对于本领域的普通技术人员而言明显会引起矛盾或不一致。可以设想,本文所述的所有实施方案在适当的情况下适用于本发明的所有不同方面。还设想任何实施方案或方面可以在适当时自由地与一个或多个其它此类实施方案或方面组合。当要素以列表的形式(例如,以马库什组或类似形式)呈现时,应当理解这些要素的每个亚组也被公开,并且任何要素可从该组中去除。应当理解,通常,在本发明或本发明的多个方面被称为包括特定要素、特征等的情况下,本发明的某些实施方案或本发明的多个方面由此类要素、特征等组成或基本上由此类
要素、特征等组成。为了简单起见,那些实施方案在每种情况下没有在本文中以如此多的笔墨具体阐述。还应当理解,本发明的任何实施方案或方面可明确地从权利要求排除,不管在说明书中是否叙述了此类具体排除。例如,可以排除任何一种或多种活性剂、添加剂、成分、任选的药剂、生物类型、障碍、受试者或其组合。
[0307]
在权利要求或描述涉及物质组合物的情况下,应当理解,根据本文所公开的任何方法制备或使用物质组合物的方法,和出于本文所公开的任何目的使用物质组合物的方法是本发明的方面,除非另外指明或除非其对于本领域的普通技术人员而言明显会引起矛盾或不一致。在权利要求或描述涉及方法的情况下,例如,应当理解,制备可用于执行所述方法的组合物的方法和根据所述方法生产的产品是本发明的方面,除非另外指明或除非对于本领域普通技术人员而言明显会引起矛盾或不一致。
[0308]
在本文给出范围的情况下,本发明包括其中包括端点的实施方案、其中排除两个端点的实施方案和其中包括一个端点而排除另一个端点的实施方案。除非另外指明,否则应该假定包括两个端点。此外,应当理解,除非另外指明或以其它方式从上下文和本领域普通技术人员的理解显而易见,否则表示为范围的值可假定为在本发明的不同实施方案中在所陈述的范围内的任何具体值或子范围,至范围下限的单位的十分之一,除非上下文另外明确规定。还应当理解,在本文中陈述一系列数值的情况下,本发明包括类似地涉及由所述系列中的任何两个值界定的任何中间值或范围的实施方案,并且最低值可视为最小值且最高值可视为最大值。如本文所用的数值包括以百分比表示的值。对于其中数值前面有“约”或“大约”的本发明的任何实施方案,本发明包括其中列举精确值的实施方案。对于其中数值前面没有“约”或“大约”的本发明的任何实施方案,本发明包括其中值前面有“约”或“大约”的实施方案。
[0309]“大约”或“约”通常包括在任一方向上(大于或小于该数字)落在数字的1%的范围内或在一些实施方案中落在数字的5%的范围内或在一些实施方案中落在数字的10%的范围内的数字,除非另有说明或以其它方式从上下文显而易见(除非这样的数字不允许超过可能值的100%)。应当理解,除非明确地相反指示,否则在本文中要求保护的包括多于一个动作的任何方法中,所述方法的动作的顺序不必限于叙述所述方法的动作的顺序,而是本发明包括顺序被如此限制的实施方案。还应该理解,除非另外指明或从上下文显而易见,否则本文所述的任何产品或组合物可被认为是“分离的”。
[0310]
实施例
[0311]
实施例1
[0312]
形成体外凝聚物:
[0313]
已知许多凝聚物组分形成体外凝聚物。通常,在盐(例如nacl)和任选地拥挤药剂(例如,聚乙二醇、蔗聚糖)的存在下,将一种或多种凝聚物组分以不同的浓度添加到溶液(例如水溶液)中。参见例如boija等人,cell,第175卷第7期,第1842-1855页(2018);sabari等人,science,第361卷,第361-371页(2018);bergeron-sandoval等人,cell,第165卷第5期,第1067-1079页(2016).5月19日;165(5):1067-1079,其相关方法明确地并入本文。在一些实施方案中,通过将约10μm的med1添加到含有150μm nacl和10%peg(例如peg-8000)的溶液中形成含有med1的体外凝聚物。在一些实施方案中,通过将约10μm的med1和er各自添加到含有150μm的nacl和10%peg(例如peg-8000)或16%蔗聚糖-400的溶液中,形成含有
med1和雌激素受体(er)的体外凝聚物。
[0314]
成像凝聚物
[0315]
在本领域中教导了体外和在细胞中成像凝聚物的方法,并且没有限制。在一些实施方案中,使用解卷积显微术、结构化照明显微术或干涉显微术来成像凝聚物。参见例如boija等人,cell,第175卷第7期,第1842-1855页(2018)和sabari等人,science,第361卷,第361-371页(2018),其相关方法明确地并入本文。
[0316]
在一些具体实施方案中,含有相关凝聚物的细胞在35mm玻璃板上生长,并使用具有airyscan检测器的lsm880共聚焦显微镜在2i/lif培养基中成像。在补充有37℃潮湿空气的37℃加热台上使细胞成像。另外,将显微镜封闭在加热至37℃的孵育室中。zen black edition版本2.3(zeiss,thornwood ny)可用于获取。可以用airyscan检测器以超分辨率(sr)模式用plan-apochromat 63x/1.4油性物镜获取图像。可以使用zen 2.3(zeiss,thornwood ny)处理原始airyscan图像。
[0317]
在一些实施方案中,dna-fish或rna-fish可以用于通过标记相关rna转录或基因组dna(例如myc)的位置来定位相关凝聚物在细胞中的位置。参见例如boija等人,cell,第175卷第7期,第1842-1855页(2018)。此技术可以与本文所公开的其它方法组合使用以确定药剂是否共定位于相关凝聚物中(例如,经由标记药剂的荧光显微术)。
[0318]
为了分析体外相分离成像实验,可以编写matlab脚本以鉴定液滴并表征它们的尺寸、长宽比、凝聚级分和分配系数。对于任何特定的实验条件,可以采用基于直方图峰值的强度阈值和尺寸阈值(2像素半径)来分割图像,在该点可以定义感兴趣的区域,并且可以定量液滴内外的信号强度。
[0319]
分配系数的计算
[0320]
如本文所用,分配系数或富集比为化合物(例如药剂)在凝聚物中和在凝聚物外部(例如周围溶液)的浓度比。如本文所述的药剂的分配系数可以使用用于确定药剂浓度的任何合适的技术(诸如本文所述的显微术技术)获得。在一些实施方案中,可以使用fiji来计算活细胞成像中的分配系数。使用每个细胞的单个共聚焦平面,可以定量凝聚物内的平均信号强度,并且将其与来自细胞的核边界内的8-12个非异染色质区域的平均信号强度进行比较。可以在hoechst通道中定义异染色质区域和核边界的限制。对于质量控制,在所选平面中具有》3个异染色质焦点的细胞可以具有计算的分配系数。
[0321]
实施例2
[0322]
该细胞核含有不同的相分离的凝聚物,其区室化和聚集具有不同物理化学特性的生物分子。在此考虑凝聚物是否聚集小分子癌症治疗剂使得它们的药效学特性改变。发现抗肿瘤药物在体外聚集为特定的蛋白质凝聚物,并且这通过与药物靶标无关的物理化学特性而发生。这种行为也在肿瘤细胞中观察到,其中药物分配影响药物活性。发现改变凝聚物的特性影响药物的浓度和活性。这些结果表明,小分子在凝聚物内的选择性分配和聚集有助于药物的药效学,并且对这种现象的进一步理解可以促进疾病治疗的进步。
[0323]
细胞的50-100亿个蛋白质分子被区室化成膜结合和非膜结合的细胞器(1-3)。许多非膜结合的细胞器是具有不同物理化学特性的相分离的生物分子凝聚物,其可以吸收和聚集特定的蛋白质和核酸(4-17)。有理由认为,选择性凝聚物分配也可能与靶标出现在凝聚物内的小分子药物一起发生,(图28a),并且此类化合物的治疗指数和功效因此可能与它
们分配到具有它们的靶标的凝聚物中的能力有关。为了测试这一观点,本研究集中在先前在各种细胞系中报道的核凝聚物的集合上,证明它们全部都发生在正常人细胞和肿瘤细胞中,并且然后用每种核凝聚物的关键组分开发体外凝聚物液滴测定以使得能够测试小分子。
[0324]
已经在不同的培养细胞系中描述了核凝聚物,但其尚未证明转录凝聚物、剪接凝聚物、异染色质凝聚物和核仁凝聚物中的每一种都出现在正常和恶性原代人组织的细胞中。这些凝聚物中的每一种均含有一种或多种蛋白质,所述一种或多种蛋白质既可以用作凝聚物的标志物,又可以用作在体外液滴测定中形成凝聚物的支架(10-12,18-32)。具体地,转录凝聚物由凝聚物形成蛋白med1和brd4标记(10,12,19),剪接斑点凝聚物由srsf2标记(11,20),异染色质凝聚物由hp1α标记(21,22)并且核仁由fib1和npm1标记(23-25)(图32a)。为了确定此类凝聚物是否也可以在健康和恶性人组织的细胞中观察到,我们获得了乳腺导管上皮、浸润性导管癌、正常结肠和结肠癌的活组织检查(图32b、32c)。免疫荧光揭示在正常和转化组织中均含有这些标记蛋白的核体(图1b、1c)。如动态生物分子凝聚物所预期的,核体大小和数量分布广泛,并且在良性和恶性组织之间没有观察到显著差异(图33a-33c)。然而,肿瘤细胞获取在驱动器癌基因处的很大的超级增强子(33),并且如下文所述,这些可以形成肿瘤特异性转录凝聚物。
[0325]
开发了一种测定来模拟这些核凝聚物并研究小分子在这些液滴内的行为(图28d)。标记每个核凝聚物的蛋白质先前已经显示在体外形成单独的凝聚物(10,11,21,23)。产生并纯化了med1、brd4、srsf2、hp1α、fib1和npm1的重组荧光标记形式(图34),并证实了这些蛋白质在体外测定中形成液滴的能力(图35a、35b)。为了研究小分子的分配行为,首先将染料荧光素(332da)和hoechst(452da)以及平均4.4千道尔顿(kda)的荧光标记的葡聚糖添加到含有六种蛋白质凝聚物中的每一种的溶液中。染料和葡聚糖似乎扩散通过所有的凝聚物而基本上没有分配(图28e、图36、图37a-37d)。小分子药物通常小于1kda,因此这些结果表明小分子药物可以通过这些核凝聚物自由扩散,除非存在除了影响分配的尺寸以外的因素。
[0326]
接下来试图确定具有驻留在核凝聚物中的靶标的不同临床重要的药物是否也表现出穿过这些凝聚物的自由扩散。最初的焦点是顺铂和米托蒽醌,它们是通过铂化或插入修饰dna并且可以被修饰以具有荧光特性(顺铂)(34)或固有荧光(米托蒽醌)的一类抗肿瘤化合物的成员。当添加到具有纯化的med1、brd4、srsf2、hp1α、fib1或npm1的液滴形成缓冲液中时,发现顺铂选择性地聚集在med1液滴中(图29a、图38a),分配系数高达600(图39a-39c)。顺铂的荧光修饰似乎对体外的这种行为没有贡献,因为经修饰的药物可以从具有未经修饰的顺铂的凝聚物中逐出,并且顺铂的异构体没有表现出相同的行为(图38b-38d)。米托蒽醌还聚集在med1凝聚物中以及fib1和npm1凝聚物中(图29b、图38a、图39a-39c)。与这些结果一致,已知米托蒽醌聚集在fib1和npm1所驻留的核仁中(35,36)。这些结果表明在体外形成的凝聚物具有即使在不存在药物靶标的情况下也能够选择性地聚集特定小分子药物的物理化学特性。
[0327]
选择靶向预期被包含在细胞的转录凝聚物内的转录调节剂的抗肿瘤药物用于进一步研究。这些靶标包括:a)雌激素受体(er)(其是转录因子和核激素受体),b)cdk7(其是在转录起始和细胞周期控制中起作用的细胞周期蛋白依赖性激酶),和c)brd4(其是参与癌
基因调节的布罗莫结构域(bromodomain)蛋白和共活化剂)(图40)。为了用共聚焦荧光显微镜监测药物行为,使用分别靶向er的荧光他莫昔芬类似物(fltx1)和靶向cdk7和brd4的经修饰的荧光thz1和jq1(37,38)。将这些化合物添加到具有med1、brd4、srsf2、hp1α、fib1和npm1蛋白的平行液滴形成测定中。fltx1和thz1优先聚集在med1液滴中(图29c-29d、图38a),并且这种行为不能归因于荧光部分(图38b、图38d)。jq1浓度呈现不同的模式,聚集在med1、brd4和npm1液滴中(图29e、图38a、图38b)。加强这些结果,发现聚集在med1凝聚物中的小分子也聚集在由纯化的完整介体复合物形成的凝聚物中(图41)和聚集在替代性拥挤药剂中形成的med1凝聚物中(图42)。这三种化合物(erα、cdk7、以及brd4的布罗莫结构域)的靶标不存在于这些体外凝聚物中,但存在于与转录因子和介体一起在体内形成凝聚物的超级增强子中(10,12,39)(图40a、40b),表明一些小分子优先聚集在与它们的蛋白质靶标相同的凝聚物中的能力可能有助于这些药物的药理学特性。
[0328]
为了进一步了解支配凝聚物中小分子富集的相互作用的性质,研究集中于med1-idr凝聚物。光致漂白后荧光恢复(frap)实验显示,顺铂分子在这种凝聚物中是高度可移动的(图43a、43b),表明该凝聚物产生在高动态可动性的状态下促进药物聚集的生理化学环境。为了解可能有助于与凝聚物中的med1选择性缔合的小分子的化学特征,使用81种化合物的小分子文库,其中荧光分子硼-二吡咯甲烯基(bodipy)用化学侧基的各种组合进行修饰(图44a),并且通过共聚焦荧光显微术测量这些分子聚集在med1凝聚物中的相对能力。发现含有芳香族环的分子优先聚集在med1凝聚物中(图44a-44d、图45a),表明π-π或π-阳离子相互作用是有利于小分子分配到med1凝聚物中的物理化学特性之一。med1中的芳香族氨基酸(其数目超过在此研究的其它凝聚物形成蛋白中的那些(图34b))可能有助于此类相互作用,并且为了研究这种可能性,产生了med1突变蛋白,其中所有30个芳香族氨基酸被突变为丙氨酸并且测试其形成凝聚物和凝聚物小分子的能力(图45b)。med1芳香族突变蛋白保留了在体外形成液滴的能力,表明芳香族氨基酸不是液滴形成所必需的(图45c),但是含有芳香族环的小分子探针和极性分子顺铂不再分配到由med1芳香族突变蛋白形成的凝聚物中(图45d、45e)。这些结果表明med1凝聚物的芳香族残基有助于选择性地聚集这些小分子的物理化学特性。
[0329]
预期小分子聚集在特定凝聚物中的能力将影响靶标接合并且因此影响药物药效学。为了研究这一点,利用了med1和hp1α凝聚物掺入dna的能力(图30a),并且测量了在其中顺铂被聚集的med1凝聚物中与在顺铂自由扩散的hp1α凝聚物中顺铂对dna铂化的相对效率(图29a)。将dna和蛋白质在液滴形成条件下混合,其中dna强烈地分配到液滴相中(图46),用顺铂处理这些凝聚物,并在生物分析仪上通过尺寸偏移可视化dna铂化。结果表明,dna在med1凝聚物中比在hp1α凝聚物中被更有效地铂化(图30b),与在med1凝聚物中升高的顺铂浓度产生增强的靶标接合的预期一致。如果顺铂被聚集在细胞中的介体凝聚物中,则将预期与介体凝聚物共定位的dna将优先被铂化。为了测试这一观点,使用特异性地识别铂化dna的抗体(图47a)(40)以及对med1、hp1α或fib1具有特异性的抗体在顺铂处理的hct116结肠癌细胞中进行共免疫荧光。与顺铂在体外对med1凝聚物的偏好一致,发现铂化dna经常与med1凝聚物共定位,但不与hp1α或fib1凝聚物共定位(图30c)。为了确定顺铂接合dna的能力是否依赖于med1凝聚物的存在,用jq1处理细胞,这引起med1凝聚物的损失(图47b),并且观察到伴随的在myc癌基因处铂化dna的减少(图47c、47d)。这些结果与小分子在特定凝聚
物中的浓度可能影响靶标接合效率的观点一致。
[0330]
在细胞中,在含有med1的凝聚物中dna的优先修饰可以预期通过延长的处理选择性地破坏这些凝聚物。为了测试这一点,将hct116结肠癌细胞工程化以表达6种核凝聚物中的每一种的gfp标记的标记蛋白(图48a-48f、图49a、图49b)。当暴露于顺铂时,观察到med1凝聚物的选择性和进行性减少(图30d、图50a、图50b、图51)。与这一点一致,顺铂处理导致在超级增强子处med1 chip-seq信号的优先损失(图40e、图52)。此外,来自铂化dna卸下的高通量测序数据(41)揭示顺铂修饰的dna优先出现在其中med1聚集的超级增强子(se)处(42)(图30f)。这些结果与顺铂优先修饰转录的基因的报道一致(41,43),并且认为这种作用是由于优先的凝聚物分配。总之,这些结果表明顺铂优先修饰se dna的模型,这进而又导致这些凝聚物的溶解。以前的研究已经表明,不同的肿瘤细胞变得高度依赖于超级增强子驱动的癌基因表达(44-48),这可能解释为什么能够进行一般dna修饰的铂药物在不同的癌症中是有效的治疗剂(49)。
[0331]
探索另一种临床上重要的抗肿瘤药物他莫昔芬的行为以评估药物反应和抗性是否与在凝聚物中的分配相关(图31a)。erα在体外以雌激素依赖性方式掺入med1凝聚物中(12);液滴测定证实了这一点并且揭示添加他莫昔芬导致erα从med1凝聚物中逐出(图31b)。进一步研究了雌激素和他莫昔芬对乳腺癌细胞中的med1凝聚物的作用,专注于myc癌基因,这是由于其显著的致癌作用和对雌激素的反应性(50)。在er 乳腺癌细胞系mcf7中的myc癌基因上观察到med1凝聚物(图40a、图53a-53d)。具有med1 if的dna fish揭示雌激素增强med1凝聚物在myc癌基因处的形成并且他莫昔芬处理减少这些(图54a、图54b)。在没有er的情况下人工med1凝聚物在凝聚物的位点处聚集fltx1(图55),表明将fltx1分配到细胞中的med1凝聚物中不需要er。这些结果与erα以雌激素依赖性、他莫昔芬敏感性方式与med1凝聚物相互作用以驱动乳腺癌细胞中的癌基因表达的模型一致。
[0332]
产生药物抗性的机制可以提供临床环境中的药物活性的线索。他莫昔芬抗性是持久的临床挑战,并且可能由多种机制(包括erα突变和med1过表达)介导(图31a、图56)(51,52)。为了研究erα突变是否改变凝聚物中的erα行为,我们产生了4种患者来源的erα突变蛋白并在他莫昔芬的存在下测试它们的分配。与wt erα相反,患者来源的erα突变体和med1构成的凝聚物在他莫昔芬处理后不被破坏(图31b、图57a、图57b)。erα点突变将对他莫昔芬的亲和力降低大约10倍(52),表明当这种亲和力降低时在液滴中的药物浓度不足以逐出这些er突变蛋白。
[0333]
med1过表达与他莫昔芬抗性和乳腺癌的不良预后相关(51),但不清楚介体复合物的一个亚基的过表达为什么产生抗性。考虑过表达的med1掺入转录凝聚物中的可能性,所述转录凝聚物含有介体分子簇(39),从而扩大它们的体积并稀释可利用的他莫昔芬(图58a)。发现从他莫昔芬敏感性细胞系mcf7来源的他莫昔芬抗性乳腺癌细胞系tamr7(53)产生4倍升高水平的med1蛋白(图58b)。在这些细胞中含有med1的凝聚物的体积大了2倍(图31c、图58c)。当在体外液滴测定中建模时,发现med1水平增加4倍导致液滴尺寸的同量增加(图59a、图59b)。此外,发现100μm他莫昔芬阻止erα掺入med1凝聚物中(图31b、31d),但在阻止erα掺入用较高med1水平产生的较大med1凝聚物中时有效性小得多(图31d)。为了证实他莫昔芬在较大的液滴中的水平更稀,测量了荧光他莫昔芬类似物fltx1在med1液滴中的富集,并发现较大的凝聚物具有较低的药物浓度(图31e)。这些结果反映在细胞中,其中栓系
的erα分子的集合形成被他莫昔芬消除的med1凝聚物,但当med1过表达时,他莫昔芬不能解离erα-med1凝聚物(图60)。这些结果支持了其中med1过表达引起形成更大的转录凝聚物的他莫昔芬抗性模型,其中他莫昔芬被稀释并且由此从凝聚物中解离er的有效性较低(图31f)。
[0334]
结果显示药物选择性地分配到凝聚物中,这可以通过独立于其分子靶标存在的物理化学特性而发生,并且细胞可以通过凝聚物改变机制发展对药物的抗性。这可以解释令人惊讶的观察结果,即抑制全局基因调节剂诸如brd4或cdk7可以对具有获得性大超级增强子的癌基因具有选择性作用(46);将抑制剂如jq1和thz1选择性分配到超级增强子凝聚物中将优先破坏那些基因座处的转录。这些结果也对未来开发有效的疾病治疗剂有意义;有效的靶标接合将取决于可测量的因素,诸如药物在凝聚物中的分配(图61a-61d)。因此,这里所描述的类型的凝聚物测定可能有助于优化凝聚物分配、靶标接合和小分子药物的治疗指数。
[0335]
材料和方法
[0336]
细胞系
[0337]
如所示获得细胞系tamr7(ecacc 16022509)。v6.5鼠胚胎干细胞是来自whitehead institute的r.jaenisch的礼物。v6.5是从c57bl/6(f)x 129/sv(m)杂交来源的雄性细胞。mcf7细胞是来自whitehead institute的r.weinberg的礼物,并且使用了来自atcc(ccl-247)的hct116细胞。使用了用med1-megfp(10)、brd4-megfp(10)、srsf2-megfp(11)或hp1α-megfp内源性地标记的v6.5鼠胚胎干细胞。细胞经测试呈支原体阴性。将crispr/cas9系统用于产生遗传修饰的内源性地标记的esc和hct116细胞。将靶标特异性序列克隆到含有sgrna骨架(其为cas9和bfp或mcherry的密码子优化形式)的质粒中。使用nebuilder hifi dna主混合物(neb e2621s)将同源定向修复模板克隆到puc19中。同源修复模板由在两侧各侧接有用pcr从基因组dna扩增的800bp同源臂的mcherry或megfp cdna序列组成。为了产生遗传修饰的细胞系,用833ng cas9质粒转染750,000个细胞,并且1,666ng非线性同源修复pcr基因分型使用phusion聚合酶(thermo scientific f531s)进行。根据试剂盒建议扩增产物并在1%琼脂糖凝胶上可视化。以下引物用于pcr基因分型:
[0338]
hp1α-mcherry_fwd(mes):aacgtgaagtgtccacagattg(seq id no:2)
[0339]
hp1α-mcherry_rev(mes):ttatggatgcgtttaggatgg(seq id no:3)
[0340]
hp1α-gfp_fwd(hct116):ccaaggtgaggaggaaatca(seq id no:4)
[0341]
hp1α-gfp_rev(hct116):cacagggaagcagaaggaag(seq id no:5)
[0342]
med1α-gfp_fwd(hct116):gaagttgagagtccccatcg(seq id no:6)
[0343]
med1-gfp_rev(hct116):cgagcacccttctcttcttg(seq id no:7)
[0344]
brd4-gfp_fwd(hct116):ctgcctcttgggcttgttag(seq id no:8)
[0345]
brd4-gfp_rev(hct116):tttggggagaggagacattg(seq id no:9)
[0346]
srsf2-gfp_fwd(hct116):caagtctcctgaagaggaagga(seq id no:10)
[0347]
srsf2-gfp_rev(hct116):aagggctgtatccaaacaaaaac(seq id no:11)
[0348]
fib1-gfp_fwd(hct116):ccttttaatcagcaacccactc(seq id no:12)
[0349]
fib1-gfp_rev(hct116):gtgaccgagtgagaatttaccc(seq id no:13)
[0350]
npm1-gfp_fwd(hct116):tcaaattcctgagctgaagtga(seq id no:14)
[0351]
npm1-gfp_rev(hct116):aacacggtagggaaagttctca(seq id no:15)
[0352]
细胞培养
[0353]
使v6.5鼠胚胎干(mes)细胞在2i lif条件下生长。使mes细胞在0.2%凝胶化(sigma,g1890)组织培养板上生长。用于2i lif培养基条件的培养基如下:967.5ml dmem/f12(gibco 11320)、5ml n2补充剂(gibco 17502048)、10ml b27补充剂(gibco 17504044)、0.5mm l-谷氨酰胺(gibco 25030)、0.5x非必需氨基酸(gibco 11140)、100u/ml青霉素-链霉素(gibco 15140)、0.1mm b-巯基乙醇(sigma)、1um pd0325901(stemgent 04-0006)、3um chir99021(stemgent 04-0004)和1000u/ml重组lif(esgro esg1107)。使用tryple表达酶(life technologies,12604021)从板上分离细胞。用fbs/lif-培养基((dmem k/o(gibco,10829-018)、1x非必需氨基酸、1%青霉素链霉素、2mm l-谷氨酰胺、0.1mm b-巯基乙醇和15%胎牛血清(fbs)(sigma aldrich,f4135))淬灭tryple。将细胞在室温下以1000rpm旋转3分钟,重悬于2i培养基中,并且将5x106个细胞接种于15cm培养皿中。
[0354]
使mcf7细胞和hct116细胞在完全dmem培养基(dmem(life technologies 11995073)、10%胎牛血清(fbs)(sigma aldrich,f4135)、1%l-谷氨酰胺(gibco,25030-081)、1%青霉素链霉素(life technologies,15140163))中生长。为了在无雌激素条件下生长,将在常规培养基中的mcf7细胞用pbs洗涤3次,然后在使用之前将培养基更换为含有无酚红dmem(life technologies 21063029)、10%活性炭处理的fbs(life technologies a3382101)、1%l-谷氨酰胺(gibco,25030-081)和1%青霉素链霉素(life technologies,15140163)的无雌激素培养基持续48小时。
[0355]
使tamr7细胞在tamr7培养基(无酚红dmem/f12(life technologies 21041025)、1%l-谷氨酰胺(gibco,25030-081)、1%青霉素链霉素(life technologies,15140163)、1%胎牛血清(fbs)(sigma aldrich,f4135)、6ng/ml胰岛素(santa cruz biotechnology,sc-360248))中生长。为了传代,在pbs(life technologies,am9625)中洗涤细胞。使用tryple表达酶(life technologies,12604021)从板上分离细胞。用指定的培养基淬灭tryple。
[0356]
活细胞成像
[0357]
使细胞在玻璃培养皿(mattek p35g-1.5-20-c)上生长。在对细胞成像之前,用不含酚红的2i培养基置换培养基,并使用andor revolution spinning disk共聚焦显微镜成像。使用fiji处理原始andor图像。对于成像mesc,使用涂覆的玻璃培养皿(在用5μg/ml聚-l-鸟氨酸(sigma-aldrich,p4957)的情况下在37℃下持续30分钟,并且在用5μg/ml层粘连蛋白(corning,354232)的情况下在37℃下持续2-16小时)。为了使mes细胞中的fib1和npm1成像,编码gfp标记的npm1或fib1的载体如上文所述用lipofectamine 3000按照包装说明书进行转染。
[0358]
组织样品的免疫荧光
[0359]
新鲜冷冻的乳腺和结肠组织购自bioivt。将冷冻的乳腺组织在pbs中的2%pfa中固定30分钟至1小时。将固定的组织在pbs中的30%蔗糖中在4℃下孵育4天。将组织包埋在oct中并冷冻。将新鲜冷冻的结肠组织包埋在oct中并冷冻。使用温度设定在-25℃或-30℃的低温恒温器将组织切片成10um切片。将切片储存在-20℃。对于if,使切片达到室温,将它们在pbs中的4%pfa中固定10分钟。在pbs中洗涤三次后,使用在pbs中的0.5%tx100透化组
织,在pbs中洗涤三次并用在pbs中的4%bsa封闭30分钟。将第一抗体稀释到在pbs中的4%bsa中并添加到组织样品中用于在室温下孵育过夜。在pbs中洗涤三次后,将样品与以1:500稀释在pbs中的4%bsa中的第二抗体一起孵育。将样品在pbs中洗涤,使用20μm/ml hoechst 33258(life technologies,h3569)将dna染色5分钟并使用vectashield(vwr,101098-042)进行固定。使用位于哈佛中心(harvard center)的elyra超分辨率显微镜获取图像用于生物成像。图像使用fiji is just imagej(https://fiji.sc/)进行后处理。
[0360]
凝聚物的核体积定量
[0361]
对于图像获取:对10个z切片进行成像。在fiji is just imagej(https://fiji.sc/)中手动定义细胞核的轮廓并且将每个细胞核的体积计算为细胞核面积(μm)*成像的z切片的数目(10)*体素深度(0.1μm)。
[0362]
使用自定义python脚本和scikit-image软件包测量细胞核中的凝聚物的体积。根据两个标准从蛋白质通道的3d图像中分割凝聚物:(1)强度阈值为高于图像平均值三个s.d.;(2)尺寸阈值(10像素最小凝聚物尺寸)。然后通过乘以宽度(μm)*高度(μm)*体素深度(0.1μm)计算分割的对象的估计体积。对于每个蛋白因子,报告了健康和恶性组织中的凝聚物的平均值和s.d.体积。每个细胞核的凝聚物的数目被定义为在所定义的细胞核的周界内包含的分割对象的数目。对于每个蛋白因子,报告了健康和恶性组织中每个细胞核的凝聚物的平均值和s.d.数目。如下计算被凝聚物占据的细胞核体积的百分比:(∑细胞核中所有检测到的凝聚物的体积)/(估计的细胞核体积)。
[0363]
抗体
[0364]
将以下抗体用于免疫荧光:npm1(ab10530)、brd4(ab128874)、med1(ab64965)、hp1a(ab109028)、fib1(ab5821)、srsf2(ab11826)、er(ab32063)、cdk7(sc-7344)、顺铂修饰的dna(ab103261)、568山羊抗大鼠a11077、山羊抗兔igg alexa fluor 488(life technologies a11008)。
[0365]
蛋白质纯化
[0366]
将人cdna克隆到t7 pet表达载体的修饰形式中。基础载体被工程化以包括5’6xhis,随后是bfp、megfp或mcherry和14个氨基酸接头序列“gapgsagsaaggsg”。(seq id no:16)。使用hifi dna组装主混合物(neb e2621s)将这些序列(通过pcr产生)与接头氨基酸一起插入框内。对所有表达构建体测序以确保序列同一性。
[0367]
对于蛋白质表达,将质粒转化到lobstr细胞(chessman实验室的礼物)中,并如下生长。将含有标记的med1构建体的新鲜细菌菌落接种到含有卡那霉素和氯霉素的lb培养基中并在37℃下生长过夜。将细胞在500ml室温lb中用新鲜添加的卡那霉素和氯霉素以1:30稀释并在16℃下生长1.5小时。添加到iptg至1mm,并继续生长20小时。收集细胞并冷冻储存。含有所有其它表达质粒的细胞以类似方式处理,除了它们在iptg诱导后在37℃下生长5小时以外。
[0368]
将srsf1和srsf2-idr的细胞沉淀重悬于含有完全蛋白酶抑制剂(roche,11873580001)的15ml变性缓冲液(50mm tris 7.5、300mm nacl、10mm咪唑、8m尿素)中,并超声处理(15秒开、60秒关,十个循环)。通过以12,000g离心30分钟使裂解物澄清,并添加到1ml已用10体积相同缓冲液预平衡的ni-nta琼脂糖(invitrogen,r901-15)中。将含有该这种琼脂糖裂解物浆液的管在室温下旋转1.5小时,然后以3,000rpm离心10分钟,用2x 5ml裂
解缓冲液洗涤并用3x 2ml含有250mm咪唑的裂解缓冲液洗脱。将洗脱液在室温下旋转孵育至少10分钟并在3,000rpm下离心10分钟以收集蛋白质。将级分在12%丙烯酰胺凝胶上电泳,将正确大小的蛋白质首先用含有50mm tris ph 7.5、500mm nacl、1mm dtt和4m尿素的缓冲液透析,然后用含有2m尿素的相同缓冲液透析,最后用含10%甘油、无尿素的缓冲液的2次改变透析。通过在3.000rpm下离心10分钟除去透析后的任何沉淀物。以类似的方式通过将细胞沉淀再悬于含有50mm tris ph7.5、500mm nacl、完全蛋白酶抑制剂的15ml缓冲液中,超声处理并在4℃下以12,000xg离心30分钟来纯化所有其它蛋白质。将裂解物添加到1ml预平衡的ni-nta琼脂糖中,并在4℃下旋转1.5小时。将树脂浆液以3,000rpm离心10分钟,用2x 5ml含有50mm咪唑的裂解缓冲液洗涤并且通过与含有250mm咪唑的2ml裂解缓冲液一起孵育10分钟或更长时间,旋转3次,然后离心并进行凝胶分析。含有正确大小的蛋白质的级分在4℃下用含有50mm tris 7.5、125mm nacl、10%甘油和1mm dtt的缓冲液的两次改变透析或者对于hp1a构建体用具有500mm nacl的相同缓冲液透析。
[0369]
以下人蛋白质或蛋白质片段用于生产:
[0370]
npm1-全长,氨基酸1-294。
[0371]
srsf2-全长、氨基酸1-221。
[0372]
hp1α-全长,氨基酸1-191。
[0373]
med1-氨基酸600-1581。
[0374]
med1-芳香族突变氨基酸600-1581,所有芳香族残基改变为丙氨酸。
[0375]
med1-碱性突变氨基酸600-1581,所有碱性残基改变为丙氨酸。
[0376]
brd4-氨基酸674-1351。
[0377]
fib1-全长,氨基酸1-321。
[0378]
er和er突变体-全长,氨基酸1-595(wt)。
[0379]
cbioportal数据获取
[0380]
对于患者突变的频率,向cbioportal(www.cbioportal.org/)查询在任何乳腺癌测序数据集中存在的esr1突变。
[0381]
药物和小分子
[0382]
获得并如下处理药物和小分子。获得hoescht 33258(life technologies h3569)并以液体形式使用,将荧光素(sigma f2456)以10mm溶解在dmso中,然后在液滴形成缓冲液中进一步稀释以供使用。将与tritc或fitc、rox(life technologies 12223012)和德克萨斯红(sigma aldrich 60311-02-6)缀合的测量为4.4kda(sigma t1037)、10kda(invitrogen d1816)、40kda(invitrogen d1842)或70kda(invitrogen d1864)的葡聚糖稀释在液滴形成缓冲液中。将fltx1(aobio 4054)溶解在dmso中,然后在液滴形成缓冲液中进一步稀释。如下所述合成thz1-tmr和jq1-rox以获得图2d-e中所显示的分子结构。将与德克萨斯红(ursa bioscience)缀合的顺铂溶解于dmso中至2mm,并在液滴形成缓冲液中稀释供进一步使用。将米托蒽醌(sigma f6545)溶解于dmso中并在液滴形成缓冲液中稀释供进一步使用。使用chemdraw软件制备化学结构。
[0383]
使用非标记分子的活细胞逐出实验如下:jq1(cayman chemical11187)、顺铂(selleck s1166)、反式铂(toku-e t108)、他莫昔芬(sigma aldrich t5648)、4-羟基他莫昔芬(sigma h7904)。
[0384]
体外液滴测定
[0385]
使用amicon ultra离心过滤器(30k mwco,millipore)将重组bfp、gfp或mcherry融合蛋白聚集并脱盐至适当的蛋白质浓度和125mm nacl。还添加重组蛋白。具有指定量的盐和指定拥挤药剂(蔗聚糖或peg)的液滴形成缓冲液(50mm tris-hcl ph 7.5、10%甘油、1mm dtt)。立即将蛋白质溶液加载到玻璃底384孔板(cellvis p384-1.5h-n)上,并用150x物镜的andor共聚焦显微镜成像。除非指明,否则所呈现的图像是沉积在玻璃盖玻片上的液滴。
[0386]
液滴实验中使用的药物和小分子浓度如下:
[0387]
德克萨斯红-顺铂
–
5um
[0388]
fltx1
–
100μm
[0389]
米托蒽醌
–
50μm
[0390]
荧光素-5μm
[0391]
hoescht
–
1mg/ml
[0392]
标记的葡聚糖
–
0.05mg/ml
[0393]
thz1-tmr
–
5μm
[0394]
jq1-rox-1μm
[0395]
rox-1μm
[0396]
tr-5μm
[0397]
对于逐出实验,将5μm标记的顺铂-tr添加到med1液滴反应物(10μm med1、50mm tris-hcl ph 7.5、10%甘油、1mm dtt、10%peg)中,以便形成聚集有顺铂-tr的med1液滴。将未标记的反式铂或未标记的顺铂(媒介物、10μm、100μm或500μm)添加到液滴混合物中,并在逐出之后测量液滴中剩余的标记的顺铂-tr的量。将100μm荧光fltx1添加到med1液滴反应物(10μm med1、50mm tris-hcl ph 7.5、10%甘油、1mm dtt、10%peg)中,以便形成聚集有fltx1的med1液滴。向液滴混合物中添加1mm非荧光形式的药物他莫昔芬,并且在逐出之后测量在液滴中剩余的荧光fltx1的量。为了测定从med1凝聚物中逐出er,在100μm雌激素(sigma e8875)的存在下在用指定的组分的情况下将荧光标记的er和med1以指定浓度混合在液滴形成缓冲液中。对于用他莫昔芬处理的条件,然后添加4-羟基他莫昔芬(sigma h7904)至终浓度100um,并如上所述在共聚焦荧光显微镜上成像。
[0398]
对于使用荧光dna的液滴测定,在具有侧翼m13f和m13r引物结合位点的载体中商业合成451个碱基对的dna片段。与cy5荧光团共价结合的引物m13f和m13r是商业合成的,并且使用这些引物扩增此片段。然后从pcr反应中纯化dna片段,并在液滴形成缓冲液中稀释用于所描述的液滴测定。为了测试重组cdk7在med1或hp1α液滴中分配的能力,重组cdk活化复合物(millipore 14-476)以0.4mg/ml提供于ph 7.5的150mm nacl中。将一小瓶cy5单反应性染料(amersham pa23001)重悬于30ul的0.2m碳酸氢钠(ph 9.3)的150mm nacl溶液中。将5ul该反应物添加到5ul蛋白质中并在室温下孵育1小时。将游离染料通过如包装说明书中所描述的流过zeba spin脱盐柱40mwco(87764,thermo scientific)进入具有终浓度为1um的在125mm nacl中的1mm dtt的液滴形成缓冲液中来去除。根据需要将该蛋白质用于液滴测定中。
[0399]
对于筛选,80种经修饰的bodipy分子的经修饰的bodipy文库从如以前所述的更大
的文库集合中进行选择(54)。将这些分子在dmso中稀释至1mm,然后在液滴形成缓冲液中稀释至10um。在含有125mm nacl和10%peg以及5um蛋白质的液滴形成缓冲液中形成med1-idr-bfp的液滴,将探针添加到此反应中至终浓度1um,将混合物添加到384孔板的一个孔中,并且在andor共聚焦荧光显微镜上以150x在488(bodipy)和405(蛋白质)通道中成像。这些图像通过上述管道定量,以定量405通道限定的液滴中的最大488信号强度。然后对这些值进行分级以定量顶部和底部“命中”。为了确保探针的荧光强度相等,如上所述对1um的在液滴形成缓冲液中的18种随机探针成像,并确定场中的平均荧光强度。采取相同的方法测量单独的bodipy(sigma 795526)在med1液滴中和在扩散状态下的荧光强度。
[0400]
含有药物的体外液滴的frap
[0401]
对于体外微滴的frap,将5个在50us停留时间处的激光脉冲应用于med1通道,并且将20个在100μs停留时间处的激光脉冲应用于顺铂通道。在andor显微镜上每1s对恢复进行成像,持续指定的时间段。使用fiji测量荧光强度。漂白后frap恢复数据对每个通道的6次重复取平均值。
[0402]
计算药物富集比
[0403]
为了分析体外液滴实验,编写使用scikit-image软件包的自定义python脚本以鉴定液滴并表征其大小、形状和强度。根据各种标准从捕获通道的平均图像中分割液滴:(1)强度阈值为高于图像平均值三个s.d.;(2)尺寸阈值(20像素最小液滴尺寸);和(3)最少圆形度(圆形度=4π
·
面积周长2)(圆形度=4π
·
面积周长2)为0.8(1为完美的圆)。在分割之后,在排除相界面附近的像素的同时计算每个液滴的平均强度,并且通过仅减去液滴形成缓冲器的暗图像的强度来校正背景。对于每个实验,定量在荧光蛋白通道中从10个独立视场中鉴定的液滴。对于每个通道计算液滴内的最大信号强度,药物通道中的最大强度被称为“最大药物强度”。为了获得扩散状态下的单独的药物或染料的强度(被称为“扩散药物强度”),将化合物以在液滴测定中使用的相同浓度添加到液滴形成缓冲液中。然后将其在共聚焦荧光显微镜上成像。在fiji中处理所得的图像以获得场的荧光强度。为了获得在药物通道中渗出的蛋白质液滴的荧光强度(称为“背景强度”),将蛋白质液滴在药物发荧光的荧光通道中成像并且如上所述进行处理以获得10幅图像上液滴内的平均最大强度。通过下式[(最大药物强度)-(背景强度)]/(扩散药物强度)获得富集比。箱形图显示了所有液滴的分布。每个点代表单个液滴。
[0404]
染色质免疫沉淀(chip)和测序
[0405]
使mcf7细胞在完全dmem培养基中生长至80%融合。使用在pbs中的1%甲醛使细胞交联15分钟,随后在冰上用终浓度为125mm的甘氨酸淬灭。将细胞用冷pbs洗涤并通过刮下在冷pbs中的细胞来收获。将收集的细胞在4℃下以1000g沉淀3分钟,在液氮中快速冷冻并储存在80℃下。所有缓冲液都含有新鲜制备的完全蛋白酶抑制剂(roche,11873580001)。将冷冻的交联细胞在冰上解冻,并且然后再悬于裂解缓冲液i(50mm hepes-koh(ph 7.5)、140mm nacl、1mm edta、10%甘油、0.5%np-40、0.25%triton x-100、蛋白酶抑制剂)中,并在4℃下旋转10分钟,然后在1350rcf.下在4℃下旋转5分钟。将沉淀重悬于裂解缓冲液ii(10mm tris-hcl(ph 8.0)、200mm nacl、1mm edta、0.5mm egta、蛋白酶抑制剂)中并且在4℃下旋转10分钟并以1350rcf.在4℃下旋转5分钟。将沉淀重悬于超声处理缓冲液(20mm tris-hcl ph 8.0、150mm nacl、2mm edta ph 8.0、0.1%sds和1%triton x-100、蛋白酶抑
制剂)中,并且然后在misonix 3000超声波仪上超声处理10个循环,每个循环在冰上30秒(18-21w),在循环之间在冰上60秒。通过在16,000rcf.下在4℃下离心10分钟将超声处理的裂解物澄清一次。保留输入材料,并且将剩余物与结合cdk7bethyl a300-405a抗体的磁珠一起在4℃下孵育过夜,以富集由cdk7结合的dna片段。将珠用以下缓冲液中的每一种洗涤两次:洗涤缓冲液a(50mm hepes-koh ph 7.5、140mm nacl、1mm edta ph 8.0、0.1%na-脱氧胆酸盐、1%triton x-100、0.1%sds);洗涤缓冲液b(50mm hepes-koh ph 7.9、500mm nacl、1mm edta ph 8.0、0.1%na-脱氧胆酸盐、1%triton x-100、0.1%sds);洗涤缓冲液c(20mm tris-hcl ph8.0、250mm licl、1mm edta ph 8.0、0.5%na-脱氧胆酸盐、0.5%igepal c-630、0.1%sds);洗涤缓冲液d(含有0.2%triton x-100的te)和te缓冲液。通过在洗脱缓冲液(50mm tris-hcl ph 8.0、10mm edta、1%sds)中伴随间歇涡旋在65℃下孵育1小时从珠上洗脱dna。交联在65℃下逆转过夜。为了纯化洗脱的dna,添加200ml te,并且然后通过添加2.5ml的33mg/ml rnase a(sigma,r4642)并在37℃下孵育2小时来降解rna。通过添加10ml的20mg/ml蛋白酶k(invitrogen,25530049)并在55℃下孵育2小时来降解蛋白质。进行苯酚:氯仿:异戊醇萃取,随后进行乙醇沉淀。然后将dna重悬于50ml te中并用于测序。根据试剂盒说明书,用swift biosciences accel-ngs 2s plus dna文库试剂盒制备chip文库。在文库制备后,将chip文库在具有200-600个碱基的尺寸-收集窗口的pippinht上的2%凝胶上运行。用来自roche的kapa文库定量试剂盒通过qpcr定量最终文库,并在illumina hiseq 2500上以单读模式测序40个碱基。
[0406]
将hct116细胞在完全dmem培养基中生长至80%融合,随后用jq1或dmso处理24小时,然后进行细胞透化(在培养基中以1:1000用tx100在pbs中的溶液在37℃下细胞透化10分钟),随后用dmf或顺铂处理6小时。使用在pbs中的1%甲醛使细胞交联15分钟,随后在冰上用终浓度为125mm的甘氨酸淬灭。将细胞用冷pbs洗涤并通过刮下在冷pbs中的细胞来收获。将收集的细胞在4℃下以1000g沉淀3分钟,在液氮中快速冷冻并储存在80℃下。所有缓冲液都含有新鲜制备的完全蛋白酶抑制剂(roche,11873580001)。将冷冻的交联细胞在冰上解冻,并且然后再悬于裂解缓冲液i(50mm hepes-koh(ph 7.5)、140mm nacl、1mm edta、10%甘油、0.5%np-40、0.25%triton x-100、蛋白酶抑制剂)中,并在4℃下旋转10分钟,然后在1350rcf.下在4℃下旋转5分钟。将沉淀重悬于裂解缓冲液ii(10mm tris-hcl(ph 8.0)、200mm nacl、1mm edta、0.5mm egta、蛋白酶抑制剂)中,并且然后在misonix 3000超声波仪上超声处理10个循环,每个循环在冰上30秒(18-21w),在循环之间在冰上60秒。通过在16,000rcf.下在4℃下离心10分钟将超声处理的裂解物澄清一次。保留输入材料,并且将剩余物与结合cdk7 bethyl a300-405a抗体的磁珠一起在4℃下孵育过夜,以富集由cdk7结合的dna片段。将珠用以下缓冲液中的每一种洗涤两次:洗涤缓冲液a(50mm hepes-koh ph 7.5、140mm nacl、1mm edta ph 8.0、0.1%na-脱氧胆酸盐、1%triton x-100、0.1%sds);洗涤缓冲液b(50mm hepes-koh ph 7.9、500mm nacl、1mm edta ph 8.0、0.1%na-脱氧胆酸盐、1%triton x-100、0.1%sds);洗涤缓冲液c(20mm tris-hcl ph8.0、250mm licl、1mm edta ph 8.0、0.5%na-脱氧胆酸盐、0.5%igepal c-630、0.1%sds);洗涤缓冲液d(含有0.2%triton x-100的te)和te缓冲液。通过在洗脱缓冲液(50mm tris-hcl ph 8.0、10mm edta、1%sds)中伴随间歇涡旋在65℃下孵育1小时从珠上洗脱dna。交联在65℃下逆转过夜。为了纯化洗脱的dna,添加200ml te,并且然后通过添加2.5ml的33mg/ml rnase a
(sigma,r4642)并在37℃下孵育2小时来降解rna。通过添加10ml的20mg/ml蛋白酶k(invitrogen,25530049)并在55℃下孵育2小时来降解蛋白质。进行苯酚:氯仿:异戊醇萃取,随后进行乙醇沉淀。然后将dna重悬于50ml te中并用于测序。根据试剂盒说明书,用swift biosciences accel-ngs 2s plus dna文库试剂盒制备chip文库。在文库制备后,将chip文库在具有200-600个碱基的尺寸-收集窗口的pippinht上的2%凝胶上运行。用来自roche的kapa文库定量试剂盒通过qpcr定量最终文库,并在illumina hiseq 2500上以单读模式测序40个碱基。
[0407]
将hct116细胞在完全dmem培养基中生长至80%融合,随后用jq1或dmso处理24小时,然后进行细胞透化(在培养基中以1:1000用tx100在pbs中的溶液在37℃下细胞透化10分钟),随后用dmf或顺铂处理6小时。使用在pbs中的1%甲醛使细胞交联15分钟,随后在冰上用终浓度为125mm的甘氨酸淬灭。将细胞用冷pbs洗涤并通过刮下在冷pbs中的细胞来收获。将收集的细胞在4℃下以1000g沉淀3分钟,在液氮中快速冷冻并储存在80℃下。所有缓冲液都含有新鲜制备的完全蛋白酶抑制剂(roche,11873580001)。将冷冻的交联细胞在冰上解冻,并且然后再悬于裂解缓冲液i(50mm hepes-koh(ph 7.5)、140mm nacl、1mm edta、10%甘油、0.5%np-40、0.25%triton x-100、蛋白酶抑制剂)中,并在4℃下旋转10分钟,然后在1350rcf.下在4℃下旋转5分钟。将沉淀重悬于裂解缓冲液ii(10mm tris-hcl(ph 8.0)、200mm nacl、1mm edta、0.5mm egta、蛋白酶抑制剂)中并且在4℃下旋转10分钟并以1350rcf.在4℃下旋转5分钟。将沉淀重悬于超声处理缓冲液(20mm hepes ph 7.5、140mm nacl、1mm edta 1mm egta、1%triton x-100、0.1%na-脱氧胆酸盐、0.1%sds、蛋白酶抑制剂)中,并且然后在misonix 3000超声波仪上超声处理10个循环,每个循环在冰上30秒(18-21w),在循环之间在冰上60秒。通过在16,000rcf.下在4℃下离心10分钟将超声处理的裂解物澄清一次。保留输入材料,并且将剩余物与结合med1抗体(bethyl a300-793a)的磁珠一起在4℃下孵育过夜,以富集由med1结合的dna片段。将珠用以下缓冲液中的每一种洗涤:用超声处理缓冲液((20mm hepes ph 7.5、140mm nacl、1mm edta 1mm egta、1%triton x-100、0.1%na-脱氧胆酸盐、0.1%sds)洗涤两次,用含有高盐的超声处理缓冲液(20mm hepes ph 7.5、500mm nacl、1mm edta 1mm egta、1%triton x-100、0.1%na-脱氧胆酸盐、0.1%sds)洗涤一次,用licl洗涤缓冲液(20mm tris ph 8.0、1mm edta、250mm licl、0.5%np-40、0.5%na-脱氧胆酸钠)洗涤一次,并且用te缓冲液洗涤一次。通过在洗脱缓冲液(50mm tris-hcl ph 8.0、10mm edta、1%sds)中伴随搅拌在65℃下孵育15分钟从珠上洗脱dna。交联在65℃下逆转12小时。为了纯化洗脱的dna,添加200ml te,并且然后通过添加2.5ml的33mg/ml rnase a(sigma,r4642)并在37℃下孵育2小时来降解rna。通过添加4ul的20mg/ml蛋白酶k(invitrogen,25530049)并在55℃下孵育30分钟来降解蛋白质。使用qiagen pcr纯化试剂盒纯化dna,在30μl缓冲液eb中洗脱,并且用于测序。根据试剂盒说明书,用swift biosciences accel-ngs 2s plus dna文库试剂盒制备chip文库。在文库制备后,将chip文库在具有200-400个碱基的尺寸-收集窗口的pippinht上的2%凝胶上运行。用来自roche的kapa文库定量试剂盒通过qpcr定量最终文库,并在illumina hiseq 2500上以单读模式测序50个碱基。
[0408]
使用参数为
–
k 1
–
m 1
–
best和
–
l设定为读取长度的bowtie将chip-seq数据与小鼠参考基因组的mm9版本进行比对。使用参数为
–w–s–
space=50、
–
nomodel
–
shiftsize=200
的macs创建用于以仓(bin)显示读数覆盖的wiggle文件,并且将每个仓的读数计数归一化为数百万的映射读数用于制作wiggle文件。每百万读数归一化的wiggle文件显示在ucsc基因组浏览器中。对于mcf7细胞中的er、med1、brd4和h3k9me3 chip-seq,使用公开的数据集(分别为geo gse60270、gsm1348516和gsm945857)。
[0409]
cdk8-介体的纯化
[0410]
cdk8-介体样品如所描述的(55)加以修改进行纯化。在亲和纯化之前,通过硫酸铵沉淀(35%)将p0.5m/qft级分聚集至12mg/ml。将沉淀重悬于含有20mm kcl、20mm hepes、0.1mm edta、2mm mgcl2、20%甘油的ph 7.9的缓冲液中,然后在亲和纯化步骤之前用含有0.15mkcl、20mm hepes、0.1mm edta、20%甘油和0.02%np-40的ph 7.9的缓冲液进行透析。如所描述的进行亲和纯化,将洗脱的材料加载到含有2ml 0.15m kcl hemg(20mm hepes、0.1mm edta、2mm mgcl2、10%甘油)的2.2ml离心管中,并在4℃下以50k rpm离心4小时。这用于除去过量的游离gst-srebp并且将cdk8-介体聚集在最终级分中。在液滴测定之前,使用具有ultracel-30膜(millipore mrcf0r030)的microcon-30kda离心过滤单元聚集纯化的cdk8-介体以获得300nm的介体复合物。向液滴测定中添加聚集的cdk8-介体至200nm的最终浓度。液滴反应含有10%peg-8000和125mm盐。
[0411]
使用rna fish的免疫荧光
[0412]
将细胞接种在盖玻片上并生长24小时,随后使用在pbs中的4%多聚甲醛(pfa)(vwr,bt140770)固定10分钟。在pbs中洗涤细胞三次之后,将盖玻片放入加湿室中或在pbs中储存在4℃下。使用在pbs中的0.5%triton x-100(sigma aldrich,x100)进行细胞透化10分钟,随后用pbs洗涤三次。用4%无igg的牛血清白蛋白(bsa)(vwr,102643-516)将细胞封闭30分钟,并将第一抗体以1:500的浓度添加到pbs中持续4-16小时。将细胞用pbs洗涤三次,随后以1:5000的浓度与第二抗体一起在pbs中孵育1小时。在用pbs洗涤两次之后,将细胞使用在pbs中的4%多聚甲醛(pfa)(vwr,bt140770)固定10分钟。在用pbs洗涤两次之后,将洗涤缓冲液a(20%stellaris rna fish洗涤缓冲液a(biosearch technologies,inc.,smf-wa1-60)、在无rnase的水(life technologies,am9932)中的10%去离子甲酰胺(emd millipore,s4117)添加到细胞中孵育5分钟。将在杂交缓冲液(90%stellaris rna fish杂交缓冲液(biosearch technologies,smf-hb1-10)和10%去离子甲酰胺中的12.5mm rna探针(stellaris)添加到细胞中,并在37℃下孵育过夜。在37℃下用洗涤缓冲液a洗涤30分钟之后,用20mm/ml hoechst 33258(life technologies,h3569)将细胞核染色5分钟,随后在洗涤缓冲液b(biosearch technologies,smf-wb1-20)中洗涤5分钟。将细胞在水中洗涤一次,随后用vectashield(vwr,101098-042)将盖玻片固定在玻璃载玻片上,最后用指甲油(electron microscopy science nm,72180)密封盖玻片。在rpi spinning disk共聚焦显微镜上用100x物镜使用metamorph获取软件和hammamatsu orca-er ccd照相机(w.m.keck microscopy facility,mit)获取图像。使用fiji is just imagej(fiji)对图像进行后处理。
[0413]
rna fish图像分析
[0414]
为了用免疫荧光分析rna fish,编写自定义python脚本以处理和分析在fish和免疫荧光通道中收集的3d图像数据。使用scipy ndimage软件包自动调用fish焦点。然后使用ndimage find_objects函数调用在3d图像中的连续fish焦点。然后通过各种标准过滤这些
fish焦点,所述标准包括尺寸、最大z投影的圆形度(圆形度==4rr
·
面积周长2;0.7)(圆形度=4π
·
面积周长2;0.7)以及存在于细胞核中(通过细胞核掩蔽确定)。然后将fish焦点集中在3d盒(长度尺寸(l)=3.0μm)中。然后合并每个fish和免疫荧光对的以fish焦点为中心的免疫荧光信号,并计算平均强度投影,从而提供以fish焦点为中心的l
×
l正方形内的免疫荧光信号强度的平均数据。作为对照,对以相同数量的随机选择的细胞核位置为中心的免疫荧光信号进行这种相同的处理。然后使用这些平均强度投影来生成信号强度的2d等值线图。使用matplotlib python软件包生成等值线图。对于等值线图,在颜色的线性范围上自定义所呈现的强度-颜色范围(n=15)。对于fish通道,使用黑色到紫红色。对于免疫荧光通道,使用chroma.js(在线颜色生成器)生成跨越15个仓的颜色,其中关键过渡颜色选为黑色、蓝色-紫色、中蓝色和灰色。这样做是为了确保读者的眼睛能够更容易地检测到信号的反差。所生成的颜色图用于所有免疫荧光图的15个均匀间隔的强度仓。使用相同的色标对以fish为中心或以随机选择的细胞核位置为中心的平均免疫荧光作图,设置成包括来自每个图的最小和最大信号。
[0415]
顺铂处理后进行免疫荧光
[0416]
将hct116细胞以每孔50k细胞接种在24孔板中,在21小时(hct的倍增时间)后产生100k个细胞。使用tx100在培养基中的溶液以0.55pmol/细胞在37℃下使细胞透化12分钟。然后将细胞用500ul培养基洗涤,用500ul在培养基中的50um顺铂处理6小时。在6小时之后,将细胞用室温pbs洗涤一次,并且然后用500ul在pbs中的4%甲醛在室温下固定12分钟。然后将细胞用pbs再洗涤3次。将盖玻片放入加湿室或在pbs中储存在4℃下。使用在pbs中的0.5%triton x-100(sigma aldrich,x100)进行细胞透化10分钟,随后用pbs洗涤三次。用4%无igg的牛血清白蛋白(bsa)(vwr,102643-516)将细胞封闭30分钟,并将第一抗体以1:500的浓度添加到pbs中持续4-16小时。将细胞用pbs洗涤三次,随后以1:5000的浓度与第二抗体一起在pbs中孵育1小时。将样品在pbs中洗涤,使用20μm/ml hoechst 33258(life technologies,h3569)将dna染色5分钟并使用vectashield(vwr,101098-042)进行固定。在rpi spinning disk共聚焦显微镜上用100x物镜使用metamorph获取软件和hammamatsu orca-er ccd照相机(w.m.keck microscopy facility,mit)获取图像。使用fiji is just imagej(fiji)对图像进行后处理。
[0417]
顺铂/凝聚物共同if
[0418]
为了分析共免疫荧光数据,编写自定义python脚本以处理和分析来自if和dapi通道的3d图像数据。使用三角阈值法检测细胞核,并对if通道应用细胞核掩蔽。将手动最小阈值应用于488通道以确定感兴趣的蛋白质(med1、hp1a或fib1)的细胞核斑点。将三角阈值法应用于561通道以确定顺铂的细胞核斑点。通过将与感兴趣的蛋白质斑点重叠的确定的细胞核顺铂斑点的数目除以细胞核顺铂斑点的总数来计算顺铂重叠的百分比。
[0419]
顺铂-seq分析
[0420]
从www.ncbi.nlm.nih.gov/sra/srx1962532[accn](测序运行id srr3933212)(41)下载rep1 24小时处理的细胞的顺铂-seq fastq文件。使用bowtie2将读数与构建的人类基因组hg19(grch37)比对以获得比对的.bam文件(56)。使用rose算法(47,57)将hela细胞中的h3k27ac chip-seq读数用于调用超级增强子。使用通过rose算法输出的超级增强子表格将超级增强子与典型的增强子分开。典型的增强子进一步被它们的h3k27ac信号分解。
最后十分位数的增强子基于h3k27ac进行提取以获得低h3k27ac类别的增强子。将每一类别的增强子(超级增强子、典型增强子和低h3k27ac信号增强子)分解成它们的组分,并且排除与黑名单区域重叠的组分。黑名单区域从encode文件www.encodeproject.org/files/encff001tdo/下载。然后将每个增强子组分在任一端延伸2kb。使用bamtogff.py脚本将24小时处理的顺铂-seq读数映射到三个类别的2kb延伸增强子中的每一种上。对于每个类别的增强子,将组分区域和侧翼区分别分成50个大小相等的仓,并且对每个仓中的读数进行计数。使用所有增强子组分和侧翼区中的每个仓的平均读数计数来产生荟萃图(meta-plot)。
[0421]
顺铂处理后进行活细胞成像
[0422]
将具有指定gfp敲入的hct116细胞以每孔35k接种于玻璃底8孔室载玻片上。在37℃下孵育过夜后,将细胞用在dmem或dmso的1:1000稀释液中的50um顺铂处理12小时。在成像之前,将细胞另外用hoechst 33342的1:5000稀释液处理以染色dna,并且用2um碘化丙啶处理以染色死细胞。对于hct116细胞中的gfp标记的med1、hp1或fib1的定量数据集,使用andor共聚焦显微镜以100x放大倍数对细胞成像。对于用媒介物或50μm顺铂处理的六个标记的系中的每一个的代表性图像,在37℃下用63x物镜在具有airyscan检测器的zeiss lsm 880共聚焦显微镜上对细胞成像。
[0423]
凝聚物得分分析
[0424]
使用scikit-image、open-cv和scipy-ndimagepython软件包,通过自定义python脚本从处理的细胞的图像中分割细胞核。通过中值过滤、阈值处理分割细胞核,通过分水岭算法进行分离,并且通过scikit图像标记功能进行标记。对于每个细胞核,如果获得z堆叠,则gfp通道(对应于med1、hp1
ɑ
或fib1)中的荧光信号是最大投影的。然后,从投影的信号生成灰度共生矩阵(glcm),并且计算每个细胞核的来自glcm
‘
相关’纹理属性。使用用于mac的graphpad prism版本8.2.0(www.graphpad.com)对各条件的相关值进行单因子anova,随后进行sidak多重比较检验。最后,为了推导出凝聚得分,从1中减去这些值。
[0425]
hct116 megfp标记细胞系的frap
[0426]
在andor共聚焦显微镜上用488nm激光进行frap。使用100%激光功率在r
漂白
≈1um的范围内进行漂白,并且图像每两秒钟收集一次。使用fiji测量荧光强度。减去背景强度,并报告相对于漂白前时间点的值。对于每个细胞系和条件,在7次重复中对漂白后frap恢复数据取平均值。
[0427]
通过分光光度法和定量相位显微术确定分配
[0428]
推导凝聚物中的药物分配系数的表达式
[0429]
这里,根据易于实验测量的量,简要地推导出客户分子在凝聚相中的分配系数的表达式。考虑由两个共存相(即稀释相和凝聚相)构成的样品,其中体积分数φ稀释相和φ凝聚相=1。如果客户分子(例如药物)也以c总计的平均浓度存在于样品中,则质量守恒要求
[0430]c总计
=c
稀释相
φ
稀释相
c
凝聚相
φ
凝聚相
,
ꢀꢀꢀ
(1)
[0431]
其中c
稀释相
和c
凝聚相
分别是客户在稀释相和凝聚相中的浓度。最后,客户在凝聚相中的分配系数被定义为p=c
凝聚相
/c
稀释相
。根据该定义和相体积分数和为1的要求,eq 1可以写为
[0432]c总计
=c
稀释相
(1-φ
凝聚相
) c
稀释相
pφ
凝聚相
,
ꢀꢀ
(2)
[0433]
其可以被简化和重新整理以产生
[0434][0435]
如在后续的章节中所描述的,从荧光光谱学测量估计的c
总计
/c
稀释相
比率,而φcond
凝聚相
从杠杆规则(m.rubinstein,r.h.colby,polymer phyics(牛津大学出版社(oxford university press),2003)如下进行推断:由s表示支架蛋白(例如med1)的浓度,质量守恒给出s总计=s
稀释相
φ
稀释相
s
凝聚相
φ
凝聚相
,与eq.1类似。再次使用对共存相的体积分数的总和为1的要求,这可以重新整理以产生
[0436][0437]
其中s
总计
和s
稀释相
由280nm处的光学吸光度通过分光光度法测量,并且s
凝聚相
由定量相位显微术使用配备有40x干燥物镜(na=0.90)的相干控制全息显微镜(q-phase,telight(以前为tescan),brno,cz)进行测量。
[0438]
紫外-可见荧光光谱法测量和分析
[0439]
紫外-可见光谱法(tecan spark20m)用于使用eq 5的比尔-朗伯定律估计溶液中的药物的绝对浓度,
[0440]
a=log10(10/i)=εcl
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
(s)
[0441]
其中a是所测量的吸光度(以吸光度单位(au)计),i0是在给定波长处的入射光的强度,i是透射强度,l是通过样品的路径长度,并且c是吸收物质的浓度。对于每种物质和波长,ε是称为摩尔吸光系数或消光系数的常数。该常数是在特定温度和压力下在给定溶剂中的基本分子特性,并且具有1/m*cm的单位。通过使用旋转沉降测定来测量分配的药物。与蛋白质一起添加已知浓度的药物并且保持供液滴形成。在30分钟之后,将混合物以15,000rpm离心10分钟。收集上清液并测量药物的浓度。通过从添加的总已知浓度的药物中减去来计算分配的药物。
[0442]
定量相位显微术测量和分析
[0443]
如下使用配备有40x干燥物镜(na=0.90)的相干控制全息显微镜(q-phase,telight(以前为tescan),brno,cz)进行定量相测量。相分离后立即将样品加载到自定义的温控流动池中,密封并使其在成像之前在重力下沉降。使用石蜡膜条作为间隔物分别用peg化的盖玻片和蓝宝石载玻片作为底表面和顶表面构建流动池。固定到蓝宝石载玻片上的peltier元件能够调节流动池温度,如先前所述(59)。测量期间将温度保持在21.00
±
0.02℃。
[0444]
使用q-phase软件从获取的全息图构建补偿相图像,随后在matlab中使用自定义代码对其进行分析。因为关于从定量相图像计算蛋白质浓度的细节将在别处广泛讨论(mccall等人,即将到来),所以这里将仅给出概念性的概述。简而言之,每个相图像基于强度被空间分段,并且含有每个分段对象的窗口被拟合为该形式的空间函数
[0445][0446]
其中是在像素位置(x,y)处的相强度;λ是照射波长,δn是在med1凝聚物与
周围稀释相之间的折射率差,并且h(x,y|r)是半径r的球体的投影高度。
[0447]
eq.6中的拟合参数是δn和r。假设没有peg分配到凝聚物中,并且将每种过滤的凝聚物中的平均支架浓度计算为
[0448][0449]
这里n0是在不存在支架和peg的情况下缓冲液的折射率,n
稀释相
是稀释相的折射率,并且两者都使用j457数字折射计(rudolph research analytic,hackettstown,nj)在21.00
±
0.01℃下进行测量。从氨基酸组成估计支架蛋白的折射率增量dn/ds(60)。
[0450]
顺铂-dna接合测定
[0451]
通过在10μl反应体积中将10μm蛋白质与含有50mm tris-hcl ph 7.5、100mm nacl、10%peg 8000、10%甘油、1mm dtt和5ng/ul dna的液滴形成缓冲液混合来形成med1-idr-bfp和hp1a-bfp液滴。将液滴反应物在室温下孵育30分钟。接下来,将增加浓度的活化顺铂(0、0.5、0.75、1、1.5和2mm)添加到液滴反应物中,并且在室温下再孵育30分钟。然后将反应物用1μl蛋白酶k(invitrogen,20mg/ml)在55℃下处理4小时。通过在生物分析仪上的尺寸位移使dna的铂化可视化。
[0452]
氨基酸和碱性/酸性斑块分析
[0453]
如先前所述(61),通过鉴定带电相互作用元件(cie)来确定碱性和酸性斑块。对于每种蛋白质,使用本地cider软件,使用5个氨基酸的滑动窗口和1个氨基酸的步长来计算沿着蛋白质序列的每个残基的净电荷(ncpr)(62)。ncpr《-0.35的4个或更多个氨基酸的延伸段被鉴定为酸性斑块(cie-),而ncpr》 0.35的4个或更多个氨基酸的延伸段被鉴定为碱性斑块(cie )。计数在总蛋白质和特别是idr内的酸性和碱性斑块的数目。单独地,还计数在全部蛋白质和idr内的芳香族残基的数目。
[0454]
细胞存活测定
[0455]
将hct116细胞以每孔50k细胞接种在24孔板中,在21小时(hct的倍增时间)后产生100k个细胞。然后将细胞在dmem培养基中用50μm顺铂或dmf处理12小时。在12小时时,将celltiter-glo试剂添加到每个孔中,随后进行celltiter-glo发光活力测定。然后测量发光,对于每个条件将5个孔进行平均。
[0456]
计算机建模
[0457]
开发了在凝聚物的存在下的药物-靶相互作用的简化模型。相关物质是药物(d)、靶标(t)和药物-靶标复合物(d-t)。假定仅存在2种类型的相,即本体/稀释核相(n)和凝聚物相(c),其以体积分数f=v
凝聚物
/v
细胞核
存在。在平衡时,遵循以下分配条件:
[0458][0459]
其中pd、p
t
是药物和靶标的分配系数。[d]c代表物质d在凝聚物相中的浓度(并且类似地对于其它组分/相)。在此模型中,药物和靶标复合物具有kd的独立于相的解离常数。
[0460]
[0461][0462]
为了求解以总水平[d]0、[t]0存在的各种物质的平衡浓度,物质平衡被写为:
[0463]
f([d]c [d-t]c) (1-f)([d]n [d-t]n)=[d]0f([t]c [d-t]c) (1-f)([t]n [d-t]n)=[dt]0[0464]
这6个浓度用2个方程和4个约束(2个来自分配,以及2个来自反应平衡)求解。在图61b-d中,结合靶标的级分被定义为:
[0465][0466]
类似的表达用于在核(本体或稀释)相中结合靶标的级分。在绘制对照的情况下,当仅存在1个相(f=0)时绘制绘图级分。
[0467]
mcf7megfp-med1细胞的产生和分析
[0468]
为了产生mcf7 megfp-med1细胞,克隆了含有具有通过10个氨基酸gs接头连接的n末端megfp融合物的全长med1的慢病毒构建体,其含有嘌呤霉素选择标记。在hek293t细胞中产生慢病毒颗粒。将250,000个mcf7细胞接种在6孔板的一个孔中并且添加病毒上清液。48小时后以1ug/ml添加嘌呤霉素持续5天进行选择。
[0469]
对于活细胞frap实验,将内源性地标记的med1-megfp mcf7细胞接种于聚-l-鸟氨酸包被的玻璃底组织培养板上。将20个在50us停留时间处的激光脉冲应用于阵列上,并每1秒在andor显微镜上对恢复成像一次,持续指定的时间段。在fiji中进行定量。从漂白的斑点中的平均信号强度减去仪器背景,然后除以从对照斑点中减去的仪器背景。每秒将这些值绘图,并且计算具有95%置信区间的最佳拟合线。为了观察med1-gfp焦点的融合,使med1-megfp mcf7细胞在无雌激素条件下生长3天,然后接种在玻璃底的板上。在成像前15分钟,将细胞用100nm雌激素处理,并且置于andor共聚焦显微镜上并在150x下成像4分钟。在fiji中对图像进行后处理。在fiji中进行荧光强度计算。
[0470]
化学
[0471]
除非另有说明,否则试剂和溶剂获自商业供应商并且未经进一步纯化即使用。在waters micromass zq仪器上获得质谱。在waters sunfire c18柱(19mm
×
50mm,5μm)上使用在含有0.05%三氟乙酸(tfa)的水中的15-95%甲醇的梯度经22分钟(28分钟运行时间)以20ml/分钟的流速进行制备型hplc。
[0472]
方案1:thz1-tmr的合成
[0473][0474]
试剂和条件:(a)(e)-4-溴丁-2-烯醇基氯化物、三乙胺、dcm,0℃~室温,然后叔-丁基甲基(6-(甲基氨基)己基)氨基甲酸酯,室温~50℃;(b)三氟乙酸、dcm,室温,然后tmr-nhs酯、二异丙基乙基胺、dcm,室温~40℃,叔-丁基e)-(6-((4-((4-((3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)氨基甲酰基)苯基)氨基)-4-氧代丁-2-烯-基)(甲基)氨基)己基)(甲基)氨基甲酸酯(2)。向1(20mg,0.044mmol,根据专利wo2014/63068制备)和三乙胺(29mg,0.27mmol)在0.8ml dcm中的溶液里添加(e)-4-溴丁-2-烯醇基氯化物(0.24ml,0.2m于dcm中)。将溶液搅拌6小时。然后添加在0.4ml dcm中的叔-丁基甲基(6-(甲基氨基)己基)氨基甲酸酯(13mg,0.052mmol)。将混合物温热至50℃并保持过夜。将混合物在真空中浓缩,然后通过制备型hplc纯化以提供中间体2(6mg,19%)。lc/ms(esi)m/z=765(m h) 。(e)-4-((6-((4-((4-((3-((5-氯-4-(1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)氨基甲酰基)苯基)氨基)-4-氧代丁-2-烯-1-基)(甲基)氨基)己基)(甲基)氨基甲酰基)-2-(6-(二甲基氨基)-3-(二甲基亚胺基(iminio))-3h呫吨-9-基)苯甲酸酯(thz1-tmr)。向2(6mg,0.0078mmol)在0.5ml dcm中的溶液里添加0.1ml tfa。将所得的溶液在室温下搅拌1小时,然后在真空中浓缩以获得作为tfa盐的游离胺,将其再次溶解于0.5ml dcm中。向该溶液中依次添加diea(5mg,0.039mmol)和tmr-nhs酯(5mg,0.0094mmol)。将混合物温热至40℃并保持过夜。将混合物在真空中浓缩,然后通过制备型hplc纯化以提供thz1-tmr(2mg,23%)。
lc/ms(esi)m/z=1077(m h) 。
[0475]
方案2:( )-jq1-rox的合成
[0476][0477]
试剂和条件:(a)三氟乙酸、dcm,室温,然后叔-丁基甲基(6-(甲基氨基)己基)氨基甲酸酯、1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸酯、二异丙基乙基胺、dmf,室温;(b)三氟乙酸、dcm,室温,然后rox-nhs酯、二异丙基乙基胺、dcm,室温~40℃叔-丁基(s)-(6-(2-(4-(4-氯苯基)-2,3,9-三甲基-6h-噻吩并[3,2-f][1,2,4]三唑并[4,3-a][1,4]二氮杂卓-6-基)-n甲基乙酰胺基)己基)(甲基)氨基甲酸酯(3)向( )-jq1(25mg,0.055mmol)在2ml dcm中的溶液里添加0.4ml tfa。将所得的溶液在室温下搅拌1小时,然后在真空中浓缩以获得作为tfa盐的游离胺,将其溶解于0.8ml dmf中。向此溶液中依次添加在0.5ml dmf、diea(35mg,0.28mmol)和hatu(24mg,0.064mmol)中的叔-丁基甲基(6-(甲基氨基)己基)氨基甲酸酯(16mg,0.065mmol)。将混合物在室温下搅拌6小时。然后通过制备型hplc纯化以提供中间体3(15mg,43%)。lc/ms(esi)m/z=627(m h) 。
[0478]
( )jq1-rox。向3(15mg,0.024mmol)在2ml dcm中的溶液里添加0.4ml tfa。将所得的溶液在室温下搅拌1小时,然后在真空中浓缩以获得作为tfa盐的游离胺,将其再次溶解于1ml dcm中。向该溶液中依次添加diea(16mg,0.12mmol)和rox-nhs酯(13mg,0.021mmol)。将混合物温热至40℃并保持过夜。将混合物在真空中浓缩,然后通过制备型hplc纯化以提供( )jq1-rox(6mg,28),lc/ms(esi)m/z=1043(m h) 。
[0479]
使用dna fish的免疫荧光
[0480]
使mcf7细胞以每孔50,000个细胞的初始接种密度在24孔板中的聚-l-鸟氨酸包被的盖玻片上在无雌激素的dmem中生长3天。然后将细胞用媒介物、10um雌二醇或10um雌二醇
和5um 4-羟基他莫昔芬处理45分钟。将hct116细胞用1μm jq1处理24小时,然后进行细胞透化(在培养基中以1:1000用tx100在pbs中的溶液在37℃下细胞透化10分钟),随后用dmf或50μm顺铂处理6小时。
[0481]
然后将盖玻片上的细胞固定在4%多聚甲醛中。如上所述进行免疫荧光。在将细胞与第二抗体一起孵育之后,将细胞在室温下在pbs中洗涤三次,每次5分钟,用在pbs中的4%pfa固定10分钟并在pbs中洗涤三次。在室温下将细胞在70%乙醇、85%乙醇以及然后100%乙醇中孵育1分钟。通过将7μl的fish杂交缓冲液(agilent g9400a)、1μl的fish探针(surefish 8q24.21 myc 294kb g101211r-8)和2μl水混合来制备探针杂交混合物。
[0482]
将5μl混合物添加到载玻片上并将盖玻片置于顶部(细胞侧朝向杂交混合物)。使用橡胶胶水密封盖玻片。一旦橡胶胶水固化,将基因组dna和探针在78℃下变性5分钟,并将载玻片在16℃下在黑暗中孵育过夜。从载玻片上取下盖玻片,并在预热的洗涤缓冲液1(agilent,g9401a)中于73℃下孵育2分钟并在洗涤缓冲液2(agilent,g9402a)中于室温下孵育1分钟。将载玻片风干并将细胞核在pbs中的20μm/ml hoechst 33258(life technologies,h3569)中在室温下染色5分钟。将盖玻片在pbs中洗涤三次,随后将盖玻片固定到玻璃载玻片上,密封,成像,并如上所述进行后处理。
[0483]
rt-qpcr
[0484]
使mcf7细胞丧失雌激素3天,然后用10nm雌激素或10nm雌激素和5um 4-羟基他莫昔芬刺激24小时。通过allprep试剂盒(qiagen80204)分离rna,随后使用高容量cdna逆转录试剂盒(applies biosystems 4368814)进行cdna合成。使用power sybr green混合物(life technologies#4367659)在quantstudio 6system(life technologies)上以生物学和技术一式三份进行qpcr。在qpcr中使用以下寡核苷酸;myc fwd aacctcacaaccttggctga,myc rev ttcttttatgcccaaagtccaa,gapdh fwd tgcaccaccaactgcttagc,gapdh rev ggcatggactgtggtcatgag。计算倍数变化并且将myc表达值归一化为gapdh表达。
[0485]
lac结合测定
[0486]
通过neb hifi克隆到含有驱动mcherry-laci融合蛋白表达的sv40启动子的psv2哺乳动物表达载体中来组装构建体。med1、hp1α的固有无序区或esr1的活化结构域通过c末端与该重组蛋白融合,通过接头序列gapgsagsaaggsg(seq id no:16)连接。对于比较在阵列上的fltx1富集的实验,将u2os-lac细胞接种在带隔室的盖玻片(1.5硼硅酸盐玻璃,nunc lab-tek,155409)上并且用med1 idr或hp1α构建体与阳离子脂质体3000(thermofisher l3000015)进行转染。在24小时之后,用1um fltx1或媒介物(dmf)处理细胞。在30分钟之后,将细胞在37℃下在具有63x物镜的具有airyscan检测器的zeiss lsm 880共聚焦显微镜上成像。对于高med1的实验,将生长在dmem中的细胞接种在玻璃盖玻片上并且使用阳离子脂质体3000(thermofisher l3000015)进行转染。在高med1条件下共转染具有含有驱动与gfp融合的med1表达的pgk启动子的哺乳动物表达载体的构建体。转染后24小时,用在dmso中复原的4-羟基他莫昔芬(sigma-aldrich h7904)处理细胞45分钟。处理后,固定细胞并且如上所述用med1抗体进行免疫荧光。然后使用具有100x物镜的rpi spinning disk共聚焦显微镜对细胞成像。
[0487]
为了分析比较栓系的med1或hp1α的lac阵列数据,使用在lac阵列中的信号(561通道)调用感兴趣的区域。然后在感兴趣的区域中测量fltx1(488通道)的平均荧光信号并除
membraneless organelles.mol.cell.57,936
–
947(2015)。
[0499]
9.t.j.nott,t.d.craggs,a.j.baldwin,membraneless organelles can melt nucleic acid duplexes and act as biomolecular filters.nat.chem.8,569
–
575(2016)。
[0500]
10.b.r.sabari,a.dall’agnese,a.boija,i.a.klein,e.l.coffey,k.shrinivas,b.j.abraham,n.m.hannett,a.v.zamudio,j.c.manteiga,c.h.li,y.e.guo,d.s.day,j.schuijers,e.vasile,s.malik,d.hnisz,i.l.tong,i.i.cisse,r.g.roeder,p.a.sharp,a.k.chakraborty,r.a.young,a.dall’agnese,a.boija,i.a.klein,e.l.coffey,k.shrinivas,b.j.abraham,n.m.hannett,a.v.zamudio,j.c.manteiga,c.h.li,y.e.guo,d.s.day,j.schuijers,e.vasile,s.malik,d.hnisz,t.i.lee,i.i.cisse,r.g.roeder,p.a.sharp,a.k.chakraborty,r.a.young,coactivator condensation at super-enhancers links phase separation and gene control.science(80-.).361,eaar3958(2018)。
[0501]
11.y.e.guo,j.c.manteiga,j.e.henninger,b.r.sabari,a.dall’agnese,n.m.hannett,j.-h.spille,l.k.afeyan,a.v.zamudio,k.shrinivas,b.j.abraham,a.boija,t.-m.decker,j.k.rimel,c.b.fant,t.i.lee,i.i.cisse,p.a.sharp,d.j.taatjes,r.a.young,pol ii phosphorylation regulates a switch between transcriptional and splicing condensates.nature.572,543
–
548(2019)。
[0502]
12.a.boija,i.a.klein,b.r.sabari,a.dall’agnese,e.l.coffey,a.v.zamudio,c.h.li,k.shrinivas,j.c.manteiga,n.m.hannett,b.j.abraham,l.k.afeyan,y.e.guo,j.k.rimel,c.b.fant,j.schuijers,t.i.lee,d.j.taatjes,r.a.young,transcription factors activate genes through the phase-separation capacity of their activation domains.cell.175,1842-1855.e16(2018)。
[0503]
13.j.j.bouchard,j.h.otero,d.c.scott,e.szulc,e.w.martin,n.sabri,d.granata,m.r.marzahn,k.lindorff-larsen,x.salvatella,b.a.schulman,t.mittag,cancer mutations of the tumor suppressor spop disrupt the formation of active,phase-separated compartments.mol.cell.72,19-36.e8(2018)。
[0504]
14.k.shrinivas,b.r.sabari,e.l.coffey,i.a.klein,a.boija,a.v zamudio,j.schuijers,n.m.hannett,p.a.sharp,r.a.young,a.k.chakraborty,enhancer features that drive formation of transcriptional condensates.mol.cell.75,549-561.e7(2019)。
[0505]
15.e.p.bentley,b.b.frey,a.a.deniz,physical chemistry of cellular liquid-phase separation.chemistry.25,5600
–
5610(2019)。
[0506]
16.m.boehning,c.dugast-darzacq,m.rankovic,a.s.hansen,t.yu,h.marie-nelly,d.t.mcswiggen,g.kokic,g.m.dailey,p.cramer,x.darzacq,m.zweckstetter,rna polymerase ii clustering through carboxy-terminal domain phase separation.nat.struct.mol.biol.25,833
–
840(2018)。
[0507]
17.p.cramer,organization and regulation of gene transcription.nature.573,45
–
54(2019)。
breast cancer shows sensitivity to fulvestrant treatment and cross-resistance between letrozole and exemestane.int.j.oncol.46,1481
–
1490(2015)。
[0544]
54.l.zhang,j.c.er,h.jiang,x.li,z.luo,t.ramezani,y.feng,m.k.tang,y.t.chang,m.vendrell,a highly selective fluorogenic probe for the detection and:in vivo imaging of cu/zn superoxide dismutase.chem.commun.52,9093
–
9096(2016)。
[0545]
55.k.d.meyer,a.j.donner,m.t.knuesel,a.g.york,j.m.espinosa,and d.j.taatjes,cooperative activity of cdk8 and gcn5l within mediator directs tandem phosphoacetylation of histone h3.embo j.27,1447
–
57(2008)。
[0546]
56.b.langmead,s.l.salzberg,fast gapped-read alignment with bowtie 2.nat.methods.9,357
–
359(2012)。
[0547]
57.w.a.whyte,s.bilodeau,d.a.orlando,h.a.hoke,g.m.frampton,c.t.foster,s.m.cowley,r.a.young,enhancer decommissioning by lsd1 during embryonic stem cell differentiation.nature.482,221
–
225(2012)。
[0548]
58.m.rubinstein,r.h.colby,polymer phyics(oxford university press,2003)。
[0549]
59.m.mittasch,p.gross,m.nestler,a.w.fritsch,c.iserman,m.kar,m.munder,a.voigt,s.alberti,s.w.grill,m.kreysing,non-invasive perturbations of intracellular flow reveal physical principles of cell organization.nat.cell biol.20,344
–
351(2018)。
[0550]
60.h.zhao,p.h.brown,p.schuck,on the distribution of protein refractive index increments.biophys.j.100,2309
–
2317(2011)。
[0551]
61.c.w.pak,m.kosno,a.s.holehouse,s.b.padrick,a.mittal,r.ali,a.a.yunus,d.r.liu,r.v pappu,m.k.rosen,sequence determinants of intracellular phase separation by complex coacervation of a disordered protein.mol.cell.63,72
–
85(2016)。
[0552]
62.a.s.holehouse,r.k.das,j.n.ahad,m.o.g.richardson,r.v pappu,cider:resources to analyze sequence-ensemble relationships of intrinsically disordered proteins.biophys.j.112,16
–
21(2017)。
[0553]
63.m.-t.wei,s.elbaum-garfinkle,a.s.holehouse,c.chih-hsiung chen,m.feric,c.b.arnold,r.d.priestley,r.v pappu,c.p.brangwynne,phase behaviour of disordered proteins underlying low density and high permeability of liquid organelles.nature.com(2017),doi:10.1038/nchem.2803。
[0554]
64.r.delage-mourroux,p.g.v.martini,i.choi,d.m.kraichely,j.hoeksema,b.s.katzenellenbogen,analysis of estrogen receptor interaction with a repressor of estrogen receptor activity(rea)and the regulation of estrogen receptor transcriptional activity by rea.j.biol.chem.275,35848
–
35856(2000)。
[0555]
65.broad institute cancer cell line encyclopedia(ccle),(可在https://portals.broadinstitute.org/ccle上获取)。
[0556]
66.cbioportal for cancer genomics,(可在https://www.cbioportal.org/上获取)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。