1.本发明涉及食品工程领域,具体为一种紫薯降血糖多肽微胶囊化产品及其制备方法和应用。
背景技术:
2.紫薯又叫黑薯,薯肉呈紫色至深紫色。紫薯的营养丰富且具有多重特殊保健功能。
3.研究发现,紫薯富含花青素、淀粉、蛋白质、可食性纤维、维生素、微量元素、可溶性无氧化物质等多种营养成分,经常食用则具有减肥、健美和健身防癌等作用。
4.虽然紫薯具有很多生物学功能,但主要用于提取花青素和淀粉,但对于紫薯蛋白的提取制备、加工、应用等目前尚无成熟技术。同时,在对提取的花青素和淀粉等成分进行利用时,均是直接将其与其他组分混合,由此导致最终产品易吸潮、稳定性差,由此降低其功效。
技术实现要素:
5.针对现有技术的不足,本发明提供了一种紫薯降血糖多肽微胶囊化产品及其制备方法和应用,其通过对紫薯降血糖多肽进行微胶囊化来提高产品的稳定性,使其能持久发挥降血糖功效。
6.为解决上述技术问题,本发明提供的技术方案如下:
7.提供了一种紫薯降血糖多肽微胶囊化产品,所述紫薯降血糖多肽微胶囊化产品由壁材溶液与芯材按照质量比(10-20):1混合而成;
8.其中,按重量计,所述壁材溶液包括:2-3份的明胶/阿拉伯胶、2-4份的β-环糊精、6-8份的紫薯可溶性膳食纤维以及70-80份的蒸馏水;
9.所述芯材包括6-12份紫薯降血糖多肽、3-6份乳酸菌、1-2份α-葡萄糖苷酶抑制剂。
10.还提供一种紫薯降血糖多肽微胶囊的生产方法,其包括如下步骤:
11.s1、制备紫薯可溶性膳食纤维;
12.s2、制备紫薯降血糖多肽;
13.s3、取上述重量份的明胶/阿拉伯胶、β-环糊精、紫薯可溶性膳食纤维,全部加入上述重量份的蒸馏水中,300r/min条件下磁力搅拌至完全溶解,以获得均匀的壁材溶液;
14.s4、取上述重量份的紫薯降血糖多肽、乳酸菌以及葡萄糖苷酶抑制剂,混合,以获得芯材;将芯材边搅拌边加入壁材溶液,且壁材溶液与芯材的质量比(10-20):1,以得到混合体系;
15.以及s5对所述混合体系进行高速剪切,待芯材完全溶解于壁材溶液中后进行真空冷冻干燥或喷雾干燥,对干燥所得固体进行研磨,以得到所述紫薯降血糖多肽微胶囊化产品。
16.优选的,所述步骤s5中,所述高速剪切条件为:剪切速度10000r/min,时间5min;
17.优选的,步骤s1中,所述紫薯可溶性膳食纤维的制备过程包括:
18.s11、挑选无损伤、无腐烂的新鲜紫薯洗净,去皮后切块,加入紫薯10倍重量的蒸馏水打浆,然后用盐酸调节ph至4.0-6.0,以得到紫薯浆液;
19.s12、对所述紫薯浆液进行高压脉冲电场处理,然后再进行高压均质处理,再用80目以上的纱布进行过滤,得到滤液和薯渣;且将所述滤液静置,以得到上清液和沉淀物,对沉淀物进行水洗、干燥,以得到紫薯淀粉;
20.s13、在所述薯渣中按其3倍重量加入蒸馏水,并加入α-淀粉酶,在ph6.0、温度85℃条件下水解0.5-1.5h,所述α-淀粉酶添加量为6-10u/g;经α-淀粉酶酶解后,对酶解体系进行酶灭活以及冷却,再加入中性蛋白酶水解,在ph7.0、温度45℃条件下水解1-2h,所述中性蛋白酶的添加量为5-15u/g;
21.s14、酶解完成后,对酶解体系进行漂洗、过滤,对过滤所得固体残留物进行干燥、粉碎。再对固体进行挤压膨化和超微粉碎处理,以得到紫薯膳食纤维原料;向所述紫薯膳食纤维原料中加入3倍重量的蒸馏水,调节ph至11-12,40℃条件下超声逆流提取60min后过滤,对滤液进行浓缩,以得到浓缩液;再向所述浓缩液中加入4倍体积的体积分数95%的乙醇,在4℃下沉淀12h,于8000r/min条件下离心10min,收集沉淀,再用体积分数95%的乙醇洗涤3次,经真空干燥即得所述紫薯可溶性膳食纤维。
22.优选的,步骤s12中,所述高压脉冲电场强度为20-40kv
·
cm-1
,且作用在紫薯浆液上的时间为4.5μs;所述高压均质压力为50-100mpa,均质时间为30min。
23.优选的,步骤s2中,所述紫薯降血糖多肽的制备过程包括:
24.s21、制备紫薯蛋白复合物;
25.s22、称取所述紫薯蛋白复合物,加入蒸馏水,配制得到底物浓度为0.01g/ml的酶解体系,添加木瓜蛋白酶,在ph7.0,温度50℃条件下酶解0.5-1.5h,所述木瓜蛋白酶添加量为4000-6000u/g;经木瓜蛋白酶酶解后,对酶解体系进行酶灭活以及冷却,再加入碱性蛋白酶,在ph 8.0,温度60℃条件下酶解4-6h,所述碱性蛋白酶添加量为5000-7000u/g;
26.s23、将完成步骤s20后所获得的酶解体系过经甲醇活化后的sep-pak柱进行脱盐,然后用蒸馏水进行洗脱,洗脱得到的溶液在35-40℃下减压浓缩,对收集到的浓缩液进行冻干,以获得冻干样品;
27.s24、将冻干样品用蒸馏水配制成质量分数5%的样品溶液,置于超滤离心管中,于4℃、3000-5000r/min条件下离心30-60min,分离得到分子量≤3kda的组分;
28.以及s25、将分子量≤3kda的组分进行凝胶色谱分离;收集洗脱液,得到2个不同的洗脱峰,并对洗脱峰所对应的组分进行鉴定,以确定出其中具有降血糖功效的组分,然后将具有降血糖功效的组分冻干成粉,即获得所述紫薯降血糖多肽。
29.优选的,所述步骤s21包括:
30.s211、步骤s12中获得的的上清液在3000-5000r/min条件下离心20-30min,得第一上清液以及第一沉淀;第一上清液中添加硫酸铵至饱和度35%,在4℃下搅拌0.5-1h后,在3000-5000r/min条件下离心20-30min,得到第二沉淀以及第二上清液;取第二上清液,添加硫酸铵至饱和度60%,在4℃下搅拌1-1.5h后,在4000-5000r/min条件下离心15-25min,得到第三沉淀以及第三上清液;取第三上清液,添加硫酸铵至饱和度90%,在4℃下搅拌1-1.5h后,经4000-6000r/min离心10-20min,得到第四沉淀以及第四上清液;
31.s212、合并第二沉淀、第三沉淀以及第四沉淀,干燥后得到第一紫薯蛋白提取物;
32.s213、合并第一上清液、第二上清液、第三上清液以及第四上清液,使用大孔树脂对合并后的上清液进行吸附-解析,上柱流速为3-5bv/h,透过液冷冻干燥得到第二紫薯蛋白提取物;
33.s214、合并第一紫薯蛋白提取物以及第二紫薯蛋白提取物,以得到所述紫薯蛋白复合物。
34.优选的,步骤s212包括:合并第二沉淀第三沉淀以及第四沉淀,然后进行透析/纳滤膜脱盐,直至透过液的电阻率为8-10μs/cm;然后干燥后得到第一紫薯蛋白提取物。
35.还提供一种上述紫薯降血糖多肽微胶囊化产品在制备降血糖食品/药品/保健品中的应用。
36.本发明结合酶解、高压脉冲电场以及高压均质对紫薯原料进行处理,进一步通过在不同阶段添加不同量的硫酸铵,以多级盐析的方式充分沉淀紫薯蛋白质,以大幅提高紫薯蛋白的提取效率和质量,进一步再对紫薯蛋白复合物进行酶解和分离,以获得具有降血糖功效的多肽,使其可作为天然降血糖物质应用于降低机体血糖,防治糖尿病。进一步再与其他降血糖功效成分复配,使用紫薯可溶性纤维、β-环糊精等壁材,对紫薯降血糖多肽进行微胶囊化处理,即可以充分利用紫薯资源,又能提高产品的稳定性,使其持久发挥降血糖功效。
附图说明
37.图1为本发明紫薯蛋白多酚复合物酶解及降血糖多肽的制备方法流程图;
38.图2为紫薯蛋白多酚复合物经sds-page电泳后的结果图;
39.图3为组分1、组分3、组分3对hepg2细胞葡萄糖消耗的影响;
40.图4为本发明组分1不同洗脱峰的结果图;
41.图5为组分1中峰1组分和峰2组分hepg2细胞葡萄糖消耗的影响。
42.图6为峰1组分中不同氨基酸的占比结果;
43.图7为峰1组分中疏水性氨基酸与非疏水性氨基酸的占比结果;
44.图8为本发明紫薯降血糖多肽微胶囊产品对小鼠空腹血糖的影响;
45.图9为本发明紫薯降血糖多肽微胶囊产品对小鼠葡萄糖耐受性的影响。
具体实施方式
46.下面将结合本发明实施例对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
47.实施例1:
48.本实施例提供了一种紫薯降血糖多肽微胶囊化产品,其由壁材溶液与芯材按照质量比(10-20):1(优选为15:1)混合而成;其中,按重量计,所述壁材溶液包括:3份的明胶或阿拉伯胶、3份的β-环糊精、6份的紫薯可溶性膳食纤维以及80份的蒸馏水;
49.所述芯材包括4份紫薯降血糖多肽、3份乳酸菌、1份α-葡萄糖苷酶抑制剂。
50.具体的,所述紫薯可溶性膳食纤维的制备过程包括:
51.s1、挑选无损伤、无腐烂的新鲜紫薯洗净,去皮后切块,加入紫薯10倍重量的蒸馏水打浆,纱布过滤去除杂质,然后用盐酸调节ph至4.0-6.0,以得到紫薯浆液;由此可先通过酸环境破坏细胞壁、细胞膜等结构,增加细胞壁、细胞膜透性,使细胞内容物(如蛋白质、多肽等)充分释放,进一步有利于后续通过酶解方式提高活性成分质量和产量;
52.s2、对所述紫薯浆液进行高压脉冲电场处理,然后再进行高压均质处理,再用80目以上的纱布进行过滤,得到滤液和薯渣;且将所述滤液静置,以得到上清液和沉淀物,对沉淀物进行水洗、干燥,以得到紫薯淀粉;所述高压脉冲电场强度为20-40kv
·
cm-1
(优选为20-40kv
·
cm-1
),且作用在紫薯浆液上的时间为4.5μs;所述高压均质压力为50-100mpa(优选为80mpa),均质时间为30min;
53.s3、在所述薯渣中加入α-淀粉酶,在ph6.0、温度85℃条件下水解0.5-1.5h(优选为1.0h),所述α-淀粉酶添加量为6-10u/g(优选为8u/g);经α-淀粉酶酶解后,对酶解体系进行酶灭活以及冷却,再加入中性蛋白酶水解,在ph7.0、温度45℃条件下水解1-2h(优选为1.5h),所述中性蛋白酶的添加量为5-15u/g(优选为10u/g);本实施例中,所述u/g指每g样品中添加的酶的酶活数量,如6-10u/g代表每g薯渣中添加的α-淀粉酶的酶活数量是6-10u;
54.完成酶解后,对酶解体系进行漂洗、过滤,对过滤所得固体残留物进行挤压膨化和超微粉碎处理,以得到紫薯膳食纤维原料;再在所述紫薯膳食纤维原料中加入3倍重量的蒸馏水,调节ph至11-12,40℃条件下超声逆流提取60min后过滤,对滤液进行浓缩,以得到浓缩液;浓缩液加入4倍体积95%乙醇,在4℃下沉淀12h,8000r/min离心10min,收集沉淀,再用95%乙醇洗涤3次,经50℃的真空干燥即得所述紫薯可溶性膳食纤维,由此可使可溶性膳食纤维含量增加,提高以紫薯膳食纤维为原料生产的产品适口性;且挤压膨化温度为150℃-180℃(优选为160℃);超微粉碎处理出粒细度为300-400目(优选为350目)。
55.如图1所示,所述紫薯降血糖多肽的制备过程包括:
56.s21、制备紫薯蛋白复合物;
57.s22、称取所述紫薯多酚复合物,加入蒸馏水,配制得到底物浓度为0.01g/ml的酶解体系,添加木瓜蛋白酶,在ph7.0,温度50℃条件下酶解0.5-1.5h,所述木瓜蛋白酶添加量为4000-6000u/g(优选为5000u/g);经木瓜蛋白酶酶解后,对酶解体系进行酶灭活以及冷却,再加入碱性蛋白酶,在ph 8.0,温度60℃条件下酶解4-6h,所述碱性蛋白酶添加量为5000-7000u/g(优选为6000u/g);
58.s23、将完成步骤s22后所获得的酶解体系过经甲醇活化后的sep-pak柱,以40rpm进行脱盐,然后用蒸馏水进行洗脱,洗脱得到的溶液在35-40℃下减压浓缩,对收集到的浓缩液进行冻干,以获得冻干样品;
59.s24、将冻干样品用蒸馏水配制成质量分数5%的样品溶液,置于超滤离心管中,于4℃、3000-5000r/min(优选为4000r/min)条件下离心30-60min(优选为45min),分离得到分子量≤3kda的组分1、3kda<分子量≤10kda的组分2以及分子量≥10kda的组分3;
60.以及s25、将分子量≤3kda的组分1进行g75凝胶色谱分离;收集洗脱液,洗脱液经过220nm紫外检测,得到2个不同的洗脱峰(如图2所示),并对洗脱峰所对应的组分进行鉴定,以确定出其中具有降血糖功效的组分,然后将具有降血糖功效的组分冻干成粉,即获得所述紫薯降血糖多肽。所述凝胶色谱分离条件为:加样量为1ml,加样浓度为50mg/ml,洗脱流速为2r/min。
61.优选的,所述步骤s21包括:
62.s211、步骤s12中获得的的上清液在3000-5000r/min条件下离心20-30min,得第一上清液以及第一沉淀;第一上清液中添加硫酸铵至饱和度35%,在4℃下搅拌0.5-1h后,在3000-5000r/min条件下离心20-30min,得到第二沉淀以及第二上清液;取第二上清液,添加硫酸铵至饱和度60%,在4℃下搅拌1-1.5h后,在4000-5000r/min条件下离心15-25min,得到第三沉淀以及第三上清液;取第三上清液,添加硫酸铵至饱和度90%,在4℃下搅拌1-1.5h后,经4000-6000r/min离心10-20min,得到第四沉淀以及第四上清液;由于已经预先通过酸溶液破坏细胞壁、细胞膜等结构,细胞内容物(如蛋白质、多肽等)能够充分释放,并将淀粉、膳食纤维等物质除去,进一步采用硫酸铵分级沉淀使其达到不同的饱和度,由此可通过该多级盐析的方式充分沉淀紫薯蛋白质;
63.s212、合并第二沉淀、第三沉淀以及第四沉淀,然后进行透析/纳滤膜脱盐,直至透过液的电阻率为8-10μs/cm,干燥后得到第一紫薯蛋白提取物;纳滤膜脱盐时采用的纳滤膜截留分子量为150-500da,由此可通过透析/纳滤膜充分脱盐,以保证提取蛋白的纯度和质量;
64.s213、合并第一上清液、第二上清液、第三上清液以及第四上清液,使用大孔树脂对合并后的上清液进行吸附-解析,上柱流速为3-5bv/h,透过液冷冻干燥得到第二紫薯蛋白提取物;
65.s214、合并第一紫薯蛋白提取物以及第二紫薯蛋白提取物,以得到所述紫薯蛋白复合物;
66.实施例2:
67.本实施例提供了一种实施例1所述紫薯降血糖多肽微胶囊化产品的生产方法,其包括:
68.s100、制备紫薯可溶性膳食纤维和紫薯降血糖多肽,其制备方法均与实施例1相同;
69.s200、取实施例1中所述重量份的明胶/阿拉伯胶、β-环糊精、紫薯可溶性膳食纤维,全部加入实施例1中所述重量份的蒸馏水中,300r/min条件下磁力搅拌至完全溶解,以获得均匀的壁材溶液;
70.且在35-50℃条件下对所述壁材溶液进行超声处理,超声功率为50-100w,超声处理时间为20min;
71.s300、取实施例1中所述重量份的紫薯降血糖多肽、乳酸菌以及葡萄糖苷酶抑制剂,混合,以获得芯材;在经超声处理后的壁材溶液中,边搅拌边加入芯材,且壁材溶液与芯材的质量比(10-20):1(优选为15:1),以得到混合体系;并对所述混合体系进行高速剪切处理,待芯材完全溶解于壁材溶液中后进行冷冻干燥或喷雾干燥,对干燥所得固体进行研磨,以得到所述紫薯降血糖多肽微胶囊化产品;高速剪切条件优选为:剪切速度10000r/min,时间5min。
72.实施例3:
73.本实施例提供了一种实施例1所述紫薯降血糖多肽微胶囊化产品在制备降血糖食品/药品/保健品中的应用。表1示出了不同提取方法对紫薯多酚紫薯蛋白得率的影响。
74.表1不同提取方法对紫薯多酚紫薯蛋白得率的影响
[0075][0076]
注:表1中常规提取指的是打浆后直接离心处理。
[0077]
从表1中可以看出,本发明中通过先柠檬酸处理,然后酶解完毕后再对所述紫薯浆液进行高压脉冲电场处理 高压均质处理,由此可充分促使细胞内容蛋白的析出,因此本发明的紫薯多酚蛋白复合物得率为2.13%,显著高于单一处理方式,如单一超声处理、单一高压脉冲电场处理所获得的蛋白得率,具体的,高压脉冲电场处理 高压均质处理的蛋白得率较单一高压脉冲电场处理提高了15%,较单一超声波辅助处理提高了39%,较常规方法提高了81%。
[0078]
表2示出了不同硫酸铵浓度对沉淀所得紫薯多酚蛋白复合物的蛋白纯度、占比的影响。
[0079]
表2不同硫酸铵浓度对紫薯多酚蛋白复合物的蛋白纯度、占比的影响
[0080] 蛋白纯度占比第二沉淀(硫酸铵饱和度35%)49.53
±
0.04%15.77%第三沉淀(硫酸铵饱和度60%)72.23
±
0.07%60.01%第四沉淀(硫酸铵饱和度90%)46.84
±
0.03%24.22%
[0081]
从表2中可以看出,通过在不同阶段添加不同量的硫酸铵,以多级盐析的方式充分沉淀紫薯蛋白质,使得不同阶段沉淀得到的紫薯蛋白均具有较高的纯度和占比,由此使得最终获得的紫薯蛋白提取效率和质量均得以大幅提高。
[0082]
进一步的,本发明合并第一紫薯蛋白提取物以及第二紫薯蛋白提取物后得到的混合物的蛋白含量为62.50
±
0.09%,将本发明得到的紫薯蛋白复合物进行sds-page分析,结果如图2所示。图2中,“1”泳道为紫薯多酚蛋白复合物中的蛋白,其显示有58、22、18和12kda四个染色带,条带清晰且不含杂质。由此说明,本发明通过多级沉淀结合膜分离的方式可有效提取紫薯蛋白,提高紫薯多酚复合物的质量。
[0083]
进一步的,采用triple-tof-ms对最终获得的紫薯蛋白复合物进行测定。利用peaks studio软件在uniport数据库中搜库分析,从紫薯蛋白中共鉴定17种蛋白质,其结果如表3所示。
[0084]
表3紫薯蛋白复合物蛋白鉴定结果
[0085][0086]
由此可发现,本发明最终获得的紫薯蛋白复合物主要包括具有生物活性的酶类和sporamin蛋白,包括sporamin a、sporamin b、β-淀粉酶、preprosporamin、多酚氧化酶、蛋白酶抑制剂、超氧化物歧化酶、紫色酸性磷酸酶、putative phd zinc finger蛋白、nbs-lrr蛋白和果胶乙酰酯酶。由此说明本发明的制备方法可最大限度的保留紫薯蛋白复合物中的各种活性成分,减少制备过程中的损失,有利于其充分发挥其作用功效。
[0087]
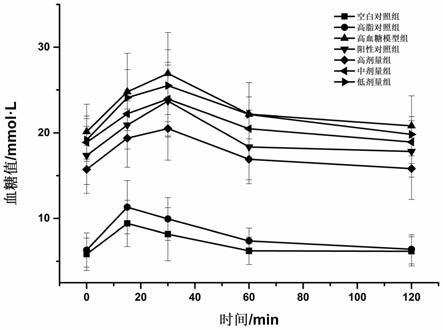
以下为分子量不同的组分1、组分2以及组分3对hepg2细胞葡萄糖消耗影响的功效实验。其具体过程如下。
[0088]
hepg2细胞培养:
[0089]
hepg2细胞经过复苏后,用含有10%新生牛血清的1640培养液转入培养瓶中,置于co2培养箱中培养,温度为37℃,相对湿度为90%,co2浓度为5%。单层贴壁后,每3d进行传代。
[0090]
紫薯蛋白多酚复合物酶解及降血糖多肽(以下为“降糖多肽”)对hepg2细胞葡萄糖消耗量的影响:
[0091]
选对数期增长的细胞进行实验,细胞经过0.25%胰蛋白酶消化后,用含有10%新生牛血清的1640培养液轻轻吹打成细胞悬液,稀释计数后,按每孔100ml含有104个细胞接种于96孔板中进行培养。待细胞贴壁后,设置正常对照组,模型组和给药组(二甲双胍组、组分1组、组分2组和组分3组),正常对照组每组加入100ml的无血清1640培养液,模型组及给药组加入100ml含有10-7
mmol/l浓度的胰岛素的无血清1640培养液,培养24h后,弃去培养基,正常对照组和模型组加入100ml无血清1640培养液,给药组分别加入100ml含药的无血清1640培养液(含药浓度为1mg/ml,0.5mg/ml,0.1mg/ml,0.05mg/ml,0.01mg/ml),继续培养24h,培养结束后,更换培养基,继续培养18h后,测定每孔培养液中的葡萄糖含量,计算葡萄糖消耗量。其结果如图3所示。
[0092]
胰岛素在机体糖代谢功能中起着重要作用,能够调控糖代谢相关酶的基因表达,低浓度的胰岛素可以起到细胞促进因子的作用,增加细胞中葡萄糖的消耗;胰岛素达到一定浓度后,会导致细胞对其敏感性降低,从而使细胞对葡萄糖的摄取与利用的能力降低。如图3所示,胰岛素建模组与正常对照组相比,细胞的葡萄糖消耗量降低,说明胰岛素抵抗模
型建立成功。进行对应的给药后,三个组分的不同浓度的对于细胞葡萄糖消耗量的影响差距较大。三个组分均在浓度为0.1mg/ml时,hepg2细胞对葡萄糖的消耗量最大,且组分1组的葡萄糖消耗量明显要高于其他两组,可达12.18%,这说明组分1对细胞葡萄糖消耗量的影响效果要优于其他两个组分,具有良好的降血糖功效。同时,三个组分都没有明显的剂量依赖性,浓度高于或低于0.1mg/ml,hepg2细胞对葡萄糖的消耗量均呈下降趋势。
[0093]
由上述实验可知,组分1降血糖功效较好,对其进行凝胶色谱分离,结果如图4所示。由图4可知,组分1经过凝胶色谱分离后,于220nm紫外检测得到两个洗脱峰,分别为峰1和峰2。
[0094]
以下为组分1中峰1和峰2对应组分对hepg2细胞葡萄糖消耗影响的功效实验。其具体过程如下:
[0095]
选对数期增长的细胞进行实验,细胞经过0.25%胰蛋白酶消化后,用含有10%新生牛血清的1640培养液轻轻吹打成细胞悬液,稀释计数后,按每孔100l含有104个细胞接种于96孔板中进行培养。待细胞贴壁后,设置正常对照组,模型组和给药组(二甲双胍组、峰1组和峰2组),正常对照组每组加入100l的无血清1640培养液,模型组及给药组加入100l含有胰岛素的无血清1640培养液,培养24h后,弃去培养基,正常对照组和模型组加入100l无血清1640培养液,给药组分别加入100l含药的无血清1640培养液(含药浓度为1mg/ml,0.5mg/ml,0.1mg/ml,0.05mg/ml,0.01mg/ml,继续培养24h,培养结束后,更换培养基,继续培养18h后,测定每孔培养液中的葡萄糖含量,计算葡萄糖消耗量。其结果如图5、表4所示。
[0096]
表4组分1中峰1和峰2对应组分对hepg2细胞葡萄糖消耗的影响
[0097]
[0098]
注:不同字母表示差异显著性(p《0.05)
[0099]
如表4及图5所示,胰岛素建模组与正常对照组相比,细胞的葡萄糖消耗量降低,说明胰岛素抵抗模型建立成功,进行对应的给药后,不同组分的不同浓度的对于细胞葡萄糖消耗量的影响差距较大。峰1组分在浓度为0.1mg/ml时,细胞对葡萄糖的消耗量最大,有16.20%,且没有明显的剂量依赖性,当浓度达到1mg/ml时,细胞对葡萄糖的消耗量低于了胰岛素模型组,这可能是由于浓度过大,对细胞的活性产生的抑制作用,从而使葡萄糖消耗量显著降低,说明峰1对应组分具有良好的降血糖功效。峰2组分在浓度为0.1mg/ml时,细胞对葡萄糖的消耗量最大,有8.77%,但显著低于细胞在峰1组分下的葡萄糖消耗量,这说明峰1组分对于细胞葡萄糖消耗量的影响效果明显优于峰2组分。
[0100]
由上述功效实验可知,步骤s5中得到的2个不同洗脱峰(如图4所示,即峰1和峰2)中,峰1对细胞葡萄糖消耗量及生长活性的影响效果均比峰2好,因此对峰1进行分子量及氨基酸组成成分分析,结果如图6-7,表5所示。
[0101]
具体的,峰1对应组分的分子量和氨基酸组成分析过程如下。
[0102]
采用凝胶渗透色谱-示差检测-18角激光光散射(gpc-ri-malls)分析联用技术测定。gpc-ri-malls联用分析条件:流动相为1.0%nacl水溶液;流速为0.7ml/min;varian210泵;wyatt十八角激光光散射检测器;wyatt示差折光检测器;色谱柱为pl aquage 408.0
×
300mm;柱温30℃;检测器温度30℃。
[0103]
氨基酸组成成分采用氨基酸分析仪测定。氨基酸分析仪的色谱条件为:na型阳离子交换柱4.6
×
60nm;流动相:柠檬酸三钠缓冲液;四元梯度洗脱:ph3.2-4.9;检测波长:510nm;流速:0.4ml;柱温:50℃。
[0104]
表5峰1对应组分分子量分析
[0105][0106]
由图6-7可知,峰1中疏水性氨基酸如苯丙氨酸、缬氨酸等所占比例较多,高达39.6%,而具有高降血糖活性的组分中疏水性氨基酸含量显著高于其他组分中的含量。由此可以推断峰1对应组分具有降血糖功能。
[0107]
进一步对步骤s1中获得的紫薯膳食纤维进行分析。具体过程如下:
[0108]
可溶性膳食纤维含量测定参照gb5009.88-2014食品中膳食纤维的测定;
[0109]
持水指数测定方法如下:分别取0.5g干燥至恒重的紫薯全粉和提取的紫薯膳食纤维粉记为w,置于离心管中,按1:20(质量体积比)比例加入蒸馏水,充分混匀,室温下静置24h后,5000r/min离心10min,弃上清液,沉淀用滤纸吸干称重,质量记为w1(g),持水指数(%)计算公式为:持水指数(%)=(w1-w)/w
×
100%;
[0110]
持油指数测定方法如下:分别取0.5g干燥至恒重的紫薯全粉和提取的紫薯膳食纤维粉记为m,置于离心管中,按1:20(质量体积比)比例加入玉米油,充分混匀,室温下静置24h后,5000r/min离心10min,弃上层油脂,称量离心管(离心管质量m0)和沉淀重量记为m1,
持油力计算公式为:持油指数(%)=(m
1-m0)/m
×
100%,检测结果如表6所示。
[0111]
表6膳食纤维性质测定结果
[0112][0113]
由此可见,本技术通过淀粉酶和蛋白酶处理后的膳食纤维含量达到76.53%,说明使用酶解的方式去除淀粉和蛋白质效果非常明显。同时通过挤压膨化和超微粉碎处理能够使可溶性膳食纤维含量增加,可提高以紫薯膳食纤维为原料食品的适口性。
[0114]
进一步的,对本发明微胶囊产品降血糖功效进行验证,具体过程如下:
[0115]
取体重为20
±
2g的icr小鼠70只,普通饲料自由饮食1周后,随机分为7组(n=10),除正常对照组继续喂食普通饲料外,其他6组采用高脂饲料喂食进行肥胖大鼠造模,体重超出正常组20%即为高脂模型造模成功,除高脂对照组,其他5组按50mg/kg的剂量连续2天腹腔注射链脲佐菌素(stz),两周后,尾部静脉取血,测定血糖值,取血糖值大于11.0mmol/ml的小鼠为高血糖模型小鼠。高血糖模型建立后,将其分为高血糖模型组、阳性对照组以及本发明紫薯降血糖多肽微胶囊产品高中低剂量组(即以下高剂量组、中剂量组、低剂量组),空白对照组、高脂对照组及高血糖模型组灌胃蒸馏水,阳性对照组灌胃二甲双胍100mg/kg,本发明高中低剂量组分别以200mg/kg,150mg/kg,100mg/kg灌胃,每周进行空腹血糖值测定,血糖测定结果见图9。
[0116]
如图9所示(注:*表示与高血糖模型组相比具有显著性差异,p《0.05),模型组的小鼠空腹血糖明显高于正常组小鼠,其中,高血糖模型组的小鼠血糖一直保持高水平状态,且略微有上升的趋势,随着给药时间的延长,给药组的小鼠血糖呈下降趋势,且均明显低于高血糖模型组小鼠血糖(p<0.05),表明本发明具有明显的降血糖功效。进一步的,最后一周对小鼠进行口服糖耐量测定,所有小鼠禁食不禁水12h后,灌胃1g/kg葡萄糖,尾部取血测定小鼠0,15,30,60,120min的血糖值,测定结果见图9。
[0117]
如图9所示,进食15min内,各组小鼠血糖均呈上升趋势,15min后,正常组小鼠血糖值开始降低,但建模组小鼠血糖值仍呈上升趋势,这表明建模组小鼠的葡萄糖耐受性相对于正常组小鼠受损。在30min时,建模组小鼠的血糖值达到最高值,各给药组小鼠的血糖值均低于高血糖模型组,30min后,各建模组小鼠的血糖值均呈现不同速率的下降,其中以高剂量组的血糖值最低,其次为阳性对照组,这表明本发明可使小鼠葡萄糖耐受量增加,其中高剂量组效果最为明显。
[0118]
进一步的,末次喂养后,小鼠禁食不禁水10h,水合氯醛麻醉,腹主动脉取血。血样于室温静置30min后,4000r/min离心获得血清,按试剂盒说明测定总胆固醇(tc)和甘油三酯(tg)的浓度,血清相关指标结果见表7。
[0119]
表7各组分对小鼠血清指标的影响
[0120][0121]
各组分对小鼠血清指标的影响如表8所示,表中高血糖模型组的总胆固醇、甘油三酯均显著高于正常对照组小鼠。经过各组不同的给药治疗后,高血糖小鼠出现不同的逆转效果,其中以高剂量组的效果最好,其总胆固醇、甘油三酯均显著低于其它组,这表明本发明中的紫薯降血糖多肽微胶囊化产品可有效降低血糖,防治糖尿病。
[0122]
综上所示,本发明结合酶解、高压脉冲电场以及高压均质对紫薯原料进行处理,进一步通过在不同阶段添加不同量的硫酸铵,以多级盐析的方式充分沉淀紫薯蛋白质,以大幅提高紫薯蛋白的提取效率和质量,进一步再对紫薯蛋白复合物进行酶解和分离,以获得具有降血糖功效的多肽,使其可作为天然降血糖物质应用于降低机体血糖,防治糖尿病。进一步再对紫薯降血糖多肽进行微胶囊化处理,以此来提高产品的稳定性,使其能持久发挥降血糖功效。
[0123]
需要说明的是,上述实施例1至3中的技术特征可进行任意组合,且组合而成的技术方案均属于本发明的保护范围。术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。在没有更多限制的情况下,由语句“包括一个
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者设备中还存在另外的相同要素。
[0124]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。