一种用于细胞成像的无试剂电致化学发光检测方法
一、技术领域
1.本发明涉及一种用于细胞成像的无试剂电致化学发光检测方法。
二、
背景技术:
2.电致化学发光(ecl)显微成像技术由于其极低的背景和出色的可控性,十分适用于研究各种细胞性质,例如:细胞表面和内部的化学组成。然而,由于对高浓度共反应剂的需求和共反应物自由基的短寿命限制,该技术无法直接实现对整个细胞底部的成像。若采用表面活性剂对细胞进行通透处理,则无法实现对活细胞的检测。此外,高浓度共反应剂的引入,也会造成严重的细胞损伤。因此在活细胞传感和显微ecl成像中,无需外加共反应剂的ecl发光体的开发是该领域的迫切需要。
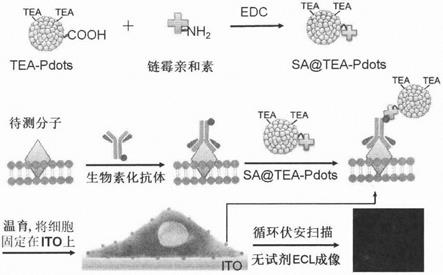
3.为了实现单个活细胞表面待测分子的无试剂ecl成像检测,该专利设计了一种共反应剂内嵌的聚合物点,其通过亲核反应在聚合物侧链引入三乙胺基团,实现分子内双电子转移,从而增强聚合物点的ecl强度。该聚合物点具有极高的ecl强度,丰富的修饰位点和低细胞毒性,并在与链霉亲和素(sa)偶联后,通过生物素标记抗体与细胞表面相应待测分子及sa的双识别作用,标记到细胞表面待测分子上,在无需外加共反应剂的条件下,实现对待测分子的细胞成像检测。
三、
技术实现要素:
4.本发明的目的是:基于聚合点中分子内双电子转移增强ecl强度,设计合成了一种侧链上偶联三乙胺基团(tea)的聚合物,并与苯乙烯-马来酸酐共聚物(psma)进行纳米共沉淀制备tea-pdots,用于活细胞表面待测分子的原位无试剂ecl成像检测。
5.该方法首先将制得的tea-pdots发光体与链霉亲和素(sa)偶联,获得的sa@tea-pdots再通过与生物素标记抗体和抗体与相应待测分子的双识别作用,标记到细胞表面待测分子上;被标记的细胞通过一个温育过程固定在ito导电玻片表面,利用简单的循环电位扫描获得ecl信号。本发明基于分子内双电子转移增强聚合物点的ecl,首次对活细胞表面的待测分子在无外加共反应剂存在时实现ecl成像检测,为活细胞表面相关分子的检测提供了一个简单、可靠的生物成像方法。
6.本发明提出的ecl成像检测方法如图1所示。首先用生物素标记抗体(生物素化抗体)识别细胞表面相应的待测分子,通过生物素与链霉亲和素的特异性识别,将链霉亲和素偶联的tea-pdots引入细胞表面,实现对细胞表面待测分子的标记。进一步通过温育将该细胞固定到ito导电玻片表面,在磷酸盐缓冲体系中,基于聚合物点的分子内双电子转移,以tea-pdots为ecl发光体,用循环电位扫描获得ecl信号,实现对细胞表面相关分子的无试剂ecl成像检测。
7.本发明通过以下技术方案来实现:
8.1)如图2所示,在钯类催化剂,如四(三苯基膦)钯、醋酸钯或二(三苯基膦)氯化钯,及无机碱存在下,2,2-(9,9-双(6-溴代己基)-9氢-芴-2,7-二基)双(4,4,5,5-四甲基-1,3,
2-二氧杂硼烷)(m1)与4,7-二溴苯并[c][1,2,5]噻二唑(m2)在100℃聚合72小时,生成聚4-(9,9-双(6-溴己基)-9h-芴-2-基)苯并[c][1,2,5]噻二唑(p1)。然后,在无机碱、四氢呋喃与二甲基甲酰胺(四氢呋喃与二甲基甲酰胺的体积比为4∶1)的混合溶液中,将生成的聚合物与二乙胺在80℃下反应96小时,生成三乙胺偶联的聚合物tea-pfbt。进一步将该聚合物与苯乙烯-马来酸酐共聚物(psma)(质量比为5∶1)通过纳米共沉淀得到表面含三乙胺的聚合物点(tea-pdots)。
[0009]
2)如图1所示,在1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)存在下,tea-pdot与链霉亲和素通过缩合反应偶联获得sa@tea-pdots。
[0010]
3)如图1所示,生物素化抗体与细胞表面相应待测抗原分子通过免疫识别将生物素基团键合到待测分子上,再通过生物素与链霉亲和素之间的亲和作用,将上述sa@tea-pdots标记到细胞表面待测分子上。
[0011]
4)如图1所示,进一步通过温育步骤将细胞固定到ito导电玻片表面,在磷酸盐缓冲体系中,以tea-pdots为ecl发光体,用循环电位扫描获得ecl信号,对细胞表面待测分子进行无试剂ecl成像检测。
[0012]
与现有技术相比,本发明具有以下特点:
[0013]
本发明中设计的三乙胺偶联的聚合物点具有在水溶液中分散性好、稳定性佳,粒径均一的特点,相比于已报导的无需外加共反应剂的ecl发光材料,本方法制备的聚合物点具有更多的生物修饰位点。此外,相比于其它商品化的聚合物点在外加共反应剂下的ecl性能,本方法制备的聚合物点由于分子内双电子转移增强了发光效果。
[0014]
与已有的ecl细胞成像方法相比,本方法首次实现了无试剂的ecl成像,能够在不对细胞进行通透处理,不对电极进行额外修饰,及不需外加共反应剂的前提下,对活细胞表面待测分子进行ecl成像检测。
四、附图说明
[0015]
图1.细胞表面待测分子的无试剂电致化学发光成像检测示意图
[0016]
图2.偶联三乙胺的聚合物点的制备方法示意图
五、具体实施方式
[0017]
实施例1:结合图2,合成偶联三乙胺的聚合物点。
[0018]
m1(100mg),m2(59.7mg),四(三苯基膦)钯(17.3mg)和碳酸钾(207.3mg)在甲苯/水(4ml/1ml)中进行混合,在氩气气氛下置于史莱克管中,100℃搅拌72小时后,在甲醇中沉淀两次得到浅橙色固体p1。再将p1(100mg)与二乙胺(1.17g)和碳酸钾(221.1mg)在四氢呋喃/二甲基甲酰胺(16ml∶4ml)中混合,在氩气气氛下置于史莱克管中,80℃搅拌96小时后,在甲醇中沉淀两次得到橙色固体tea-pfbt。
[0019]
将tea-pfbt(100μl,1mg ml-1
的四氢呋喃溶液)与psma(20μl,1mg ml-1
的四氢呋喃溶液)加入1.88ml四氢呋喃中,超声脱气20分钟,再将混合物快速注入1ml水中,继续超声处理4分钟。在真空下旋转蒸发浓缩后,将浓缩液用0.22μm孔径的聚(醚砜)过滤器过滤,获得在水中均匀分散的偶联三乙胺的聚合物点(tea-pdots)。
[0020]
实施例2:结合图1,将tea-pdots与链霉亲和素偶联。
[0021]
tea-pdots(1ml,50μg ml-1
),4-羟乙基哌嗪乙磺酸(20μl,1m)和聚乙二醇(20μl,5wt%,mw=3350)混匀后,将溶液ph调节至7.0左右。随后,将新鲜制备的edc(20μl,5mg ml-1
)和链霉亲和素(20μl,1mg ml-1
)依次添加到混合物中,并在室温下搅拌5小时。然后,将牛血清白蛋白(20μl,10wt%)添加到溶液中继续搅拌30分钟,以防止非特异性吸附。最后,用triton x-100(0.5wt%)超滤3次,分离得到链霉亲和素偶联的tea-pots(sa@tea-pots)。
[0022]
实施例3:结合图1,用sa@tea-pots对活细胞表面待测分子进行无试剂ecl成像检测
[0023]
在5%co2的潮湿气氛中37℃下,将sk-br-3细胞在含10%胎牛血清和100μg ml-1
青霉素-链霉素的mccoy
′
s 5a培养基中培养,获得浓度为5
×
10
5-2
×
106cells/ml的细胞分散液。取200μl该分散液与生物素化的抗体(1μl,1mg ml-1
)在黑暗及室温下旋转振荡45分钟,然后用磷酸盐缓冲液(pbs)洗涤三次。随后,将细胞与200μl sa@tea-pots在黑暗及室温下再孵育45分钟,用pbs洗涤三次并转移到2.5cm
×
2.5cm ito导电玻片上,在37℃、5%co2中温育8小时将细胞固定在ito导电玻片表面。
[0024]
ecl成像过程在自制的成像系统上进行操作,该成像系统由倒置显微镜(dmi8,德国徕卡),科研相机(ixon ultra,英国安道尔)和电化学工作站(chi-660d,上海辰华)组装而成。其中,固定了细胞的ito导电玻片为工作电极,银/氯化银丝线为参比电极,铂丝为对电极。该系统封闭在自制的暗盒中,以避免外部光线的干扰。通过施加扫速为0.5v s-1
的循环电压(0-1.5v),在缓冲液中以60秒的曝光时间来记录发光图像。使用photoshop和徕卡软件分析ecl图像强度,从而实现对活细胞表面待测分子的ecl成像检测。
[0025]
实施例4:根据实施例3,对活细胞表面人表皮生长因子受体-2(her2)进行无试剂ecl成像检测
[0026]
将200μl细胞分散液与生物素化的her2抗体(1μl,1mg ml-1
)在黑暗及室温下旋转振荡45分钟,然后用磷酸盐缓冲液(pbs)洗涤三次。随后,将细胞与200μl sa@tea-pots在黑暗及室温下再孵育45分钟,用pbs洗涤三次并转移到2.5cm
×
2.5cm ito导电玻片上,在37℃、5%co2中温育8小时后,将该ito导电玻片作为工作电极,采用同样的成像系统对活细胞表面待测her2进行ecl成像检测。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。