1.本发明涉及源于显性变异基因的疾患的治疗剂。
背景技术:
2.源于基因变异的疾患包括:源于隐性(recessive)变异基因的疾患及源于显性(dominant)变异基因的疾患。前一类疾患在存在纯合变异型基因时发病,但后一类疾患在存在杂合变异型基因时也发病。这是由于源于隐性变异基因的蛋白质不会阻碍源于正常基因的蛋白质的功能,但源于显性变异基因的蛋白质会阻碍源于正常基因的蛋白质的功能,或者会获得正常蛋白质以上的活性从而引起过度的细胞响应。除此之外,显性变异还包括变异引起源于正常基因的蛋白质不足的情况(单倍体障碍)。
3.由于这种差异,源于隐性变异基因的疾患与源于显性变异基因的疾患,在基因治疗的治疗战略上不同。关于前一类疾患,开发了向患者导入正常基因的治疗方法。关于后一类疾患,需要开发将基因组内变异了的碱基序列置换为正常碱基序列的治疗方法,现在需要开发这种治疗方法。
4.在基础研究领域,近年来基因组编辑技术的开发受到关注,开发了各种基因组编辑技术(参考专利文献1及2)。专利文献1揭载的方法使cas9多肽及以dna为靶的rna与靶核酸接触,从而调节该靶核酸的转录。专利文献2揭载的方法不依赖于同源性,而是将外源dna序列结合到非分裂细胞的基因组中。已出现了很多将这些基因组编辑技术应用到各种领域的尝试。
5.(现有技术文献)
6.专利文献1:国际公布第2013/176772号小册子
7.专利文献2:国际公布第2018/013932号小册子
技术实现要素:
8.(发明要解决的问题)
9.基因变异为隐性还是显性,是通过亲属系谱分析及基因诊断来判断的。但是,根据以往的诊断知识,能够基于致病基因来区分隐性或显性(例如:视紫红质(rodopsin)基因是显性,usherin基因是隐性)。即使是由相同致病基因引起的疾患,多数情况下每个患者的变异位点也不同。因此,在源于显性变异基因的疾患的治疗中,需要根据每个患者来将变异所在的碱基置换为正常碱基。但是,这种操作需要大量的劳力及成本,这一问题成为阻碍制剂化的屏障。
10.本发明是鉴于上问题而进行的,本发明的目的是提供源于显性变异基因的疾患的新型治疗剂。
11.(用以解决问题的技术手段)
12.为解决所述课题,本发明的一个方面的治疗剂是源于基因组内正常基因发生显性变异而成的显性变异基因的疾患的治疗剂,
13.所述治疗剂含有供体dna,所述供体dna包含具有下列序列(a)~(c)的多核苷酸:
14.(a)所述正常基因;
15.(b)位于所述正常基因的上游且被设计核酸酶(designer nucleases)切割的第1反向靶序列;
16.(c)位于所述正常基因的下游且被设计核酸酶切割的第2反向靶序列,
17.(其中,反向靶序列是:存在于所述基因组内且被所述设计核酸酶切割的靶序列的、倒位序列)。
18.(发明的效果)
19.根据本发明的一个方面,能够提供源于显性变异基因的疾患的新型治疗剂。
附图说明
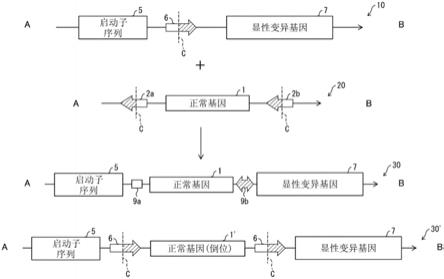
20.图1是本发明的一个方面的治疗剂的功能示意图。
21.图2是将本发明的一实施方式的治疗剂应用于视紫红质基因修复的一例示意图。
22.图3示出将现有的基因组编辑技术应用于视紫红质基因修复时的缺点。
23.图4示出视紫红质基因的修复实验中研究了的3种grna。
24.图5是视紫红质基因的修复实验所用的供体dna的结构示意图。
25.图6是视紫红质基因的修复实验的实验手法的概略示意图。
26.图7是示出视紫红质基因的修复实验结果的显微图像。示出视网膜中视紫红质的表达。
27.图8是示出视紫红质基因的修复实验结果的显微图像。示出视网膜的切片中视紫红质的表达。
28.图9是示出视紫红质基因的修复实验结果的图表。示出各grna的敲入效率。
29.图10是示出视紫红质基因的修复实验结果的显微图像。示出使用了抗视紫红质抗体得到的荧光染色图像。
30.图11是示出通过非病毒性递送(电穿孔)来进行的视紫红质基因的修复实验的结果的显微图像。示出视网膜中视紫红质的表达。
31.图12是示出通过病毒性递送(aav载体)来进行的视紫红质基因的修复实验的结果的显微图像。示出视网膜中视紫红质的表达。
32.图13是示出通过病毒性递送(aav载体)来进行的视紫红质基因的修复实验的结果的显微图像。示出视网膜的切片中视紫红质的表达。
33.图14是示出视紫红质基因的修复实验结果的显微图像。示出通过敲入正常视紫红质基因,使视网膜变性得到了抑制。
34.图15是示出视紫红质基因的修复实验结果的显微图像。通过眼底图像确认了视紫红质的表达。
35.图16是示出视紫红质基因的修复实验结果的图表。示出视功能性眼球反应检查(qomr)的结果。
36.图17示出被选定在人类视紫红质基因外显子1的上游的grna识别序列的位置。
37.图18是用于验证grna识别序列的切割效率的ssa测定法的概略示意图。
38.图19是示出ssa测定法的结果的显微图像。示出egfp的表达。
39.图20是正常人类视紫红质基因的供体dna的结构示意图。
40.图21示出外周蛋白基因的修复实验中研究了的3种grna识别序列的位置。
41.图22是外周蛋白基因的修复实验所用的供体dna的结构示意图。
42.图23是外周蛋白基因的修复实验结果的显微图像。示出外周蛋白的表达。
43.《附图标记说明》
44.1:正常基因
45.2a:第1反向靶序列
46.2b:第2反向靶序列
47.6:靶序列
48.7:显性变异基因
49.20:供体dna
50.a:上游
51.b:下游
具体实施方式
52.以下,对本发明的一实施方式进行说明,但本发明不限定为以下说明的各方案,可在说明书所示的范围内进行各种变更。对不同实施方式及实施例中分别揭载的技术手段进行适当组合而得到的实施方式及实施例也包含在本发明的技术范围内。
53.本说明书中记载的学术文献和专利文献均在本说明书中作为了参考文献而援引。
54.本说明书中,如无特别说明,则表示数值范围的“a~b”是指“a以上且b以下”。
55.〔1.源于显性变异基因的疾患的治疗剂〕
56.一实施方式中,本发明提供源于基因组内正常基因发生显性变异而成的显性变异基因的疾患的治疗剂。该治疗剂含有供体dna,所述供体dna包含具有下列序列(a)~(c)的多核苷酸。(a)正常基因;(b)位于正常基因的上游且被设计核酸酶切割的第1反向靶序列;(c)位于正常基因的下游且被设计核酸酶切割的第2反向靶序列。
57.〔治疗剂的作用机制〕
58.以下,参照图1,对本发明的一个方面的治疗剂的作用机制进行说明。图1示出了治疗前的基因组10、供体dna20、及治疗后的基因组30。本发明的一实施方式的治疗剂含有供体dna20。供体dna20包含正常基因1,通过将正常基因1敲入基因组内,将显性变异基因7敲除。结果,源于显性变异基因7的疾患得到治疗。
59.图1中,治疗前的基因组10、供体dna20、及治疗后的基因组30均从上游a向着下游b方向示出。治疗前的基因组10及治疗后的基因组30中,关于编码有内源显性变异基因7的核苷酸链,5’侧是“上游”,3’侧是“下游”。关于与所述核苷酸链互补的核苷酸链,3’侧是“上游”,5’侧是“下游”。
60.另一方面,供体dna20中,关于编码有正常基因1的核苷酸链,5’侧是“上游”,3’侧是“下游”。关于与所述核苷酸链互补的核苷酸链,3’是“上游”,5’是“下游”。另外,供体dna20可以是不具有其互补核苷酸链的单链dna。
61.图1的第1栏是通过本发明的一实施方式的治疗剂来进行治疗前的基因组10的示意图。治疗前的基因组10含有启动子序列5及显性变异基因7。因此,产生显性变异基因7的
翻译产物,从而引起各种疾病。
62.启动子序列5与显性变异基因7之间存在着靶序列6,靶序列6中含有切割位点c。一实施方式中,靶序列6的至少一部分被设计核酸酶中的经适当设计了的核酸结合位点识别,从而切割位点c被该设计核酸酶中的核酸酶位点切割。该实施方式中的设计核酸酶可举出tale核酸酶(talen,转录激活因子样效应物核酸酶)、锌指核酸酶(zfn)等。其他实施方式中,靶序列6的至少一部分被适当设计了的grna识别,从而切割位点c被设计核酸酶中的核酸酶位点切割。该实施方式中的设计核酸酶可举出cas核酸酶等。此时,被设计核酸酶切割的dna的末端优选为平滑末端。这是因为dna的切割端若为平滑末端,则切割后易于通过nhej(非同源末端连接)进行dna修复而将正常基因插入。
63.作为满足这些条件的设计核酸酶,可举出cas核酸酶(包括:crispr相关核酸酶;天然的cas核酸酶(cas9等)及人工变异体(dcas等))、tale核酸酶(talen)、锌指核酸酶(zfn)、五肽重复(ppr)蛋白质等。
64.靶序列6的位置并无特别限定,只要是正常基因1插至切割位点c后能够通过启动子序列5控制正常基因1即可。靶序列6的位置例如可为(i)启动子序列5与显性变异基因7之间、(ii)显性变异基因7的内部(例如,外显子1的内部)。
65.图1的第2栏是本发明的一实施方式的治疗剂所含的供体dna20的示意图。供体dna20含有:具有正常基因1、第1反向靶序列2a、及第2反向靶序列2b的多核苷酸。这些序列的顺序从上游依次为第1反向靶序列2a、正常基因1、第2反向靶序列2b。
66.正常基因1是编码有实质上正常发挥功能的蛋白质的基因。其中,若蛋白质具有多个功能,只要至少1个功能实质上正常,则可视作“实质上正常发挥功能的蛋白质”。例如,若蛋白质的功能为某种活性(基因表达活性等),则指通过适当的测定法来测得的该活性的强度可为野生型蛋白质的活性的80%以上、90%以上或95%以上(上限值可为120%、110%或105%)。一实施方式中,正常基因1为野生型基因。
67.第1反向靶序列2a及第2反向靶序列2b是靶序列6的倒位序列。也就是说,从上游侧开始读取靶序列6时的碱基序列是与从下游侧开始读取第1反向靶序列2a及第2反向靶序列2b时的碱基序列一致的。因此,第1反向靶序列2a及第2反向靶序列2b也含有切割位点c。
68.图1的第3栏是通过本发明的一实施方式的治疗剂进行治疗后的基因组30的示意图。通过设计核酸酶(未图示)的作用,运用非同源末端修复(nhej),将供体dna中的正常基因1插入启动子序列5与显性变异基因7之间。通过将显性变异基因7插入启动子序列5的下游,启动子序列5使正常基因1的产物得以产生(敲入)。另一方面,正常基因1的末端至少存在终止密码子,因此不会伴随正常基因1的转录而发生显性变异基因7的泄漏(泄漏表达)。
69.所述机制中,grna(未图示)也可参与。例如,设计核酸酶若为cas核酸酶,则cas核酸酶与grna协作以切割dna双链。
70.其中,治疗前的基因组10中存在着的靶序列6在治疗后消失(9a、9b)。因此,正常基因1一旦被插入,则该正常基因1不会因为设计核酸酶的作用而被除去。
71.关于nhej,有时插入序列会与预期方向相反地倒位插入(图1的第4栏)。倒位插入而成的基因组30’含有正常基因(倒位)1’。当发生这种插入时,不产生正常基因1的正常产物。但是倒位插入而得的基因组30’中,靶序列6位于正常基因(倒位)1’的上游及下游。因此,由于设计核酸酶的作用,正常基因(反向)1’会被切除,并再次发生运用nhej的基因组修
复。
72.由此,本发明的一实施方式的治疗剂能够一边运用nhej一边将正常基因1插入正确的方向。
73.〔治疗剂的各种方式〕
74.一实施方式中,治疗剂含有grna及/或设计核酸酶。该grna及/或设计核酸酶可以以表达载体的形态、rna的形态、或蛋白质的形态包含在治疗剂中。另外,grna与设计核酸酶可互相融合为1体。
75.若采用所述方式,则治疗剂包含基因组编辑所需的主要要素。因此能够仅使用所述治疗剂来更高效地治疗源于显性变异基因的疾患。
76.一实施方式中,供体dna20在正常基因1与第2反向靶序列2b之间含有转录控制序列。转录控制序列是对基因的转录产物(mrna)的产生进行控制(例如,亢进或抑制)的序列。一实施方式中,转录控制序列是转录抑制序列。一实施方式中,转录控制序列是位于基因的3’末端侧的非翻译序列(3’侧非翻译区域)。作为转录控制序列的其他具体例子,可举出多聚腺苷酸扩增序列(sv40pa、兔珠蛋白多聚腺苷酸、bgh多聚腺苷酸)。另外,作为转录控制序列,可采用将多聚腺苷酸扩增序列与绝缘子(insulator)序列(边界序列:用于防止除插入基因之外的序列带来的影响)组合而成的序列。
77.采用所述方式,则治疗后的基因组30中,转录控制序列位于正常基因1与显性变异基因7之间。因此,例如能够更确实地阻止伴随正常基因1的转录而发生的显性变异基因7的泄漏(泄漏表达)。对于显性变异基因7强烈表达的细胞,这种方式特别有利。
78.一实施方式中,治疗剂用于非分裂细胞。如上所述,本发明的一实施方式的治疗剂运用nhej。因此,优选将治疗剂用于基于nhej的dna链切割修复效率表现得高的细胞。一般而言,与分裂细胞相比,非分裂细胞的dna链切割修复中,nhej的运用频度更高。因此优选将治疗剂用于非分裂细胞。作为非分裂细胞的一例,可举出视细胞(视杆细胞、视锥细胞)、视网膜色素上皮细胞、视神经细胞等。
79.一实施方式中,正常基因1为选自视紫红质基因、外周蛋白基因、best1基因及optn基因(视神经病变诱导基因)的1者以上。一实施方式中,正常基因1是视紫红质基因、外周蛋白基因、best1基因、或optn基因。
80.一实施方式中,源于显性变异基因的疾患为选自视网膜色素变性症、黄斑营养不良及遗传性青光眼的1者以上。一实施方式中,源于显性变异基因的疾患是视网膜色素变性症、黄斑营养不良、或遗传性青光眼。
81.正常基因1的构造只要是能够得到正常基因产物即可,并无特别限定。正常基因1的内部可具有或不具有非翻译区域。一实施方式中,正常基因1是正常基因产物的cdna。一实施方式中,正常基因1是野生型的基因产物的cdna。
82.若正常基因1不具有非翻译区域,则供体dna20的基因组可实现小型化。因此有利于将供体dna20组入载体(质粒载体、病毒载体等)中。
83.若通过载体将治疗剂所含的成分导入细胞内,则所使用的载体并无特别限定。作为可由载体导入的治疗剂成分,可举出供体dna20、grna的表达载体、设计核酸酶的表达载体等。利用各种载体向细胞内导入的方法可采用公知的技术。
84.选自供体dna20、grna、及设计核酸酶的至少2种也可构成为1个载体。例如,(i)
grna和设计核酸酶、(ii)供体dna20和grna、(iii)供体dna20和设计核酸酶、(iv)供体dna20和grna和设计核酸酶可构成为1个载体。
85.作为载体的具体例子,可举出噬菌体载体、质粒载体、病毒载体、逆转录病毒载体、染色体载体、游离基因载体、病毒性载体(细菌质粒、噬菌体、酵母游离基因等)、酵母染色体成分、病毒(杆状病毒、乳多空病毒、牛痘病毒、腺病毒、腺相关病毒、鸟痘病毒、伪狂犬病病毒、疱疹病毒、慢病毒、逆转录酶病毒等)、基于它们的组合的载体(粘粒、噬菌粒等)等。上述之中,从通用性高的观点来看,优选质粒载体。另外,从临床应用较多的观点来看,优选病毒载体,更优选腺相关病毒载体(aav载体)。
86.或者,治疗剂所含的成分也可不借助载体导入细胞内。例如,供体dna可直接以dna分子形态,grna可直接以rna分子形态,设计核酸酶可直接以蛋白质形态导入细胞内。作为这种导入方法,可举出与电穿孔、显微注射、声孔效应、激光照射、阳离子性物质(阳离子性聚合物、阳离子性脂质、磷酸钙等)复合化了的转染。
87.〔试剂盒〕
88.本发明的一个方面的试剂盒用于治疗源于基因组内正常基因发生显性变异而成的显性变异基因的疾患。该试剂盒具备上述供体dna。
89.若试剂盒具备grna(或其表达载体)及/或设计核酸酶(或其表达载体),则可将供体dna、grna及设计核酸酶制成单剂试剂,或也可分开制成2个以上试剂(例如,可将供体dna与grna及设计核酸酶分开制成不同的试剂)。此时,2个以上试剂可容纳在不同容器中。
90.一实施方式中,“试剂盒”是指用于任意用途的任意试剂等的组合。该用途可为医学用途或实验用途。
91.〔制剂、剂型、处方〕
92.本发明的一实施方式的治疗剂可以按照常规方法来制成。更具体而言,可将上述供体dna、任选的grna及/或设计核酸酶(或它们的表达载体)、及任选的医药品添加物进行配制,从而制成制剂。
93.本说明书中,医药品添加物是指除制剂所含的有效成分之外的物质。为了更易实现制剂化,实现品质稳定性,提高有用性等,所以制剂含有医药品添加物。作为医药品添加物的例子,可举出赋形剂、粘合剂、崩解剂、润滑剂、流化剂(抗固剂)、着色剂、胶囊包衣、涂层剂、增塑剂、矫味剂、甜味剂、着香剂、溶剂、增溶剂、乳化剂、悬浮剂(粘着剂)、增稠剂、ph调节剂(酸化剂、碱化剂、缓冲剂)、湿润剂(可溶化剂)、抗菌性防腐剂、螯合剂、栓剂基料、软膏底剂、固化剂、软化剂、医用水、推进剂、稳定剂、防腐剂。本领域技术人员可按照预期的剂型、投予途径以及标准药学习惯来选择这些医药品添加物。
94.本发明的一实施方式的治疗剂可含有除供体dna、grna及设计核酸酶之外的有效成分。该有效成分可具有与源于显性变异基因的疾患的治疗相关的效果,或具有其他效果。
95.例如,可通过美国食品及药品管理局(fda)、欧洲药品管理局(ema)、日本国厚生劳动省等所制定的标准来了解以上说明了的有效成分及医药品添加物的具体例子。
96.本发明的一实施方式的治疗剂可采用任意剂型。作为剂型的例子,可举出滴眼剂、片剂、胶囊剂、内服剂、外用剂、栓剂、注射剂、吸入剂。
97.本发明的一实施方式的治疗剂可根据医师及医务人员的判断来适当配药。另外,本发明的一实施方式的治疗剂的投予量及投予计划可根据医师及医务人员的判断来适当
决定。
98.本发明的一实施方式的治疗剂的投予途径可根据治疗剂的剂型、欲处置的疾患种类及严重程度等要素来适当选择。作为投予途径的例子,可举出滴眼投予、非经口投予、皮内投予、肌肉内投予、腹腔内投予、静脉内投予、皮下投予、鼻腔内投予、硬膜外投予、经口投予、舌下投予、鼻腔内投予、脑内投予、阴道内投予、透皮投予、直肠内投予、吸入、局部投予等。
99.被投予本发明的一实施方式的治疗剂的“受试者”不限定为人类。可适用于其他非人类哺乳动物。作为所述非人类哺乳动物,可举出偶蹄类(牛、野猪、家猪、绵羊、山羊等)、奇蹄类(马等)、啮齿类(小鼠、大鼠、仓鼠、松鼠等)、兔目(兔等)、食肉类(狗、猫、貂等)等。上述非类人哺乳动物除包括家畜或伴侣动物(玩赏动物)之外,还包括野生动物。
100.本发明的一实施方式的治疗剂还可用于除生物体之外的范畴。例如,可用于源于生物体的体系(被摘除的组织、培养细胞等)。
101.〔2.源于发生了显性变异的视紫红质基因的疾患的治疗剂〕
102.一实施方式中,本发明提供源于基因组内正常视紫红质基因经显性变异后而成的显性变异视紫红质基因的疾患的治疗剂。该治疗剂含有供体dna,所述供体dna包含具有下列序列(a)~(c)的多核苷酸:(a)正常视紫红质基因;(b)位于正常视紫红质基因的上游且被设计核酸酶切割的第1反向靶序列;(c)位于正常视紫红质基因的下游且被设计核酸酶切割的第2反向靶序列。
103.这种供体dna的构成例示于图2的第1栏。图中,“rho cdna”是正常视紫红质蛋白质的cdna,相当于“正常视紫红质基因”。另外,“反向grna序列”相当于第1反向靶序列及第2反向靶序列。图2的例子中,将cas9用作设计核酸酶,所以第1反向靶序列及第2反向靶序列是由grna识别的序列。acgfp是用来判断正常视紫红质基因是否成功插入的标记蛋白质,无需包含在治疗剂中。
104.所述治疗剂将正常视紫红质基因敲入内源性视紫红质基因的启动子与显性变异视紫红质基因的外显子1之间。结果,显性变异视紫红质基因被敲除(图2的中栏及下栏)。
105.一实施方式中,治疗剂含有grna及/或设计核酸酶。该grna及/或设计核酸酶可以以表达载体的形态包含在治疗剂内。另外,grna与设计核酸酶可互相融合为1体。一实施方式中,供体dna在正常视紫红质基因与第2反向靶序列之间含有转录控制序列(图2中,“3’utr”相当于该转录控制序列)。这些内容如〔1〕节中所述,不再赘述。
106.一实施方式中,供体dna进一步含有使正常视紫红质基因高度表达的序列。图2中,“chimeric intron,嵌合内含子”相当于该序列。已知该序列是源于人类β珠蛋白基因及免疫球蛋白基因的嵌合体内含子,且能够提高培养细胞体系中的蛋白质的表达量(choi t et al.(1991)
″
a generic intron increases gene expression in transgenic mice,
″
molecular and cellular biology,vol.11(no.6),pp.3070-3074;sakurai k et al.(2007)
″
physiological properties of rod photoreceptor cells in green-sensitive cone pigment knock-in mice,
″
journal of general physiology,vol.130(no.1),pp.21-40.)。
107.一实施方式中,正常视紫红质基因的表达盒插入在pleaklessiii质粒中。也就是说,供体dna插入在pleaklessiii质粒中。pleaklessiii质粒是质粒的内源性因素对插入序
列的转录活性造成的影响较轻的载体(详情参考tunekawa y et al.(2016)
″
developing a de novo targeted knock-in method based on in utero electroporation into the mammalian brain,
″
deveopment,vol.143(issue 17),pp.3216-3222.)。
108.采用所述方案,则从供体dna向基因组dna插入正常视紫红质基因的概率可提高,并且能够提高正常视紫红质基因的表达效率(详情参考本说明书的实施例及图11)。
109.一实施方式中,治疗剂进一步含有grna的表达载体及设计核酸酶的表达载体,且它们通过非病毒性递送来递送到细胞内。此方案中,grna的表达盒与正常视紫红质基因的表达盒及/或设计核酸酶的表达盒设置在不同载体上。例如,grna的表达盒与正常视紫红质基因的表达盒及/或设计核酸酶的表达盒插入在不同质粒中。
110.采用所述方案,则能够提高正常视紫红质基因的表达效率(详情参考本说明书的实施例及图11)。但这种效果在采用非病毒性递送(电穿孔等)时才能够发挥。若采用病毒性递送,则优选的条件不同。
111.一实施方式中,治疗剂进一步含有grna的表达载体及设计核酸酶的表达载体,且它们通过病毒性递送来递送到细胞内。此方案中,供体dna、grna的表达载体及设计核酸酶的表达载体优选由aav载体构成。另外,aav载体优选为选自aav2、aav5、aav8及aav9的1种以上。这些aav载体对视细胞具有较高亲和性,因此能够高效地将治疗剂的有效成分递送到视细胞。
112.在使用aav载体的方式中,供体dna、grna的表达载体及设计核酸酶的表达载体优选分别由不同aav载体构成。
113.采用所述方案,则能够提高正常视紫红质基因的表达效率(详情参考本说明书的实施例及图12)。
114.一实施方式中,grna识别的序列为序列号6(grna1:tctgtctacgaagagcccgtggg)或序列号8(grna3:ctgagctcgccaagcagccttgg)。根据所述方案,运用nhej的敲入效率能得到提高。
115.例如,若将本发明的一实施方式的治疗剂用于治疗人类的眼睛疾患,则治疗剂的投予方法优选采用视网膜下投予(subretinal injection)、玻璃体投予(vitreous injection)及上脉络膜腔投予(suprachoroidal injection)。另外,通过投予所述治疗剂,例如在视网膜色素变性症患者中,能够达到以下效果:(i)防止视细胞的变性及/或修复变性了的视细胞、(ii)防止视细胞的功能降低及/或恢复降低了的视细胞功能、(iii)防止视功能的降低及/或恢复降低了的视功能。
116.〔显性变异视紫红质基因的治疗的优点〕
117.以下,参考图2、3,说明将本发明的一实施方式的治疗剂用于治疗显性变异视紫红质基因时的优点。作为显性变异视紫红质基因引起的疾患,可举出视网膜色素变性症。该疾患可能是视细胞(视杆细胞)的细胞死亡引起的遗传性中途失明疾患。视紫红质基因变异引起的视网膜色素变性症的患者在视网膜色素变性症患者总体中约占6%。
118.人类的视紫红质蛋白质是由约348个氨基酸构成的、特别存在于视杆细胞的感光性g蛋白偶联受体(gpcr)。该蛋白质分布在视杆细胞外节部分的盘膜。编码视紫红质蛋白质的视紫红质基因(rho)包含5个外显子、翻译蛋白质的编码区(cds;10kb)、5’侧非翻译区域(1.5kb)、及3’侧非翻译区域(多聚腺苷酸扩增序列等;2kb左右)构成(图2)。并且,已有报告
中指出,根据视紫红质基因变异了的视网膜色素变性患者的基因诊断结果,发现了包括显性变异在内的110种基因变异(图3)。
119.通常的基因组编辑技术所基于的战略是“删除变异并插入正确的基因”,因此需要分别针对这110种基因变异来分别设计适当的grna及供体dna。另外,很多基因组编辑技术会运用同源重组修复(hdr)。hdr在分裂细胞中的发生频度高,但在非分裂细胞中的发生频度低。在此一提的是,出现了显性变异视紫红质基因的视细胞是非分裂细胞。这也就是说,通常的主流基因组编辑技术难以有效地治疗视细胞。
120.与此相对,本发明的一实施方式的治疗剂通过在启动子序列与显性变异视紫红质基因之间敲入正常视紫红质基因,从而敲除显性变异视紫红质基因。也就是说,无论显性变异视紫红质基因所含的基因变异为何种类型(即使是未知的变异),都能够采用相同的grna及供体dna来治疗。另外,由于治疗剂运用了nhej,所以即使对作为非分裂细胞的视细胞,也能够高效地进行基因组编辑。
121.〔其他〕
122.本发明还包含以下方式。
123.1.124.一种治疗剂,其是源于基因组内正常基因发生显性变异而成的显性变异基因的疾患的治疗剂,
125.所述治疗剂含有供体dna,所述供体dna包含具有下列序列(a)~(c)的多核苷酸:
126.(a)所述正常视紫红质基因;
127.(b)所述位于正常视紫红质基因的上游且被设计核酸酶切割的第1反向靶序列;
128.(c)所述位于正常视紫红质基因的下游且被设计核酸酶切割的第2反向靶序列,
129.(其中,所述反向靶序列是:存在于所述基因组内且被所述设计核酸酶切割的靶序列的、倒位序列)。
130.[2]根据[1]所述的治疗剂,其中,
[0131]
所述供体dna还含有下列序列(d):
[0132]
(d)位于所述正常基因与所述第2反向靶序列之间的转录控制序列。
[0133]
[3]根据[1]或[2]所述的治疗剂,其还含有下列(i)及/或(ii):
[0134]
(i)grna、或该grna的表达载体;
[0135]
(ii)所述设计核酸酶、或该设计核酸酶的表达载体。
[0136]
[4]根据[1]~[3]中任一项所述的治疗剂,其中,
[0137]
所述供体dna还含有使所述正常视紫红质基因高度表达的序列。
[0138]
[5]根据[1]~[4]中任一项所述的治疗剂,其中,
[0139]
所述供体dna通过非病毒性递送来递送到细胞内,
[0140]
所述正常视紫红质基因的表达盒插入在pleaklessiii质粒。
[0141]
[6]根据[5]所述的治疗剂,
[0142]
所述治疗剂还含有所述grna的表达载体及所述设计核酸酶的表达载体,
[0143]
所述供体dna、所述grna的表达载体及所述设计核酸酶的表达载体通过非病毒性递送来递送到细胞内,
[0144]
所述grna的表达盒与所述正常视紫红质基因的表达盒及/或所述设计核酸酶的表
达盒设置在不同载体上。
[0145]
[7]根据[1]~[4]中任一项所述的治疗剂,
[0146]
所述治疗剂还含有所述grna的表达载体及所述设计核酸酶的表达载体,
[0147]
所述供体dna、所述grna的表达载体及所述设计核酸酶的表达载体由aav载体构成,
[0148]
所述aav载体为选自aav2、aav5、aav8及aav9的1种以上。
[0149]
[8]根据[7]所述的治疗剂,其中
[0150]
所述供体dna、所述grna的表达载体及所述设计核酸酶的表达载体分别由不同aav载体构成。
[0151]
[9]根据[1]~[9]中任一项所述的治疗剂,其中,
[0152]
所述grna所识别的序列为序列号6或序列号8。
[0153]
<1>一种源于基因组内正常基因发生显性变异而成的显性变异基因的疾患的治疗方法,
[0154]
所述治疗方法具有向投予对象(例如,人类或除人类之外的哺乳动物(牛、家猪、绵羊、山羊、马、狗、猫、兔、小鼠、大鼠等)等)投予治疗剂的步骤,
[0155]
所述治疗剂含有供体dna,所述供体dna包含具有下列序列(a)~(c)的多核苷酸:
[0156]
(a)所述正常基因;
[0157]
(b)位于所述正常基因的上游且被设计核酸酶切割的第1反向靶序列;
[0158]
(c)位于所述正常基因的下游且被设计核酸酶切割的第2反向靶序列。
[0159]
(其中,反向靶序列是:存在于所述基因组内且被所述设计核酸酶切割的靶序列的、倒位序列)。
[0160]
<2>根据<1>所述的治疗方法,其中,
[0161]
所述供体dna还含有下列序列(d):
[0162]
(d)位于所述正常基因与所述第2反向靶序列之间的转录控制序列。
[0163]
<3>根据<1>或<2>所述的治疗方法,其中,
[0164]
所述治疗剂还含有下列(i)及/或(ii):
[0165]
(i)grna、或该grna的表达载体;
[0166]
(ii)所述设计核酸酶、或该设计核酸酶的表达载体。
[0167]
<4>根据<1>或<3>所述的治疗方法,其中,
[0168]
所述治疗剂使用于非分裂细胞。
[0169]
<5>根据<1>~<4>中任一项所述的治疗方法,其中,
[0170]
所述正常基因为选自视紫红质基因、外周蛋白基因、外周蛋白基因、best1基因及optn基因的一者以上。
[0171]
<6>根据<1>~<5>中任一项所述的治疗方法,其中,
[0172]
所述疾患是选自视网膜色素变性症、黄斑营养不良及遗传性青光眼的一者以上。
[0173]
(1)一种源于基因组内正常基因发生显性变异而成的显性变异基因的疾患的治疗剂,其中,
[0174]
所述治疗剂含有供体dna,所述供体dna包含具有下列序列(a)~(c)的多核苷酸:
[0175]
(a)所述正常基因;
[0176]
(b)位于所述正常基因的上游,且被设计核酸酶切割的第1反向靶序列;
[0177]
(c)位于所述正常基因的下游,且被设计核酸酶切割的第2反向靶序列。
[0178]
(其中,反向靶序列是:存在于所述基因组内且被所述设计核酸酶切割的靶序列的、倒位序列)。
[0179]
(2)根据(1)所述的治疗剂,其中,
[0180]
所述供体dna还含有下列序列(d):
[0181]
(d)位于所述正常基因与所述第2反向靶序列之间的转录控制序列。
[0182]
(3)根据(1)或(2)所述的治疗剂,其还含有下列(i)及/或(ii):
[0183]
(i)grna、或该grna的表达载体;
[0184]
(ii)所述设计核酸酶、或该设计核酸酶的表达载体。
[0185]
(4)根据(1)~(3)中任一项所述的治疗剂,
[0186]
其使用于非分裂细胞。
[0187]
(5)根据(1)~(4)中任一项所述的治疗剂,其中,
[0188]
所述正常基因是选自视紫红质基因、外周蛋白基因、best1基因及optn基因的一者以上。
[0189]
(6)根据(1)~(5)中任一项所述的治疗剂,其中,
[0190]
所述疾患是选自视网膜色素变性症、黄斑营养不良及遗传性青光眼的一者以上。
[0191]
实施例
[0192]
〔材料〕
[0193]
[表达盒]
[0194]
按照常规方法如下制作了要组入载体的表达盒。
[0195]
1.核酸酶的表达盒
[0196]
作为核酸酶,使用了源于酿脓链球菌(streptococcus pyogenes)的cas9(spcas9)(编码spcas9的序列:序列号1、uniprot数据库(uniprot登录no.q99zw2)。为了在视杆细胞中进行核酸酶特异性表达,作为启动子,采用了源于牛的视紫红质启动子内的300bp(序列号2、基因位置:chr22:56,231,474-56,231,769)或2.2kbp(序列号3、基因位置:chr22:56,231,473-56,233,726)的区域(gouras p et al.(1994)
″
reporter gene expression in cones in transgenic mice carrying bovine rhodopsin promoter/lacz transgenes,
″
visual neuroscience,vol.11(issue 6),pp.1227-1231;matsuda t&cepko cl(2007)
″
controlled expression of transgenes introduced by in vivo electroporation,
″
pnas,vol.104(no.3),pp.1027-1032;onishi a et al.(2010)
″
the orphan nuclear hormone receptor errβcontrols rod photoreceptor survival,
″
pnas,vol.107(no.25),pp.11579-11584.)。另外,作为多聚腺苷酸扩增序列,采用了兔β珠蛋白的多聚腺苷酸扩增序列(序列号4、基因位置:chr1:146,236,661-146,237,138)。多聚腺苷酸扩增序列也可换为其他通用的多聚腺苷酸扩增序列(sv40pa、hgh pa等)。
[0197]
将从上游依次设置着牛视紫红质启动子的300bp区域、编码spcas9的序列、及多聚腺苷酸扩增序列的表达盒称为“rho300-cas9”。同样地,将从上游依次设置着牛视紫红质启动子的2.2kbp区域、编码spcas9的序列、及多聚腺苷酸扩增序列的表达盒称为“rho2k-cas9”。
[0198]
2.grna的表达盒
[0199]
grna序列是由用于识别靶核酸的序列crrna与用于激活切割的tracerrna所构成的复合体。使用spcas9的pam序列(ngg)的grna搜索引擎(http://crispr.technology/),选择了利用crrna来识别的序列。
[0200]
tracerrna的序列为5'-guuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguu aucaacuugaaaaaguggcaccgagucggugc-3'(序列号5)。搜索范围为从外显子1的翻译起始点算起朝上游侧的100bp以内。该区域位于视紫红质基因的外显子1的上游且为进化非保守区域(evolutionary non-conserved regions)。从搜索所提示的特异性较高的候选区域之中,选择了碱基序列不重复的3个区域。各序列如下(各grna所识别的序列的位置关系参考图4)。
[0201]
grna1的识别序列:序列号6(tctgtctacgaagagcccgtggg;评价值:高(800))
[0202]
grna2的识别序列:序列号7(ggctctcgaggctgccccacggg;评价值:高(800))
[0203]
grna3的识别序列:序列号8(ctgagctcgccaagcagccttgg;评价值:中(600))。
[0204]
将从上游依次设置着人类u6启动子序列(基因位置chr15:67,840,082-67,840,309)、各crrna序列及tracerrna序列的表达盒各自称为“u6-grna1”、“u6-grna2”、“u6-grna3”。
[0205]
3.正常视紫红质基因
[0206]
作为正常视紫红质基因,使用了正常小鼠视紫红质蛋白质的cdna(序列号9、登录no.nm_145383.2)。
[0207]
视紫红质蛋白质占视细胞外节的9成以上,所以所要敲入的正常视紫红质基因需要具有高表达量。因此在正常视紫红质基因的上游设置了源于人类β-珠蛋白基因及免疫球蛋白基因的嵌合体内含子序列(228bp(序列号10)、参考choi op cit.;sakurai op cit.)。在培养细胞的蛋白质表达实验中,该嵌合体内含子序列用于提高表达量。
[0208]
另外,在正常视紫红质基因的下游,删除了该正常视紫红质基因的终止密码子。并且,依次设置了furin序列及p2a序列(78bp;均为自溶肽序列;序列号11)、acgfp基因(720bp;序列号12)、以及、视紫红质基因的3’非翻译区域(al-ubaidi mr et al.(1990)
″
mouse opsin:gene structure and molecular basis of multiple transcripts,
″
journal of biological chemistry,vol.265(no.33),pp.20563-20569.)及其下游的100bp的序列(合计2158bp、序列号13、基因位置:chr6:115,936,720-115,938,976)。furin序列及p2a序列(这些序列在视紫红质蛋白质的c末端侧及acgfp蛋白质的n末端侧被切割,因此不影响其他蛋白质)使视紫红质蛋白质的表达与acgfp蛋白质的表达连动。另外,acgfp基因是使供体基因的敲入和表达得以可视化的报告基因。
[0209]
另外,在如上所得到的序列的上游及下游设置了反向靶序列。反向靶序列是将上述grna的碱基序列的上游与下游反转的序列(倒位序列)。将选用了与grna1相对应的反向靶序列的表达盒称为“mrho-hiti-donor[grna1]”。将选用了与grna2相对应的反向靶序列的表达盒称为“mrho-hiti-donor[grna2]”。将选用了与grna3相对应的反向靶序列的表达盒称为“mrho-hiti-donor[grna3]”。
[0210]
图5是包含如上制作的正常视紫红质基因的表达盒(约4.4kb)的供体基因的结构示意图。由于存在反向靶序列,若反方向插入正常视紫红质基因,则插入了的序列会被cas9
重新切割。并且,切割及插入会反复进行,直至沿顺方向插入正常视紫红质基因。
[0211]
4.mcherry
[0212]
作为是否导入了基因的报告基因,使用了作为红色荧光蛋白质的mcherry(编码mcherry的序列:序列号14)。作为启动子,使用了cag启动子(序列号15)或源于牛的视紫红质启动子的300bp区域(序列号16)。作为多聚腺苷酸扩增序列,使用了兔β珠蛋白的多聚腺苷酸扩增序列。报告基因可变更为其他红色荧光蛋白质(mrfp、dsred2、tdtomato等)。另外,多聚腺苷酸扩增序列也可变更为其他通用的多聚腺苷酸扩增序列(sv40pa、hgh pa等)。
[0213]
将从上游依次设置着cag启动子、编码mcherry的序列、及多聚腺苷酸扩增序列的表达盒称为“cag-mcherry”。同样地,将从上游依次设置着牛视紫红质启动子的300bp区域、编码mcherry的序列、及多聚腺苷酸扩增序列的表达盒称为“rho300-mcherry”。
[0214]
对基于基因组编辑的治疗而言,无需mcherry的表达盒,因此本发明的一实施方式的治疗剂无需包括mcherry的表达盒。
[0215]
〔质粒载体〕
[0216]
按照常规方法制作了具有上述表达盒的质粒载体。质粒载体的具体结构如下。
[0217]
1.cas9的表达载体
[0218]
将质粒pcagig(addgene#11159)之中的、从cag启动子至polya序列的区域置换为rho300-cas9或rho2k-cas9。由此,制作了表达载体“prho300-cas9”及“prho2k-cas9”。
[0219]
2.grna的表达载体
[0220]
向质粒pbluescriptii的多克隆位点(mcs)插入了u6-grna1、u6-grna2或u6-grna3。由此,制作了表达载体“pu6-grna1”、“pu6-grna2”及“pu6-grna3”。
[0221]
3.正常视紫红质基因的表达载体
[0222]
向质粒pleaklessiii(tunekawa y et al.(2016)
″
developing a de novo targeted knock-in method based on in utero electroporation into the mammalian brain,
″
deveopment,vol.143(issue 17),pp.3216-3222.)的mcs插入了mrho-hiti-donor[grna1]、mrho-hiti-donor[grna2]、或mrho-hiti-donor[grna3]。由此,制作了表达载体“pleaklessiii-mrho-hiti-donor[grna1]”、“pleaklessiii-mrho-hiti-donor[grna2]”、及“pleaklessiii-mrho-hiti-donor[grna3]”。
[0223]
其中,pleaklessiii是质粒的内源性转录活性对插入序列的影响较轻的质粒。该质粒在mcs的上游设置着cmv启动子及3个sv40-polya。因此,源于质粒的内源性转录活性在供插入插入序列的mcs序列之前就停止了。
[0224]
4.mcherry的表达载体
[0225]
通过限制酶处理从质粒pcagig的cag启动子除去了gfp的序列,然后,插入了cag-mcherry或rho300-mcherry。由此,制作了表达载体“pcag-mcherry”及“prho300-mcherry”。
[0226]
〔实施例1:所使用的grna对敲入效率的影响〕
[0227]
分别针对上述grna1、grna2及grna3,研究了正常视紫红质基因的敲入效率。
[0228]
以表1所示的比例混合了含有上述表达载体的溶液,从而制备了3种敲入溶液。
[0229]
[表1]
[0230][0231]
表达载体的总浓度为5-7ug/μl
[0232]
向出生后0天(p0)的小鼠(6只)的视网膜下注入0.3~0.4μl的hiti-grna1、hiti-grna2、hiti-grna3。以视网膜侧与阳极相接的方式用夹钳电极(nepagene株式会社制造的cuy650-7)夹住小鼠的头部,通过电穿孔装置(nepagene株式会社制造的nepa21)施加电脉冲,从而将表达载体导入细胞内(详情参考已报告的技术:matsuda op cit.;onishi op cit.;de melo j&blackshaw s(2011)
″
in vivo electroporation of developing mouse retina,
″
journal of visualized experiments,(57),e2847.)。图6是上述方法的概略示意图。
[0233]
组入了rho2k-cas9中的视紫红质启动子在分化到视杆细胞中后,在p7~10开始活化。也就是说,在作为非分裂细胞的视杆细胞中,cas9开始表达。
[0234]
在p21,采样了6个眼球(此时,视网膜的细胞分化基本完成)。将该眼球以眼球外侧的巩膜被剥离的状态(视杯;eyecup),在4%多聚甲醛溶液(nacalai tesque株式会社制造)中以室温固定1小时。然后,使用荧光体视显微镜拍摄gfp及mcherry的荧光图像。结果示于图7。
[0235]
图7上栏示出的重叠图像(overlay)中,虚线的圆圈表示1个眼球。另外,图7的中段示出acgfp的荧光图像,示出被敲入了正常视紫红质基因的细胞。下栏示出mcherry的荧光图像,示出被导入了表达载体的细胞。
[0236]
如图7所示,当使用grna1及grna3时,确认有绿色光。该结果启示了:从能够提高正常视紫红质基因的敲入效率的观点来看,优选选择grna1或grna3来作为grna。
[0237]
接着,利用与上述相同的视杯,制作了视网膜切片,并且观察了acgfp及mcherry的荧光图像。结果示于图8。
[0238]
如图8的视网膜切片的荧光图像所示,仅在视杆细胞主要所在的视网膜外颗粒层(onl),确认到表达了acgfp的细胞。另一方面,除视网膜外颗粒层之外,在分布有水平细胞、双极细胞及无长突细胞的视网膜内颗粒层(inl)中也确认到表达了mcherry的细胞。该结果示出在视杆细胞中特异性地发生了正常视紫红质基因的敲入。
[0239]
接着,根据如上得到的视网膜切片的荧光图像,计算了视网膜外颗粒层(onl)中的、“表达了acgfp的细胞”/“表达了mcherry的细胞”的比例。结果示于图9。
[0240]
如图9所示,当使用grna1或grna3时,以约8~9成的高概率发生了敲入。
[0241]
接着,将使用grna1而敲入了正常视紫红质基因的小鼠的视网膜切片用抗视紫红质抗体染色。结果示于图10。
[0242]
如图10所示,在表达了acgfp的细胞中,确认到抗视紫红质抗体的结合。也就是说确认到了在被敲入了正常视紫红质基因的细胞中的、视紫红质蛋白质的表达。
[0243]
〔实施例2:表达载体的构成对敲入效率的影响〕
[0244]
研究了表达载体的构成对敲入效率的影响。具体而言,通过改变供组入表达盒的质粒的种类、及组入1个质粒中的表达盒的组合方式,研究了这些因素对敲入效率的影响。为此,除了制备了上述表达载体,还制备了以下的表达载体。
[0245]
这些表达载体是使用两端具有itr序列的质粒形态的腺相关病毒(aav)载体(paav)来制备的。paav具有5kb左右的封包上限,以不溢出该上限的方式,设计了表达盒。
[0246]
1.paav-u6-grna1:rho300-mcherry
[0247]
将u6-grna1(grna1的表达盒)及rho300-mcherry(mcherry的表达盒)插入paav。由此,制备了串接型表达载体“paav-u6-grna1:rho300-mcherry”。
[0248]
2.paav-u6-grna1:mrho-hiti-donor[grna1]
[0249]
将u6-grna1(grna1的表达盒)及mrho-hiti-donor[grna1](正常视紫红质基因的表达盒)插入paav。由此,制备了串接型表达载体“paav-u6-grna1:mrho-hiti-donor[grna1]”。
[0250]
3.paav-mrho-hiti-donor[grna1]
[0251]
将mrho-hiti-donor[grna1](正常视紫红质基因的表达盒)插入paav。由此,制备了表达载体“paav-mrho-hiti-donor[grna1]”。
[0252]
4.paav-rho2k-cas9
[0253]
将rho2k-cas9(cas9的表达盒)插入paav。由此,制备了表达载体“paav-rho2k-cas9”。
[0254]
5.paav-rho300-cas9
[0255]
将rho300-cas9插入paav。由此,制备了表达载体“paav-rho300-cas9”。
[0256]
以表2所示的比例混合了含有上述表达载体的溶液,从而制备了以下(1)~(8)的敲入溶液。各溶液的特征如下所示。
[0257]
(1)对照
[0258]
(2)将rho启动子从2kb缩短为300bp
[0259]
(3)将grna的表达盒与mcherry的表达盒串接
[0260]
(4)将正常视紫红质基因的表达盒插入paav
[0261]
(5)将(3)及(4)的条件组合
[0262]
(6)将(2)~(4)的条件组合
[0263]
(7)将grna的表达盒与正常视紫红质基因的表达盒串接
[0264]
(8)将(2)及(7)的条件组合
[0265]
[表2]
[0266][0267]
表达载体的总浓度为5-7μg/μl
[0268]
使用所述敲入溶液,以与实施例1同样的方式,通过电穿孔法将表达载体导入细胞内。
[0269]
在p21,采集了眼球。将该眼球解剖而得到视杯后,使用荧光体视显微镜拍摄了acgfp及mcherry的荧光图像。结果示于图11。
[0270]
对(1)与(2)的实施结果进行比较可知,无论使用rho2k还是使用rho300作为视紫红质启动子,acgfp的表达强度均未变化。这启示了即使视紫红质启动子缩短为300bp,也不会影响敲入效率。
[0271]
对(1)、(3)及(7)的实施结果进行比较可知,将grna的表达盒与其他表达盒复合化而得到的表达载体,与非复合化的表达载体相比,acgfp的表达强度降低。这启示了不将grna的表达与其他表达盒复合化,则敲入效率提高。
[0272]
对(1)与(4)的实施结果进行比较可知,将正常视紫红质基因的表达盒插入paav而得到的表达载体,与将正常视紫红质基因的表达盒插入pleaklessiii而得到的表达载体相比,acgfp的表达强度降低。这启示了将正常视紫红质基因的表达盒插入pleaklessiii,则
敲入效率提高。
[0273]
〔实施例3:病毒性递送方式下的敲入效率〕
[0274]
研究了病毒性递送方式下的敲入效率。具体而言,使用确认了会感染成熟视杆细胞的第8型aav,制备了各aav8载体,并研究了它们的敲入效率。为此,制备了以下的重组aav8病毒。
[0275]
1.aav8-rho300-cas9
[0276]
将rho300-cas9(cas9的表达盒)插入paav。然后,通过aav无辅助表达体系,制备了重组aav8病毒“aav8-rho300-cas9”。
[0277]
2.scaav8-u6-grna1-wpre-u6-grna1
[0278]
为了提高grna的表达效率,制备了夹有wpre(woodchuck hepatitis virus posttranscriptional regulatory element)的循环串接型表达盒“u6-grna1-wpre-u6-grna1”。另外,为了提高表达效率,将该表达盒插入自互补型(self-complementary)的pscaav中。然后,通过aav无辅助表达体系,制备了重组scaav8病毒“scaav8-u6-grna1-wpre-u6-grna1”。wpre是使从细胞核递送至细胞质的mrna的稳定性提高且促进成熟的序列,其促进相对于病毒的封包性、病毒效价、及导入基因的表达。
[0279]
3.aav8-mrho-hiti-donor[grna1]
[0280]
将mrho-hiti-donor[grna1](正常视紫红质基因的表达盒)插入paav。然后,通过aav无辅助表达体系,制备了重组aav8病毒“aav8-mrho-hiti-donor[grna1]”。
[0281]
4.aav8-cag-mcherry-wpre
[0282]
将cag-mcherry(mcherry的表达盒)及wpre插入paav。然后,通过aav无辅助表达体系,制备了重组aav8病毒“aav8-cag-mcherry-wpre”。
[0283]
使用这些重组aav8病毒,向小鼠导入了正常视紫红质基因。导入时所用的表达载体及基因复制数示于表3。
[0284]
[表3]
[0285][0286]
将试验例1及试验例2的重组aav8病毒注入3月龄的小鼠的视网膜下,使其感染。采集感染后1个月时及2个月时的视网膜,制备了平面(flat-mount)标本。然后,以与实施例2相同的方式,拍摄了acgfp及mcherry的荧光图像。结果示于图12。
[0287]
图12的左列示出感染了试验例1的重组aav8病毒的小鼠的视网膜的荧光图像(上栏:感染后1个月、下栏:感染后2个月)。另外,图12的右列示出感染了试验例2的重组aav8病毒的小鼠的视网膜的荧光图像(上栏:感染后1个月、下栏:感染后2个月)。图中的箭头示出将重组aav8病毒注射至视网膜下的注射位置。
[0288]
左列下栏的虚线区域是确认到微量的acgfp表达的区域。试验例1虽然是不导入grna的表达载体的阴性对照,但观察到了aav的itr的转录活性所带来的acgfp。也就是说,
试验例1中,实际上未发生正常视紫红质基因的敲入。
[0289]
如图12所示,关于acgfp表达的发生范围,感染后1个月时为视网膜的1/4,感染后2个月时扩大为约2/3。这与aav病毒感染细胞而转移到细胞核内并使细胞表达导入基因的所需时间相关联。
[0290]
接着,制备了感染后2个月时的视网膜的切片,观察了acgfp及mcherry的荧光图像。结果示于图13。图13的左列示出感染了试验例1的重组aav8病毒的小鼠的视网膜的荧光图像。右列示出感染了试验例2的重组aav8病毒的小鼠的视网膜的荧光图像。
[0291]
如图13所示,感染了试验例2的重组aav8病毒后2个月时的视网膜切片中,确认到了与实施例2(图8)同程度地表达了acgfp的细胞。另外,感染了试验例1的重组aav8病毒后2个月时的视网膜切片中虽然也确认到了表达了acgfp的细胞,但此结果是aav的itr的转录活性带来的。
[0292]
〔实施例4:rho
p23h
视网膜色素变性症模型小鼠的基因治疗〕
[0293]
作为视网膜色素变性症模型小鼠,使用敲入了rho
p23h
的小鼠,其中,rho
p23h
在人类rho变异现象中发生得最多(参考sakami s et al.(2011)
″
probing mechanisms of photoreceptor degeneration in a new mouse model of the common form of autosomal dominant retinitis pigmentosa due to p23h opsin mutations,
″
journal of biological chemistry,vol.286(no.12),pp10551-10567.)。该敲入小鼠中,rho基因的外显子1的第23个脯氨酸残基被置换为了组氨酸残基。该敲入小鼠的视紫红质蛋白质未折叠为正确结构而引起内质网应激,因此发生了视网膜变性(参考chiang wc et al.(2015)
″
robust endoplasmic reticulum-associated degradation of rhodopsin precedes retinal degeneration,
″
molecular neurobiology,vol.52(issue 1),pp.679-695.)。
[0294]
具有该纯合变异的小鼠(rho
p23h/p23h
)在p10~p20,大部分的视杆细胞变性并最终发生细胞死亡。然后,达到1月龄时,视细胞所在的神经细胞层(外颗粒层:onl)发生薄层化。因此,该小鼠可有效用于检测通过治疗而存活了的视杆细胞。
[0295]
另一方面,在达至p30前,具有该杂合变异的小鼠(rho
/p23h
)的onl的厚度变为一半左右,但此后,视网膜变性变得平缓。此时,视细胞的微细形态(视细胞外节的长度等)及视网膜电图的响应程度为正常小鼠的一半左右。因此,该小鼠可有效用于评价通过治疗而存活了的视杆细胞的功能。
[0296]
[4-1.rho
p23h/p23h
小鼠的基因治疗]
[0297]
对p0的rho
p23h/p23h
小鼠的一只眼睛使用实施例2所用的敲入溶液(1),导入了表达载体。表达载体的导入方法以与实施例4相同的方式采用了电穿孔法。作为对照,另一侧眼睛不进行电穿孔。
[0298]
在达到p14、p21及p50时制作了视网膜的切片。用抗视紫红质抗体及dapi对该切片进行组织染色。结果示于图14。
[0299]
如图14所示,在p14,被敲入了正常视紫红质基因的视网膜的onl的厚度与对照的视网膜的onl的厚度相同。而在p21及p50,被敲入了正常视紫红质基因的视网膜中,存在表达了acgfp的细胞,且onl的薄层化得到了抑制,并在外节部分确认到了视紫红质的表达。与此相对,对照的视网膜的onl发生了薄层化。也就是说,通过敲入正常视紫红质基因,rho
p23h/p23h
小鼠中的视杆细胞的变性得到了抑制。这说明发生了正常视紫红质基因的敲入及p23h
视紫红质的敲除,并且通过正常视紫红质的表达而避免了视细胞的死亡。
[0300]
[4-2.rho
/p23h
小鼠的基因治疗]
[0301]
准备2只1月龄的rho
/p23h
小鼠,分别向其左眼注入实施例3的试验例2中所用的重组aav8病毒。aav8病毒的注入手法与实施例3相同。作为对照,右眼不注入aav8病毒。
[0302]
感染后1个月时,通过荧光眼底造影检查,确认了acgfp荧光。结果示于图15。图15的上栏示出右眼的荧光图像,下栏示出左眼的荧光图像。另外,左列示出向野生型小鼠注入aav8病毒且感染后1个月后实施荧光眼底造影检查时的荧光图像。
[0303]
如图15所示,尽管2只rho
/p23h
小鼠之间存在个体差异,但小鼠均具有表达了acgfp的细胞。也就是说,这个结果启示了在这些视细胞中,通过敲入正常视紫红质基因,正常视紫红质进行表达,而不是p23h变异视紫红质进行表达。
[0304]
接着,感染后3个月时,使用qomr视觉运动反应定量系统(phenosys公司制造),进行了视动眼球反应检查,对右眼及左眼的视动眼球反应进行了定量。该检查中,将小鼠放在四面被监视器围绕着的检查箱内。在监视器上显示宽度不同的条纹图案,且以一定的时间间隔左右移动条纹。若检查箱内的小鼠注意到了条纹图案,则其头部会跟随条纹图案的移动而移动(视动眼球反应)。从上往下看,若头部为顺时针旋转,则意味着源于左眼的视动眼球反应,若为逆时针,则意味着源于右眼的视动眼球反应。小鼠头上方的摄像头追踪头的位置,对视动眼球反应进行了定量化。结果示于图16。
[0305]
图16的左图是未注入aav8病毒的、未处理的rho
/p23h
小鼠的试验结果的图表。中央图及右图是向左眼注入了aav8病毒的2只rho
/p23h
小鼠的试验结果的图表。
[0306]
野生型小鼠的两眼均对0.2cyc/deg的条纹图案示出最高响应,正确反应率(平均视动反应,mean optomotor response)为2.0左右(未图示)。与此相对,如图16所示,未处理的rho
/p23h
小鼠(左图)的两眼与野生型一样地均对0.2cyc/deg的条纹图案示出最高响应,但正确反应率低于野生型,为1.5左右。另一方面,向左眼注入了aav8病毒的2只rho
/p23h
小鼠(中央图及右图)的左眼的正确反应率显著高于右眼。该结果明显表明通过正常视紫红质基因的敲入,使rho
/p23h
小鼠的视杆细胞的功能低下得到了抑制。这是由于发生了正常视紫红质基因的敲入及p23h视紫红质的敲除,从而正常视紫红质进行表达,由此视功能得到恢复,或者视功能低下得到了抑制。
[0307]
〔实施例5:对人类视紫红质基因的基因治疗的验证〕
[0308]
[5-1.grna]
[0309]
为了验证对人类视紫红质基因的基因治疗的可能性,研究了对于人类细胞可有效利用的grna的识别序列。
[0310]
使用面向spcas9的grna搜索引擎(http://crispr.technology/),在从人类视紫红质基因的外显子1的翻译起始点算起朝上游侧100bp以内的区域内,搜索了grna识别序列。结果找到了利用grna(hs086172148)来识别的序列(序列号17:tcaggccttcgcagcattcttgg;评价值:高(800))。grna(hs086172148)所识别的序列的位置示于图17。图17中,箭头示出cas9切割位置。
[0311]
[5-2.ssa(单链复性)测定法]
[0312]
通过单链复性(ssa)测定法验证了grna(hs086172148)识别序列的被切割效率。图18是ssa测定法的概要模式图。
[0313]
如图18所示,在ssa测定法所用的增强型绿色荧光蛋白质(egfp)基因表达质粒的egfp基因序列内,插入grna(hs086172148)识别序列,;来制备了修饰egfp基因表达质粒。在与grna(hs086172148)识别序列相邻的位置,该质粒所含的编码egfp的碱基序列部分相同。也就是说,在grna(hs086172148)识别序列的上游及下游具有部分相同的碱基序列。
[0314]
因此,grna(hs086172148)识别序列被cas9切割时,位于切割位置的上游及下游的重复序列会引起同源重组或单链复性。由此,完成编码整个egfp的碱基序列,从而egfp可进行表达。
[0315]
将制作了的修饰egfp基因表达质粒、grna(hs086172148)的表达载体、及、cas9的表达载体混合,制备了转染用混合液。使用该转染用混合液,对hek293细胞实施了转染。转染了的hek293细胞在37℃、5%co2的条件下培养了72小时,然后,检测到了egfp的表达。作为对照,使用不含grna(hs086172148)表达载体的体系也进行了同样的实验。结果示于19。
[0316]
如图19所示,在转染了修饰egfp基因表达质粒及grna(hs086172148)的表达载体这两者的细胞中,检测到了egfp信号。这表明grna(hs086172148)识别序列在grna(hs086172148)及cas9的作用下,实际上被切割了。
[0317]
[5-3.制备含有正常人类视紫红质基因的供体dna]
[0318]
使用grna(hs086172148)识别序列,制备了正常人视紫红质基因的供体dna。图20是所制备的供体dna的表达盒(约4.1kb)的结构示意图。
[0319]
作为正常视紫红质基因,使用了从正常人类视紫红质基因的cdna(1044bp、登录no.nm_000539.3)中删除了终止密码子而得到的序列。如图20所示,正常视紫红质基因上游设置着嵌合体内含子序列(228bp、序列号10)。正常人类视紫红质基因的下游依次设置着furin序列及p2a序列(78bp;序列号11)、acgfp基因(720bp;序列号12)、以及人类视紫红质基因的3’非翻译区域及其下游的100bp的序列(合计1725bp、序列号18)。并且,在所得到的序列的上游及下游设置与grna(hs086172148)相对应的反向靶序列,从而制备了正常人视紫红质基因的供体dna的表达盒。
[0320]
将如上制备的表达盒插入病毒型或非病毒型的质粒,可以制备正常人类视紫红质基因的表达载体。将制备了的正常人类视紫红质基因的表达载体导入器官培养人类视网膜、人类视网膜类器官等中,可以对供体dna的基因在人类视细胞中的导入效率进行详细评价。
[0321]
〔实施例6:验证对除视紫红质基因之外的会引发显性变异的基因的基因治疗〕
[0322]
验证了对除视紫红质基因之外的会引发显性变异的基因进行基因治疗的可能性。具体而言,在小鼠中,研究了正常外周蛋白(peripherin、prph2)基因的敲入效率。显性变异外周蛋白基因是视网膜色素变性症及黄斑营养不良的致病基因,此前已经报告了90种以上的不同疾患变异。
[0323]
[6-1.grna]
[0324]
使用面向spcas9的grna搜索引擎(http://crispr.technology/),在从小鼠外周蛋白基因的外显子1的翻译起始点算起朝上游侧的100bp以内的进化非保守区域内,搜索了grna识别序列。结果,找到了3个grna识别序列。各序列如下(与各grna相对应的各grna识别序列的位置关系参考图21)。
[0325]
grna4的识别序列:序列号19(tgctcttccctagaccctagcgg;评价值:高(800))
[0326]
grna5的识别序列:序列号20(gggctggaccgctagggtctagg;评价值:高(900))
[0327]
grna6的识别序列:序列号21(gagctcactcggattaggagtgg;评价值:高(800))。
[0328]
针对grna4~6,分别制备了从上游依次设置着人类u6启动子序列、与各识别序列相对应的crrna序列、及tracerrna序列的表达盒。将该表达盒插入质粒pbluescriptii的mcs中,从而制备了grna4~6的表达载体(pu6-grna4、pu6-grna5、及pu6-grna6)。
[0329]
[6-2.正常外周蛋白基因]
[0330]
以与正常小鼠视紫红质基因的供体dna相同的方式,制备了正常外周蛋白基因的供体dna。图22是所制备的供体dna的表达盒(约3.6kb)的结构模式图。
[0331]
作为正常外周蛋白基因,使用了从正常小鼠外周蛋白蛋白质的cdna(登录no.nm_008938.2)中删除了终止密码子而得到的序列。正常外周蛋白基因的上游设置着嵌合体内含子序列(228bp、序列号10)。正常外周蛋白基因的下游依次设置着furin序列及p2a序列(78bp;序列号11)、acgfp基因(720bp;序列号12)、以及外周蛋白基因的3’非翻译区域及其下游的100bp的序列(合计1486bp、序列号22、基因位置:chr17:46,923,548-46,925,033)。并且,在所得到的序列的上游及下游设置与grna4~6每一者各自相对应的反向靶序列,由此制备了正常外周蛋白基因的供体dna的表达盒。
[0332]
将如上制备的表达盒插入质粒pleaklessiii的mcs中,从而制备了与grna4~6每一者各自相对应的正常外周蛋白基因的表达载体(pleaklessiii-mprph2-hiti-donor[grna4]、pleaklessiii-mprph2-hiti-donor[grna5]、及pleaklessiii-mprph2-hiti-donor[grna6])。
[0333]
[6-3.敲入效率的研究]
[0334]
与对小鼠视紫红质基因进行的实施例1同样的方式,研究了正常外周蛋白基因的敲入效率。
[0335]
将grna4~6的各表达载体(pu6-grna4、pu6-grna5、或pu6-grna6)、正常外周蛋白基因的表达载体(pleaklessiii-mprph2-hiti-donor[grna4]、pleaklessiii-mprph2-hiti-donor[grna5]、或pleaklessiii-mprph2-hiti-donor[grna6])、cas9的表达载体(prho2k-cas9)、及mcherry的表达载体(pcag-mcherry),以与实施例1相同的比例混合,从而制备了3种敲入溶液。
[0336]
向出生后0日(p0)的小鼠(4只)的视网膜下注入敲入溶液0.3~0.4μl,通过电穿孔法将表达载体导入细胞内。在p21,采集了4个眼球,将其以眼球外侧的巩膜被剥离的状态(视杯;eyecup),在4%多聚甲醛溶液(nacalaitesque株式会社制造)中以室温固定1小时。然后,使用荧光体视显微镜拍摄gfp及mcherry的荧光图像。另外,用与上述相同的视杯,制作了视网膜切片,并且观察了acgfp及mcherry的荧光图像。结果示于图23(上栏:视杯、下栏:视网膜切片)。
[0337]
如图23所示,当使用grna4及grna6时,确认有绿色光。该结果启示了:使用grna4或grna6,则能够敲入正常外周蛋白基因。另外,如图23的下栏所示,仅在视杆细胞主要所在的视网膜外颗粒层(onl),确认到表达了acgfp的细胞。另一方面,除视网膜外颗粒层之外,在分布有水平细胞、双极细胞及无长突细胞的视网膜内颗粒层(inl)中也确认到表达了mcherry的细胞。该结果示出在视杆细胞中特异性地发生了正常外周蛋白基因的敲入。
[0338]
(产业上的可利用性)
[0339]
本发明例如可用于源于显性变异基因的疾患的治疗。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。