1.本发明涉及一种原生质体制备方法,尤其是一种树舌原生质体制备方法。
背景技术:
2.目前树舌主要研究在分离提纯生物活性物质体外检测,体内分子生物学研究未见报道。制备树舌灵芝原生质体为树舌体内生物学研究奠定基础。
3.灵芝在分类上分为灵芝亚属、树舌亚属、粗皮灵芝亚属,灵芝亚属中又包含灵芝组和紫芝组,树舌亚属与其他灵芝属亲缘性较远,遗传背景不尽相同,在现有的灵芝原生质体制备方法中,对树舌灵芝虽然可以制备出原生质体,但质壁分离效果差,无法获得大量原生质体。并且对于原生质体制备过程中的污染并没有人为因素进行控制,容易造成原生质体无法进行后续的使用。
4.同时,获得的原生质体没有杂质可以稳定恢复细胞壁成功再生是制备原生质体的主要目的。现有原生质体制备方法需要大量的酶液,实验耗费量比较大,性价比不高。已报道的过滤方法均采用多层纱布过滤容易导致原生质体混入酶解残渣和部分原生质体粘连在纱布上,减少原生质体的产量和未完全没解菌丝影响后续转化和细胞融合等实验。
技术实现要素:
5.本发明的技术任务是针对以上现有技术的不足,而提供一种树舌原生质体制备方法。
6.本发明解决其技术问题所采用的技术方案是:一种树舌原生质体制备方法,具体步骤如下:
7.(1)菌丝活化:将树舌灵芝菌丝接种于pda固体斜面培养基中,在28℃恒温培养箱中黑暗培养10天,至菌丝长满培养基,然后在无菌操作台中用接菌环挑取菌丝接种于pda液体培养基,恒温摇床28℃,黑暗,120rpm/min培养5天,至菌丝生长活力旺盛;
8.(2)菌球收集:用无菌纱布过滤液体菌丝,过滤后用0.6m甘露醇缓冲液反复冲洗,用手轻轻挤压,除去多余水分,将0.1克菌球置于无菌2.0离心管中,用无菌镊子捣碎,离心12000rpm一分钟,用移液器吸取离心管中多余的水分,留下的菌丝备用。
9.(3)酶液的配置:采用2%的溶壁酶、1%的cellulase r-10、0.5%的snailase混合组成复合酶,与0.05%氨苄青霉素、0.1%硫酸链霉素溶解于0.6m甘露醇缓冲液中,然后再用0.1m的盐酸调节ph为5.0,最后采用0.45μm透膜过滤灭菌,过滤得到的液体为酶解液。
10.(4)酶解:在1毫升酶解液中,加入0.1克菌丝,置于30℃黑暗条件,酶解3小时,每10分钟轻轻晃动酶解液使菌丝悬浮于酶解液中。
11.(5)原生质体收集:用移液器吸取酶解液滴加到100μm细胞筛进行初步过滤,然后再用70μm细胞筛进行二次过滤,二次过滤后的滤液用移液器收集转移到离心管中,在3000r/min下离心10分钟,去上清液,用0.6m甘露醇反复洗涤,直到含有原生质体0.6m甘露醇缓冲液清澈透明,保证彻底去除酶解液。
12.本发明的优点:首先实验操作简便,仅用2.0mlep管就可以完成,无需反复使用大离心管,接着采用2%溶壁酶、1%cellulase r-10、0.5%snailase复合酶液进行原生质体制备,有助于提高原生质体质壁分离效果,每0.1g菌丝可产生5.6~9.2
×
108原生质体,使得舌原生质体制备的产量稳定,可以为后续在进行类似实验减少细胞计数步骤,利用细胞筛可以明显减少原生质体在纯化过程中的损耗,并可以减少原生质体制备过程中的残渣。氨苄青霉素、硫酸链霉素酶解液的使用,可以明显降低细菌污染的情况。
附图说明
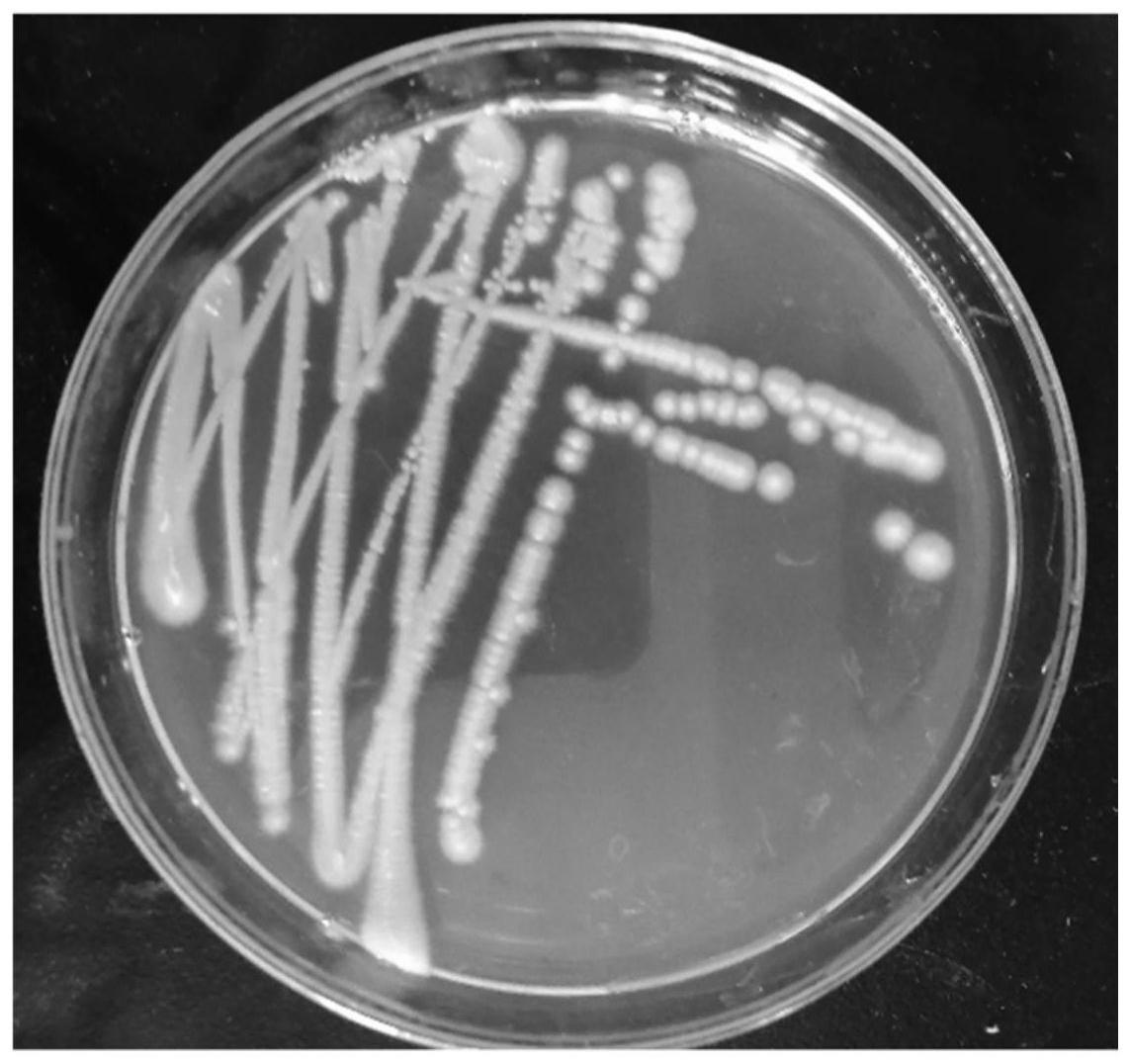
13.图1是本发明酶解液的图片。
14.图2本发明原生质体纯化后图片。
15.图3是本发明优化条件下细胞计数结果。
16.从图1中可以明显看出原生质体和细胞壁等残渣,图2中可以明显看出原生质体和细胞壁等残渣已被清除。
具体实施方式
17.下面结合说明书附图对本发明做以下详细说明。
18.一种树舌原生质体制备方法,具体步骤如下:
19.pda培养基:去皮马铃薯250g/l,葡萄糖20g/l,kh2po
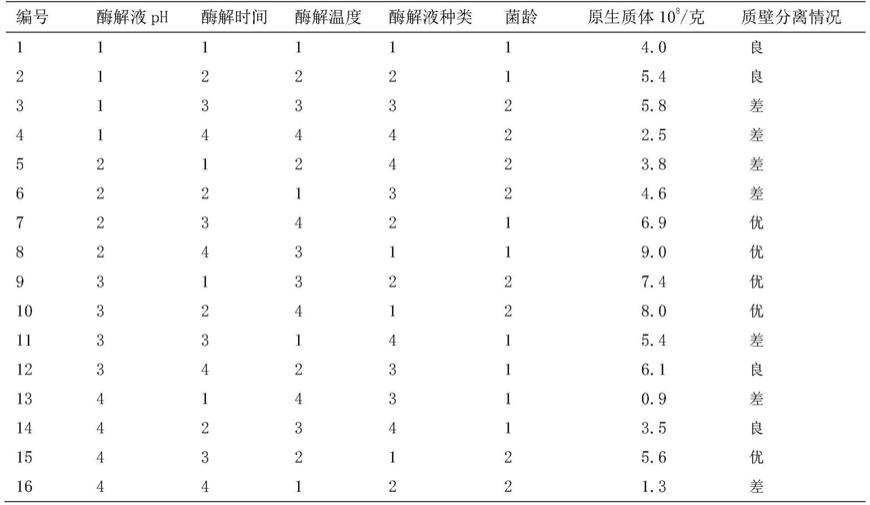
4 3g/l,mgso411.5g/l,盐酸噻胺20-30mg/l,固体培养基添加琼脂粉15g/l(液体培养基不加),纱布过滤,110℃,灭菌30min。
20.(1)菌丝活化:将树舌灵芝菌丝接种于pda固体斜面培养基中,在28℃恒温培养箱中黑暗培养10天,至菌丝长满培养基,然后在无菌操作台中用接菌环挑取菌丝接种于pda液体培养基中,恒温摇床28℃,黑暗,120rpm/min培养5天,至菌丝生长活力旺盛。
21.(2)菌球收集:用无菌纱布过滤液体菌丝,过滤后用0.6m甘露醇缓冲液反复冲洗,用手轻轻挤压,除去多余水分,将0.1克菌球置于无菌2.0离心管中,用无菌镊子捣碎,离心12000rpm一分钟,用移液器吸取离心管中多余的水分,留下的菌丝备用。
22.(3)酶液的配置:采用2%的溶壁酶、1%的cellulase r-10、0.5%的snailase混合组成复合酶,与0.05%氨苄青霉素、0.1%硫酸链霉素溶解于0.6m甘露醇缓冲液中,然后再用0.1m的盐酸调节ph为5.0,最后采用0.45μm透膜过滤灭菌,过滤得到的液体为酶解液。
23.(4)酶解:在1毫升酶解液中,加入0.1克菌丝,置于30℃黑暗下酶解3小时,每10分钟轻轻晃动酶解液使菌丝悬浮于酶解液中。
24.(5)原生质体收集:用移液器吸取酶解液滴加到100μm细胞筛进行初步过滤,然后再用70μm细胞筛进行二次过滤,二次过滤后的滤液用移液器收集转移到离心管中,在3000r/min下离心10分钟,去上清液,用0.6m甘露醇反复洗涤,直到含有原生质体0.6m甘露醇缓冲液清澈透明,保证彻底去除酶解液,以防影响下游实验,用0.6m甘露醇缓冲液按照0.4ml/g菌丝定容。完成后保存于-4℃(可保存一周左右)用于后续实验。
25.实验对照见表1:
26.设计树舌灵芝原生质体正交实验表,对酶解液ph、酶解时间、酶解温度、酶解液种类、菌龄这5个因素进行分析。
27.酶解液ph:4.0(1)、5.0(2)6.0(3)7.0(4);
28.酶解时间:2h(1)、2.5h(2)3h(3)3.5h(4);
29.酶解温度:26℃(1)、28℃(2)30℃(3)32℃(4);
30.菌龄:5d(1)、7d(2);
31.酶解液种类:(1):2%溶壁酶、1%cellulase r-10、0.5%snailase;
32.(2):2%溶壁酶、1%cellulase r-10;
33.(3):2%溶壁酶、0.5%snailase;
34.(4):2%溶壁酶;
[0035][0036]
表1
[0037]
多因素方差分析研究酶解液种类、酶解温度、菌龄、酶解时间,酶解液ph共5个因素对于原生质体数量的差异关系。分析可知:酶解液种类、酶解温度、酶解时间、酶解液ph会对原生质体数量产生显著性差异关系(p《0.05)。
[0038]
利用极差分析研究5个因素(酶解液种类、酶解温度、菌龄、酶解时间、酶解液ph)实验组中4个水平每个水平对于原生质体数量的影响。其中酶解液为2%溶壁酶、1%cellulase r-10、0.5%snailase;酶解液ph为5.0;酶解时间为3h;酶解温度为30℃;菌龄时间为5天为树舌原生质体制备最优方案,通过最优实验方案制备原生质体可达到9.2
×
108个/克并且原生质体质壁分离效果优秀。
[0039]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。