1.本发明涉及微生物与环境工程技术交叉领域,尤其是涉及一种生化复合材料及其制备方法和应用。
背景技术:
2.重金属土壤污染对生物多样性、农业生产以及整体环境和人类健康均构成威胁。目前许多国家采用各种土壤修复技术降低土壤金属浓度,例如物理化学修复和植物修复,然而,这些技术仍存在许多缺点。微生物钙化作为近年来环境岩土较新的研究领域,是一种特殊的生物矿化方法,其核心技术即为micp(microbially induced calcite precipitation,微生物诱导碳酸钙沉淀),通过自然界中某类微生物,其新陈代谢可产生分解尿素的脲酶,尿素分解后产生的碳酸根离子与自然界游离的金属钙离子结合生成胶凝晶体的过程,从而达到重金属固定化,并且提高土壤质地的刚度和强度。目前重金属污染土壤修复的传统方法都具有一定的局限性,而微生物修复技术的非破坏性、绿色经济性、环境友好性,使其逐步发展成为极具前景的土壤修复技术。
3.在受到重金属污染的土壤中,micp反应很大程度将交换态的重金属离子固定为具有内部稳定性的碳酸盐沉淀形式。通过这一步骤,降低了重金属的生物毒性和生物利用度。因此开发一种高效、低成本、可持续的生态除金属方法是十分必要和迫切的。然而由于与本地微生物的竞争以及开放土壤中的不利生长条件,外源产脲酶的微生物在这种土壤修复模式中受到了生存的限制。此外,直接掺入外源接种微生物会降低其垂直运输和在土壤中的定植能力。因此,需要一种合适的接种材料来更好地利用微生物诱导碳酸钙沉淀来进行土壤修复。
4.利用上述微生物固定土壤重金属的方法与生物炭作为载体结合形成的生化复合材料(bcm)也被证明有利于植物生长。然而,生物炭作为热分解基质比天然可用的纤维或多孔物质更加昂贵。在这种背景下,需要考虑引入其他经济有效的基质或生物材料用于产脲酶菌的固定化和稳定化。
技术实现要素:
5.本发明的目的在于克服上述现有技术的不足之处而提供一种生化复合材料及其制备方法和应用。本发明筛选出一株高产量脲酶的产脲酶菌株,可以促进生物诱导的碳酸钙沉积(micp);将其菌株添加于生化复合材料中,使得生化复合材料具有高效碳酸钙沉淀能力,有利于重金属污染土壤的修复,同时具有较高的脲酶活性、脲酶产量及最优细菌繁殖能力。
6.第一目的,本发明提供了一种产脲酶菌株,所述产脲酶菌株的序列如seq id no:1所示,所述产脲酶菌株为芽孢杆菌bacillus sp.wa,所述芽孢杆菌bacillus sp.wa已于2021年3月15日保藏于广东省微生物菌种保藏中心,保藏地址为广州市先烈中路100号大院59号楼5楼,保藏编号为gdmcc no:61559。
7.本发明的芽孢杆菌bacillus sp.wa从电子废弃场收集的土壤中分离得到的,在25℃~35℃的静态培养条件下进行24小时的细菌培养。
8.第二目的,本发明提供了上述产脲酶菌株在制备脲酶中的应用。
9.第三目的,本发明提供了上述产脲酶菌株在降低重金属土壤中尿素含量的用途。
10.该芽孢杆菌bacillus sp.wa能够在添加营养源和尿素的环境中催化尿素水解成氨和碳酸盐,并进一步允许碳酸盐离子结合游离重金属离子形成金属碳酸盐,继而实现土壤重金属固定化。
11.第四目的,本发明提供了一种生化复合材料,包括上述产脲酶菌株和可持续材料载体。
12.本发明的生化复合材料具有高脲酶生产能力和对重金属环境具有高抗性的优点。并且该生化复合材料不会产生额外具有环境毒性的物质,不会产生二次污染,促进可持续发展。
13.加入芽孢杆菌bacillus sp.wa和可持续材料载体组成的生化复合材料其生产脲酶的产量可高达4u/mg~5u/mg。
14.作为本发明所述生化复合材料的优选实施方式,所述可持续材料载体包括玉米芯粉、豆渣、木屑和甘蔗渣中的至少一种,更优选地,所述可持续材料载体为玉米芯粉。
15.参考图5,当可持续材料载体为玉米芯粉时,其成本低廉,且作为载体对土壤内产脲酶菌株的富集和菌株诱导的钙沉积具有极高的促进作用,无需使用高成本生物炭作为细菌载体。
16.第五目的,本发明提供了上述生化复合材料的制备方法,包括以下步骤:
17.s1、将所述产脲酶菌株在30℃~40℃、ph值为6.0~7.0的条件下在含有氮源的营养培养基培养得到细菌悬浮液;
18.s2、将步骤s1制备的细菌悬浮液与可持续材料载体混合离心,获得生化复合材料。
19.更优选地,步骤s1中的产脲酶菌株处于在需氧和静态培养条件下培养。
20.作为本发明所述生化复合材料的制备方法的优选实施方式,细菌悬浮液的体积与可持续材料载体的质量之比为(10~20):1,更优选地,细菌悬浮液的体积与可持续材料载体的质量之比为10:1。
21.当细菌悬浮液的体积与可持续材料载体的质量之比为上述范围时,可持续材料载体对细菌的吸附固定能力较佳,当细菌悬浮液的体积与可持续材料载体的质量之比为10:1时,可持续材料载体对细菌的吸附固定能力达到最优,附图4提供了该质量比下的生化复合材料的扫描电子显微镜观测的照片。
22.作为本发明所述生化复合材料的制备方法的优选实施方式,所述步骤s2中,将步骤s1制备的细菌悬浮液与可持续材料载体在温度为30℃~40℃条件下以120rpm/min~160rpm/min的转速混合8~16h。
23.作为本发明所述生化复合材料的制备方法的优选实施方式,所述氮源包括尿素,所述尿素的浓度为2%~3%。
24.作为本发明所述生化复合材料的制备方法的优选实施方式,所述营养培养基中包含氯化钙,氯化钙的浓度小于25ppm。
25.第六目的,本发明提供了一种固定化土壤中重金属的方法,采用上述产脲酶菌株
或者上述生化复合材料固定化土壤中的重金属。
26.当使用本发明的产脲酶菌株或者生化复合材料对土壤重金属固定时,不需要加入大量化学固定剂,减少了化学试剂带来的再次污染。
27.作为本发明所述固定化土壤中重金属的方法的优选实施方式,将上述生化复合材料添加至被重金属污染的土壤中持续2周至4周。
28.作为本发明所述固定化土壤中重金属的方法的优选实施方式,生化复合材料的浓度为10%(v:w)g材料/kg土壤~20%(v:w)g材料/kg土壤。
29.作为本发明所述固定化土壤中重金属的方法的优选实施方式,所述重金属包括镉,每千克的土壤包括5mg~12mg的镉。
30.第七目的,本发明提供了上述生化复合材料在修复重金属污染土壤中的应用。
31.本发明的生化复合材料在修复重金属污染土壤应用中,无需加入大量化学固定剂,可减少修复成本。
32.当加入生化复合材料至重金属污染土壤中,发现其土壤样本表面官能图案最高,有利于菌株的吸附,菌株的密度很高,进一步有利于提高菌株诱导的生物钙沉积的效率。通过28天土壤修复实验可知,加入生化复合材料的土壤中离子交换态的重金属减少了一半并降至国标(0.5mg/kg)以下,呈稳定形态的碳酸根结合态含量增加两倍,有效解决了土壤重金属污染的问题。
33.与现有技术相比,本发明具有以下有益效果:
34.1)本发明筛选出一株高产量脲酶的产脲酶菌株,该产脲酶菌株可以促进微生物诱导的碳酸钙沉积(micp);
35.2)本发明的生化复合材料具有高脲酶生产能力和对重金属环境具有高抗性的优点;并且该生化复合材料不会产生额外具有环境毒性的物质,不会产生二次污染,促进了可持续发展;
36.3)本发明采用玉米芯粉作为持续材料载体,其成本低廉,且作为载体对土壤内产脲酶菌株的富集和菌株诱导的钙沉积具有极高的促进作用,无需使用高成本生物炭作为细菌载体,节省了生产成本;
37.4)在土壤修复过程中,加入本发明的生化复合材料后的被试土壤具有最高脲酶活性与产量及最优细菌繁殖能力。
附图说明
38.图1为实施例1细菌筛选过程;
39.图2为产脲酶菌株的脲酶活性分析结果图;
40.图3为实施例2制备的生化复合材料的电子扫描显微镜(sem)成像图i;
41.图4为实施例2制备的生化复合材料的电子扫描显微镜(sem)成像图ii;
42.图5为玉米芯粉以及豆渣两种材料作为细菌载体制备生化复合材料的傅里叶转换红外光谱(ftir)谱图;
43.图6为实施例2制备的生化复合材料的傅里叶转换红外光谱(ftir)谱图;
44.图7为实施例2制备的生化复合材料的脲酶活性图;
45.图8为分别加入实施例2制备的生化复合材料、产脲酶菌株、玉米芯粉、尿素营养液
的土壤样本细胞密度图(a为加入生化复合材料的土壤样本、b为加入产脲酶菌株的土壤样本、c为加入玉米芯粉的土壤样本、d为加入尿素营养液的土壤样本);
46.图9为实施例2制备的生化复合材料置入含镉土壤中后与同实验下对照组样本的重金属分布分析图;
47.图10为试验例一中土壤修复实验的流程图。
具体实施方式
48.为更好的说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。
49.在以下实施例中,所使用的实验方法如无特殊说明,均为常规方法,所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
50.实施例1、产脲酶菌株的富集、纯化及脲酶活性分析
51.1、产脲酶菌株的富集
52.1.1本发明的产脲酶菌株来源于广东省贵屿镇的某电子废弃场收集的土壤中分离得到的,在25℃~35℃的静态培养条件下进行24小时的细菌培养。通过2mm孔径筛面去除大颗粒杂质后,取每份5克分置于洁净的50ml锥形瓶中,加入25ml,85%的氯化钠(nacl)溶液,并为溶液配制50mg/l的氯化镉(cdcl2)和4%的尿素;
53.1.2将步骤1.1中所配溶液置入恒温振荡培养箱中,恒温振荡培养箱的设定温度为37℃,设定转速为120rpm,培养时间为7天。
54.2、产脲酶菌株的纯化
55.2.1取经过步骤1.2处理后的溶液,每份分别稀释为原溶液浓度的10-2
、10-3
、10-4
;
56.接上步,取上述每种浓度的溶液样品分别取0.5ml涂布于含40%尿素的尿素固体培养基上;
57.接上步,将所述培养基置入30℃下恒温培养箱中并每日观察菌落繁殖状况;
58.2.2取步骤2.1中具有较旺盛菌落形态的培养基,并选取形态良好且与培养基基质有积极脲酶反应的菌落,具体体现为菌落周围呈现向外扩散的紫色色圈;
59.接上步,用无菌接种环通过平板画线法接种至步骤2.1中含40%尿素的尿素固体培养基中;
60.2.3取步骤2.2中具有较旺盛菌落形态的培养基,并选取3~5个形态良好且与培养基基质有积极脲酶反应的菌落,接种至5ml肉汤培养液(lb)中,置入恒温培养箱;恒温培养箱温度设定为37℃;恒温培养箱时间范围为24小时。
61.3、产脲酶菌株的脲酶活性分析
62.3.1取步骤2.3处理的肉汤培养液,分别使用移液枪取200μl的培养液于洁净的250ml锥形瓶中,每瓶培养液一共取三次重复样品,在每个锥形瓶中,配入:
63.针孔灭菌氢氧化钠(naoh)溶液(1m,30μl);
64.接上步,针孔灭菌尿素溶液(40%,5ml);
65.接上步,针孔灭菌氯化钙(cacl2)溶液(25mm,10ml);
66.接上步,针孔灭菌肉汤培养液(lb)(85ml)。
67.3.2将上述步骤3.1的锥形瓶置入恒温振荡培养箱中;恒温振荡培养箱温度设定为
37℃;恒温振荡培养箱转速设定为160rpm。
68.3.3将经过步骤3.2处理的锥形瓶,各取1ml溶液置入离心机离心得到含有细胞外蛋白的上清液;离心机转速为10000rpm;离心机离心时长为10min;离心机温度设定为4℃。
69.3.4配制铵离子溶液用作脲酶活性分析用的标准溶液,铵离子溶液的浓度为0mm,0.5mm,1mm,2mm,3mm,4mm,5mm。
70.3.5配制磷酸缓冲液为脲酶活性分析用的空白对照溶液,具体配置方法为:
71.取27.6克纯磷酸二氢钠(nah2po4)粉末溶于1l去离子水,标记为a溶液;取28.4克纯磷酸氢钠(na2hpo4)粉末溶于1l去离子水,标记为b溶液;取5.3ml的a溶液和94.7ml的b溶液与100ml去离子水混合,得到200ml混合溶液;取100ml混合溶液,加入900ml去离子水稀释为1l的磷酸缓冲液。
72.3.6配制纳氏试剂(nessler’s reagent)和200mm尿素溶液作为脲酶活性分析用试剂,具体配制方法为:
73.取15ml纳氏试剂溶液,与60ml去离子水混合稀释,得到检测用纳氏试剂;取0.6克尿素,溶于100ml的步骤3.5中配置的磷酸缓冲液,得到检测用尿素溶液。
74.3.7用移液枪取:步骤3.2中锥形瓶中含有纯化产脲酶菌株的尿素培养液、步骤3.3中含有细胞外蛋白的上清液、步骤3.4中的铵离子溶液、步骤3.5中的磷酸缓冲液中样品于96孔板,并加入纳氏试剂和尿素溶液作为脲酶活性分析所用试剂,具体方法为:
75.加入含有纯化产脲酶菌株的尿素培养液10μl,标记为a;
76.加入含有细胞外蛋白的上清液10μl,标记为b;
77.加入铵离子溶液,每种浓度的体积均为50μl,标记为c;
78.加入磷酸缓冲液10μl,标记为d;
79.加入上述四种待测溶液后,在abd溶液中,加入150μl纳氏试剂和40μl200mm尿素溶液;
80.在c溶液中加入150μl纳氏试剂。
81.3.8将步骤3.7中的96孔板置入酶标仪测量样品溶液在480nm波长下的吸光度,具体方法为:
82.设定分光波长为480nm;设定检测温度为30℃;设定检测间隔为5分钟;
83.在步骤3.2中对含有纯化产脲酶菌株的尿素培养液的培养开始后的第0、12、24、48、72、96、120、144小时实施步骤3.7~步骤3.8的检测,共8次。
84.3.9由步骤3.2中含有纯化产脲酶菌株的尿素培养液,用移液枪各取200μl放入96孔板中,置于分光光度计中进行光密度od600的测量,以检测细菌繁殖效率,具体实施方法为:
85.设定分光波长为600nm;设定检测温度为30℃;设定检测间隔为5分钟。
86.分析结果:
87.参考图1,筛选出的细菌菌株在脲酶鉴定培养基上呈阳性。
88.其脲酶活性分析结果参考图2,菌株e在24小时后的脲酶活性最优,因此作为候选细菌进行后续的研究工作。
89.因此,将本发明筛选得到的菌株命名为芽孢杆菌bacillus sp.wa,所述芽孢杆菌bacillus sp.wa已于2021年3月15日保藏于广东省微生物菌种保藏中心,保藏地址为广州
市先烈中路100号大院59号楼5楼,保藏编号为gdmcc no:61559。
90.实施例2、一种生化复合材料及其制备方法
91.1)根据步骤3.8所得的脲酶活性与细菌光密度数据合理选择具有高脲酶活性与高光密度的芽孢杆菌bacillus sp.wa作为生化复合材料的原料之一,接种至以营养琼脂为基质的培养皿中,储存于4℃冰箱中;
92.2)配制尿素营养液(nbu)作为生化复合材料的形成介质,具体方法为:
93.称取2.6克营养肉汤粉末,溶解于170ml去离子水中;
94.接上步,加入20ml的250mm的针孔灭菌氯化钙(cacl2)溶液;
95.接上步,加入10ml的40%的针孔灭菌尿素溶液;
96.接上步,加入60μl的针孔灭菌氢氧化钠(naoh)溶液;
97.完成上述步骤后,得到200ml尿素营养液(nbu);
98.3)取适量玉米芯置入破壁机中磨碎为粉末状,置于紫外线灯下灭菌;灭菌时长为7天;
99.4)取步骤1)中储存的芽孢杆菌bacillus sp.wa的培养基,用无菌接种环接种至5ml肉汤培养液中,置于恒温振荡培养箱中培养,具体方法为:
100.设定培养温度为37℃;设定振荡器转速为160rpm;培养时间为24小时;
101.5)取步骤4)中含芽孢杆菌bacillus sp.wa的肉汤培养液,用移液枪取200μl并接种至步骤2)中所配制的200ml尿素营养液中,置于恒温振荡培养箱中培养,具体方法为:
102.设定培养温度为37℃;设定振荡器转速为160rpm;培养时间为24小时;
103.6)称量步骤3)中玉米芯粉末20克,混于步骤5)中含芽孢杆菌bacillus sp.wa的尿素营养液,置入恒温振荡培养箱中培养,具体方法为:
104.设定培养温度为37℃;设定振荡器转速为160rpm;培养时间为12小时,即得本发明的生化复合材料。其中生化复合材料的电子扫描显微镜(sem)成像如图3和图4所示。
105.采用不同细菌载体制备的生化复合材料的修复系数结果如表1所示。
106.表1
[0107][0108]
修复系数(%)=((final cd concentration
–
initial cd concentration)/initial cd concentration)
×
100%。
[0109]
本发明选择了玉米芯粉以及豆渣两种材料作为细菌载体(参考图5),只有玉米芯粉呈现出良好的细菌附着及富集的效果。因此对于后续的土壤修复实验,选用玉米芯粉做载体的生化复合材料(实施例2)。
[0110]
试验例一、土壤修复实验
[0111]
将实施例2制备的生化复合材料应用于实验用含镉元素的土壤并设置空白对照组,具体方法为:
[0112]
取8个空塑料桶,8个桶分别放入1.5公斤普通盆栽土壤和15毫克硝酸镉粉末;将8个桶分别标记为bcm1、bcm2、b1、b2、cp1、cp2、c1、c2,其中对应加入的材料为:
[0113]
表2
[0114][0115][0116]
分别取加入上述材料后的第0、7、14、21、28天的土壤样本进行ftir和荧光显微镜的分析,结果如图6、8所示。
[0117]
由图6所示,加入实施例2中生化复合材料的土壤样本表面官能团最高(最下面一条线),最利于产脲酶菌株的吸附,进一步有利于提高产脲酶菌株诱导的生物钙沉积效率。
[0118]
由图7所示,当取加入实施例2制备的生化复合材料后的第7、14、21、28天的土壤样本中的脲酶活性高于其他土壤样本的脲酶活性。当取加入实施例2制备的生化复合材料后的第28天的土壤样本中的脲酶活性可高达4u/mg~5u/mg。
[0119]
由图8所示,加入实施例2制备的生化复合材料的土壤细菌密度最高,生物富集能力最强。
[0120]
图9为根据tessier(1979)标准方法中指定的实验方法进行土壤重金属分布分析。结果表明,经过28天的土壤修复实验,加入本发明的生化复合材料的土壤中离子交换态的镉减少了一半并降至国标(0.5mg/kg)以下,呈稳定形态的碳酸根结合态含量增加两倍,有效解决了土壤重金属污染的问题。
[0121]
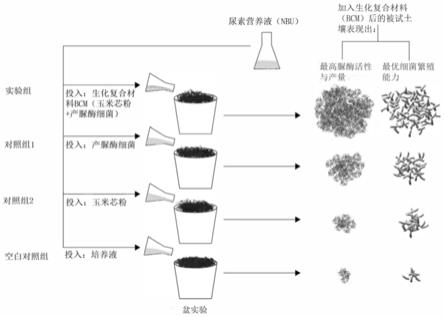
由图10所示,加入实施例2制备的生化复合材料后的被试土壤表现出最高脲酶活性与产量及最优细菌繁殖能力,而其他对照组及空白组的被试土壤的脲酶活性和产量及最优细菌繁殖能力均不及实施例2制备的生化复合材料后的被试土壤。
[0122]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
