1.本发明属于药物合成技术领域,具体涉及一种唑吡坦的制备方法。
背景技术:
2.酒石酸唑吡坦(zolpidem tartrate),化学名为2-(4-甲基苯基)-n,n,6-三甲基咪唑并[1,2-a]吡啶-3-乙酰胺酒石酸盐,是一种非苯二氮杂类催眠药,商品名由法国synthelabo公司原研,1988年在法国首次上市。临床用于治疗严重的睡眠障碍疾病,如偶发性失眠症和暂时性失眠症;此外,本品对原发性失眠、抑郁症、精神病引起的失眠也都有显著的疗效;具有药效快、成瘾性低等特点。其化学结构式如下:
[0003][0004]
目前关于唑吡坦的合成工艺报道较多,如中国专利申请cn106946876a、cn106749237a、cn103360387a、cn106866661a及文献酒石酸唑吡坦的绿色合成工艺研究,《中国药物化学杂志》,2018,28(1),39-42、酒石酸唑吡坦的合成,《中国药业》,2014,23(5),16-17、酒石酸唑吡坦的合成新工艺,《中国医药工业杂志》,2017,48(12),1726-1730、酒石酸唑吡坦的合成工艺研究,《天津药学》,2002,14(l),69-70、chem.sci.,2013,4,764-769、eur.j.org.chem.,2019,4034-4042、heterocycl.commun.,2017;aop,445-448、journal of pharmacy and pharmacology,2018,79(9),1164-1173、organic preparations and procedures international:the new journal for organic synthesis,43:2,260-264、der pharma chemica,2012,4(6):2466-2469、j.org.chem.,2017,5391-5397、organic letters,2017,19,9,2226-2229、in288884、2003mu01081、2004ch00125、2007mu00160、2009ch00904、2013mu02428(同族wo2015011722a2)、ep1311509b1、ep1917263b1、ep1172364b1、ep01809627、、us2006084806a1、us200900799a1、us2011189794a1、wo0214306a1、wo2004087703a1、wo2009007995a1、wo2010122576a1、wo2015011722a2中均报道了唑吡坦及其相关中间体的制备方法。
[0005]
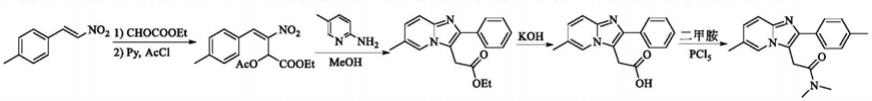
如文献org.lett.,2012,14(17):4580-4583以对甲基-β-硝基苯乙烯为起始原料,经michael加成、酰化、关环以及水解反应后,在五氯化磷作用下与二甲胺缩合得目标产品。
[0006]
但该法起始原料价昂,生产成本较高;所用吡啶刺激性大,对健康及环境都不利。
[0007][0008]
此外,文献angew.chem.int.ed.engl.,2010,49(15):2743-2746中以对甲基苯甲醛为起始原料,先和2-氨基-5-甲基吡啶缩合生成相应的shiff碱,然后在三氟甲磺酸铜[cu(otf)2]和氯化亚铜的催化下与n,n-二甲基丙炔酰胺环合生成目标产品。但该法所用的n,
n-二甲基丙炔酰胺和cu(otf)2价格极贵,大大增加了生产成本。
[0009][0010]
另外,专利de10121638a1、pl196300b1、ep1395586b1、us6562975b1、us2002183522a1、us20040087794a1、us20050054669a1、wo02090356a2、wo2005010002a1、cn101336242a及文献j.med.chem.,1997,40(19):3109-3118中以n,n-二甲基-4-氧代-4-(对甲基苯基)丁酰胺或其下游中间体为起始原料,与溴素溴代后,与2-氨基-5-甲基吡啶环合得目标产品。虽然该方法绿色化程度较高、原子经济性好,但仍存在以下不足:1)起始原料价昂,总收率较低,仅为17%;2)溴代化合物难以纯化,要进行2~3次精制才能得到95%以上的纯度,收率低(50%~60%);3)粗品反应中的杂质较多,产品的纯化难度大;除可利用产品溶于酸水的特点去掉一些杂质外,其他杂质只能靠多次精制除去,收率很低(30%)。
[0011][0012]
此外,专利gb9915489、gb1076089、ep0050563、us4492695、us4382938、us20070027180a1及文献arkivoc,2009(ii)315-320、journal of labelled compounds and radiopharmaceuticals,1986,23,393-400、journal of labelled compounds and radiopharmaceuticals,2000,43,385-394、inventi rapid:med chem,2014(2):1-8中以对甲基苯乙酮或其下游周健体为起始原料,先溴代生成2-溴-4'-甲基苯乙酮,再经缩合、mannich反应、氰基取代以及水解得2-(6-甲基-2-(对甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙酸,最后再与大大过量的二甲胺反应得唑吡坦。
[0013][0014]
但该工艺路线反应步骤长、操作繁琐。同时在mannich反应中应用到基因毒性物质甲醛进行反应,n-烷基化步骤中使用了剧毒、沸点较低的碘甲烷进行,季铵盐被剧毒品氰化钠亲核取代制备氰基中间体2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈,使得整个反应操作过程危险,安全性较低。此外将氰基转化为酰胺时,需在加热条件下,向反应体系中长时间通入干燥的hc1气体,操作繁琐,不利于工业化生产。最后酰胺化时使用cdi(cdi是一种非常昂贵的、有毒的、引起过敏的和吸湿性的化合物,因此用于工业化规模生产非常困难,另一个就是通过此方法得到的所需的目标产品被cdi的分解产物所污染,因此只能在复杂的纯化方法的帮助下才能得到符合药典的严格要求的唑吡坦)以及毒性较大的三氯氧磷或五氯化磷进行。
[0015]
为消除上述方法中的缺陷,有许多制备杂芳基乙酰胺的方法已经被提出。一般而言,它们的差别在于用于引入乙酰胺侧链的方法及所用试剂的不同,主要分为以下三种策略:
[0016]
专利us4794185、fr2600650、ep251589以6-甲基-2-(4-甲基苯基)咪唑[1,2-a]吡啶为关键中间体或起始原料,与n,n-二甲基-2,2-二甲氧基-乙酰胺反应制得α-羟基-n,n-二甲基-乙酰胺衍生物,然后经socl2氯代后,通过nabh4、zn(bh4)2、kbh4、libh4还原脱氯得唑吡坦。
[0017][0018]
该合成方法虽然避免了使用剧毒品氰化钠,但在羟基还原过程中用到了强腐蚀性、强刺激性,可致人体灼伤的socl2进行氯代反应,同时还原反应中使用了对人体危害性较大的硼氢化物(与硼氢化钠接触后有咽喉痛、咳嗽、呼吸急促、头痛、腹痛、腹泻、眩晕、眼结膜充血、疼痛等症状),并且硼氢化物活性较高,反应过程中会释放出氢气,操作危险,难以用于药物合成领域。
[0019]
此外上述工艺还需要分别制备侧链中间体,使得制备唑吡坦所需的步骤总数很多,生产周期增加,因此不适合大规模生产;同时侧链n,n-二甲基-2,2-二甲氧基乙酰胺只能在特殊设备辅助下才能制备,无法以工业化规模生产,并且其对痕量的水和酸敏感,使得该路线难以放大生产。
[0020]
美国专利us4808594a采用相同策略对唑吡坦衍生物进行了合成,但是在还原脱氯过程中采用强致癌物质吊白块进行,该物质对人体的肺、肝脏和肾脏损害极大,使得操作安全性较低。
[0021]
中国专利申请cn1972939a、cn1729188a、ep01809627中则将杂芳基α-羟基乙酰胺、强酸(硫酸、高氯酸或其混合物)、卤化物(libr、nabr、kbr、mgbr2、cabr2或nh4br)、催化剂(铂、钯、钌、锇、铱、或铑催化剂)和除水剂(羧酸酐、羧酰氯或硫酸镁、分子筛)的混合物与氢源(氢气,1~4个大气压)接触后制备唑吡坦。虽然该工艺减少了氯代工艺,但仍需要在贵金属催化下进行反应,同时反应压力较大,操作较危险。
[0022][0023]
中国专利申请cn1668617a则以羟乙酰胺衍生物作为试剂进行侧链的延伸制备,但是该试剂不易获得,同时所采用还原试剂pbr易引起灼伤、并对呼吸系统有刺激性,因此在放大操作期间难以进行。
[0024]
[0025]
专利ep1038875t1、ep1038875a2则采用(缩)乙醛酸单水合物作为侧链延伸制备相应酸衍生物后,再还原羟基,最后与二甲胺反应制备唑吡坦。但该工艺使用腐蚀性极强且难以处理的化学药品(如甲酸),同时也涉及过滤和真空蒸馏操作,此外该工艺还使用贵金属催化剂,需要在重新加工后进行回收,使得该工艺难以大规模实施
[0026][0027]
专利wo0008021a2、wo0008021a3、us6407240b1采用乙醛酸甲酯或其甲基半缩醛作为侧链延伸制备相应酯衍生物后,羟基氯代后还原,最后经二甲胺解制得唑吡坦。虽然该方法采用酯的直接二甲胺解方式引入二甲氨基,可以省去cdi、三氯氧磷或五氯化磷的使用,但是此方法使用的侧链延伸试剂不易获得,同时还原羟基用到不易获得的甲烷亚磺酸钠或者毒性较大的吊白块,同样不适合工业化放大生产。
[0028][0029]
综上,目前唑吡坦的制备方法在工艺安全、操作繁琐,收率不高,生产成本较高等方面存在许多不足,因此,研究寻找一条反应条件温和,操作过程简便,产品收率高、纯度高,生产成本低的适合工业化生产唑吡坦的反应路线仍是目前需要解决的问题。
技术实现要素:
[0030]
针对目前现有唑吡坦制备技术存在的问题,本发明提供了一种新的唑吡坦的制备方法。通过该方法所制得的目标产品具有较高的纯度、收率。
[0031]
本发明的具体技术方案如下:
[0032][0033]
其中,r为ch3或c2h5。
[0034]
一种如式i所示的唑吡坦的制备方法,具体包括以下步骤:
[0035]
步骤a:低温下将化合物sm-1加入酸的有机溶剂中,控温回流至反应结束后,经后处理制得中间体ii。
[0036]
步骤b:将中间体ii加入二甲胺的溶液中,控温至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦。
[0037]
优选地,步骤a中所述的酸为hcl、h2so4、hbr中的一种或其组合,其中特别优选hcl。
[0038]
在一实施例中,步骤a中当酸为hx酸时所述酸的有机溶剂为hcl/meoh、hcl/etoh、hbr/meoh、hbr/etoh饱和溶液中的一种或其组合。
[0039]
在另一实施中,步骤a中当酸为h2so4时为1~4mol/l的h2so4/meoh或h2so4/etoh溶液中的一种或其组合,其中特别优选2mol/l。
[0040]
优选地,步骤a中当酸为hx酸时,所述的sm-1与相应反应溶剂的投料质量体积比为1:20~40,g/ml,其中特别优选1:30,g/ml;步骤a中当酸为h2so4时,所述的sm-1与相应反应溶剂的投料质量体积比为1:6~15,g/ml,其中特别优选1:9,g/ml
[0041]
优选地,步骤a中所述的加入sm-1的温度为-5~0℃。
[0042]
优选地,步骤a中所述的后处理步骤为:将反应液降至室温,减压浓缩至干后,加入纯化水中,饱和碳酸氢钠溶液调节ph至7,甲苯提取,纯化水洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为中间体ii。
[0043]
优选地,步骤b中所述的反应溶剂为甲醇、乙醇、异丙醇、四氢呋喃中的一种或其组合,其中特别优选甲醇。
[0044]
优选地,步骤b中所述的二甲胺溶液的浓度为1~20mol/l,其中特别优选12mol/l。
[0045]
优选地,步骤b中所述的中间体ii与二甲胺的投料摩尔比为1:4~12,其中特别优选1:7。
[0046]
优选地,步骤b所述的反应温度为-10~0℃。
[0047]
本发明的有益效果:
[0048]
1.本发明提供了一种新的唑吡坦的制备方法,以2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈为起始物料,氰基酯解后经二甲胺解制得目标产品。该工艺后处理操作简便,只需通过简单的精制即可得到纯度较高的唑吡坦;
[0049]
2.本发明中唑吡坦的制备工艺,相较于现有技术中氰基水解成酰胺后继续水解得酸后再与二甲胺反应制备唑吡坦的工艺相比,可明显缩短反应步骤。同时目标产品的获得是通过二甲胺的酯解来制备,避免了cdi、三氯氧磷或五氯化磷等活化试剂的使用,提高了原子经济性,降低了生产成本,简化了单元操作,更适合工业化生产。
具体实施方式
[0050]
下面通过实施例来进一步说明本发明,应该正确理解的是:本发明的实施例仅仅是用于说明本发明,而不是对本发明的限制,所以,在本发明的方法前提下对本发明的简单改进均属于本发明要求保护的范围。
[0051]
对本发明得到的唑吡坦化合物结构确证如下:
[0052][0053]
m.p.195.2~196.1℃;esi-hrms(m/z):308.1756[m h]
;1h nmr(400mhz,cd3od-d4)δ9.54(s,1h),7.60~7.84(m,2h),7.40(d,j=7.4hz,2h),7.31(d,j=7.4hz,2h),4.48(d,j=5.4hz,2h),2.81(s,3h),2.50(s,3h),2.42(s,3h),2.40(s,3h);
13
c nmr(101mhz,
cd3od-d4)δ176.73,140.55,138.15,137.99,133.35,129.89,129.57,129.33,126.69,124.78,119.91,119.00,36.93,36.73,21.13,15.47。
[0054]
本发明采用hplc测定唑吡坦的hplc纯度,色谱条件如下:
[0055]
色谱柱:ymc triart-c
18
柱(4.6mm
×
250mm,5μm)或效能相当的色谱柱;
[0056]
流动相:流动相a:硫酸钠水溶液(取无水硫酸钠2.84g与三氟乙酸1ml,加水溶解并稀释至1000ml),流动相b:乙腈,梯度洗脱;
[0057]
柱温:35℃;
[0058]
检测波长:248nm;
[0059]
流速:1.0ml/min;
[0060]
进样量:20μl;
[0061]
其中,唑吡坦的保留时间为18.7min左右。
[0062]
洗脱梯度如表1所示:
[0063]
表1洗脱梯度表
[0064][0065]
以下各实施例中,未详细描述的各种过程和方法是本领域中公知的常规方法。
[0066]
中间体ii的合成
[0067]
实施例1
[0068]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入hcl的饱和甲醇溶液(784ml)中,控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯,收率95.6%,hplc纯度99.87%。
[0069]
实施例2
[0070]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入hbr的饱和乙醇溶液(523ml)中,控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸乙酯,收率92.3%,hplc纯度99.65%。
[0071]
实施例3
[0072]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入hcl的饱和甲醇溶液(470ml)中,控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯
(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯,收率86.4%,hplc纯度99.32%。
[0073]
实施例4
[0074]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入hcl的饱和乙醇溶液(1045ml)中,控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸乙酯(中间体ii-2),收率91.5%,hplc纯度99.70%。
[0075]
实施例5
[0076]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入hcl的饱和甲醇溶液(1097ml)中,控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯(中间体ii-1),收率85.3%,hplc纯度98.97%。
[0077]
实施例6
[0078]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入硫酸/乙醇溶液(4mol/l,157ml)中,密闭控温110℃至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸乙酯,收率92.2%,hplc纯度99.65%。
[0079]
实施例7
[0080]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入硫酸/乙醇溶液(1mol/l,392ml)中,密闭控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸乙酯,收率90.1%,hplc纯度99.56%。
[0081]
实施例8
[0082]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入硫酸/乙醇溶液(4.5mol/l,105ml)中,密闭控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸乙酯,收率86.6%,hplc纯度99.26%。
[0083]
实施例9
[0084]
控温-5~0℃,将2-(6-甲基-2-(4-甲基苯基)咪唑并[1,2-a]吡啶-3-基)乙腈(sm-1,26.13g,0.1mol)加入硫酸/甲醇溶液(0.8mol/l,445ml)中,密闭控温回流至反应结束后,将反应液降至室温,减压浓缩至干后,加入纯化水(500ml)中,饱和碳酸氢钠溶液调节ph至7,甲苯(200ml
×
3)提取,纯化水(200ml
×
2)洗涤,有机层无水硫酸钠干燥,过滤,滤液减压浓缩至干后,即为2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯,收率85.1%,hplc纯度98.86%。
[0085]
唑吡坦的合成
[0086]
实施例10
[0087]
将中间体2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯(14.72g,0.05mol)加入二甲胺的甲醇溶液(12mol/l,29ml,0.35mol)中,控温-5~0℃至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦,收率96.5%,hplc纯度99.92%。
[0088]
实施例11
[0089]
将中间体2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯(14.72g,0.05mol)加入二甲胺的乙醇溶液(12mol/l,16.6ml,0.2mol)中,控温-5~0℃至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦,收率92.5%,hplc纯度99.71%。
[0090]
实施例12
[0091]
将中间体2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯(14.72g,0.05mol)加入二甲胺的甲醇溶液(15mol/l,10ml,0.15mol)中,控温-5~0℃至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦,收率86.3%,hplc纯度99.35%。
[0092]
实施例13
[0093]
将中间体2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯(14.72g,0.05mol)加入二甲胺的异丙醇溶液(10mol/l,60ml,0.6mol)中,控温-5~0℃至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦,收率90.0%,hplc纯度99.75%。
[0094]
实施例14
[0095]
将中间体2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸甲酯(14.72g,0.05mol)加入二甲胺的甲醇溶液(8mol/l,81ml,0.65mol)中,控温-5~0℃至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦,收率85.9%,hplc纯度98.95%。
[0096]
实施例15
[0097]
将中间体2-(6-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)乙酸乙酯(15.42g,0.05mol)加入二甲胺的四氢呋喃溶液(12mol/l,29ml,0.35mol)中,控温-5~0℃至反应结束后,过滤,所得滤饼经乙腈重结晶后即为目标产品唑吡坦,收率94.3%,hplc纯度99.77%。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
