组合物以及解除细菌内毒素毒性的方法
相关申请的交叉引用
1.本技术要求于2019年5月31日提交的申请号为62/855,907的美国临时申请的权益。上述申请的全部内容在此通过引用完整地并入本技术中。电子序列表的引用
2.电子序列表的内容(“rhog_0100wp_st25.txt”;大小为7,766字节,创建于2020年6月1日)在此通过引用完整地并入本技术中。
技术领域
3.本技术公开的主题总体上涉及用于解除细菌内毒素的毒性的组合物和方法。
背景技术:
4.细菌内毒素(例如,脂多糖)的毒性是导致各种健康问题的重要因素。需要能够在体外和在体内解除细菌内毒素的毒性的新型试剂。
技术实现要素:
5.一方面,本技术提供一种包括工程化或天然存在的硫氰酸生成酶的组合物,所述硫氰酸生成酶包括磷酸结合模体。
6.在一些实施方案中,硫氰酸生成酶具有去磷酸化活性。在一些实施方案中,硫氰酸生成酶能够使细菌内毒素去磷酸化。在一些实施方案中,细菌内毒素是脂多糖(lps)或脂磷壁酸(lta)。在一些实施方案中,磷酸结合模体包括cx1x2x3x4x5r表示的序列,其中x1包括1个氨基酸,x2包括1个氨基酸,x3包括1个氨基酸,x4包括1个氨基酸,以及x5包括1个氨基酸。在一些实施方案中,x1是e或r;x2是y、f、e、t、k或g;x3是s或g;x4是s或g;x5是v或e。
7.在一些实施方案中,磷酸结合模体包括seq id no.3-15所示的序列。在一些实施方案中,磷酸结合模体包括seq id no.3所示的序列。在一些实施方案中,硫氰酸生成酶包括seq id no.16所示的序列。在一些实施方案中,硫氰酸生成酶是或来自哺乳动物肠道硫氰酸生成酶、人类硫氰酸生成酶,或牛肝脏硫氰酸生成酶。
8.在一些实施方案中,组合物包括一种或一群产生硫氰酸生成酶的微生物。在一些实施方案中,所述微生物是益生菌。在一些实施方案中,组合物是食品、营养配方、乳制品,或其组合。在一些实施方案中,食品包括植物的一部分。在一些实施方案中,乳制品是非巴氏奶、部分巴氏乳、乳成分,或乳脂球膜成分。
9.另一方面,本技术提供药物制剂包括本发明所述的组合物药物制剂。在一些实施方案中,药物制剂还包括稳定剂、活化剂、载体、渗透剂、推进剂、消毒剂、保护剂、稀释剂、营养剂、赋形剂,或它们的组合。在一些实施方案中,药物制剂是疫苗。
10.一方面,本技术提供了一种治疗细菌内毒素诱发的健康状况的方法,该方法包括向需要的受试者施用包括有效数量的硫氰酸生成酶的组合物,其中所述硫氰酸生成酶能够解除细菌内毒素的毒性。在一些实施方案中,所述组合物是本技术的工程化、非天然存在的
sambrook);current protocols in molecular biology(1987)(f.m.ausubel et al.eds.);the series methods in enzymology(academic press,inc.):pcr 2:a practical approach(1995)(m.j.macpherson,b.d.hames,and g.r.taylor eds.):antibodies,alaboratory manual(1988)(harlow and lane,eds.):antibodies a laboratory manual,2
nd edition 2013(e.a.greenfield ed.);animal cell culture(1987)(r.i.freshney,ed.);benjamin lewin,genes ix,published by jones and bartlet,2008(isbn 0763752223);kendrew et al.(eds.),the encyclopedia of molecular biology,published by blackwell science ltd.,1994(isbn0632021829);robert a.meyers(ed.),molecular biology and biotechnology:acomprehensive desk reference,published by vch publishers,inc.,1995(isbn 9780471185710);singleton et al.,dictionary of microbiology and molecular biology 2nd ed.,j.wiley&sons(new york,n.y.1994),march,advanced organic chemistry reactions,mechanisms and structure 4th ed.,john wiley&sons(new york,n.y.1992);and marten h.hofker and jan van deursen,transgenic mouse methods andprotocols,2
nd edition(2011).
20.如本文所使用的,单数形式“一个(a)”、“一个(an)”和“所述(the)”包括单数和复数指示物,除非上下文明确规定另有说明。
21.术语“任选的(optional)”或“任选地(optionally)”是指随后描述的事件、情况或取代基可能发生,也可能不发生,并且该描述包括事件或情况发生的实例和不发生的实例。
22.通过端点表示数值范围的引述包括所有数字和包含在相应范围内的分数,以及所引述的端点。
23.术语“约”相对于参考数值及其语法等效物,如本文所用的,可以包括数值本身以及从该数值上加上或减去10%的数值范围。例如,“约10”的量包括10和从9到11的任意量。例如,术语“约”相对于参考数值还可以包括从该值加或减10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的值。
24.如本文所用的,“生物样品”可以包含整个细胞和/或活细胞和/或细胞碎片。生物样品可以含有(或衍生自)“体液”。在本发明包括的实施方案中,体液选自羊水、房水、玻璃体液、胆汁、血清、母乳、脑脊液、耵(耳垢)、乳糜、食糜、内淋巴、外淋巴、渗出物、粪便、女性射液、胃酸、胃液、淋巴液、粘液(包括鼻腔引流和痰液)、心包液、腹膜液、胸膜液、脓液、炎症分泌物(pus)、唾液、皮脂(皮肤油)、精液、痰液、滑液、汗液、眼泪、尿液、阴道分泌物、呕吐物以及它们的一种或多种的混合物。生物样品包括细胞培养物、体液、体液细胞培养物。体液可以从哺乳动物生物体中获得,例如通过穿刺或其他收集或取样程序。
25.术语“受试者”、“个体”和“患者”在本文中可以互换使用,以指代脊椎动物,优选哺乳动物,更优选人类。哺乳动物包括但不限于鼠、猿猴、人类、农场动物、运动动物和宠物。还包括在体内获得或在体外培养的生物实体的组织、细胞及其后代。
26.术语“示例性的”在本文中用于表示用作示例、实例或说明。本文所述的“示例性的”的任何方面或设计不一定被解释为优于或优于其他方面或设计。相反,使用示例性一词旨在以具体的方式呈现概念。
27.衍生自一个物种的蛋白质或核酸意味着该蛋白质或核酸具有与该物种中的内源性蛋白质或核酸或其一部分相同的序列。衍生自该物种的蛋白质或核酸可以直接从该物种
的生物体中获得(例如,通过分离),或者可以通过例如,重组产生或化学合成来产生。
28.术语“蛋白质”和”多肽”是指包括通过肽键连接在一起的氨基酸的化合物,且可以互换使用。如本文所用的,其中“氨基酸序列”被引述为蛋白质或肽分子的氨基酸序列。“氨基酸序列”可以从编码蛋白质的核酸序列中推导出来。然而,诸如“多肽”或“蛋白质”之类的术语并不意味着将氨基酸序列限制为被推导的氨基酸序列,而是可以包括对被推导的氨基酸序列的翻译后修饰,例如氨基酸缺失、添加和修饰,例如糖基化和脂质部分的添加。此外,除非另有说明,否则使用非天然氨基酸(如d-氨基酸)来提高稳定性或药代动力学行为也落入术语“氨基酸序列”的范围。
29.以下对各种实施例进行描述。应当注意的是,具体实施方式并非旨在作为详尽的描述或作为对本文所讨论的更广泛方面的限制。结合特定实施例描述的一个方面不一定限于该实施例,并且与任何其他实施例一起实践。本说明书中通篇提及的“一个实施方案(one embodiment)”、“一个实施例(an embodiment)”、“一个示例实施例”,是指与该实施例相关的特定特征、结构或特性被包括在本发明的至少一个实施方案中。因此,短语“在一个实施方案中(in one embodiment)”、“在一个实施方案中(in an embodiment)”或“一个示例实施方案”在整个说明书中的各个地方出现并不一定都是,而是可能指同一实施方案。此外,这些特定特征、结构或特性可以以任何合适的方式组合,如本领域技术人员从本公开内容中,在一个或多个实施方案中显而易见的那样。此外,虽然本文中描述的一些实施方案包括一些但不包括在其他实施方案中的其他特征,但不同实施方案的特征的组合意味着在本发明的范围内。例如,在所附权利要求中,任何要求保护的实施方案都可以任意组合使用。
30.所有出版物、已发表的专利文献和专利申请在此通过引用并入本技术中,其程度与每一份出版物、已公开的专利文献或专利申请被具体和单独地指出为通过引用而并入的程度相同。概述
31.本技术提供用于解除细菌内毒素的毒性的组合物和方法。一方面,本技术提供包括工程化或天然存在的硫氰酸生成酶的组合物,或其功能结构域。工程化或天然存在的硫氰酸生成酶可以包括磷酸结合模体。硫氰酸生成酶可以通过去磷酸化解除一种或多种细菌内毒素(例如,lps)的毒性。
32.另一方面,本技术还包括解除细菌内毒素的毒性的方法及相关应用。在一些实施方案中,所述应用包括治疗健康状况的方法,例如,细菌内毒素引起的病症,通过向需要的受试者给予包括硫氰酸生成酶或其变体的组合物。在某些实施方案中,所述应用包括解除在体外例如在药物制剂或细菌中产生的产品中的细菌内毒素的毒性的方法。
33.在一些实施方案中,本技术提供了一种用于多种疾病的蛋白质、多核苷酸和/或载体。由于其器官的分布,蛋白质可能在治疗涉及胃肠道、儿童皮肤、肝脏、肺、脑、脂肪组织或骨骼的疾病中特别有用。在一些实施方案中,本技术提供一种用于治疗肾脏疾病的蛋白或多核苷酸和/或载体。组合物
34.一方面,本技术提供了包括硫氰酸生成酶、其功能片段和/或其变体的组合物。所述组合物还可以包括适合于硫氰酸生成酶的各种应用的成分。硫氰酸生成酶
66.doi:10.1002/pro.2225.)。同源蛋白质可能但不一定在结构上相关,或者仅在结构上部分相关。
41.在一些实施方案中,硫氰酸生成酶可以是来自真核生物例如,哺乳动物的硫氰酸生成酶。哺乳动物硫氰酸生成酶的例子包括哺乳动物肠道硫氰酸生成酶、人类硫氰酸生成酶,或牛硫氰酸生成酶(例如,登录号p00586)。牛肝脏硫氰酸生成酶可以是牛肝脏硫氰酸生成酶。在一些实施例中,硫氰酸生成酶可以是人类硫氰酸生成酶或其变体。在某些实施方案中,硫氰酸生成酶可以来自原核生物,例如大肠杆菌。硫氰酸生成酶变体
42.硫氰酸生成酶可以是例如,工程化或非天然存在的变体形式的野生型硫氰酸酶生成与野生型对应物相比,硫氰酸生成酶变体可以包括一个或多个修改。硫氰酸生成酶的变体可以作为野生型硫氰酸生成酶。在替代情况下,工程化或非天然硫氰酸生成酶可具有降低或无硫转移酶活性。硫氰酸生成酶的变体可以具有除硫转移酶以外的活性,例如去磷酸化活性。
43.在一些实施方案中,硫氰酸生成酶或其变体包括一个或多个磷酸结合模体。磷酸结合模体可以结合到磷原子上。在某些情况下,磷酸结合模体包含硫氰酸生成酶的活性位点环。例如,硫氰酸生成酶的活性位点环包括与人类硫氰酸生成酶(登录号:baa13327)的248-253位氨基酸相对应的氨基或包括序列crkgvt(seq id no.2)。
44.在其他情况下,磷酸结合模体包含硫氰酸生成酶的修饰的活性位点环。在一些实施方案中,活性位点环的氨基酸残基具有宽的变异性,这与硫氰酸生成酶及其变体所发挥的独特的生物学功能有关。例如,氨基酸残基可以在活性位点环中变异(例如,修饰、插入或删除)以改变活性环与配体的结合亲和力和/或特异性。例如,磷酸结合模体可以在活性位点环路中具有一个或多个额外的氨基酸残基(例如,额外的1、2、3或更多个氨基酸)。这种修饰的活性位点环可以具有更宽的、能够容纳磷原子的催化口袋,磷原子的范德华半径略大于硫原子。可选地或附加地,磷酸结合模体可以在活动站点环路中具有一个或多个氨基酸置换。从该结构元件延伸的氨基酸侧链可以限定催化口袋的脊,并且可以在底物识别和磷的催化活性中发挥作用。
45.在一些实施方案中,磷酸结合模体包括cx1x2x3x4x5r所示的序列,其中,x1包括1个氨基酸,x2包括1个氨基酸,x3包括1个氨基酸,x4包括1个氨基酸,以及x5包括1个氨基酸。在一些实施例中,x1是e或r。在一些实施例中,x2是y、f、e、t、k或g。在一些实施例中,x3是s或g。在一些实施例中,x4是s或g。在一些实施例中,x5是v或e;x1为e或r,x2为y、f、e、t、k或g;x3为s或g;x4是s或g;x5是v或e。
46.磷酸结合模体的序列示例包括以下列出的那些序列:表1seq id no.序列3ceysgvr4cefsgvr5cregsvr6crysgvr7cetsgvr
8ceysgvr9ceysger10crksser11ceksser12cekgser13crgsser14cefsser15ceysser
47.在一些实施例中,硫氰酸生成酶变体是活性位点环序列crkgvt(seq id no.2)被seq id no.3-15所示的序列之一替换的人类硫氰酸生成酶。在一个特定的实施例中,硫氰酸生成酶变体包括:酸生成酶变体包括:多核苷酸和载体
48.在一些实施方案中,组合物包含一种或多种编码硫氰酸生成酶,或其功能片段,或其变体的多核苷酸。在一些实施方案中,组合物可以包括载体,所述载体包括一种或多种编码硫氰酸生成酶,或其功能片段,或其变体的多核苷酸。
49.载体可以是病毒载体(例如,腺病毒载体、慢病毒载体或腺相关病毒载体),其中病毒衍生的dna或rna序列存在于用于包装进入病毒的载体中。病毒载体还包括由病毒携带的、用于转染到宿主细胞中多核苷酸。某些载体能够在它们所引入的宿主细胞中自主复制(例如具有细菌复制起点的细菌载体和附加体型哺乳动物载体)。其他载体(例如,非附加体型哺乳动物载体)在被引入宿主细胞后被整合到宿主细胞的基因组中,从而随着宿主基因组一起被复制。
50.某些载体可能能够引导与其可操作连接的基因的表达。这种载体在本文中被称为“表达载体”。重组dna技术中常用的表达载体通常以质粒的形式存在。载体可以是重组表达载体,包括本发明的、以适合于在宿主细胞中表达核酸的形式存在的核酸,这意味着重组表达载体包括一个或多个调节元件,其可以基于拟被用于表达的宿主细胞进行选择,宿主细
胞可操作地连接至拟被表达的核酸序列。如本文所使用的,“可操作地连接”意指着目标核苷酸序列以允许表达核苷酸序列的方式与调节性元件相连接。(例如,在载体引入宿主细胞时,表达在体外转录/翻译系统中或表达在宿主细胞中)。药物制剂
51.本文进一步提供的还包括药物制剂。药物制剂可以包括硫氰酸生成酶,其功能片段、或其变体。该制剂可以包括治疗有效量的活性成分(例如,硫氰酸生成酶,其功能片段,或其变体)以及药学上可接受的载体。药物制剂还可以包括稀释剂、填充剂、盐、缓冲剂,稳定剂,增溶剂,活化剂、渗透剂、推进剂、消毒剂、保护剂、稀释剂、营养剂、赋形剂以及本领域熟知的其他材料,或它们的组合。药物制剂可以以盐的形式施用,前提是这些盐在药学上是可接受的。盐可以使用有机合成化学领域的技术人员已知的标准程序来制备。
[0052]“药物制剂”是指通常含有赋形剂的组合物,例如,所述赋形剂是本领域常规的且适合于施用至细胞或受试者的药学上可接受的载体。本专利说明书中通篇使用的“药学上可接受的”与本领域相一致且是指与药物组合物的其他成分相容且对药物组合物的接受者无害。在一些情形下,药物制剂是疫苗。
[0053]
药物制剂可以包括一种或多种载体或赋形剂。载体或赋形剂的实例包括任何和所有的溶剂、稀释剂、缓冲液(例如,中性缓冲盐水或磷酸盐缓冲盐水)、增溶剂、胶体、分散介质、溶媒(vehicle)、填充剂、螯合剂(例如,edta或谷胱甘肽)、氨基酸(例如,甘氨酸),蛋白质、崩解剂、粘合剂、润滑剂、润湿剂、乳化剂、甜味剂、着色剂、调味剂、芳香剂、增稠剂、用于达到仓储效应(depot effect)的试剂、包衣剂、抗真菌剂、防腐剂、稳定剂、抗氧化剂、张力控制剂、吸收延迟剂等。这种材料可以是无毒的,并且不应干扰细胞或活性组分的活性。载体或赋形剂或其他材料的精确性质可取决于给药途径。例如,药物制剂可以是肠胃外可接受的水溶液的形式,其不含热原并具有合适的ph值、等渗性和稳定性。
[0054]
所述药物制剂的形式可以是例如片剂、胶囊剂、丸剂、粉末剂、颗粒剂、悬浮剂、乳剂、溶液剂、凝胶剂(包括水凝胶)、糊剂、软膏剂、箱剂、硬膏剂、灌药剂(drench)、注射剂、植入物、喷雾剂,或气溶胶。
[0055]
药物制剂可以包括一种或多种药学上可接受的盐。术语“药学上可接受的盐”是指由药学上可接受的无毒碱或酸制备的盐,包括无机碱或有机碱和无机酸或有机酸。衍生自无机碱的盐包括铝盐、铵盐、钙盐、铜盐、铁盐、亚铁盐、锂盐、镁盐、锰盐、亚锰盐、钾盐、钠盐、锌盐等。特别优选的是铵盐、钙盐、镁盐、钾盐和钠盐。衍生自药学上可接受的有机无毒碱的盐包括伯胺、仲胺和叔胺的盐;取代的胺,包括天然存在的取代胺、环胺;以及碱性离子交换树脂,如精氨酸、甜菜碱、咖啡因、胆碱、n,n
′‑
二苄基乙二胺、二乙胺、2-二乙氨基乙醇、2-二甲基氨基乙醇、乙醇胺、乙二胺、n-乙基吗啉、n-乙基哌啶、葡萄糖胺、氨基葡萄糖、组氨酸、哈胺(hydrabamine)、异丙胺、赖氨酸、甲基葡萄糖胺、吗啉、哌嗪、哌啶、聚胺树脂、普鲁卡因、嘌呤、可可碱、三乙胺、三甲胺、三丙胺、三羟甲基氨基甲烷等。药学上可接受的盐的实例包括所有可接受的盐、例如醋酸盐、乳酸盐、苯磺酸盐、月桂酸酯、苯甲酸盐、苹果酸盐、碳酸氢盐、马来酸盐、硫酸氢盐、扁桃酸盐、酒石酸氢盐、甲磺酸盐、硼酸盐、甲基溴化物、溴化物、甲基硝酸盐、乙二胺四乙酸钙盐、甲基硫酸盐、樟脑磺酸盐、粘酸盐、碳酸盐、萘磺酸盐、氯化物、硝酸盐、克拉维酸盐、n-甲基葡萄糖胺盐、柠檬酸盐、铵盐、乙二胺四乙酸盐、草酸盐、乙二胺四乙酸盐、草酸盐、乙二磺酸盐、帕莫酸盐(恩波酸盐(embonate))、依托酸盐
(estolate)、棕榈酸盐、乙磺酸盐(esylate)、泛酸盐、富马酸盐、磷酸盐/二磷酸盐、葡庚糖酸盐(gluceptate)、聚半乳糖苷酸盐、葡糖酸盐、水杨酸盐、谷氨酸盐、硬脂酸酯、对羟乙酰氨基苯胂酸盐(glycollylarsanilate)、硫酸盐、己基间苯二酚盐、碱式醋酸盐、海巴明盐(hydrabamine)、琥珀酸盐、氢溴酸盐、单宁酸盐、盐酸盐、酒石酸盐、羟基萘酚盐、茶氯酸盐、碘化物、甲苯磺酸盐、异硫酸盐、三乙基碘化物、乳酸盐、帕诺酸盐(panoate)、戊酸盐等,其可以用作改变溶解度或水解特性的剂型,或可以用于缓释或促药制剂。可以理解,如本文所使用的,对特定试剂(例如,神经介素u受体激动剂或拮抗剂)的引用还包括其药学上可接受的盐。
[0056]
在一些实施方案中,药物制剂可以是缓释制剂。缓释制剂的实例包括含有本发明蛋白质的固体疏水性聚合物的半透性基质,该基质以有形制品例如,薄膜或微胶囊形式呈现。缓释基质的实例包括聚酯、水凝胶(例如,聚(2羟乙基甲基丙烯酸酯)或聚(乙烯醇))、聚乳酸、l-谷氨酸和γ-乙基-l-谷氨酸的共聚物、不可降解的乙烯-醋酸乙烯酯、可降解的乳酸-乙醇酸共聚物,以及聚-d-(-)-3-羟基丁酸。
[0057]
当本发明的包封蛋白质可能在体内长时间停留时,它们可能由于暴露在37℃的水气中而变性或聚集,导致生物活性的丧失和可能的免疫原性的变化。可以根据所涉及的机制制定合理的稳定化战略。例如,如果聚集机理是通过硫代二硫化物形成分子间的s-s键,则通过修饰巯基残基,从酸性溶液中冻干,控制水分含量,使用适当的添加剂以及开发特定的聚合物基质组合物来实现稳定。
[0058]
在一些实施方案中,本技术还包括一种用于向受试者施用药物制剂的递送装置或系统。递送装置或系统的实例包括封装在脂质体、微粒、微胶囊、微细胞、聚合物、胶囊、片剂等中。在一个实施方案中,递送装置是脂质体。在脂质体中,活性成分除其他药学上可接受的载体外,还与两亲性试剂(例如脂质体)结合,该脂质体其以胶束、不溶性单层、液晶或层状物的聚集形式存在于水溶液中。用于脂质体制剂的合适脂质包括但不限于甘油单酯、甘油二酯、硫酸脑苷脂(sulfatide)、溶血卵磷脂、磷脂、皂苷、胆汁酸等。在另一个实施方案中,药物制剂可以在控释系统中递送,控释系统包括但不限于:输送泵(参见,例如,saudek等人,new engl.j.med。321:574(1989)and a semi-permeable polymeric material(例如,参见howard等人,j.neurosurg.71:105(1989))。此外,控释系统可以放置在治疗靶点(例如,肿瘤或感染组织)附近,因此只需要全身剂量的一小部分。例如,参见goodson,in:medical applications of controlled release,1984.(crc press,boca raton,fla.).
[0059]
在一些实施方案中,药物制剂包含有效量的活性成分(例如,硫氰酸生成酶、其功能片段或其变体,和/或一种或多种调节剂)。术语“有效量”是指研究人员、兽医、医生或其他临床医生正在寻求的组织、系统、动物或人类中能够引起生物或药物反应,特别是可以预防或减轻正在治疗的疾病或病症的一种或多种局部或全身症状或特征的量。在一个特定实施方案中,活性成分的有效量可以解除细菌内毒素的毒性并改善由细菌内毒素(例如,它们的毒性)引起或与之相关的健康问题。
[0060]
在一些实施方案中,活性成分在治疗特定病症或病症中有效治疗的量取决于该病症或病症的性质,并且可以通过本领域技术人员的标准临床技术来确定。此外,体外测定可以任选地用于帮助确定最佳剂量范围。制剂中要使用的精确剂量还可以取决于给药途径,以及疾病或病症的整体严重程度,并且可以根据医生的判断和每个患者的情况来决定。在
某些实施方案中,主治医师可以给予低剂量的药物并观察患者的反应。可以施用较大剂量的药物,直到为患者获得最佳治疗效果,并且在那个点上剂量不会进一步增加。一般而言,药物的日剂量范围位于本领域已知的特定药物或生物制剂的范围内。有效剂量可以从体外或动物模型测试系统的剂量-反应曲线推断出来。在一些情形下,可以使用本发明的组合物来确定合适的治疗持续时间。剂量也会根据个体患者的年龄、体重和反应而变化。去免疫
[0061]
硫氰酸生成酶在药物制剂中的可能被去免疫。硫氰酸生成酶可以被去免疫以使其对给定物种(例如人类)无免疫原性或免疫原性较低。在一些实施方案中,硫氰酸生成酶的序列已被改变以消除一个或多个b-或t-细胞表位。去免疫可以通过多肽的结构改变来实现。可以采用本领域技术人员已知的任何去免疫技术。用于去免疫蛋白质的一种合适的技术,例如,在wo 00/34317中描述,其公开内容全部并入本技术中。酶稳定化和药代动力学技术
[0062]
硫氰酸生成酶(例如,那些从天然来源分离的以及工程化的硫氰酸生成酶)可用于诊断和疾病治疗。替代的磷酸酶(例如,具有去磷酸化活性的硫氰酸生成酶)具有例如改变的(例如,提高的)比活(specific activity)、稳定性(例如,体内t
1/2
,或储存稳定性(例如,保质期))或底物特异性。在一些实施例中,硫氰酸生成酶可以具有提高的热稳定性(例如,通过改变一些氨基酸序列(例如,引入与人类硫氰酸生成酶的e102d相对应的突变)。硫氰酸生成酶的稳定化可以通过对多肽的结构改变来实现。任何可以提高药代动力学技术的稳定化技术和策略都可用于提高硫氰酸生成酶的稳定性(包括热稳定性和血浆半衰期),包括但不限于使用fc融合或基因融合到白蛋白。其他示例性制剂
[0063]
在一些实施方案中,组合物可以包括替代制剂或除药物制剂以外的替代制剂。这种替代制剂还可以包含硫氰酸生成酶、其功能片段或其变体。这种替代制剂的实例包括食物、食品、乳制品以及细胞和微生物。
[0064]
在一些实施例中,本技术所提供的包括食物或食品,所述食物或食品包括硫氰酸生成酶、其功能片段或其变体。食物或食品的例子包括肉类、蔬菜、植物、水果和面粉类产品。在某些情况下,食品包括来自生物(例如,动物或植物)的成分和/或一种或多种调节剂,所述生物体表达或经基因修饰以表达硫氰酸生成酶,其功能片段或其变体。所述食品可以来自生物(例如,动物、植物、真菌或微生物),所述经基因修饰以表达所需硫氰酸生成酶、其功能片段或其变体。在一些实施例中,食品包括有效调节受试者的胃肠道菌群水平的硫氰酸生成酶(tst)的量。在一些实施例中,组合物是一种包括硫氰酸生成酶的饮料产品,所述硫氰酸生成酶的量可以有效调节受试者的胃肠道菌群水平。
[0065]
在一些实施例中,本技术提供的包括乳制品,例如,牛奶、黄油、奶酪、奶油和酸奶。在某些实施例中,乳制品包括非巴氏杀菌乳制品或部分巴氏乳或乳成分。在一个特定的实施例中,乳制品包括乳脂肪球膜成分。在某些情况下,乳制品可以来自表达硫氰酸生成酶、其功能片段或其变体的动物(例如,奶牛)。
[0066]
在一些实施例中,本技术所提供的包括微生物。微生物可以例如,通过分泌,产生(自然或通过基因工程)硫氰酸生成酶,其功能片段或其变体。在一些实施方案中,组合物包括益生菌。在一个实施例中,益生菌可以是分泌/产生重组人/牛肝脏硫氰酸生成酶的肠溶
包衣胶囊或可以是基因改造的益生菌胶囊。在另一个实施例中,益生菌可以是产生重组人类硫氰酸生成酶和/或牛肝脏硫氰酸生成酶的基因修饰的益生菌。在另一个实施例中,益生菌可以是分泌/生产人类和牛硫氰酸生成酶的基因修饰的益生菌。在另一个实施例中,益生菌可以是分泌/产生人类硫氰酸生成酶或营养配方的基因改造的益生菌。益生菌
[0067]
在一些实施方案中,微生物是益生菌。术语“益生菌”或“有益微生物(益生微生物)”是指通过改善肠道微生物平衡而有益地影响受试者的非致病微生物。这样的有益微生物可以优选自抗炎微生物和/或选自乳酸菌和双歧杆菌。乳酸菌包括所有的种、亚种以及以下所列的属的菌株:人肉杆菌、肠球菌、乳酸菌、乳球菌、明串珠菌,以及培多球菌。还包括链球菌属的非致病物种、亚种和菌株,如链球菌唾液亚种。嗜热性或嗜热链球菌。
[0068]
所述微生物可以是乳酸杆菌属,例如,耐乙酰乳酸杆菌、酸性乳杆菌、嗜酸乳杆菌、敏捷乳杆菌、低温乳杆菌、消化乳杆菌,解淀粉乳杆菌,嗜淀粉乳杆菌,嗜淀粉乳杆菌,动物乳杆菌,亚利桑那乳杆菌,鸟乳杆菌,双发酵乳杆菌、短乳杆菌、布氏乳杆菌、干酪乳杆菌、腔肠乳杆菌(lactobacillus coelohominis)、丘状乳杆菌、棒状乳杆菌棒状亚种、棒状乳杆菌扭曲亚种、卷曲乳杆菌、弯曲乳杆菌、塞浦路斯干酪乳杆菌(lactobacillus cypricasei)、德氏乳杆菌保加利亚亚种、德氏乳杆菌德氏亚种、德氏乳杆菌乳亚种、德氏乳杆菌亚种、榴莲乳杆菌(lactobacillus durianus)、equi乳杆菌、费氏乳杆菌(lactobacillus farciminis)、费伦托什乳杆菌(lactobacillus ferintoshensis)、发酵乳杆菌、蚂蚁乳杆菌(lactobacillus formicalis)、噬果糖乳杆菌、弗氏乳杆菌(lactobacillus frumenti)、格氏乳杆菌(lactobacillus gasseri)、草乳杆菌(lactobacillus graminis)、仓鼠乳杆菌、瑞士乳杆菌、瑞士乳酸菌酸奶亚种(lactobacillus helveticus subsp.jugurti)、异型腐酒乳杆菌(lactobacillus heterohiochii)、希氏乳杆菌(lactobacillus hilgardi)、同型腐酒乳杆菌(lactobacillus homohiochii)、肠乳杆菌、日本乳杆菌、詹氏乳杆菌(lactobacillusjensenii)、约氏乳杆菌、开菲尔乳杆菌、泡菜乳杆菌(lactobacillus kimchii)、昆基乳杆菌(lactobacillus kunkeei)、莱希曼氏乳杆菌、莱蒂乳杆菌(lactobacillus letivazi)、林氏乳杆菌(lactobacillus lindneri)、坏发酵乳杆菌(lactobacillus malefermentans)、马里乳杆菌、麦芽糖乳杆菌(lactobacillus maltaromicus)、噬肉乳杆菌(lactobacillus manihotivorans)、明德乳杆菌(mindensis乳杆菌)、黏液乳杆菌(lactobacillus mucosae)、鼠乳杆菌、纳格利乳杆菌(lactobacillus nagelii)、口乳杆菌、面包乳杆菌、豹乳杆菌(lactobacillus pantheri)、类布赫内氏乳杆菌乳杆菌(lactobacillus parabuchneri)、副干酪乳杆菌副干酪亚种、副干酪乳杆菌假植物亚种、副干酪乳杆菌耐受亚种、类开菲尔乳杆菌(lactobacillus parakefiri)、类扁平乳杆菌(lactobacillus paralimentarius)、类植物乳杆菌(lactobacillus paraplantarum)、戊糖乳杆菌、恶味乳杆菌(lactobacillus perolens)、植物乳杆菌、桥杆菌(lactobacillus pontis)、鹦鹉嘴乳杆菌(lactobacillus psittaci)、罗伊氏乳杆菌、鼠李乳杆菌、瘤胃乳杆菌、沙克乳酸杆菌(lactobacillus sakei)、唾液乳杆菌、唾液乳杆菌水杨素亚种(lactobacillus salivarius subsp.salicinius)、唾液乳杆菌唾液亚种、旧金山乳杆菌、尖乳杆菌、斯瓦比寡食乳杆菌(lactobacillus suebicus)、嗜热乳杆菌、耐热乳杆菌、牛痘乳杆菌、阴道乳杆菌、费斯莫尔德乳杆菌(lactobacillus versmoldensis)、小牛肉
葡萄球菌(staphylococcus vitulinus)、蚯蚓乳杆菌(lactobacillus vermiforme)、玉米乳杆菌。在一个实施例中,所述微生物是植物乳杆菌。
[0069]
所述微生物可以是双歧杆菌属、例如,青春双歧杆菌、嗜气双歧杆菌、角双歧杆菌、动物双歧杆菌、星状双歧杆菌、两歧双歧杆菌、牛双歧杆菌、短双歧杆菌、链状双歧杆菌、球囊双歧杆菌、棒状双歧杆菌、兔双歧杆菌、齿双歧杆菌、高卢双歧杆菌(bifidobacterium gallicum)、鸡胚双歧杆菌(bifidobacterium gallinarum)、印度歧杆菌(bifidobacterium indicum)、长双歧杆菌、长双歧杆菌长亚种(bifidobacterium longum bv.longum)、长双歧杆菌婴儿亚种,长双歧杆菌猪亚种大双歧杆菌(bifidobacterium magnum)、瘤胃双歧杆菌(bifidobacteriummerycicum)、最小双歧杆菌(bifidobacterium minimum)、假小链双歧杆菌(bifidobacterium pseudocatenulatum)、假长双歧杆菌球形亚种(bifidobacterium pseudolongum subsp.globosum)、假长双歧杆菌假长亚种(bifidobacterium pseudolongum subsp.pseudolongum)、嗜冷双歧杆菌(bifidobacterium psychroaerophilum)、雏双歧杆菌(bifidobacterium pullorum)、反刍双歧杆菌、世纪双歧杆菌(bifidobacterium saeculare)、斯卡多维双歧杆菌(bifidobacterium scardovii)、枯草双歧杆菌(bifidobacterium subtile)、嗜酸热双歧杆菌、嗜酸热双歧杆菌猪亚种、嗜热双歧杆菌、嗜草双歧杆菌、尿双歧杆菌(bifidobacterium urinalis)。
[0070]
在一些实施例中,所述益生菌的例子包括布拉氏酵母菌;鼠李糖乳杆菌gg;植物乳杆菌299v;丁酸梭状芽胞杆菌m588;艰难梭菌vp20621(无毒艰难梭菌菌株);干酪乳杆菌和嗜酸乳杆菌的组合;干酪乳杆菌、保加利亚乳酸杆菌和嗜热链球菌的组合;嗜酸乳杆菌和两歧双歧杆菌的组合;嗜酸乳杆菌、德氏乳杆菌保加利亚亚种、干酪乳乳杆菌保(lactobacillus bulgaricus casei)、植物乳杆菌(lactobacillus bulgaricus plantarum)、长双歧杆菌、婴儿双歧杆菌、短双歧杆菌、唾液链球菌嗜热亚种。治疗方法
[0071]
另一方面,本技术提供了治疗由细菌内毒素产生或与之相关的健康状况的方法。例如,该健康状况可能由细菌内毒素的毒性引起或与之有关。
[0072]
总体而言,所述方法包括向有需要的受试者施用本技术所述的组合物或药物制剂,例如,包括硫氰酸生成酶或其功能域的组合物或药物制剂,其中,所述硫氰酸生成酶能够解除细菌内毒素的毒性。
[0073]
在一些实施例中,所述方法包括以口服方式给予所述组合物。在一些实施例中,所述方法包括以局部方式施用所述组合物。在某些情况下,施用是将组合物递送到胃肠道的粘膜层和/或与例如上消化道粘膜硫氰酸生成酶络合。在一个特定的实施例中,组合物被施用到哺乳动物胃肠道的粘膜组织,用于胃肠道粘膜层的原位解毒和/或络合。在一些实施例中,所述方法包括通过静脉输注来施用组合物。施用可以通过肠胃外、直肠、口服或局部、静脉内、肌肉内、皮下、腹膜、室周围、鼻腔、肺或粘膜的方式进行。
[0074]
在一些实施方案中,所述方法包括在手术时或几乎与手术(例如,并行)同时或在受试者遭受外伤后尽快(例如,在2、4、6、8、10、12、24、48或96小时内)给予所述化合物。
[0075]
在一些实施方案中,所述方法还包括例如,在组合物之前、同时或之后给予抗生素。在这样的方法中,硫氰酸生成酶的量可以是,例如,约1至10,000单位,例如,1至200、200至500、500至1,000、1,000至5,000,或5,000至10,000单位。更高的剂量,例如,10,000至50,
000单位,也是可能的。这些剂量可以在一个或多个小时或天数内施用。如本技术所用的,一个单位是指在测定方法的规定条件下每分钟催化转化1微摩尔底物的酶的量。例如,本技术所用的硫氰酸生成酶的单位可以指在实施例1和2所述测定条件下每分钟催化1微摩尔底物去磷酸化的硫氰酸生成酶的量。
[0076]
内毒素可能来自革兰氏阳性菌。内毒素可能来自梭状芽胞杆菌(例如,艰难梭菌)、埃希氏杆菌(例如,大肠杆菌)、博德特氏菌属、布兰克菌属(blanchamera)、沙门氏菌、嗜血杆菌、克雷伯氏菌、变形杆菌、肠杆菌、假单胞菌、巴氏杆菌、不动杆菌、衣原体、和奈瑟菌属。在一个实施例中,内毒素是lps。在另一个实施例中,内毒素来自艰难梭菌(c.diff)。在另一个实施例中,内毒素来自大肠杆菌。在一个特定的实施例中,内毒素是来自c.diff的lps。在另一个实施例中,内毒素是来自大肠杆菌的lps。内毒素的例子包括脂多糖(lps)、脂质a,脂磷壁酸(lta)和脂寡糖(los)。
[0077]
这些方法可以包括通过灌注(irrigation)受感染区域来施用组合物。这些方法还可以包括将组合物局部施用于受感染的区域。
[0078]
健康状况的例子包括细菌感染(例如,革兰氏阴性菌的感染)、肠道疾病、艰难梭菌感染、胃肠道菌群调节、抗生素相关性腹泻(aad)、胃肠道感染、腹部感染、细菌过度生长交替、小肠细菌生长过度、败血症、感染性休克、全身炎症反应综合征、脑膜炎球菌血症、外伤、失血性休克、烧伤、手术、器官移植、肝脏疾病、胰腺炎、小肠结肠炎、牙周病、肺炎、囊性纤维化、哮喘、冠心病、充血性心力衰竭、肾脏疾病、溶血性尿毒症综合征、阿尔茨海默病、类风湿性关节炎、狼疮、系统性红斑狼疮、代谢紊乱、肥胖、糖尿病、血脂异常、胰岛素抵抗综合征、代谢综合征、脂肪性肝炎、脂肪肝、非酒精性脂肪肝脏疾病、高血糖症、葡萄糖不耐症、糖耐量受损、胰岛素抵抗、高脂血症、高甘油三酯血症、高胆固醇血症、低hdl水平、高hdl水平、腹部肥胖、动脉粥样硬化、高血压,以及心血管疾病。在一个实施例中、健康状况可以是宿主防御抗性。
[0079]
在一些实施例中,健康状况可以是lps介导的、lps引起的,或lps加重的疾病。在某些情况下,健康状况可以是由革兰氏阳性菌感染/lps引起的包括肾脏、肝脏、胃肠道、腹部感染和肺部损伤在内的疾病。
[0080]
在一些实施例中,该方法可用于调节受试者体内的胃肠道菌群水平,该方法包括向受试者施用硫氰酸生成酶或其变体的组合物,其施用的量足以有效增加胃肠道中共生菌的数量,减少胃肠道中致病菌的数量,或增加共生菌的数量并减少胃肠道中致病菌的数量,从而调节受试者的胃肠道菌群水平。其他示例性应用
[0081]
另一方面,本技术提供了制备试剂、疫苗和药物制剂的方法。在一些实施方案中,在初始制备时,试剂、疫苗和药物制剂可能包括细菌内毒素。这些方法可以包括将组合物与试剂、疫苗和药物制剂一起孵育,其中所述组合物解除细菌内毒素的毒性。
[0082]
在某些实施例中,可能期望在试剂、疫苗或药物制剂中含有细菌内毒素,但这样的应用可能受到内毒素毒性的限制。在这样的情形下,本技术中的组合物可用于解除内毒素的毒性。然后,毒性被解除的内毒素可用于试剂、疫苗或药物制剂,例如,作为疫苗中的佐剂或疫苗抗原。蛋白质制备
[0083]
硫氰酸生成酶,其片段及其变体可以通过本领域公知的重组技术进行制备。参见例如,green and sambrook,molecular cloning:alaboratory manual,4th edition(2012)。这些由重组技术生产的工程化多肽可以由多核苷酸表达。本领域技术人员将理解,编码这种工程化多肽的多核苷酸(包括dna和rna),可以从硫氰酸的cdna生成酶、其片段或其变体中获得,同时考虑到密码子使用的简并性,还可以根据需要进一步工程化以纳入所指定的置换。这些多核苷酸序列可以并入促进微生物宿主中mrna的转录和翻译的密码子。
[0084]
宿主细胞可以采用用于蛋白质生产的表达或克隆载体进行转化,并在常规营养培养基中培养,对培养基进行适当的修饰以诱导启动子,选择转化子或扩增编码目标序列的基因。用于产生本发明的蛋白质的宿主细胞可以在各种培养基中培养。市售培养基,如ham's f10(sigma)、最低必需培养基(mem)(sigma)、rpmi-1640(sigma)和dulbecco的modified eagle's培养基((dmem),sigma)适用于培养宿主细胞。必要时,可以补充激素和/或其他生长因子(如胰岛素、转铁蛋白或表皮生长因子)、盐(如氯化钠、钙、镁和磷酸盐)、缓冲液(如hepes)、核苷酸(如腺苷和胸苷)、抗生素(如gentamycintm药物)、微量元素(定义为通常以微摩尔范围内的最终浓度存在的无机化合物),以及葡萄糖或等效的能量来源。任何其他必要的补充剂也可以以本领域技术人员已知的适当浓度加入。培养条件,如温度、ph等,是先前用于宿主细胞选择表达的那些条件,并且对于技术人员而言是显而易见的。
[0085]
在某些情况下,蛋白质可以使用细胞翻译系统来制备。出于这样的目的,必须对编码多肽的核酸进行修饰,以允许体外转录以产生mrna,并允许在所使用的特定无细胞系统中对mrna进行无细胞翻译(真核生物如哺乳动物或酵母无细胞翻译系统或原核生物如细菌无细胞翻译系统)。
[0086]
在某些情况下,蛋白质可以通过化学合成(例如,通过solid phase peptide synthesis,2
nd ed.,1984,the pierce chemical co.,rockford,ill.)中描述的方法制备。蛋白质的修饰也可以通过化学合成来制备。
[0087]
蛋白质可以通过针对蛋白质化学领域通常已知的蛋白质的分离/纯化方法来纯化。非限制性实例包括萃取、重结晶、盐析(例如,用硫酸铵或硫酸钠)、离心、透析、超滤、吸附色谱、离子交换色谱、疏水色谱、正相色谱、反相色谱、凝胶过滤、凝胶渗透色谱、亲和色谱、电泳、逆流分布或其任何这些的组合。纯化后,多肽可以交换到不同的缓冲液中和/或通过本领域已知的各种方法中的任何一种进行浓缩,包括但不限于过滤和透析。
[0088]
纯化后的多肽优选具有至少85%的纯度,更优选至少95%的纯度,最优选至少98%的纯度。无论纯度的确切数值如何,多肽都是足够纯的,可以用作医药产品。实施例实施例1
–
解除斑马鱼中的细菌内毒素(lps)的毒性
[0089]
该实施例表明,内源性硫氰酸生成酶解除在肠上皮、肝脏、肾脏和肺部硫氰酸生成酶表达高的地方遇到的lps的毒性。首先,申请人通过将7dpf斑马鱼幼虫暴露于150μg/ml lps中,测试了去磷酸化的lps对斑马鱼的毒性是否更小,这些lps已经与牛肝脏硫氰酸生成酶(tst)进行了预孵育。预孵育的lps对斑马鱼完全无毒,而相同剂量的模拟处理的lps在5小时内引起100%的致死率。为了产生毒性解除的lps,将lps与来自牛肝的10u/ml硫氰酸生成酶在37℃下孵育5h,然后在80℃下孵育10分钟,以破坏硫氰酸生成酶活性。模拟处理的lps通过在相同条件下孵育lps而不添加牛硫氰酸生成酶酶而制备。
实施例2
–
工程化硫氰酸生成酶解除细菌内毒素(lps)的毒性
[0090]
申请人通过向人类硫氰酸生成酶进行突变来产生工程化硫氰酸生成酶。图2示出了重组人类硫氰酸生成酶的定点突变脱去大肠杆菌e.coli的lps的磷酸基。
[0091]
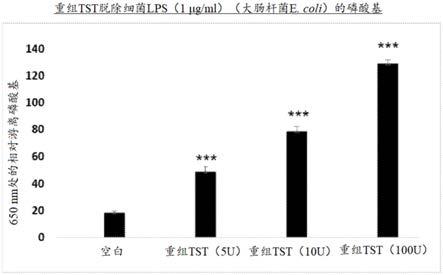
通过如图2所示的定点突变(sdm),工程化人类硫氰酸生成酶具有快速脱去大肠杆菌(e.coli)的lps的磷酸基的能力,如图3所示。定点突变的人类硫氰酸生成酶具有活性位点环,其由7个残基而不是野生型人类硫氰酸生成酶中的6个残基形成。这导致了一个更宽的催化口袋,该口袋容纳了一个范德华半径略大于硫原子的磷原子。为了测试工程化人类硫氰酸生成酶的解除毒性的功能(在图3中示出为“rectst(重组tst)”),lps与工程化人类硫氰酸生成酶(5-100单位/ml)在1μg/ml lps下预孵育30分钟。相反,阴性对照热灭活(95℃持续1h)工程化人类硫氰酸生成酶加入到反应混合物中,加入1μg/ml lps。为了检测从lps释放的无机磷(pi),加入孔雀石绿溶液(25μl)持续10分钟,然后由分光光度法的吸光度读数(650nm波长)测定活性,同时将chen kt等人,am j physiol gastrointest liver physiol2010 aug;299(2):g467-75)中所述的背景读数纳入考虑中。每次测定分三份进行。
[0092]
本发明的所描述的方法、药物组合物和试剂盒的各种修改和变化对于本领域技术人员来说是显而易见的,而不会偏离本发明的范围和精神。尽管已经结合具体实施例对本发明进行了描述,但可以理解的是,它能够进一步修改,并且如要求保护的本发明不应不适当地局限于这种具体的实施方案。实际上,对于本领域技术人员来说显而易见的用于实施本发明的所描述的模式的各种修改都旨在落在本发明的范围内。本技术旨在涵盖本发明的任何变型、使用或适配,总体上遵循本发明的原理并包括对本发明所属领域已知习惯做法的本技术的这种偏离,并且可以适用于之前阐述的本技术的的必要特征。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。