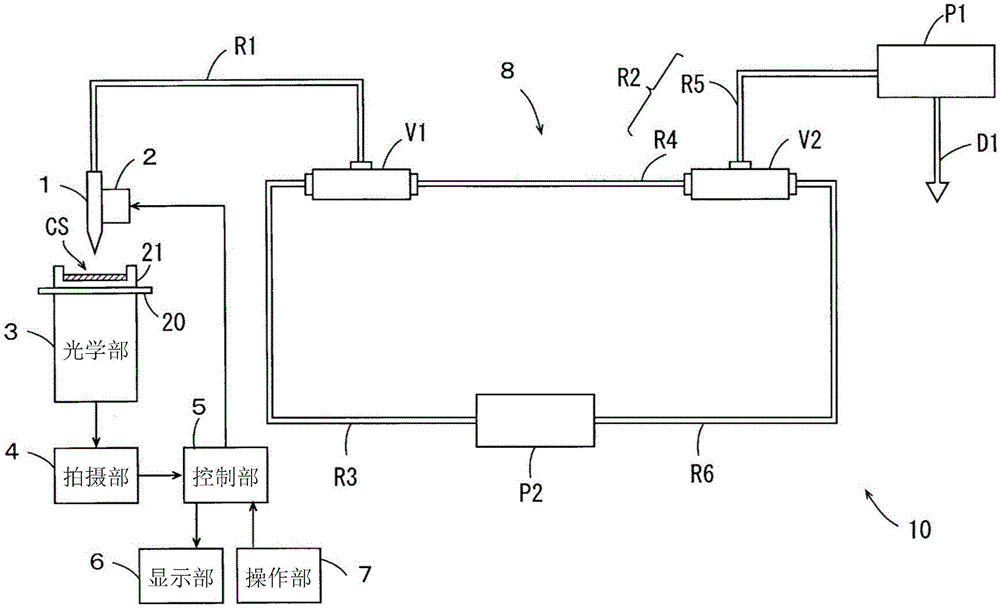
仅就美国而言,本申请是2016年9月1日提交的美国申请15/254,852(未决,未公开)的部分继续案,该美国申请要求2015年9月3日提交的美国临时申请62/213,880的优先权权益。上述优先权申请特此通过引用整体并入本文以用于所有目的。
技术领域
本申请一般涉及基于蛋白质的药物化合物的生产。它还涉及细胞的修饰和选择以及用目标基因转染这种细胞以获得细胞系以用于以高生产力生产具有改进的生物学和药理学特征的蛋白质。
背景技术
生物制剂构成了药物市场的不断增长的比例。它们比其他药物具有更高的特异性,从而导致副作用较小的更具针对性的疗效。随之而来的是对改进工业生产手段、具有更高生产力和更低成本的新兴需求。
一些治疗性蛋白质的治疗剂量和给药方案可能需要每位患者每年超过10g蛋白质。当前的蛋白质生产水平通常不超过每升培养液4g,更典型地低于每升2g。为了供应特定蛋白质产品的市场,每年可能需要生产400,000kg。这意味着需要处理1亿升培养基——约为40个尺寸的游泳池的体积——这反过来将需要几个耗资$10亿的专用制造设施。
在A.D.Bandaranayake and S.C.Almo,FEBS Lett 2014,588(2):253-260;以及T.Lai等人,Pharmaceuticals 2013,6:579-603中讨论了哺乳动物蛋白质生产的最新进展。在T.Omasa等人,Current Pharmaceutical.Biotechnology,2010:11,233-240;C.A.Wilkens and Z.P.Gerdzen,PLOS ONE,2015年3月13日;以及J.Y.Kim等人,Appl.Microbiol.Biotechnol.2012,93:917-930中对中国仓鼠卵巢(CHO)细胞的细胞工程和培养进行了综述。使用CRISPR/Cas 9等系统的多重基因组工程由L.Cong等人,Science 2013,339(6121):819-823;Y.Huang等人,J.Immunol.Methods 2007,322:28-39;J.S.Lee等人,Science Reports,February 25,2015;以及P.Mali等人,Nat.Methods 2013,10(10):957-963进行了综述。
美国专利5,607,845(Spira等人,Pharmacia&Upjohn)提出了一种用于使用融合方案获得生产细胞系的增加产量的方法。美国专利6,420,140(Hori等人,Abgenix Inc.)提出了通过细胞融合方法生产多聚体蛋白质。使用CRISPR/Cas9和CRISPy在CHO细胞中进行基因组编辑由C.Ronda等人,Biotechnol.Bioeng.2014,111:1604-1616进行了综述。
迄今为止描述的技术均不具有本发明的技术的特征和益处,如以下部分所述。
技术实现要素:
使用先前可用的技术,治疗性蛋白质(例如抗体)的生产昂贵,需要大量培养基和复杂的基础设施。本公开提供了基于每个细胞的显著增加的蛋白质产量,降低了商业生产的成本并潜在地提高了产品质量。
本公开中描述的模型细胞系适用于高水平的蛋白质生产。原则上,本发明可以在任何始发真核细胞系(包括但不限于哺乳动物细胞、昆虫细胞和酵母细胞)上实施。在不一定对特定蛋白质具有特异性的基础上筛选细胞的一种或多种支持蛋白质生产的特征:例如,细胞中内质网的密度、高尔基体器(Golgi apparatus)的密度和/或与起始混合物中的其他细胞相比其他所需的表型特征水平。选择的细胞具有增加的从转基因生产蛋白质或其他基因产物的能力。所选择的细胞可能会或可能不会显示出内源基因的增加产量,因为内源基因受到进一步的调控限制。编码治疗性蛋白质的基因通常在一个或多个选择循环之前、之后或期间被转染到细胞中。根据所选定的蛋白质,可以获得可生产每升培养液8g或更多的蛋白质的细胞系。
本发明的一个方面是一种获得适用于高水平生产基于蛋白质的药物的细胞系的方法。始发细胞群就蛋白质生产能力而言通常是异质的,和/或它可以以这种方式处理,使得其中包含的至少一些细胞具有与整个细胞群相比每个细胞生产更多蛋白质量的能力。例如,处理细胞的混合物,使得该混合物形成一种或多种细胞杂交体,每个杂交体包含来自混合物的两个或更多个细胞的全部或部分基因组。从该群中选择细胞以获得生产细胞群,其与起始混合物中的其他细胞相比富含支持增加的蛋白质生产和/或分泌的更高密度的一种或多种亚细胞细胞器。始发混合物可基本上由来自单一细胞系的细胞[例如中国仓鼠卵巢(CHO)细胞]或两个或更多个不同细胞系的组合组成。
当本公开提及“生产细胞系”时,其意在指适合于生产基因产品(例如用于商业用途或销售)的细胞系。本公开中提出的技术解释了如何获得具有特殊特性的生产细胞系,这些特殊特性使细胞能够生产高水平(每个细胞或每个培养物体积)和/或具有特定目标特征的基因产物。根据该技术选择的细胞系可能包含或可能不包含用于生产特定产品的重组转基因,因为可以在选择之前或之后引入转基因。无论是否存在转基因,根据本发明生产的细胞系都具有特殊的特性,一旦转基因被引入细胞,该特殊的特性就能够使该细胞成为高水平的产品生产者。这种特殊的特性可包括参与蛋白质生产的细胞内细胞器(例如内质网或高尔基体器)的相对富集。细胞从转基因中高水平生产的能力并不一定意味着细胞也具有从内源基因高水平生产的能力:事实上,如果增加的生产能力对生产由转基因编码的靶基因产物具有选择性,则靶纯度(与总细胞产量相比)也将增加,这可能有助于纯化。
用于选择合适的高产细胞的方法可以包括以下程序中的一种或多种的任意组合:
·选择与混合物中的其他细胞相比,每个细胞内质网密度相对较高的单个细胞或杂交体;
·选择与混合物中的其他细胞相比,高尔基体器密度相对较高的单个细胞或杂交体;
·将细胞与染色内质网和/或高尔基体的活体染料一起孵育,并根据与每个细胞相关联的活体染料的量分选细胞;
·在混合物中的细胞中表达融合蛋白,其中融合蛋白包含生成光学信号的肽(例如GFP或萤光素酶),与由内质网和/或高尔基体器加工的肽融合,由此可以选择以比混合物中的其他细胞更高的水平表达光信号的细胞。
用于获得高产细胞的方法可以进一步包括以下一种或多种程序:
·选择生长更快或在特定培养条件下生长得更好的细胞;
·将细胞与对细胞表面配体具有特异性的抗体(抗体任选地标记或连接到颗粒)结合,并选择用抗体标记的细胞,从而获得富含表达配体的细胞的亚群;
·选择与混合物中的其他细胞相比生产相对高水平标记蛋白的细胞,其中标记蛋白从细胞分泌和/或在细胞表面表达,例如分泌性碱性磷酸酶或分泌性荧光素酶;
·选择与混合物中的其他细胞相比,在标记蛋白上生产优选糖基化模式或密度的细胞;以及
·培养生产细胞群;并针对相同特征重新分选其中的细胞,从而获得进一步富集其中亚细胞细胞器的增加密度是稳定可遗传的细胞的亚群。
可以根据本公开获得特定靶蛋白的生产细胞系,例如,通过用编码靶蛋白的转基因转染来自已经被选择用于高水平蛋白生产的细胞系的细胞。任选地,高水平生产的进一步选择在转染后可以继续。替代地,可以将编码目标蛋白的转基因转染到起始细胞群中,然后选择细胞,该细胞与混合物中的其他细胞相比生产从目标基因表达的高水平的蛋白质产物。在任一情况下,转基因都可以通过随机插入而插入到细胞的基因组中,或者插入到与基因组中的其他位置相比允许或支持高水平转录的预选位置处。然后可以从转染和选择的细胞中建立针对靶蛋白的生产细胞系。
举例来说,目标基因可以编码抗体重链、抗体轻链或单链抗体。生产细胞系可以表达抗体重链和抗体轻链两者,该抗体重链和抗体轻链结合以生产具有所需特异性的抗体。生产细胞系可以表达治疗酶、激素、生长因子,或作为血液的天然存在的成分的蛋白质。
本发明的另一方面是根据本公开中提供的方法生产的细胞系,该细胞系已经被选择用于高水平的蛋白质生产——无论是在它被遗传修饰以表达靶蛋白之前还是之后。这种细胞系可以具有选自以下的特征:基因组,其包含两个或更多个亲本细胞系的部分或全部基因组;与任何亲本细胞系相比更高浓度的内质网和/或高尔基体器;以及从重组插入基因之一或组合生产特定水平蛋白质的能力,如本公开后面所述进行定量。生产细胞系可以是也可以不是克隆的。
对发明人具有当前商业利益的本发明的方面由所附权利要求指出。本发明的其他方面将从以下描述中显而易见。
附图说明
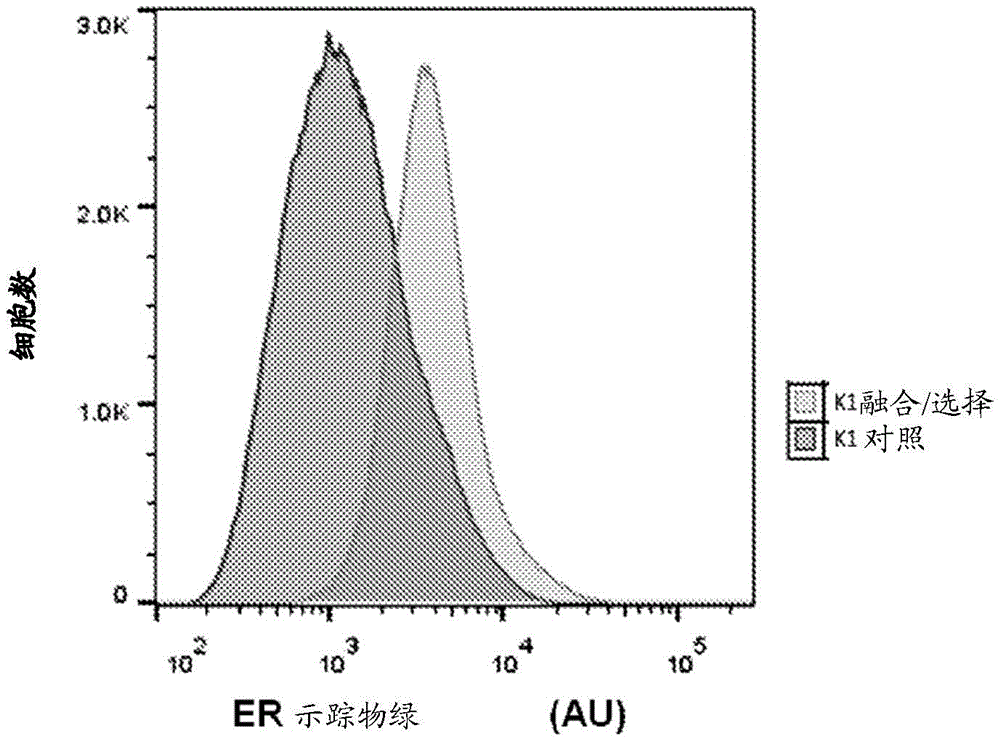
图1示出了与CHO细胞自体杂交体相比,天然CHO细胞中内质网(ER)染色的细胞频率分布。
图2示出了与CHO细胞自体杂交体相比,转染到天然CHO细胞中的碱性磷酸酶的相对表达水平。融合细胞中的表达显示出超过4倍的改善(p<0.05)。
具体实施方式
本公开提供了用于制造基于蛋白质的药剂的改进的细胞系,显著降低了商业生产的成本。通过针对在非特异基础上支持蛋白质生产的一个或多个特征(例如,与起始混合物中的其他细胞相比内质网、高尔基体器和/或其他所需表型特征的水平),从混合群中选择细胞而获得细胞系。通过制成细胞杂交体来制备用于功能选择的细胞,可以获得特别有效的生产细胞系。可以在一个或多个融合和选择循环之前或之后将编码目标治疗性蛋白质的基因转染到细胞中。
背景
新的生物制药产品以每年约100种的速度上线,而生物仿制药生产的竞争也在不断加剧。显然需要能够减少生产这些产品所需的培养物量和成本的技术。
本公开提供的技术允许以超过当前标准的生产率(可能高达8g/升或更多)生产蛋白质生物产品。此处描述的高效生产细胞系可以通过多种方式用于工业应用。关于生物仿制药,具有名牌产品的公司可以通过降低其产品成本结构来保持营销优势。同样,生产生物仿制药的公司将在成本上与名牌产品竞争。细胞系通过增加现有工厂的能力提供了相当大的生产灵活性;允许从更少或更小的设施生产更多的蛋白质;并降低新产品的成本和投入临床的时间(time-to-clinic)。
生成高水平靶蛋白的生产细胞系是通过从混合细胞群中筛选和分选出更适合于在每个细胞基础上更多或更快速地生产蛋白质的个体细胞而获得的。
制备细胞杂交体
个体高产细胞可以选自在这方面具有异质性的任何细胞群,如以下部分所述。许多单细胞系(例如CHO细胞)在增殖细胞群中的基因含量和细胞内器方面一开始就具有足够的多样性,从而可以直接从标准培养物中分选和选择出高产细胞。
任选地,为了提高最终产品收率或增强分选过程,用户可以通过采用将增强细胞群内蛋白质生产水平的异质性,或者通常增加整个细胞群或其亚群的蛋白质产量水平的一种技术或各技术的组合来制备用于分选的细胞。合适的技术是那些改变细胞基因组以例如增加或改组对参与蛋白质生产或加工的细胞内机制有贡献的基因的技术。以这种方式改变或改组基因组可能产生许多遗传变体,其具有各种不同特性的一个或多个,包括蛋白质生产水平和生长速率。
本发明的制造者已经发现,适用于蛋白质生产的细胞可以通过与其他细胞融合而获得更高的生产水平。在不限制本发明的实践的情况下,假设将两个细胞融合在一起在参与蛋白质生产的细胞的成分、遗传学或遗传控制方面是部分相加的。如果改进的特性繁殖真实,则是有益的。因此,在细胞融合后,它们通常要经过针对目标表型特征的多轮培养和选择。所得细胞可以是非整倍体或以其他方式保留编码参与蛋白质生产的细胞成分的亲代细胞的全部或部分基因组。
适用于融合的模型细胞是已经用于工业蛋白质生产的细胞系,例如CHO细胞、小鼠骨髓瘤NS0细胞、小鼠骨髓瘤SP2/0细胞、人胚肾(HEK)293细胞和幼仓鼠肾(BHK-21)细胞。其他中国仓鼠细胞类型(例如,制成分泌蛋白的乳腺和肝细胞)、人类细胞系和无脊椎动物细胞(例如可具有所需糖基化特性的昆虫和软体动物细胞)也是合适的。在本公开的上下文中,“细胞系”是可以在组织培养中连续、广泛或无限繁殖的细胞群。就与细胞将从转基因生产的蛋白质的量有关的一种或多种表型特征而言,起始细胞系通常是异质的。当培养时,根据本公开获得的生产细胞系可以生产异质的、基本同质的或克隆的后代。
通过获得待融合细胞的细胞混合物来进行细胞融合:(来自一种细胞系、或多于一种细胞系,或至少一种细胞系和至少一种原代细胞群的混合物)。然后将细胞混合物进行适当的融合方案:例如,通过在促进杂交体形成的培养条件下培养,通过进行电融合,通过与融合病毒(如仙台病毒)结合,通过将细胞置于接触(例如,通过温和离心),通过用诸如聚乙二醇(PEG)之类的融合剂处理,或使用其任何有效组合。
出于本公开的目的,通过将两个或更多个细胞融合在一起制成的细胞可称为自体杂交体(来自同一细胞系的融合在一起的细胞)、同型杂交体(具有相同基因型的细胞)、同种异型杂交体(来自具有不同基因型的同一物种的不同个体的细胞)和异种型杂交体(来自不同物种的细胞)。自体杂交体通常使用基本上(即,至少99%)由来自单个细胞系的细胞组成的细胞群形成。其他类型的杂交体通常使用来自具有潜在互补特性的两个或更多个细胞系的细胞群形成。本公开还包括从原代来源分离或获得的一种或多种细胞群与其自身或与建立或克隆的细胞系的融合。
可以使用任何合适的技术将细胞融合成杂交体。例如,细胞可以在融合剂的存在下和/或在促进杂交体形成的培养条件下培养,或者可以迫使接触,例如通过温和离心,任选地与融合剂[例如聚乙二醇(PEG)]组合。通常通过将两个细胞融合在一起获得融合细胞,尽管三个或更多个细胞的融合是可能的。人们认识到,两种不同细胞群的融合将产生混合细胞产物(同型、同种异型或异种型杂交体,具体取决于亲本细胞系)和自体杂交体。如果需要,可以使用荧光标记的或表面结合的抗体将自体或同型杂交体与同种异型或异种型杂交体分离,该抗体对表达于混合物中一种细胞系而非另一种细胞系上的配体具有特异性。
除非另外明确指出,否则所有这些组合都在本发明的范围内。在杂交体群中重复细胞融合以进一步增强效果,和/或与其他细胞系交叉杂交以赋予最终细胞系额外的有益特性可能是有益的。因此,融合和选择步骤可以重复进行两次、三或四次或更多次。
选择高产细胞系
本公开的一个有价值的见解在于以下想法:可以通过从混合细胞群中选择细胞来增加蛋白质产量,该细胞与起始混合物中的其他杂交体或亲本细胞相比具有支持增加的蛋白质产量的更高水平的亚细胞机制或生物化学。选择不一定对特定蛋白质的生产具有特异性的至少一种表型特征。该特征不仅仅是目标蛋白或替代物的表达水平。相反,它是一种支持生产各种不同蛋白质的特征。这些特征包括亚细胞细胞器(特别是参与从细胞分泌蛋白质的那些)的相对密度,以及帮助完成或分泌各种不同蛋白质的酶的相对水平或浓度。
参与蛋白质生产的亚细胞细胞器包括内质网(ER)和高尔基体器。可以测量这些中的任一者或两者并将其用作分选或选择的基础,而不会使用活体染料破坏细胞,并且可以基于相关染料的量来选择细胞。
这种染料可例如从Molecular Probes公司商购获得。用于ER的活性染料的示例包括:
·ER-示踪物TM蓝白DPX(E12353)
·ER示踪物TM绿(格列本脲FL)(E34251)
·ER-示踪物TM红(格列本脲TR)(34250)
·DiOC6(D273)
·DiOC5(D272)。
用于高尔基体器的活性染料包括:
·NBD C6-6-神经酰胺(N1154)
·NBD C6-鞘磷脂
·FL C5-神经酰胺(D3521)
·TR神经酰胺(D7540)
替代地或附加地,用户可以测试基于表达的标记系统,该标记系统将引入靶向ER或高尔基体的荧光蛋白。它们是融合蛋白,该融合蛋白包含表达光学标记的部分,并融合有靶向待标记的细胞器或由待标记的细胞器加工的蛋白质序列。示例包括以下:
Invitrogen:
·CellLightTMER-GFP(C10590)
·CellLightTMER-GFP(C10591)
·CellLightTM高尔基体-GFP(C10592)
·CellLightTM高尔基体-GFP(C10593)
Evrogen:
·pmKate2-ER(FP324)
·pFusionRed-ER(FP420)
·pTagRFP-高尔基体(FP367)
·pTagRFP-高尔基体(FP367)
·pFusionRed-高尔基体(FP419)
Clontech:
·pDsRed2-ER载体(632409)
·pDsRed-单体-高尔基体载体(632480)
·pAcGFP1-高尔基体载体(632464)
在用这些染料中的任一种染色后,可以选择(例如,通过流式细胞术和分选)细胞,该细胞具有的平均染色水平就对例如ER、高尔基体或光学标记的基因产物染色而言是一种或多种亲本细胞系的至少1.2、1.5、2或超过2倍。
要选择的其他特征可包括但不限于表型特征、免疫学特征和蛋白质生产水平。免疫学特征可以包括细胞对所需配体的表达(例如,由细胞分泌或在表面上表达)。例如,可以通过直接或间接抗体标记,然后进行FACS,或通过结合抗体包被的微珠并从该微珠中释放来选择细胞,该细胞具有的对这种标记的平均表达水平是亲本系的至少1.5、2、3或5倍。目标免疫学标记包括参与分泌蛋白生产的配体,例如糖基化酶。根据本公开可用于筛选细胞的其他分选方法可包括PCR激活的细胞分选、荧光原位杂交流式细胞术(FISH-PC)或FISH,接着是激光捕获。
同时或作为单独的步骤,还可以针对制造目的所需的特征,从混合细胞群中选择个体细胞:例如在特定培养条件下生长得更好的细胞,或表达相对较低水平的一种或多种不想要的污染物的细胞。
为了生成足够稳定以用于制造生物制剂的细胞系,所选择的细胞可以通过几次细胞分裂在培养物中生长,然后重新测试以查看所需特征是否稳定,针对每个所需特征总共查看两次、三次或超过三次。
用目标基因转染细胞
为了生成表达目标蛋白(靶蛋白)的细胞系,可以在引起宿主细胞系中的表达的泛在启动子或哺乳动物启动子的控制下,用编码蛋白质的基因转染生产细胞或其前体。可以在使用瞬时转染方法插入蛋白质表达盒的加工过程中确定靶蛋白的生产水平。替代地或随后地,可以进行永久性转染,其将目标基因或标记基因整合到细胞系的基因组中。可以使用基于脂质体的试剂(例如,LipofectamineTM2000或FuGENETM6)、磷酸钙、电穿孔或用基于腺病毒、逆转录病毒或慢病毒的载体进行转染。
在转染之后,测试细胞的靶蛋白的生产或分泌(通常在克隆或有限稀释培养物之后),例如通过酶联免疫吸附测定(ELISA)进行。选择所需蛋白质产量增加的细胞或克隆。目标可以是蛋白质产量增加,为亲本细胞系的1.5、2、4、8、12、16或20倍;和/或在典型的制造条件下产量为每升培养液6g、8g、10g、12g、15g或20g的水平。还可以测试目标蛋白的其他所需特征,例如唾液酸化的质量或糖基化的其他方面。
原则上,转染可以在一个或多个融合和选择其他特征的循环之前、期间或之后进行。例如,融合和选择可以在用目标基因转染之前进行,从而建立适合用户选择的蛋白质的高水平生产的亲本细胞系。替代地,转染可以在始发亲本细胞系中进行,并用于在随后的融合和分选步骤期间跟踪生产水平,或为这种分选提供另一个基础。替代地,转染可以作为中间步骤进行,其中细胞已经进行了一些其他特征(例如ER或高尔基体)的一个或多个融合和选择的循环,所得杂交体被转染以表达目标蛋白,然后进行进一步的融合和选择循环,以表达目标蛋白和/或本公开前面提到的其他特征。
目标蛋白可以是用于制造的生物制剂:例如,抗体重链、抗体轻链、单链抗体、治疗酶、激素、生长因子或通常作为血液成分的蛋白质。
另一种选项是使用标记蛋白作为最终将制造的蛋白质的代替物来开发细胞系:例如,分泌的碱性磷酸酶或分泌的荧光素酶。同样,转染可以在多个融合和选择的循环之前、期间或之后进行,任选地使用标记的表达水平作为一个或多个循环中的选择标准。这创建了一种亲本细胞系,该亲本细胞系针对标记蛋白的表达进行了优化,期望该细胞系的有益特性在进一步遗传改变后将得以保留以生产具有商业价值的生物产品。
最终,一旦开发出具有标记蛋白的所需表达水平的细胞系,则用目标蛋白替换该标记。使用上面列出的技术,可以再次随机转染到基因组中,并减少标记蛋白的表达。替代地,可以使用靶向整合技术将标记蛋白的基因替换为编码目标蛋白的基因。这种技术包括例如CRISPR/Cas9、锌指重组酶(ZFR)或转录激活因子样效应核酸酶(TALEN)。这样,目标基因在与基因组中的其他位置相比允许或支持高水平转录的预选位置处被插入到来自生产细胞系或混合物的细胞的基因组中。
关于使用靶向整合技术的更多信息,读者可以参考L.Cong等人,Science 2013,339(6121):819-823;Y.Huang等人,J.Immunol.Methods 2007,322:28-39;J.S.Lee等人,Science Reports,February 25,2015;以及P.Mali等人,Nat.Methods 2013,10(10):957-963;以及C.Ronda等人,Biotechnol.Bioeng.2014,111:1604-1616。
附加特征的掺入
本公开中提供的系统和技术可以与一种或多种替代策略组合以增强细胞生长或蛋白质生产以用于制造目的。这种技术包括载体和表达平台工程、基因组学的方法、基因递送和整合的进步、使用染色质开放元件增强蛋白质生产、克隆筛选策略的改进等。
例如,在A.D.Bandaranayake and S.C.Almo,FEBS Lett 2014,588(2):253-260;T.Lai等人,Pharmaceuticals 2013,6:579-603;T.Omasa等人,Current Pharmaceutical.Biotechnology,2010:11,233-240;C.A.Wilkens and Z.P.Gerdzen,PLOS ONE,2015年3月13日;J.Y.Kim等人,Appl.Microbiol.Biotechnol.2012,93:917-930;以及C.Ronda等人,Biotechnol.Bioeng.2014,111:1604-1616中讨论了这种技术。
适合掺入的一个这种特征是快速增殖。混合细胞群可以在生产细胞系开发期间的任何时间进行筛选,要么同时进行,要么作为与细胞的选择分开的步骤进行,该细胞基于内质网和/或高尔基体的含量适于在每个细胞基础上进行高水平蛋白质生产。在选择期间从该群中去除或稀释无活力或生长缓慢的细胞以加快生长。
作为说明,细胞在合适的培养基中并在合适的条件下培养。细胞的典型种子浓度为2x105个细胞/mL。将细胞培养两天,然后通过将细胞稀释至2x105个细胞/mL的浓度进行继代培养。根据需要重复,以便稀释生长缓慢的细胞。随着混合培养物中较快速生长的细胞的比例增加,可以减少继代培养步骤之间的时间和/或可以增加每个步骤的细胞稀释程度。
生产细胞的特征
与亲本或始发细胞系相比,已经选择用于高水平蛋白质生产的细胞系或混合细胞群可以通过几种不同参数中的任何一个或多个进行表征。例如,选择的细胞可具有:(1)比起始细胞更具非整倍体的基因组,其包含两个或更多个亲本细胞系(其可能相同也可能不同)的部分或全部基因组,(2)与任何一种或所有亲本细胞系相比浓度更高(例如,2至5倍或4至8倍,或超过2、4或8倍)的内质网和/或高尔基体器),(3)每个细胞或每升培养液生产明显高于亲代细胞系的靶蛋白水平(例如,2至5倍或4至8倍,或多于2、4或8倍)的能力,(4)每个细胞生产特定靶蛋白量(例如,多于50、65、75、100、150、200、300或500pg/细胞/天,或50至200或75至300pg/细胞/天)的能力;或者(5)每体积培养液生产一定量的目标蛋白(例如,每升培养液至少5、8、12、20或30g,或8至20g或10至50g的蛋白质)的能力。
为了进行这种比较的目的,可以将生产细胞系与原始细胞系的标准化群进行比较,该原始细胞系要么手头保存,要么作为同一系统的一部分,要么从参考来源获得。例如,可以将CHO衍生的生产细胞与来自美国典型培养物保藏中心的CRL-12023细胞进行比较。本公开包括用于高水平生产基于蛋白质的药物的系统,包括起始细胞系,以及从其衍生的生产细胞系,该生产细胞系的每个细胞具有相对高密度的内质网和/或高尔基体器,如例如使用上面列出的一种或多种活体染料所确定的那样。
该技术的益处
根据实践和应用的模式,本公开中描述的本发明的方面可以以任何组合提供以下任何益处:
·随着市场规模的增加,减少扩大或建造新的GMP生产设施的需要;
·使用相对较小或较少的生物反应器提供千克数量的蛋白质成品的GMP生产,
·降低经验证的生物制剂的生产成本;
·创建适合高水平表达所需生物制剂家族的生产细胞系;
·减少待表达基因整合后所需的克隆或选择步骤;
·提高产品质量(例如,糖基化);以及
·提供高质量的小批量研究材料,缩短投入临床试验的时间。
实施例
实施例1
可以使用CHO细胞的K1系(CCL-61)实施本发明的技术。根据以下方案融合在培养物中生长的CHO细胞群以制成同种型杂交体:
1.离心107个细胞.
2.丢弃上清液
3.通过轻敲管底打破沉淀
4.在一分钟的时间内加入100pL的50%PEG,同时用移液器吸头混合细胞
5.继续搅拌细胞额外一分钟
6.在混合的同时在一分钟内加入100pL的生长培养基
7.在混合的同时在三分钟内加入300pL的生长物
8.缓慢加入mL.的生长培养基
9.于37℃孵育五分钟
10.离心
11.将沉淀重新悬浮在20mL的生长培养基中并转移到125mL培养瓶中
12.正常培养。
替代地,使用ECM2001脉冲发生器(BTX)采用电融合程序。将107个细胞离心并重新悬浮在1mL的CytofusionTM培养基C中,然后转移到融合室中。细胞与150V/cm的交流脉冲对齐10秒。细胞融合由单个1200V/cm的方波直流脉冲触发25微秒。让细胞静置5分钟,离心,然后重新悬浮于生长培养基中并正常培养。
替代地,可以采用病毒诱导的融合方案。存在多种使用仙台病毒的方案:例如,使用GenomONETMHVJ-E试剂盒(美国Cosmo Bio):将细胞离心并以2x105个细胞/25μL的浓度重新悬浮于冰冷的细胞融合缓冲液中。将2.5μL冰冷的HVJ-E(仙台病毒膜)悬浮液加入细胞中并轻敲混合。混合物在冰上孵育5分钟;然后在37℃下孵育15分钟。将生长培养基添加到混合物中,并将其转移到六孔板中进行培养。
亚细胞细胞器的标记和分选可以如下进行。将细胞离心并用HBSS缓冲液洗涤一次。在HBSS中制备ER-示踪物绿和/或ER-示踪物蓝/白的1pM溶液。将细胞重新悬浮在染色溶液中,并在37℃下孵育30分钟。然后用PBS洗涤细胞。
如果细胞要用于分析性FACS,则将它们重新悬浮于PBS中;如果要对它们进行分选,则将它们重新悬浮在补充有1%FBS的PBS中。收集了表现出ER-示踪物染料的最高染色量的10%的活菌群。将细胞收集到含有生长培养基的管中,离心,重新悬浮在新鲜培养基中,然后正常培养。
实施例2
CHO-K1细胞暴露于PEG辅助的融合程序。将细胞回收一周,然后重复该程序总共3次。从第三次融合中回收后,将细胞用活体ER-示踪染料(ER-示踪物TM绿(格列本脲 FL);Invitrogen,E34251)染色,并使用FACSAriaIITM细胞分选仪(BD Biosciences)进行分选。收集了表现出ER-示踪物染料的最高染色量的10%活菌群。在培养物中回收两周后,将细胞暴露于最终融合,用ER-示踪染料染色,并使用LSRIITM流式细胞仪(BD Biosciences)进行分析。
为了测量融合细胞和亲本CHO群中的蛋白质产量,转染细胞以表达分泌的碱性磷酸酶(SEAP)。转染如下进行:
1.离心106个细胞.
2.丢弃上清液
3.重新悬浮于100μL细胞系NucleofectorTM溶液T中
4.加入2pg SEAP表达质粒
5.转移到电穿孔比色皿
6.使用AmaxaTMNucleofector II和预设程序U-023进行电穿孔
7.加入0.5ml生长培养基
8.将细胞转移到每孔含有mL.培养基的6孔板中
图1是针对内质网(ER)水平融合和染色后CHO细胞的FACS(荧光激活细胞分选)曲线。与起始CHO细胞系相比,融合细胞显示出更高的ER平均水平。
图2示出了转染结果(分泌的碱性磷酸酶的比生产力)。融合细胞中标记蛋白的表达显示出超过4倍的改进。
*****
就美国的所有目的而言,本公开中提及的每一个出版物和专利文件都以引用的方式整体并入本文以用于所有目的,如同每个这种出版物或文件被具体和单独指出以引用方式并入本文。
虽然已经参考特定实施方案描述了本发明,但是可以做出改变并且可以替换等同物以使本发明适应特定上下文或作为常规实验的预期用途,从而实现本发明的益处而无需脱离了所要求保护的范围。
本文用于企业家、创业者技术爱好者查询,结果仅供参考。