1.本发明属药物制剂领域,涉及用于治疗眼部疾病的组合物,更具体是涉及一种包括野生型穿膜肽penetratin的衍生物和生理ph条件下带正电荷的药物的组合物。
背景技术:
2.穿膜肽(cell-penetrating peptides,cpps)是一种生理ph条件下带正电荷的短肽,可以介导共价或非共价连接的分子或给药系统(如、脂质体、纳米粒、胶束等)进入细胞(j.controlled release,2019,309:106-124)。
3.由于野生型穿膜肽penetratin的衍生物保留了野生型penetratin在生理ph条件下带正电荷的特性,从而现有技术中认为,野生型穿膜肽penetratin的衍生物通过静电相互作用与生理ph条件下带负电荷的药物结合并实现眼内递送。即,野生型穿膜肽penetratin的衍生物通过静电相互作用可以与生理ph条件下带负电荷的基因、多肽和蛋白质等生物大分子药物自组装形成纳米复合物,或者在聚合物存在的情况下与生理ph条件下带负电荷的基因、多肽和蛋白质等生物大分子药物自组装形成纳米复合物,实现上述生物大分子药物的眼内递送。例如参见中国专利申请cn108976288(a)。
4.然而,对于生理ph条件下带正电荷的药物,因为其与野生型穿膜肽penetratin的衍生物同样均带有正电荷,一般认为无法通过上述这种方式进行眼内递送给药。因此,现有技术中亟需解决如何促进生理ph条件下带正电的药物在眼内的吸收以及实现所述药物的眼内递送问题。
技术实现要素:
5.本发明的目的是提供一类人工改造的穿膜肽(cell-penetrating peptides,cpps)与药物的组合物。
6.为此,本发明提供了一种用于治疗眼部疾病的组合物,该组合物包括:
7.(i)生理ph条件下带正电荷的药物,和
8.(ii)野生型穿膜肽penetratin的衍生物,所述野生型穿膜肽penetratin的衍生物具有下述氨基酸序列:
9.rx1ikiwfx2x3rrmkwkk
10.其中,x1、x2和x3代表疏水性氨基酸,选自天然来源的氨基酸丙氨酸(alanine,a)、缬氨酸(valine,v)、亮氨酸(leucine,l)、异亮氨酸(isoleucine,i)、脯氨酸(proline,p)、苯丙氨酸(phenylalanine,f)、色氨酸(tryptophan,w)、甲硫氨酸(methionine,m)和非天然来源的氨基酸α-氨基丁酸(α-aminobutyric acid)、α-氨基戊酸(α-aminopentanoic acid)、α-氨基己酸(α-aminohexanoic acid)、α-氨基庚酸(α-aminoheptanoic acid),以及它们的组合。
11.本发明所述用于治疗眼部疾病的组合物,优选所述组合物是溶液或混悬液。
12.本发明所述的用于治疗眼部疾病的组合物,优选x1、x2和x3代表疏水性氨基酸,x1、
x2和x3中的至少两个选自天然来源的氨基酸丙氨酸(alanine,a)、缬氨酸(valine,v)、亮氨酸(leucine,l)、异亮氨酸(isoleucine,i)、脯氨酸(proline,p)、苯丙氨酸(phenylalanine,f)、色氨酸(tryptophan,w)、甲硫氨酸(methionine,m)和非天然来源的氨基酸α-氨基丁酸(α-aminobutyric acid)、α-氨基戊酸(α-aminopentanoic acid)、α-氨基己酸(α-aminohexanoic acid)、α-氨基庚酸(α-aminoheptanoic acid),以及它们的组合。
13.本发明所述用于治疗眼部疾病的组合物,优选x1、x2或x3为色氨酸(tryptophan,w)。
14.本发明所述用于治疗眼部疾病的组合物,优选x1、x2或x3中的至少两个为色氨酸(tryptophan,w)。
15.本发明所述用于治疗眼部疾病的组合物,优选所述野生型穿膜肽penetratin的衍生物的氨基酸序列为:
16.rwikiwfqnrrmkwkk
17.rqikiwfwnrrmkwkk
18.rqikiwfqwrrmkwkk
19.rwikiwfwnrrmkwkk
20.rwikiwfqwrrmkwkk
21.rqikiwfwwrrmkwkk
22.rwikiwfwwrrmkwkk。
23.本发明所述用于治疗眼部疾病的组合物,优选所述野生型穿膜肽penetratin的衍生物的氨基酸序列为:
24.rwikiwfwnrrmkwkkk
25.rwikiwfqwrrmkwkkk
26.rqikiwfwwrrmkwkkk
27.rwikiwfwwrrmkwkk。
28.本发明所述的用于治疗眼部疾病的组合物,优选所述药物为多肽或蛋白类药物。
29.本发明所述的用于治疗眼部疾病的组合物,其中优选所述药物选自以下的一种或多种:纳米抗体(nanobody)、雷珠单抗(ranibizumab)、阿柏西普(aflibercept)、奥克纤溶酶(ocriplasmin)、贝伐单抗(bevacizumab)、阿达木单抗(adalimumab)、阿特珠单抗(atezolizumab)、贝利木单抗(belimumab)、西妥昔单抗(cetuximab)、达洛珠单抗(dalotuzumab)、地诺单抗(denosumab)、埃罗妥珠单抗(elotuzumab)、英夫利昔单抗(infliximab)、伊匹单抗(ipilimumab)、伊奇珠单抗(ixekizumab)、那他珠单抗(natalizumab)、nist单抗(nistmab)、纳武单抗(nivolumab)、奥滨尤妥珠单抗(obinutuzumab)、奥法木单抗(ofatumumab)、帕利珠单抗(palivizumab)、派姆单抗(pembrolizumab)、帕妥珠单抗(pertuzumab)、雷莫芦单抗(ramucirumab)、利妥昔单抗(rituximab)、曲妥珠单抗(trastuzumab)和内皮抑素(endostatin)。
30.本发明所述的用于治疗眼部疾病的组合物,优选所述药物选自以下的一种或多种:纳米抗体、雷珠单抗、阿柏西普、奥克纤溶酶、贝伐单抗和西妥昔单抗。
31.本发明所述的用于治疗眼部疾病的组合物,优选所述药物选自以下的一种或多种:雷珠单抗、阿柏西普和贝伐单抗。
32.本发明所述的用于治疗眼部疾病的组合物,优选所述纳米抗体选自以下的一种或多种:卡帕珠单抗(caplacizumab)、奥索拉珠单抗(ozoralizumab)和伏巴利珠单抗(vobarilizumab)。
33.本发明所述的用于治疗眼部疾病的组合物,优选野生型穿膜肽penetratin的衍生物与所述药物的比例为摩尔比为0.1:1-50:1。
34.本发明所述的用于治疗眼部疾病的组合物,更优选野生型穿膜肽penetratin的衍生物与所述药物的比例为摩尔比为0.5:1-35:1。
35.本发明所述的用于治疗眼部疾病的组合物,更优选野生型穿膜肽penetratin的衍生物与所述药物的比例为摩尔比为1:1-20:1。
36.本发明所述的用于治疗眼部疾病的组合物,最优选野生型穿膜肽penetratin的衍生物与所述药物的比例为摩尔比为3:1-15:1。
37.本发明还提供了一种为需要的受试者治疗眼部疾病的方法,所述方法包括施用治疗有效量的根据本发明所述的用于治疗眼部疾病的组合物。
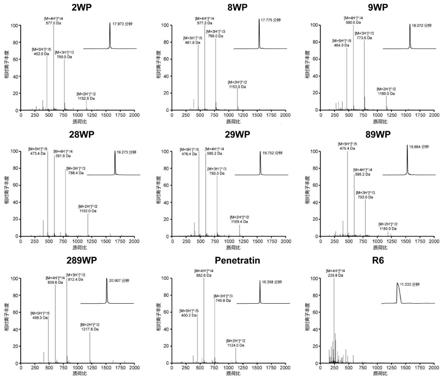
38.本发明所述的方法,其中所述方法优选包括将治疗有效量的根据本发明所述的组合物给患者滴眼给药。
39.本发明还提供了所述的组合物在制备用于治疗眼部疾病的药物中的用途。
附图说明
40.图1:合成多肽质谱及液相图谱
41.图2:28wp促进纳米抗体在人角膜上皮细胞中摄取的流式图(左)及平均荧光强度对比(右)。
42.图3:不同比例的89wp/纳米抗体组合物在人视网膜色素上皮细胞中的摄取。
43.图4:不同摩尔比条件下,29wp促进奥克纤溶酶在人视网膜色素上皮细胞中的摄取。
44.图5:不同摩尔比条件下,289wp促进西妥昔单抗在人角膜上皮细胞中的摄取。
45.图6:不同摩尔比条件下多肽/雷珠单抗组合物细胞摄取定量评价。
46.图7:不同摩尔比条件下多肽/雷珠单抗组合物细胞摄取定量评价。
47.图8:不同多肽制备的多肽/雷珠单抗组合物细胞摄取定量评价。
48.图9:多肽/雷珠单抗组合物在人角膜上皮细胞中同步摄取行为。
49.图10:多肽/雷珠单抗组合物在人视网膜色素上皮细胞中同步摄取行为。
50.图11:多肽/雷珠单抗组合物滴眼液细胞摄取机制。
51.图12:多肽/雷珠单抗组合物滴眼给药1h后兔体内各组织(血浆、房水、玻璃体、视网膜)雷珠单抗浓度。
52.图13:多肽/雷珠单抗组合物滴眼给药后雷珠单抗在兔体内浓度分布变化。
53.图14:多肽/阿柏西普组合物滴眼给药后阿柏西普在兔体内浓度分布。
具体实施方式
54.普通滴眼剂在结膜囊内滞留时间短,吸收效果差,特别是基因、多肽和蛋白质等生物大分子药物经局部滴眼给药后,眼部生物利用度极低,并且几乎不能到达眼后段;眼内注
射剂和眼内植入剂生物利用度虽高,但患者顺应性差,且容易导致严重的并发症。
55.为了解决现有技术中的上述缺陷,本发明将经人工改造的穿膜肽作为眼部吸收促进剂,可通过非创伤途径滴眼给药,通过非共价连接将在生理ph条件下带正电荷的药物递送至眼内。所述穿膜肽是一种生理ph条件下带正电荷的短肽,而所述药物为在生理ph条件下带正电荷的药物。申请人意想不到地发现,所述生理ph条件下带正电荷的穿膜肽和所述生理ph条件下带正电荷的药物的组合物可以显著促进细胞的摄取。与仅使用所述生理ph条件下带正电荷的药物的情况比较,所述组合物使得细胞摄取显著增加。
56.本发明提供了一种用于治疗眼部疾病的组合物,该组合物包括:(i)生理ph条件下带正电荷的药物,和(ii)野生型穿膜肽penetratin的衍生物。所述野生型穿膜肽penetratin的衍生物为基于天然来源的穿膜肽penetratin,采用氨基酸突变的方法,设计并制备的一系列对眼组织穿透性好、生物安全性高的多肽衍生物,可通过非创伤途径将与其混合的生理ph条件下带正电荷的药物递送至眼内。通过本发明的组合物,能够介导所述生理ph条件下带正电荷的药物高效地透过眼部的吸收屏障,促进药物进入眼内并到达眼后段,进而提高生理ph条件下带正电荷的药物的眼部生物利用度。
57.所述野生型多肽penetratin的氨基酸序列如下:
58.rqikiwfqnrrmkwkk
59.野生型penetratin对眼组织的穿透能力随着分子的疏水性增强而得到改善。因此,本发明所述penetratin衍生物在保持野生型penetratin基本氨基酸序列不变的前提下,利用氨基酸突变技术,在其分子中引入疏水性氨基酸,进而增强所得到的penetratin衍生物的眼组织穿透能力。
60.具体地说,本发明是在野生型penetratin的基础之上,保持其原有碱性氨基酸精氨酸(arginine,r)、赖氨酸(lysine,k)以及原有疏水氨基酸异亮氨酸(isoleucine,i)、苯丙氨酸(phenylalanine,f)、色氨酸(tryptophan,w)、甲硫氨酸(methionine,m)的序列不变,利用多肽固相合成技术,以疏水性氨基酸取代penetratin分子中的亲水性氨基酸谷氨酰胺(glutamine,q)和天冬酰胺(asparagine,n),进而得到一系列多肽衍生物。
61.所述penetratin衍生物的特征在于对野生型penetratin不同亲水性氨基酸(谷氨酰胺和天冬酰胺)位点用不同的疏水性氨基酸进行取代。所述疏水性氨基酸选自天然来源的氨基酸丙氨酸(alanine,a)、缬氨酸(valine,v)、亮氨酸(leucine,l)、异亮氨酸(isoleucine,i)、脯氨酸(proline,p)、苯丙氨酸(phenylalanine,f)、色氨酸(tryptophan,w)、甲硫氨酸(methionine,m)和非天然来源的氨基酸α-氨基丁酸(α-aminobutyric acid)、α-氨基戊酸(α-aminopentanoic acid)、α-氨基己酸(α-aminohexanoic acid)、α-氨基庚酸(α-aminoheptanoic acid)等,以及它们的组合。
62.在野生型penetratin基础之上进行结构改造得到的多肽衍生物,其氨基酸序列如表1所示,其中,突变的氨基酸用下划线标示。该表格中未给出非天然氨基酸突变的实例,不同疏水氨基酸的组合突变仅给出代表性实例。
63.penetratin衍生物对眼组织的穿透能力与其疏水性(亲脂性)相关,疏水性(亲脂性)越强,penetratin衍生物对眼组织的穿透能力也越强。因此,利用其它疏水性氨基酸制备的penetratin衍生物也将获得增强的眼部吸收促进效果。
64.本发明中所述penetratin衍生物相对于因安全性问题极少在眼部应用的小分子
吸收促进剂,这种多肽类吸收促进剂易于降解,因而生物安全性更好。另一方面,多肽类吸收促进剂易于修饰和改造,以实现不同的应用目标,而且本发明所述的penetratin衍生物较天然来源的野生型penetratin具有更强的眼部吸收促进能力。
65.表1.野生型penetratin经结构改造后得到的penetratin衍生物
66.[0067][0068]
在本领域中,等电点(isoelectric point,pi)是指分子如蛋白质或多肽的净电荷为零的ph值。例如参见文献:kentaro tomii.protein properties.encyclopedia of bioinformatics and computational biology.2019,2:28-33.(doi:10.1016/b978-0-12-809633-8.20266-5)。由于两性离子所带电荷因溶液的ph值不同而改变,当两性离子正负电荷数值相等时,溶液的ph值即其等电点。本发明中所述在生理ph条件下带正电荷的药物,即等电点高于7.45的药物,如多肽或蛋白药物。
[0069]
在本领域中,生理ph条件是指:在生理状态下,人体的ph范围介于7.35至7.45,平均值为7.40。人体中血液的ph值维持在7.4
±
0.03很窄的范围。例如参见文献:hopkins e,sharma s.physiology,acid base balance.in:statpearls[internet].statpearls publishing;treasure island(fl):jun 16,2019.pmid:29939584;以及melvin e.laski,neil a.kurtzman.acid-base disorders in medicine.disease-a-month.1996,42(2):59-125。由于本发明中药物的等电点高于生理状态下人体的ph范围,因此在所述生理ph条件下所述药物带正电荷。
[0070]
表2.在生理ph条件下带正电荷的药物
[0071]
药物名称等电点分子量(千道尔顿,kd)阿柏西普8.8115阿达木单抗8.9148阿特珠单抗8.6145贝利木单抗8.6147贝伐单抗8.3149
卡帕珠单抗9.228西妥昔单抗8.8152达洛珠单抗9.0146地诺单抗8.9147埃罗妥珠单抗8.0148英夫利昔单抗7.6149伊匹单抗9.2148伊奇珠单抗8.1146那他珠单抗7.8149纳米抗体9.613nist单抗9.2150纳武单抗8.0146奥滨尤妥珠单抗8.6146奥法木单抗9.0149奥克纤溶酶7.727奥索拉珠单抗8.838帕利珠单抗9.3148派姆单抗7.6149帕妥珠单抗9.0148雷莫芦单抗9.1147雷珠单抗8.848利妥昔单抗9.4145曲妥珠单抗9.1145伏巴利珠单抗8.726
[0072]
本发明组合物可以通过以下方式获得:
[0073]
将野生型穿膜肽penetratin的衍生物与生理ph条件下带正电荷的多肽或蛋白质药物通过物理混合制备而成。
[0074]
发明人发现,通过物理混合获得的本发明组合物可以促进蛋白药物在眼内的吸收。发明人通过细胞摄取实验,对本发明的组合物在体外促进细胞摄取的效果进行了比较。结果显示,penetratin衍生物与在生理ph条件下带正电的蛋白药物的摩尔比在0.1:1-50范围内的组合物可以获得蛋白药物在眼内的良好吸收。并且在penetratin衍生物中,双突变(28wp、29wp、89wp)和三突变(289wp)衍生物促进吸收效果更好。
[0075]
所述生理ph条件下带正电的蛋白药物包括雷珠单抗,等电点8.8;贝伐单抗,等电点8.8;和阿柏西普,等电点8.2。所述组合物特别在摩尔比介于5:1至35:1时具有最佳的促进吸收效果。
[0076]
纳米抗体是一类新颖而独特的抗原结合片段,来自于天然存在于羊驼血清中的重链抗体。纳米抗体是重组的、单一结构域的可变片段,来源于羊驼的重链抗体,可选择性地与特定抗原结合。例如参见文献:i,muyldermans s.the therapeutic potential of nanobodies.biodrugs.2020,34:11-26;rubel chakravarty,shreya goel,
weibo cai.nanobody:the“magic bullet”for molecular imaging?theranostics 2014;4(4):386-398。
[0077]
常见的纳米抗体包括:caplacizumab(通用名alx 0681或alx-0081,商品名cablivi),分子量28kda,等电点9.2;ozoralizumab(通用名atn-103),分子量38kda,等电点8.8;vobarilizumab(通用名alx-0061),分子量26kda,等电点8.7。
[0078]
本发明已经在小鼠体内证实,通过滴眼给药所述组合物,可以将纳米抗体递送到眼内(包括眼前段的角膜和眼后段的视网膜)。在单独使用纳米抗体的情况下,则几乎不产生吸收。
[0079]
具体地,与不含野生型穿膜肽penetratin的衍生物89wp只含有纳米抗体的药物比较,包括89wp与纳米抗体且二者的摩尔比范围为5:1~50:1的组合物的细胞摄取显著增加。当89wp与纳米抗体的摩尔比为10:1-15:1时,获得了最佳的促进摄取效果。如图3所示,通过对89wp与纳米抗体二者的比例(89wp:纳米抗体)分别为5:1、10:1、15:1、20:1、25:1、30:1、35:1、40:1、45:1和50:1的组合物进行比较。结果显示,89wp:纳米抗体为10:1和15:1的两组组合物获得了最多的细胞摄取。
[0080]
同样,通过将包括89wp和雷珠单抗的组合物滴眼给药给家兔,证明了在家兔体内可以通过所述组合物将雷珠单抗递送到眼内(包括眼后段的视网膜和玻璃体)。效果显著优于对照r8。
[0081]
其中,r8为8聚精氨酸(arginine,r)的缩写,是一种经典的人工合成穿膜肽。有文献报道用r8的同系物6聚精氨酸(r6)将雷珠单抗和贝伐单抗通过滴眼给药递送到小鼠眼内。例如参见:invest ophthalmol vis sci.2017;58(5):2578-2590.doi:10.1167/iovs.16-20072.。还有文献报道,r8比r6有更好的促进吸收效果。例如参见:j control release.2007;118(2):177-84.doi:10.1016/j.jconrel.2006.12.022。
[0082]
在本发明中,发明人用r8做对照,证明本发明的效果优于r8,从而证明本发明获得了优于文献报道中的r6的技术效果。如果不加89wp则不产生吸收。
[0083]
具体地,利用细胞摄取实验在体外筛选野生型穿膜肽penetratin的衍生物(r6(6聚精氨酸)、野生型penetratin、2wp、8wp、9wp、28wp、29wp、89wp、289wp)与雷珠单抗的组合物,摩尔比设定为10:1,选用了2种不同的细胞,其中29wp、289wp效果最好,与不含野生型穿膜肽penetratin的衍生物只含有雷珠单抗的组合物比较,细胞摄取显著增加。
[0084]
与含有文献报道(例如参见:invest ophthalmol vis sci.2017;58(5):2578-2590.doi:10.1167/iovs.16-20072.,其中6聚精氨酸(r6)将雷珠单抗和贝伐单抗通过滴眼给药递送到小鼠眼内)具有吸收促进作用的多肽r6和雷珠单抗的组合物比较(r6:雷珠单抗的比例与野生型穿膜肽penetratin的衍生物:雷珠单抗的比例相同),以及与含有野生型penetratin和雷珠单抗的组合物比较(野生型penetratin:雷珠单抗的比例与野生型穿膜肽penetratin的衍生物:雷珠单抗的比例相同),细胞摄取显著增加。如图6所示,细胞摄取分别增加13.5、14.7倍。
[0085]
利用细胞摄取实验在体外筛选89wp与雷珠单抗的组合物,选用了3种不同的细胞,二者摩尔比变化范围5:1~18:1,与不含89wp只含有雷珠单抗的组合物比较,细胞摄取显著增加。与含有文献报道具有吸收促进作用的多肽r8和雷珠单抗的组合物比较(r8:雷珠单抗的比例介于5:1-30:1,高于89wp:雷珠单抗的比例),细胞摄取显著增加。如图4和图5所示,
细胞摄取增加了2.2-6.7倍。
[0086]
利用细胞摄取实验在体外筛选289wp与雷珠单抗的组合物,选用了2种不同的细胞,证实289wp与雷珠单抗形成组合物(摩尔比10:1)后,二者同步被细胞摄取。
[0087]
利用细胞摄取实验在体外筛选29wp和289wp与雷珠单抗的组合物,分别利用29wp和289wp与雷珠单抗形成复合物(摩尔比10:1),在家兔体内证实通过滴眼给药可以将雷珠单抗递送到眼内(包括眼前段的房水,眼后段的视网膜和玻璃体)。如果不加野生型穿膜肽penetratin的衍生物,雷珠单抗几乎不吸收。在这种情况下,发明人意想不到地发现,野生型穿膜肽penetratin的衍生物能够与在生理ph条件下带正电荷的雷珠单抗产生相互作用,并且野生型穿膜肽penetratin的衍生物能够将雷珠单抗带入到眼内。利用细胞摄取实验在体外筛选289wp与阿柏西普的组合物。其中,利用289wp与阿柏西普形成组合物(摩尔比10:1),在家兔体内证实通过滴眼给药可以将阿柏西普递送到眼内(包括眼前段的房水,眼后段的视网膜和玻璃体)。如果不加野生型穿膜肽penetratin的衍生物,阿柏西普几乎不吸收。
[0088]
通过本发明的组合物,获得了意想不到的技术效果。具体地,本发明组合物中的penetratin衍生物保留了野生型penetratin在生理ph条件下带正电荷的特性,通过与生理ph条件下带正电荷的药物通过非共价方式形成组合物,意想不到地实现了上述药物的更好的眼内递送。
[0089]
例如,通过在小鼠体内施用所述组合物,本发明证实了通过滴眼给药,所述组合物可以将药物如纳米抗体递送到眼内,包括将药物如纳米抗体递送到眼前段的角膜和眼后段的视网膜。通过在兔体内施用所述组合物,本发明证实了通过滴眼给药,所述组合物可以将药物如雷珠单抗和阿柏西普递送到眼内,包括将药物如雷珠单抗和阿柏西普递送到眼前段的角膜和眼后段的视网膜。在仅施用该药物而不包括所述野生型穿膜肽penetratin的衍生物的情况下,无法获得该递送效果。
[0090]
实施例
[0091]
以下结合本发明的具体实施例进一步阐明本发明,但并不限制其保护范围。
[0092]
实施例1.野生型穿膜肽penetratin衍生物的合成、纯化及表征
[0093]
采用固相合成技术进行多肽合成,多肽序列如表3所示。
[0094]
采用制备液相对冻干后粗品进行纯化,制备柱为waters xbridge
tm beh130 prep c18柱(19
×
250mm,10μm),冻干后进行后续纯度及分子量表征。
[0095]
表3多肽序列信息
[0096][0097][0098]
*:采用peptidemass计算工具求得多肽的理论平均分子量,https://web.expasy.org/peptide_mass/
[0099]
采用高效液相色谱法考察多肽纯度,色谱条件如下,
[0100]
色谱柱:ymc-pack ods-a柱(4.6
×
150mm,5μm);
[0101]
柱温:20℃;
[0102]
流动相:a相为纯水(含0.1%tfa),b相为乙腈(含0.1%tfa),野生型穿膜肽penetratin的衍生物流动相方法为5-65%b,30min,多肽r6则为2-32%b,30min;
[0103]
流速:0.7ml/min;
[0104]
检测波长:214nm。
[0105]
采用电喷雾电离质谱(esi-ms)考察多肽分子量,检测条件如下,流动相:甲醇:纯水:甲酸=80:19.9:0.1;
[0106]
流速:0.3ml/min;
[0107]
毛细管电压:3000v;
[0108]
干燥气体温度及流速:350℃,12l/min。
[0109]
多肽纯度及分子量见表4,具体谱图信息详见图1。所有多肽液相纯度均在95%以上,分子量正确,可用于后续实验。
[0110]
表4多肽液相纯度及分子量
[0111]
名称纯度(214nm)实测分子量pe96.47%2246.402wp95.94%2304.008wp98.11%2304.809wp97.84%2318.4028wp95.71%2362.2029wp99.22%2376.8089wp96.16%2377.00289wp97.65%2434.20
r695.81%955.20
[0112]
实施例2.多肽促进纳米抗体被眼部细胞摄取
[0113]
取适量纳米抗体(等电点9.6,分子量13kd)溶于100mm na2co3溶液,加入荧光标记试剂sulfo-cy5-nhs,4℃条件下搅拌反应过夜,体系于4℃纯水中透析后冻干,即得荧光探针cy5标记的纳米抗体。
[0114]
多肽28wp与cy5标记的纳米抗体分别溶解于磷酸缓冲溶液(pbs,浓度10mm,ph7.4)中,将28wp溶液与cy5标记的纳米抗体溶液按摩尔比5:1混合,室温条件下放置24h,得到28wp与纳米抗体组合物。
[0115]
取生长状态良好的人角膜上皮细胞(hcec),按1
×
104细胞/孔铺于24孔板,培养24h后,弃去培液,加入28wp与纳米抗体组合物(含cy5标记的纳米抗体浓度为1μm),37℃孵育2h,弃去药液,用10mm pbs(含0.02mg/ml肝素钠)洗3次,收集细胞,重悬于10mm pbs,流式细胞仪进行检测。
[0116]
由图2可见,游离纳米抗体自身很难被人角膜上皮细胞摄取。多肽28wp与纳米抗体形成的组合物与细胞孵育后,纳米抗体的细胞摄取显著改善,较游离纳米抗体的细胞摄取增加至19.4倍。
[0117]
实施例3.不同比例多肽/纳米抗体组合物的细胞摄取
[0118]
按照表5中比例配制89wp/纳米抗体滴眼液,4℃孵育过夜,备用。
[0119]
表5. 89wp/纳米抗体滴眼液组合物
[0120][0121][0122]
将arpe-19细胞铺于24孔板,培养24h以上。弃去培液,每孔加入200μl药液及300μl无血清培液,孵育2h后,弃去药液,pbs洗3次,将细胞消化并重悬于pbs中,流式检测cy5荧光信号(ex 645nm,em 665nm)。
[0123]
89wp与纳米抗体摩尔比从5:1至50:1条件下的细胞摄取见图3。
[0124]
图3为不同比例的89wp/纳米抗体组合物在arpe-19细胞中的摄取。其中,89wp与纳米抗体的摩尔比分别为5:1,10:1,15:1,20:1,25:1,30:1,35:1,40:1,45:1,50:1。
[0125]
结果表明,在该比例范围内,89wp可以显著促进纳米抗体的细胞摄取,在摩尔比
10:1-30:1范围内促进摄取效果较好。因此,优选的89wp与纳米抗体摩尔比范围为5:1至35:1,更进一步优选10:1至30:1。
[0126]
实施例4.多肽促进奥克纤溶酶被眼部细胞摄取
[0127]
多肽29wp与cy5标记的奥克纤溶酶(ocriplasmin,等电点7.7,分子量27kd)分别溶解于柠檬酸缓冲溶液(浓度0.53mg/ml)中,将29wp溶液与cy5标记的奥克纤溶酶溶液按摩尔比0.1:1、0.3:1、0.5:1、0.7:1、0.9:1和1:1混合,室温条件下放置24h,得到29wp与奥克纤溶酶组合物。
[0128]
取生长状态良好的人视网膜色素上皮细胞(arpe-19),按1
×
104细胞/孔铺于24孔板,培养24h后,弃去培液,加入含有不同29wp与奥克纤溶酶摩尔比的组合物(含cy5标记的奥克纤溶酶浓度为1μm),37℃孵育2h,弃去药液,用10mm pbs(含0.02mg/ml肝素钠)洗3次,收集细胞,重悬于10mm pbs,流式细胞仪进行检测。
[0129]
由图4可见,在摩尔比0.1:1至1:1条件下,多肽29wp与奥克纤溶酶形成的组合物可以使奥克纤溶酶在人视网膜色素上皮细胞中的摄取增加7至21倍。
[0130]
实施例5.多肽促进西妥昔单抗被眼部细胞摄取
[0131]
多肽289wp与cy5标记的西妥昔单抗(cetuximab,等电点8.8,分子量152kd)分别溶解于磷酸缓冲溶液(pbs,浓度10mm,ph7.4)中,将289wp溶液与cy5标记的西妥昔单抗溶液按摩尔比0.5:1、0.7:1、1:1、3:1、5:1、7:1和10:1混合,室温条件下放置24h,得到289wp与西妥昔单抗组合物。
[0132]
取生长状态良好的人角膜上皮细胞(hcec),按1
×
104细胞/孔铺于24孔板,培养24h后,弃去培液,加入含有不同289wp与西妥昔单抗摩尔比的组合物(含cy5标记的西妥昔单抗浓度为1μm),37℃孵育2h,弃去药液,用10mm pbs(含0.02mg/ml肝素钠)洗3次,收集细胞,重悬于10mm pbs,流式细胞仪进行检测。
[0133]
由图5可见,在摩尔比0.5:1至10:1条件下,多肽289wp与西妥昔单抗形成的组合物可以使西妥昔单抗在人角膜上皮细胞中的摄取增加12至32倍。
[0134]
实施例6.不同比例多肽/雷珠单抗组合物的细胞摄取
[0135]
首先,对雷珠单抗进行荧光标记。取一定量雷珠单抗注射液,4℃纯水中透析3d脱盐(截留分子量10kd),冻干后取5mg复溶于100mm na2co3溶液中,加入0.12mg荧光标记试剂sulfo-cy5-nhs,4℃条件下搅拌反应过夜,体系于4℃纯水中透析3d后冻干,即得荧光标记雷珠单抗(cy5-rani)。
[0136]
随后制备多肽/雷珠单抗组合物。称取适量多肽,用一定体积市售雷珠单抗注射剂溶解,再加入等体积市售雷珠单抗注射液溶剂,4℃保存,备用。
[0137]
对不同的多肽/雷珠单抗组合物摄取效果进行评价。取生长状态良好的hcec、arpe-19和huvec细胞,按1
×
104细胞/孔分别铺于24孔板,培养24h后,弃去培液,加入不同组合物多肽/cy5-rani混合物溶液(均含cy5-rani 1μm),37℃孵育2h,弃去药液,用10mm pbs(含0.02mg/ml肝素钠)洗3次,收集细胞,重悬于10mm pbs,流式检测阳性细胞率和平均荧光强度,检测通道激发波长638nm,发射波长660nm。
[0138]
不同摩尔比条件下多肽介导的抗体细胞摄取结果如下。以眼部渗透能力较强的多肽89wp与cy5标记雷珠单抗(cy5-rani)按不同摩尔比混合后,考察其细胞摄取行为,结果如图6、图7所示。
[0139]
图6为不同摩尔比条件下多肽介导雷珠单抗细胞摄取定量评价。其中,取一定量多肽按不同摩尔比(89wp/rani,1:1,3:1,5:1,7:1,10:1;r8/rani,5:1,15:1,30:1)与cy5标记雷珠单抗1μm混合,4℃孵育24h,然后与不同细胞在37℃条件下共孵育2h。采用one-way anova检验进行显著性分析,以dunnett’s检验校正(n=3,
ns
p》0.05,***p《0.001,与游离雷珠单抗比较)。
[0140]
图7为不同摩尔比条件下多肽介导雷珠单抗细胞摄取的定量评价。其中,取一定量多肽89wp按不同摩尔比(5:1,7:1,10:1,12:1,15:1,18:1)与cy5标记雷珠单抗1μm混合,4℃孵育24h,然后与不同细胞在37℃条件下共孵育2h。采用one-way anova检验进行显著性分析,以tukey’s检验校正(n=3,
ns
p》0.05,*p《0.05,**p《0.01,***p《0.001)。
[0141]
结果表明,在摩尔比1:1至10:1条件下,多肽介导雷珠单抗细胞摄取呈上升趋势。根据初步筛选结果进一步优化89wp与雷珠单抗的摩尔比,在5:1至18:1条件下,与游离抗体相比,多肽89wp介导抗体在3种细胞中摄取量增加2.2-6.7倍(p《0.001);随多肽用量增加,抗体细胞摄取量总体呈上升趋势,在hcec细胞中,摩尔比10:1条件下抗体细胞摄取量与摩尔比7:1、12:1无显著性差异(p》0.05),在arpe-19细胞中,摩尔比10:1条件下抗体细胞摄取量显著高于摩尔比7:1混合物(p《0.001),较低于摩尔比12:1混合物(p《0.01),在huvec细胞中,摩尔比10:1条件下抗体细胞摄取量显著高于摩尔比7:1混合物(p《0.001),与摩尔比12:1混合物无显著性差异(p》0.05),略低于摩尔比15:1混合物(p《0.05)。总体上摩尔比10:1条件下多肽介导抗体细胞摄取量较低摩尔比组合物显著增加,此后继续增加多肽用量,抗体细胞摄取量增速趋缓,为提高多肽利用率,最终确定摩尔比10:1为最优组合物处方。
[0142]
实施例7.不同多肽/雷珠单抗组合物的细胞摄取
[0143]
在摩尔比10:1条件下制备不同多肽和雷珠单抗组合物,考察其在hcec和arpe-19细胞中摄取行为,结果如图6所示。
[0144]
图8为不同多肽介导雷珠单抗细胞摄取的定量评价。其中,取不同多肽10μm与1μm cy5-rani混合,4℃孵育24h得到组合物溶液,将组合物溶液与不同细胞在37℃孵育2h后检测,或将组合物溶液在4℃保存7天后与细胞孵育,流式检测细胞平均荧光强度值(ex 638nm/em 660nm)。
[0145]
结果表明,在2种细胞模型中,野生型penetratin介导雷珠单抗细胞摄取量均低于其含疏水衍生肽组合物溶液的细胞摄取量,并且衍生肽亲脂性增强,介导雷珠单抗细胞摄取量呈上升趋势。在hcec细胞中,多肽29wp、289wp介导雷珠单抗细胞摄取能力最强,相比于游离抗体,平均荧光强度分别增加13.5、14.7倍,在arpe-19细胞中有相同结果,基于多肽29wp、289wp的组合物溶液组细胞平均荧光强度分别增加11.1、11.3倍。将所制备组合物溶液于4℃条件下保存7d后考察其细胞摄取行为,与新鲜制备混合物相比,总体上大部分组合物溶液细胞摄取有所下降,但在2种细胞中基于29wp、289wp组合物溶液组细胞平均荧光强度仍为最高(289wp效果略优于29wp),因此选择多肽29wp、289wp为优选眼部吸收促进剂与市售雷珠单抗注射液组合,进行后续体内药动学评价。
[0146]
实施例8.多肽/雷珠单抗组合物的细胞摄取机制
[0147]
在本实施例中对多肽与雷珠单抗的同步细胞摄取行为进行研究。
[0148]
在摩尔比10:1条件下制备羧基荧光素标记的多肽289wp(289wp-fam)和cy5标记的雷珠单抗(cy5-rani)组合物,考察二者在hcec和arpe-19细胞中同步摄取行为,结果如图9、
图10所示。
[0149]
图9为多肽/抗体在hcec细胞中的同步摄取行为。a为羧基荧光素(fam)标记多肽289wp(289wp-fam)的细胞摄取平均荧光强度。b为cy5标记雷珠单抗(cy5-rani)的细胞摄取平均荧光强度。c为289wp-fam和cy5-rani细胞同步摄取流式图。各组合物均含289wp-fam 10μm、cy5-rani 1μm,溶于市售雷珠单抗注射液溶剂中,均与细胞37℃共孵育后(289wp-fam/cy5-rani组,两者混合4℃孵育24h后与细胞共孵育1.5h;289wp-fam,cy5-rani组,289wp-fam与细胞共孵育1.5h,弃去,cy5-rani继续与细胞共孵育1.5h;289wp-fam cy5-rani组,两者混合后立即与细胞共孵育1.5h)进行流式检测(fam,ex 488nm/em 520nm;cy5,ex 638nm/em 660nm)。采用one-way anova检验进行显著性分析,以tukey’s检验校正(n=3,
ns
p》0.05,***p《0.001)。
[0150]
图10为多肽/抗体在arpe-19细胞中同步摄取行为。其中,a为fam标记多肽289wp(289wp-fam)的细胞摄取平均荧光强度。b为cy5标记雷珠单抗(cy5-rani)的细胞摄取平均荧光强度。c为289wp-fam和cy5-rani的细胞同步摄取流式图。各组合物均含289wp-fam 10μm、cy5-rani 1μm,溶于市售雷珠单抗注射液溶剂中,均与细胞37℃共孵育后(289wp-fam/cy5-rani组,两者混合4℃孵育24h后与细胞共孵育1.5h;289wp-fam,cy5-rani组,289wp-fam与细胞共孵育1.5h,弃去,cy5-rani继续与细胞共孵育1.5h;289wp-fam cy5-rani组,两者混合后立即与细胞共孵育1.5h)进行流式检测(fam,ex 488nm/em 520nm;cy5,ex 638nm/em 660nm)。采用one-way anova检验进行显著性分析,以tukey’s检验校正(n=3,
ns
p》0.05,*p《0.05,***p《0.001)。
[0151]
结果表明,对于多肽(289wp-fam)细胞摄取,在hcec细胞中,各组细胞平均荧光强度值无显著性差异,而在arpe-19细胞中,对于289wp-fam细胞摄取,组合物溶液组平均荧光强度是游离多肽的9/10,其余组则与游离多肽无显著性差异,表明单独给以多肽或将多肽与抗体组合后给药,两种细胞对于多肽289wp-fam摄取均变化不大,抗体对多肽细胞摄取基本无影响。而与游离抗体相比,组合物溶液组(289w-fam/cy5-rani)、分步摄取组(289wp-fam,cy5-rani)、新鲜混合组(289wp-fam cy5-rani)在hcec细胞中摄取平均荧光强度分别是其23.2倍、12.6倍、21.3倍(p《0.001),而对于arpe-19细胞,混合溶液组、分步摄取组、新鲜混合组平均荧光强度值分别是游离抗体的7.4倍、5.3倍、6.2倍(p《0.001),表明多肽与抗体同步给药,或先以多肽处理细胞,继之给以抗体,均可大幅改善抗体细胞摄取效果(p《0.001),但同步给药优于分步给药(p《0.001)。
[0152]
实施例9.多肽/雷珠单抗组合物的细胞内吞机制
[0153]
在不同温度或添加内吞抑制剂条件下,采用流式细胞术考察多肽289wp与雷珠单抗组合物的细胞内吞机制,结果如图11所示。
[0154]
图11为多肽/雷珠单抗组合物的细胞摄取机制。其中,a和b分别为温度和内吞抑制剂对组合物中多肽和雷珠单抗在hcec细胞、arpe-19细胞中摄取的影响。无抑制条件下289wp-fam或组合物(mixture)中cy5-rani摄取量作为对照(100%)。采用单尾anova分析显著性差异,dunnett’s检验做校正(样本数3,
ns
p》0.05,*p《0.05,**p《0.01,***p《0.001)。
[0155]
结果表明,对于组合物中289wp-fam的细胞摄取,与对照组相比(289wp-fam,细胞摄取率为100%),在hcec细胞中,4℃或添加抑制剂氯丙嗪、高渗蔗糖、dynasore(抑制动力蛋白的gtp酶活性)条件下289wp-fam细胞摄取降幅明显,细胞摄取率分别为23.3%、
53.2%、54.4%、49.4%,在arpe-19中也有类似结果,对应细胞摄取率分别为34.3%、55.8%、70.1%、47.8%,表明在两种细胞中,289wp主要是通过能量依赖、网格蛋白介导的内吞途径进入细胞。而对于雷珠单抗细胞摄取,与对照组相比(mixture,细胞摄取率为100%),在hcec细胞中,4℃或添加抑制剂氯丙嗪、高渗蔗糖、dynasore条件下cy5-rani细胞摄取率显著下降,细胞摄取率分别为40.6%、37.8%、35.2%、24.4%,在arpe-19细胞中也有类似结果,对应细胞摄取率分别为79.6%、63.0%、75.7%、31.4%。
[0156]
实施例10.多肽介导纳米抗体的无创眼内递送
[0157]
首先,对纳米抗体进行荧光标记。取1mg脱盐纳米抗体(等电点9.6,分子量13kd)溶于600μl碳酸缓冲溶液(10mm,ph9.0),于4℃预冷,然后滴入异硫氰酸荧光素(fitc)溶液(0.53mg fitc溶于53μl dmso),4℃反应24h,反应结束后4℃透析(mwco 2kd)除去过量fitc及无机盐,冻干得fitc标记纳米抗体。
[0158]
随后,通过如下方法研究多肽/纳米抗体组合物在小鼠眼内的分布。精密称取fitc标记纳米抗体1.0mg溶于120μl生理盐水,取出60μl与0.5mg穿膜肽89wp混匀,4℃放置24h后使用,作为多肽/纳米抗体组合物,剩余60μl作为游离纳米抗体滴眼液。
[0159]
小鼠右眼给药,每5min给一次药,共3次,每次给药5μl。其中,游离纳米抗体(nb)溶液含fitc标记纳米抗体(绿色)浓度为8.33μg/μl,多肽/纳米抗体混合溶液含多肽89wp、fitc标记纳米抗体浓度均为8.33μg/μl。最后一次给药结束后1h处死小鼠,用40ml生理盐水做心脏灌流,摘取眼球,生理盐水冲洗,fas眼球固定液中固定24h,15%、30%蔗糖溶液梯度脱水,做眼球横截面冰冻切片,采用dapi染色,在激光共聚焦显微镜下观察荧光信号分布。
[0160]
滴眼后纳米抗体在各眼组织中分布的半定量分析的结果如下。表6、表7和表8为滴眼给药后纳米抗体在小鼠角膜、角巩膜缘、视网膜部位分布量的比较。
[0161]
表6为滴眼后纳米抗体的眼角膜分布。游离抗体滴眼组或多肽/纳米抗体溶液滴眼组给药剂量均为125μg荧光标记纳米抗体/眼。采用imagej软件计算角膜区域平均绿色荧光强度值(fitc标记的纳米抗体呈绿色荧光)。结果显示,与游离纳米抗体比较,89wp/纳米抗体组合物滴眼给药,使纳米抗体在角膜部位的分布量增加了3.1倍。
[0162]
表6滴眼给药后纳米抗体在小鼠眼角膜分布荧光信号强度比较
[0163][0164]
*与游离抗体滴眼组相比,平均荧光强度增加的倍数。
[0165]
表7为滴眼后纳米抗体的角巩膜缘分布。游离抗体滴眼组或多肽/纳米抗体溶液滴眼组给药剂量均为125μg荧光标记纳米抗体/眼。采用imagej软件计算角巩膜缘区域平均绿色荧光强度值(fitc标记的纳米抗体呈绿色荧光)。结果显示,与游离纳米抗体比较,89wp/纳米抗体组合物滴眼给药,使纳米抗体在角巩膜缘部位的分布量增加了3.5倍。
[0166]
表7滴眼给药后纳米抗体在小鼠角-巩膜缘分布荧光信号强度比较
[0167][0168]
*与游离抗体滴眼组相比,平均荧光强度增加的倍数。
[0169]
表8为滴眼后纳米抗体的视网膜分布。游离抗体滴眼组或多肽/纳米抗体溶液滴眼组给药剂量均为125μg荧光标记纳米抗体/眼。采用imagej软件计算视网膜区域平均绿色荧光强度值(fitc标记的纳米抗体呈绿色荧光)。结果显示,与游离纳米抗体比较,89wp/纳米抗体组合物滴眼给药,使纳米抗体在视网膜部位的分布量增加了4.1倍。
[0170]
表8滴眼后纳米抗体小鼠视网膜分布荧光信号强度比较
[0171][0172]
*与游离抗体滴眼组相比,平均荧光强度增加的倍数。
[0173]
上述眼组织的绿色荧光信号半定量分析结果表明,滴眼给药后1h,在角膜、角巩膜缘邻接视网膜、眼底视网膜区域,多肽/纳米抗体溶液滴眼组绿色荧光信号强度均显著强于游离抗体滴眼组(p《0.01),表明纳米抗体溶液中加入多肽89wp,可以显著增加滴眼给药后纳米抗体眼内吸收,特别在眼底视网膜分布显著增加。
[0174]
实施例11.多肽/雷珠单抗组合物滴眼给药后在家兔眼内的分布
[0175]
首先,制备多肽/雷珠单抗(rani)溶液。取一定量市售雷珠单抗注射液(10mg/ml),用市售产品溶剂等体积稀释至5mg/ml,用所得溶液溶解r8至4.0mg/ml得r8/rani混合溶液,或溶解89wp至7.4mg/ml得89wp/rani混合溶液,4℃储存备用,使用前至少于4℃孵育24h,并在室温静置1h。
[0176]
市售雷珠单抗注射液溶剂处方组成:10mm组氨酸盐酸盐,10%α,α-海藻糖,0.01%吐温20,ph5.5。
[0177]
随后,确定给药及取组织样本方案。
[0178]
选择1kg左右健康雄性家兔,实验前进行眼科检查确保眼睛正常,实验过程遵循实验动物伦理规范。家兔每只眼滴入30μl药液,含雷珠单抗150μg/眼。给药后1h取组织样本。
[0179]
取样时,采用安乐死处死家兔,立即由心脏取血1ml左右,加到1.5ml抗凝管中,4℃、2500g离心15min,取上清,-20℃保存备用;分别抽取房水、玻璃体于ep管中,-20℃保存备用;分离视网膜组织,4℃、2500g离心10min,弃上清,10mm pbs洗2次,称重,采用总蛋白提取试剂盒抽提组织总蛋白于10mm pbs中,-20℃保存备用。
[0180]
基于如下步骤建立elisa检测方法。
[0181]
1)抗原包被:用包被液(0.05m碳酸盐缓冲液,ph9.6)将hvegf-a
165
稀释至1μg/ml,将稀释好的抗原包被液于每个酶标板孔中加入100μl,封板后置于4℃包被过夜。
[0182]
2)洗板:弃去抗原包被液,用洗涤液(0.02m磷酸盐缓冲液,ph7.4,含0.05%吐温
20)加满所有包被孔,静置30s后扣干,重复6次。
[0183]
3)封闭:在酶标板每孔加入250μl封闭液,封板后4℃孵育过夜。
[0184]
4)弃去封闭液,洗板同上。
[0185]
5)孵育一抗(含雷珠单抗样品):取样品各100μl加入酶标孔,封板后37℃孵育1h。
[0186]
6)弃去一抗溶液,洗板同上。
[0187]
7)孵育二抗:各孔加入稀释倍数为1:400的hrp标记二抗(f(ab')2-goat anti-human igg(h l)cross-adsorbed secondary antibody,hrp)100μl,封板后37℃孵育1h。
[0188]
8)弃去二抗溶液,洗板同上。
[0189]
9)显色:每孔加入tmb溶液200μl,封板后37℃避光显色3min,每孔加终止液(2m硫酸溶液)50μl。
[0190]
10)检测:终止后10min内于酶标仪测定各孔od
450nm
值,以样品浓度为横坐标,以od
450nm
值为纵坐标做标准曲线,据此计算各样品含雷珠单抗浓度。
[0191]
随后测定雷珠单抗的组织浓度。准备已包被抗原(hvegf-a165)elisa板及提取组织(血浆、房水、玻璃体、视网膜总蛋白提取液),重复上述步骤5)至步骤10),同时做样品随行检测标曲,计算雷珠单抗组织浓度。
[0192]
通过elisa法检测雷珠单抗的组织浓度的结果如下。以样品浓度对应吸光度值做标准曲线。给定浓度范围内(5-120ng/ml),elisa检测od
450nm
值与样品浓度线性关系较好(r2》0.98),在该浓度范围内,采用elisa法检测雷珠单抗浓度方法可行。
[0193]
雷珠单抗在眼组织中的分布如下。滴眼给药后1h,兔眼各组织雷珠单抗浓度如图12所示。
[0194]
图12为滴眼给药1h后兔体内各组织(血浆、房水、玻璃体、视网膜)雷珠单抗浓度。阴影区域为文献报道的雷珠单抗半数有效浓度(ec
50
)。采用单尾anova分析显著性差异,tukey’s检验做校正(
ns
p》0.05,*p《0.05,**p《0.01,与rani组相比)。
[0195]
结果表明,对于游离雷珠单抗滴眼组(rani),给药后1h,兔眼房水、玻璃体、视网膜药物浓度几乎测不出,远低于文献报道的雷珠单抗半数有效浓度(ec
50
);对于r8/rani溶液组,经滴眼给药,在房水中未达到有效治疗浓度,在玻璃体达到有效治疗浓度下限,在视网膜组织浓度可达到有效治疗浓度,优于游离雷珠单抗组(p=0.0377);对于89w/rani复合物组,经滴眼给药,在房水未达到有效治疗浓度,在玻璃体和视网膜组织可达到有效治疗浓度,显著优于游离雷珠单抗组(p=0.0025)。
[0196]
实施例12.多肽/雷珠单抗组合物滴眼给药后在家兔体内的药动学
[0197]
首先,制备滴眼液。制备多肽/雷珠单抗组合物,取一定量市售雷珠单抗注射剂(10mg/ml),用市售产品溶剂等体积稀释至5mg/ml,用所得溶液溶解29wp至2.48mg/ml得组合物29wp/rani,或溶解289wp至2.54mg/ml得组合物289wp/rani,4℃储存备用,使用前至少于4℃孵育24h,并在室温静置1h。
[0198]
随后,确定给药及取样方案。选择1kg左右健康雄性家兔,实验前进行眼科检查确保眼睛正常,实验过程遵循实验动物伦理规范。家兔每只眼滴入30μl不同组合物溶液,含雷珠单抗150μg/眼。给药后1h、4h、8h、12h、24h分别取眼组织样品。
[0199]
接着,测定雷珠单抗的组织浓度。准备已包被抗原(hvegf-a165)elisa板及提取组织(血浆、房水、玻璃体、视网膜总蛋白提取液),重复实施例11中的建立elisa检测方法中的
步骤5)至步骤10),同时做样品随行检测标曲,计算雷珠单抗组织浓度。
[0200]
结果如下:给定浓度范围内(5-120ng/ml),elisa检测od
450nm
值与雷珠单抗样品浓度线性关系较好(r2》0.98),在该浓度范围内,采用elisa法检测雷珠单抗浓度方法可行。
[0201]
多肽/雷珠单抗组合物滴眼后兔体内药动学行为。采用elisa法检测滴眼给药后多肽介导雷珠单抗在兔体内各组织分布,结果如图13、表9所示。
[0202]
图13为滴眼给药后多肽/雷珠单抗组合物在兔体内的浓度分布变化。其中,给药剂量:289wp/rani组合物组含289wp 76.2μg/眼、雷珠单抗150μg/眼;29wp/rani组合物组含29wp 74.4μg/眼、雷珠单抗150μg/眼;rani组含雷珠单抗150μg/眼。检测给药后1h、4h、8h、12h、24h雷珠单抗组织浓度。阴影区域为文献报道的雷珠单抗半数有效浓度(ec
50
)。采用单尾anova分析显著性差异,tukey’s检验做校正(
ns
p》0.05,*p《0.05,**p《0.01,与rani组相比)。
[0203]
表9滴眼给药后多肽介导雷珠单抗兔体内浓度分布(ng/ml or ng/g)。
[0204][0205]
结果表明,药物经眼表滴入后可能存在全身吸收,以血浆中雷珠单抗浓度表征雷珠单抗全身分布行为,给药后1h,289wp/rani组合物组雷珠单抗血浆浓度为17.2
±
1.4ng/ml,29wp/rani组合物组为21.7
±
9.2ng/ml,达到文献报道的雷珠单抗半数有效浓度(ec
50
),而rani组滴眼给药1h后在血液中未检出雷珠单抗,给药后4h,289wp/rani组合物组及29wp/rani组合物组血浆浓度降至0.9
±
0.9ng/ml、14.0
±
5.0ng/ml,给药后8h,各组雷珠单抗血浆浓度基本为0,表明滴眼给药后,多肽介导雷珠单抗存在一定全身吸收,但给药后4h雷珠单抗血浆浓度大幅下降,8h后基本清除完毕。对于房水中雷珠单抗含量,给药后1h和4h,289wp/rani组合物组及29wp/rani组合物组雷珠单抗浓度处于文献报道的雷珠单抗半数有效浓度(ec
50
)范围内(9.0-28.8ng/ml),前者略高,而rani组给药后1h房水中雷珠单抗浓度仅为1.7ng/ml,表明雷珠单抗单独滴眼后难以在房水中达到有效治疗浓度。对于玻璃体内雷珠单抗浓度,仅289wp/rani组合物组滴眼后1h可达到文献报道的雷珠单抗半数有效浓度(ec
50
)(27.0
±
7.8ng/ml)。以视网膜中雷珠单抗浓度表征抗体向病灶部位分布,给药后1h、4h及8h,289wp/rani组合物组雷珠单抗视网膜浓度分别为107.1
±
55.4ng/g、63.4
±
43.6ng/g、21.9
±
4.4ng/g,均值分别为游离抗体组的20.6、12.2、4.2倍(p《0.05),并且高于或处于文献报道的雷珠单抗半数有效浓度(ec
50
)浓度范围内,表明单次滴眼给药后8h内,289wp/rani组合物可维持视网膜中的雷珠单抗处于有效浓度范围内,而29wp/rani组合物滴眼给药后1-8h,视网膜浓度在13.7-35.8ng/g,也可达到文献报道的雷珠单抗半数有效浓度(ec
50
),但浓度偏低,持续时间较短,表明29wp眼内递送雷珠单抗效果不如289wp。同时考虑到多肽/雷珠单抗组合物滴眼给药后,雷珠单抗视网膜浓度》玻璃体或房水中浓度,因此
推断多肽介导雷珠单抗到达视网膜可能是通过结膜
→
巩膜
→
脉络膜
→
视网膜途径吸收。
[0206]
实施例13.多肽/阿柏西普组合物滴眼给药后在家兔体内的药动学
[0207]
首先,制备滴眼液。制备多肽/阿柏西普组合物,采用市售阿柏西普注射液溶剂稀释阿柏西普(40mg/ml)至20mg/ml,取此溶液溶解多肽289wp至6.16mg/ml,4℃储存备用,使用前至少于4℃孵育24h,并在室温静置1h。
[0208]
市售阿柏西普注射液溶剂处方组成:10mm磷酸盐缓冲溶液,40mm氯化钠,0.03%吐温20,5%蔗糖,ph6.2。
[0209]
其次,确定给药及取样方案。选择1kg左右健康雄性家兔,实验前进行眼科检查确保眼睛正常,实验过程遵循实验动物伦理规范。家兔每只眼滴入30μl不同组合物溶液,含阿柏西普600μg/眼。给药后1h取眼组织样品。
[0210]
随后,测定阿柏西普组织浓度。准备已包被抗原(hvegf-a165)elisa板及提取组织(血浆、房水、玻璃体、视网膜总蛋白提取液),重复实施例11中的建立elisa检测方法中的步骤5)至步骤10),同时做样品随行检测标曲,计算阿柏西普组织浓度。
[0211]
结果如下:给定浓度范围内(0-156.25ng/ml),elisa检测od
450nm
值与阿柏西普样品浓度线性关系较好(r2》0.98),在该浓度范围内,采用elisa法检测阿柏西普浓度方法可行。
[0212]
采用elisa法检测滴眼给药后多肽介导阿柏西普在兔体内各组织分布,结果如图14所示。
[0213]
图14为滴眼给药后多肽/阿柏西普溶液在兔体内的浓度分布。其中,给药剂量:afli组含阿柏西普600μg/眼;289wp/afli组合物组含289wp 184.8μg/眼、阿柏西普600μg/眼。检测给药后1h阿柏西普组织浓度。采用双尾非配对t检验分析显著性差异(
ns
p》0.05,*p《0.05)。
[0214]
结果表明,给药后1h,游离阿柏西普组或289wp/afli组合物组血浆中均未检出阿柏西普。与afli组相比,289wp/afli组合物滴眼后房水(p《0.05)、玻璃体中阿柏西普浓度略高,而视网膜浓度达到237.6
±
162.2ng/g,显著高于afli组(p《0.05),表明多肽289wp可显著改善阿柏西普的眼部吸收。与多肽/雷珠单抗滴眼液类似,阿柏西普可能经结膜
→
巩膜
→
脉络膜
→
视网膜途径吸收。
[0215]
上述实验证明,与仅使用所述生理ph条件下带正电荷的药物的情况比较,所述组合物使得细胞摄取显著增加。通过本发明的组合物,能够介导所述生理ph条件下带正电荷的药物高效地透过眼部的吸收屏障,促进药物进入眼内并到达眼后段,进而提高生理ph条件下带正电荷的药物的眼部生物利用度,显著促进了生理ph条件下带正电荷的药物的细胞摄取。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。