il-5的结合分子及其制备方法和应用
技术领域
1.本发明涉及医药生物技术领域,具体而言,涉及针对il-5的结合分子及其制备方法和应用。
背景技术:
2.人白细胞介素5,又称interleukin-5,或il-5,其与il-13和粒细胞-巨噬细胞集落刺激因子(g m-csf)均是参与造血和炎症的细胞因子(metcalf;1986)。所有三种细胞因子都会促进嗜酸性粒细胞的产生,功能发挥和细胞存活(metcalf;1986),因此,具有影响炎性疾病的能力,例如在哮喘、特应性皮炎和过敏性鼻炎中,嗜酸性粒细胞起主要的效应作用。
3.作为嗜酸性粒细胞特异性细胞因子的il-5已经受到大多数研究者的注意,其中il-5mrna和蛋白质水平在来自症状性哮喘患者的肺组织和支气管肺泡灌洗液(bal)中有提升(fukuda等1994)。研究者还观察到il-5水平与过敏原激发和疾病活动之间的相关性(sur等,1996)。然而,显而易见的是,不仅il-5,gm-csf和il-3也在哮喘中的嗜酸性粒细胞产生和活化中起作用,有证据表明gm-csf和il-3在过敏性炎症发生位置合成(bagley等,1997b;allen等,1997)。这些细胞因子的表达可能有助于增加浸润性嗜酸性粒细胞的总数和嗜酸性粒细胞活化的程度。还有一种可能,这些细胞因子对不同阶段的嗜酸性粒细胞浸润作用有作用。来自接受抗原攻击的患者的最新动力学数据显示,il-5水平在攻击后第2~7天之间增加,而gm-csf在第2天达到峰值,并且在第16天保持升高。
4.il-5、gm-csf和il-3通过与细胞表面受体结合来刺激嗜酸性粒细胞和其他正常细胞和癌细胞,所述细胞表面受体包含配体特异性α链和由三种受体共有的链(βc)(bagley等1997a)。与每个受体的α链结合是受体激活的最初步骤,然而,单独α链结合不足以发生活化。随后配体会招募βc,随后是一个具有两个主要功能结果的步骤:首先,它允许il-5、gm-csf和il-3的结合变得基本上不可逆转;其次,它导致完全受体激活(bagley等1997a)。由于βc是这些受体的主要信号传导成分,它的参与导致jak-2,stat-5和其他信号分子的激活,最终导致通常与il-5相关的过多细胞活动,gm-csf和il-3刺激如嗜酸性粒细胞粘附,引发脱颗粒和细胞毒性,以及延长细胞活力(bates等,1996)。
5.为了在体内阻断或拮抗嗜酸性粒细胞活化细胞因子的活性,研究者尝试了三种主要方法。其中一个利用针对牵连细胞因子的抗体。例如,il-5的抗体被用于过敏原诱导的哮喘的动物模型中,并且这一方法已经显示出在预防嗜酸性粒细胞流入气道和支气管高反应性方面具有相对长效的作用(mauser等,1995)。但是现在仍然缺乏亲和力高的,能特异性抗il-5的抗体或以il-5为靶点的药物,鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供il-5的结合分子及其制备方法和应用。
7.本发明是这样实现的:
8.第一方面,实施例提供了il-5的结合分子,其能够特异性结合il-5且包含至少一
个免疫球蛋白单一可变结构域,所述免疫球蛋白单一可变结构域包括互补决定区cdr1、cdr2和cdr3;
9.其中,cdr1的氨基酸序列选自如seq id no.43~49所示序列中的任意一种;cdr2的氨基酸序列选自如seq id no.50~56所示序列中的任意一种;cdr3的氨基酸序列选自如seq id no.57~62所示序列中的任意一种。
10.第二方面,本发明实施例提供了分离的核苷酸,其编码如前述实施例所述的il-5的结合分子。
11.第三方面,本发明实施例提供了重组载体,其含有前述实施例所述的分离的核苷酸。
12.第四方面,本发明实施例提供了宿主细胞,其含有前述实施例所述的重组载体。
13.第五方面,本发明实施例提供了il-5的结合分子的制备方法,其包括培养如前述实施例所述的宿主细胞,获得il-5的结合分子。
14.第六方面,本发明实施例提供了用于结合il-5蛋白的偶联物,其包括偶联组分,以及如前述实施例所述的il-5的结合分子;
15.所述偶联组分与所述il-5的结合分子偶联;所述偶联组分包括用于检测的标记物和/或化合物。
16.第七方面,本发明实施例提供了用于检测il-5的试剂盒,其包括前述实施例所述的il-5的结合分子。
17.第八方面,本发明实施例提供如前述实施例所述的il-5的结合分子在制备用于治疗疾病且以i l-5为靶点的药物中的应用。
18.本发明具有以下有益效果:
19.本发明实施例提供了il-5的结合分子及其制备方法和应用,该结合分子能够特异性结合il-5且包含至少一个免疫球蛋白单一可变结构域,所述免疫球蛋白单一可变结构域包括互补决定区cdr1、cdr2和cdr3;其中,cdr1的氨基酸序列选自如seq id no.43~49所示序列中的任意一种;cd r2的氨基酸序列选自如seq id no.50~56所示序列中的任意一种;cdr3的氨基酸序列选自如se q id no.57~62所示序列中的任意一种。该结合分子可特异性结合il-5,并能够有效阻断il-5诱导的细胞增殖,可用于il-5相关疾病的预防、诊断和/或治疗。
附图说明
20.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
21.图1为实施例1中人源重组il-5的蛋白质凝胶电泳分析结果;
22.图2为实施例1中针对il-5重组蛋白的纳米抗体文库筛选后的富集情况;其中,p/n=生物淘选中阳性孔洗脱下的噬菌体感染tg1细菌后生长的单克隆细菌数/阳性孔洗脱下的噬菌体感染tg1细菌后生长的单克隆细菌数,该参数在富集发生后会逐渐增大;i/e=生物淘选中每轮加入阳性孔的噬菌体总量/生物淘选中每轮从阳性孔洗脱出的噬菌体总量,
该参数在富集发生后会逐渐趋近于1;
23.图3为实施例2中抗体株1b3和2b3的人源化变体的分别比对结果;
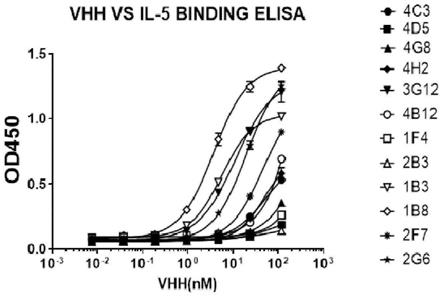
24.图4为验证例1中从实施例1中获得的大肠杆菌表达的12株抗体与il-5结合能力的分析结果;
25.图5为验证例2中tab1和tab2与il-5结合量效曲线;
26.图6为验证例2对照抗体1(tab1)和对照抗体2(tab2)与中和il-5诱导的tf-1细胞增殖量效曲线;
27.图7为验证例3中从实施例3中获得的特异性针对il-5的fc融合单域抗体中和il-5诱导的tf-1增殖量效曲线;
28.图8为验证例3中从实施例3中获得的不同人源化的fc融合单域抗体中和il-5诱导的tf-1增殖量效曲线。
具体实施方式
29.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
30.名词定义
31.本文中的“单域抗体”,sdab,是一种天然缺失轻链的抗体,该抗体只包含一个重链可变区(vhh),也被称为纳米抗体。
32.本文中“人源化抗体”是指将目标抗体(如动物抗体)的重链可变区与人抗体的恒定区融合而得到的抗体,或将目标抗体的互补决定区(cdr1~3序列)移植至人抗体的可变区内,得到的抗体,或将目标抗体根据人抗体骨架区(fr1~4)的特征进行氨基酸的突变后获得的抗体。人源化抗体可用合成法或定点突变法。
33.本文中“双链抗体”,diabody,是一种小分子的双价双特异性抗体片段,能同时识别2种抗原的抗体。hollinger等将a抗原抗体的轻链可变区基因(vla)与抗b抗原抗体的重链可变区(vhb)通过短肽分子连接;同样地,将vha和vlb连接,将两组嵌合基因置于双顺反子的表达质粒中,构建成双链抗体的表达质粒,表达后,vla-vhb与vha-vlb交叉连接,形成双特异性抗体。在本技术中,双价抗体能识别的其中一种抗原为il-5蛋白,另一种可识别的抗原可选自现有的任意一种抗原。
34.本文中“多价抗体”,又称多链抗体,是指一种通过改造抗体结构后(与双链抗体类似),能够同时识别多种抗原的抗体(同双链抗体),在本技术中,其能识别的其中一种抗原为il-5蛋白。
35.本说明书中提到的“cdr”为抗体的互补决定区,抗体通常包含两个可变区,重链可变区和轻链可变区,重链可变区或轻链可变区通常包括3个cdrs。
36.实施方式
37.本发明实施例提供了il-5的结合分子,其能够特异性结合il-5且包含至少一个免疫球蛋白单一可变结构域,所述免疫球蛋白单一可变结构域包括互补决定区cdr1、cdr2和cdr3;
38.其中,cdr1的氨基酸序列选自如seq id no.43~49所示序列中的任意一种;cdr2的氨基酸序列选自如seq id no.50~56所示序列中的任意一种;cdr3的氨基酸序列选自如seq id no.57~62所示序列中的任意一种。
39.优选地,所述互补决定区cdr1、cdr2和cdr3的氨基酸序列如(1)~(13)中任一项所示;
40.(1)如seq id no.43、56和58所示;
41.(2)如seq id no.49、51和60所示;
42.(3)如seq id no.47、56和57所示;
43.(4)如seq id no.45、54和57所示;
44.(5)如seq id no.46、50和61所示;
45.(6)如seq id no.47、56和62所示;
46.(7)如seq id no.48、56和57所示;
47.(8)如seq id no.45、53和57所示;
48.(9)如seq id no.44、55和57所示;
49.(10)如seq id no.43、56和59所示;
50.(11)如seq id no.43、52和59所示;
51.(12)如seq id no.47、56和59所示;
52.(13)如seq id no.47、52和59所示;
53.在可选的实施方式中,所述免疫球蛋白单一可变结构域还包括骨架区,所述骨架区包括fr1、fr2、fr3和fr4;单域抗体的结构为:fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4。
54.其中,所述fr1的氨基酸序列选自如seqidno.63~68所示序列中的任意一种;所述fr2的氨基酸序列选自如seqidno.69~72所示序列中的任意一种;所述fr3的氨基酸序列选自如seqidno.73~86所示序列中的任意一种;所述fr4的氨基酸序列如seqidno.87所示。
55.优选地,所述免疫球蛋白单一可变结构域的骨架区fr1、fr2和fr3的序列如下(14)~(28)中任一项所示;
56.(14)如seq id no.65、72和85所示;
57.(15)如seq id no.65、72和82所示;
58.(16)如seq id no.64、71和86所示;
59.(17)如seq id no.65、72和73所示;
60.(18)如seq id no.65、72和84所示;
61.(19)如seq id no.66、69和83所示;
62.(20)如seq id no.68、72和76所示;
63.(21)如seq id no.66、69和79所示;
64.(22)如seq id no.63、72和85所示;
65.(23)如seq id no.67、70和80所示;
66.(24)如seq id no.65、72和78所示;
67.(25)如seq id no.65、72和77所示;
68.(26)如seq id no.67、70和81所示;
69.(27)如seq id no.65、72和74所示;
70.(28)如seq id no.65、72和75所示。
71.优选地,所述免疫球蛋白单一可变结构域为vhh。
72.优选地,所述vhh的氨基酸序列选自如seq id no.1~12所示序列中的任意一种。
73.优选地,所述所述vhh为人源化的vhh。
74.优选地,所述人源化的vhh的序列选自如seq id no.13~21所示序列中的任意一种。
75.优选地,所述结合分子还包含免疫球蛋白fc区,所述免疫球蛋白fc区与vhh相连。
76.优选地,所述免疫球蛋白fc区是人免疫球蛋白fc区;
77.优选地,所述人免疫球蛋白fc区是人igg4的fc区。
78.本发明实施例提供了分离的核苷酸,其编码如前述任意实施方式所述的il-5的结合分子。
79.优选地,所述核苷酸的序列选自如seq id no.22~42所示序列中的任意一种。
80.本发明实施例提供了重组载体,其含有如前述任意实施方式所述的分离的核苷酸。在可选实施方式中,重组载体可以为质粒、噬菌体或病毒载体。
81.本发明实施例提供了宿主细胞,其含有如前述实施例所述的重组载体。在可选实施例中,宿主细胞可以为原核细胞或真核细胞。
82.本发明实施例提供了il-5的结合分子的制备方法,其包括培养如前述实施例所述的宿主细胞,获得il-5的结合分子。
83.需要说明的是,上述任意实施方式所述的结合分子可以通过人工合成的方式制备,也可先合成其编码基因,在进行生物表达得到。
84.本发明实施例还提供了用于结合il-5蛋白的偶联物,其包括偶联组分,以及如前述任意实施方式所述的il-5的结合分子,所述偶联组分与所述il-5的结合分子偶联;所述偶联组分包括用于检测的标记物和/或化合物。
85.优选地,所述用于检测的标记物为放射性元素。
86.本发明实施例还提供了用于检测il-5蛋白的试剂盒,其包括如前述任意实施方式所述的il-5的结合分子。
87.此外,本发明实施例还提供了所述的il-5的结合分子在制备用于治疗疾病且以il-5为靶点的药物中的应用。
88.优选地,所述疾病选自:哮喘、过敏性皮炎、湿疹、关节炎、疱疹、慢性原发性荨麻疹、硬皮病、肥大性瘢痕、慢性阻塞性肺疾病、特应性皮炎、特发性肺纤维化、川崎病、镰状细胞病、格雷夫斯氏病、舍格伦综合征、自体免疫淋巴组织增生性综合征、自体免疫性溶血性贫血、巴雷特食管、自体免疫葡萄膜炎、结核病和肾病中的任意一种。
89.以下结合实施例对本发明的特征和性能作进一步的详细描述。
90.实施例1
91.抗il-5蛋白的单域抗体的制备。
92.a、人源重组il-5蛋白的表达载体的构建:
93.在ncbi中检索获得il-5的编码序列,其收录号为nm_000879.2,该序列编码产生的氨基酸序列登录号为np_000870.1。分别通过tmhmm和smart网站对np_000870.1对应的氨基酸序列进行蛋白跨膜区和胞外端的分析。分析结果显示,il-5蛋白没有跨膜区,为分泌蛋
白;全长134个氨基酸,其中1~19位为该蛋白的信号肽。利用基因合成的方式,将编码il-5蛋白的20-134位氨基酸的核苷酸序列克隆到载体pcdna3.4中。将构建好的载体进行sanger测序,并比对原始序列,检测无误后,将该重组质粒进行批量抽提,去除内毒素,转染悬浮293f进行目的蛋白的表达和纯化,纯化后人源重组il-5蛋白的sds-page分析结果如图1所示。
94.由图1可知,表达纯化的人源重组il-5的蛋白纯度约90%,本实施例中获得的il-5蛋白将用于骆驼的免疫和抗体筛选。
95.b、抗il-5蛋白的单域抗体文库的构建:
96.将600μg步骤a中纯化获得的人源重组il-5蛋白与等体积的弗氏完全佐剂混合,免疫一只内蒙古阿拉善双峰驼。免疫方式为每周免疫一次,共连续免疫7次。且除首次免疫外,其余6次均是采用300μg il-5重组蛋白与弗氏不完全佐剂等体积混合进行动物免疫,使骆驼产生抗il-5的抗体。
97.动物免疫结束后,抽取骆驼外周血淋巴细胞100ml并提取细胞的rna。利用提取的总rna合成cdna,并通过套式pcr反应以cdna为模板扩增vhh(重链抗体可变区)。然后,利用限制性内切酶分别酶切pmecs载体和vhh片段(扩增获得的),然后将酶切后的片段和载体链接;并将连接后的片段点转化至感受态细胞tg1中,构建il-5蛋白的噬菌体展示文库,并测定库容,文库(重组tg1细胞)的库容大小约为1
×
109。
98.c、抗il-5蛋白的单域抗体的筛选:
99.取200μl步骤b获得的重组tg1细胞至2
×
ty培养基中培养,培养期间,加入40μl辅助噬菌体vcsm13侵染tg1细胞,并培养过夜以扩增噬菌体,次日利用peg/nacl沉淀噬菌体,离心收集扩增噬菌体,获得扩增后的噬菌体文库。
100.将稀释在nahco3(100mm ph 8.3)中的il-5蛋白500μg偶联在酶标板上,4℃放置过夜,同时设立阴性对照孔;第2天加入200μl的3%的脱脂乳,室温封闭2h;封闭结束后,加入100μl扩增后噬菌体文库(大约2
×
10
11
个噬菌体颗粒),室温作用1h;作用1小时后,用pbs 0.05%tween-20洗5遍,以洗掉未结合的噬菌体;用终浓度为2.5mg/ml的胰蛋白酶将与il-5蛋白特异性结合的噬菌体解离下,并感染处于对数生长期的大肠杆菌tg1细胞,37℃培养1h,产生并收集噬菌体用于下一轮的筛选,相同筛选过程重复1轮,逐步得到富集,当富集倍数达到10倍以上时,富集效果如图2和表1所示。
101.表1富集效果
[0102] 第一轮第二轮第三轮i/e800035.714285714p/n3.125180.64516132500
[0103]
由结果可知,第三轮富集p/n为2500,i/e为4。
[0104]
d、用噬菌体的酶联免疫法筛选抗il-5的特异性阳性克隆:
[0105]
当富集倍数达到10倍以上时,从筛选获得的阳性克隆中挑选400个单菌落分别接种于含100μg/ml氨苄青霉素的tb培养基的96深孔板中,并设置空白对照,37℃培养至对数期后,加入终浓度为1mm的iptg,28℃培养过夜。
[0106]
利用渗透涨破法获得抗体粗提液;将人源重组il-5蛋白分别释至100mm ph 8.3的nahco3中,并将100μg重组il-5蛋白蛋白在酶标板(elisa板)中4℃包被过夜;将获得的抗体
粗提液取100μl转移至加入抗原(重组il-5蛋白)的elisa板上,室温孵育1h;用pbst洗去未结合的抗体,加入100μl经1:2000稀释后的mouse anti-ha tag antibody(鼠抗ha抗体,thermo fisher),在室温孵育1h;用pbst洗去未结合的抗体,加入100ul经1:20000稀释后的anti-rabbit hrp conjugat e(山羊抗兔辣根过氧化物酶标记抗体,购自于thermo fisher),在室温孵育1h;用pbst洗去未结合的抗体,加入辣根过氧化物酶显色液,37℃下反应15min后,加入中止液,于酶标仪上450nm波长处,读取吸收值;当样品孔od值大于对照孔5倍以上时,判定为阳性克隆孔;将阳性克隆孔的菌转摇在含有100μg/μl氨苄青霉素的lb培养基中,以便提取质粒并进行测序。并根据序列比对软件vector nti分析各个克隆株的基因序列,把cdr1,cdr2,cdr3序列相同的株视为同一克隆株,而序列不同的株视为不同克隆株,最终获得特异性抗il-5蛋白的单域抗体。单域抗体的氨基酸序列为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4结构,构成整个vhh。获得的单域抗体重组质粒(阳性质粒,目的序列)可以在原核系统中进行表达,最终获得单域抗体蛋白。
[0107]
e、il-5蛋白的特异性单域抗体在宿主大肠杆菌中的纯化及表达:
[0108]
将步骤d中测序分析所获得不同克隆株的阳性质粒(pmecs-vhh)电转化到大肠杆菌hb2151中,并将其涂布在lb amp glucose即含有氨苄青霉素和葡萄糖的培养平板上,37℃培养过夜;挑选单个菌落接种在5ml含有岸边青霉素的lb培养液中,37℃摇床培养过夜;接种1ml的过夜培养菌种至330ml tb培养液中,37℃摇床培养,培养到od600nm值达到0.6-0.9时,加入1m iptg,28℃摇床培养过夜;离心,收集大肠杆菌,利用渗透胀破法,获得抗体粗提液;通过镍柱亲和层析法纯化出抗体,纯化后的单域抗体(请参照表2)。
[0109]
表2单域抗体的信息
[0110]
2b3-v2
ꢀꢀꢀꢀꢀꢀꢀꢀ
√2b3-v3
ꢀꢀꢀꢀꢀꢀꢀꢀ
√2b3-v4
ꢀꢀꢀꢀꢀꢀꢀꢀ
√
[0121]
表4克隆1b3、2b3人源化变体的序列编号以及部分变体中的氨基酸变化
[0122][0123][0124]
实施例3
[0125]
f、il-5蛋白的单域抗体的fc融合蛋白的真核表达载体的构建:
[0126]
将实施例1步骤d中筛选出来的单域抗体经sanger测序得到其核苷酸序列;通过序列合成的方式将密码子优化后的上述核苷酸序列合成至改造的载体rjk-v4-hfc中。
[0127]
rjk-v4-hfc是一种纳米抗体通用的目标载体,为一种在invitrogen商业化载体pcdna3.4(载体资料链接:https://assets.thermofisher.com/tfs-assets/lsg/manuals/pcdna3_4_topo_ta_cloning_kit_man.pdf)的基础上融合了人源igg的重链编码序列(ncbi accession no.:ab776838.1)中的fc区段后改造而来的,即该载体包含了igg重链的铰链区(hinge)ch2和ch3区。具体改造方案如下:
[0128]
选取pcdna3.4上的限制性酶切位点xbai和agei;在fc片段编码序列的5’端和3’端通过重叠pcr的方式分别引入多克隆位点(mcs,multiple cloning site)和6
×
his标签。使用分别带有xbai和agei酶切位点的一对引物通过pcr的方式将上述片段扩增;用限制性内切酶xbai和agei分别酶切pcdna3.4和带有xbai和agei酶切位点引物的扩增片段;将酶切后的载体和插入片段在t4连接酶的作用下连接,然后将连接产物转化至大肠杆菌,扩增,测序核实,获得重组真核表达载体。
[0129]
将构建好的重组真核表达载体转化至dh5α大肠杆菌中,培养进行质粒大提,去除内毒素;将大提后的质粒再进行序列测序鉴定;将确定无误后的重组载体准备后续真核细胞转染表达。
[0130]
g、il-5蛋白的特异性单域抗体的fc融合蛋白在悬浮expi cho-s细胞中表达:
[0131]
转染前3天,以2.5
×
105/ml的浓度细胞传代和扩大培养expicho-s
tm
细胞,计算出的所需的细胞体积,并转移至装有120ml(终体积)的expicho
tm
表达培养基的500ml摇瓶中;使细胞浓度达到约(4~6)
×
106活细胞/ml;在转染前一天,将expicho-s
tm
细胞稀释浓度至3.5
×
106活细胞/ml,使细胞过夜培养;转染当天,测定细胞密度和活细胞百分比。转染之前细胞密度应达到约(7~10)
×
106活细胞/ml;用预热至37℃新鲜的expicho
tm
表达培养基将细胞稀释至6
×
106个活细胞/ml。计算出的所需的细胞体积转移至装有新鲜的已预热的100ml(终体积)的expicho
tm
表达培养基的500ml摇瓶中;使轻轻颠倒混匀
expifectamine
tm
cho试剂,用3.7ml optipro
tm
培养基稀释expifectamine
tm
cho试剂,回荡或混匀;用冷藏的4ml optipro
tm
培养基稀释质粒dna(步骤f中获得的),回荡混匀;将expifectamine cho/质粒dna复合物室温孵育3min,然后轻轻加入制备的细胞悬液中,加入过程中轻轻回荡摇瓶;将细胞在37℃、8%co2、加湿的空气中震荡培养;转染后第1天(18-22小时后)添加600μl expifectamine
tm
cho enhancer(增强子)和24ml expicho fee d(补料)。在转染后约8天(细胞活率低于70%)收集上清。
[0132]
h、il-5蛋白的单域抗体的fc融合蛋白在悬浮293f细胞中的表达。
[0133]
转染前3天以2.5
×
105/ml细胞传代和扩大培养293f细胞,计算出的所需的细胞体积转移至装有新鲜的已预热的120ml(终体积)的opm-293cd05 medium培养基的500ml摇瓶中。使细胞浓度达到约(2~3)
×
106活细胞/ml。转染当天,测定细胞密度和活细胞百分比。转染之前细胞密度应达到约(2~3)
×
106活细胞/ml。用预热的opm-293cd05 medium将细胞稀释至1
×
106个活细胞/ml。计算出所需的细胞体积转移至装有新鲜的已预热的100ml(终体积)的培养基的500ml摇瓶中。用4ml opti-mem培养基稀释pei(1mg/ml)试剂,回荡或吹打混匀;用4ml opt-mem培养基稀释质粒dna(步骤f中获得的),回荡混匀,并用0.22um的滤头过滤。室温孵育5min。将稀释的pei试剂加入稀释的dna中,颠倒混匀。将pei/质粒dna复合物室温孵育15~20分钟,然后轻轻加入制备的细胞悬液中,加入过程中轻轻回荡摇瓶。将细胞在37℃、5%co2、120rpm震荡培养。转染后第24h、72h添加5ml opm-cho pff05补料。在转染后约7天(细胞活率低于70%)收集上清。
[0134]
i、il-5蛋白的单域抗体的fc融合蛋白的纯化
[0135]
将步骤g或h中获得fc融合蛋白的表达上清用0.45μm的一次性滤头过滤除掉不可溶杂质;将滤液使用蛋白纯化仪进行亲和层析纯化,利用人源fc融合蛋白与protein a(蛋白a)结合的能力,使用偶联protein a的琼脂糖填料进行纯化;将滤液通过1ml/分钟的流速流穿protein a预装柱,该步骤中滤液中的目标蛋白会与填料结合;通过低盐和高盐缓冲液将柱上结合的杂质蛋白洗涤;用低ph缓冲液将柱上结合的目标蛋白进行洗脱;将洗脱液迅速加入ph9.0的tris-hcl溶液,进行中和。
[0136]
将上述中和后的蛋白溶液透析后,进行sds-page分析,确定蛋白纯度在95%以上,且浓度在0.5mg/ml以上后,低温保存备用。
[0137]
验证例1
[0138]
实施例1提供的il-5蛋白的特异性单域抗体的结合量效曲线测定。
[0139]
包被50μl 1μg/ml il-5蛋白于酶标板上,4℃过夜。洗板;加入200μl5%牛奶,37℃封闭1h。获取实施例1提供的il-5蛋白的特异性单域抗体(vhh),将vhh稀释至2μg/ml,然后5倍梯度稀释抗体,共8个浓度梯度。洗板;加入50μl抗体,两复孔,37℃孵育1h。洗板;加入50μl鼠抗ha标签hrp二抗,37℃孵育30min。洗板(多洗几次);加入50μl预先恢复常温的tmb,避光常温反应15min。加入50μl终止液(1n hcl),酶标仪读数保存。绘制曲线,计算ec50,如图4和表5所示。
[0140]
表5 ec50结果
[0141]
[0142]
验证例2
[0143]
靶向人源il-5蛋白的工具抗体(toolantibody,tab)的表达和纯化。
[0144]
获取tab1(对照抗体1)和tab2(对照抗体2),其中,tab1为mepolizumab,序列来自专利us7982005b2,tab2为reslizumab序列,来自专利us6056957。
[0145]
将搜索到的tab1和tab2序列委托通用生物系统(安徽)有限公司进行哺乳动物细胞表达系统密码子优化,并分别克隆至pcdna3.1载体。
[0146]
经过抗性筛选,选择质粒阳性菌扩增,使用质粒中提试剂盒(macherey nagel,cat#740412.50)抽提质粒。按照每100ml细胞加入100μg质粒(50μg重链 50μg轻链),使用pei在293f细胞(培养基:freestyle 293expression medium,thermo,cat#12338026 f-68,thermo,cat#24040032)中瞬转表达;转染6~24h后加入5%体积的10%peptone(sigma,cat#p0521-100g),8%co
2 130rpm培养约7~8天;细胞活率降至50%时收取表达上清,使用proteina(ge,cat#17-5438-02)重力柱纯化;pbs透析后,使用nanodrop测定浓度,sec鉴定纯度,间接elisa验证结合能力;通过本方法获得的tab抗体,浓度不小于2mg/ml,纯度大于94%,与il-5蛋白(novoprotein,cat#cs33)结合ec50结果如图5和表6所示。
[0147]
表6 ec50结果
[0148] tab1tab2hlggec501.3210.7574~4.591
[0149]
人源重组il-5蛋白诱导的tf1细胞增殖以及工具抗体(tab)中和增殖实验。
[0150]
人源重组il-5蛋白诱导的tf1细胞增殖实验:将复苏后传代3-4待次的tf-1细胞按10000个每孔铺入96孔板;将人源il-5蛋白配置最高浓度为500ng/ml的溶液,并进行5倍梯度稀释;将梯度稀释好的il-5蛋白溶液按细胞培养液的等体积加入细胞培养孔;孵育72h后,用发光法细胞活力检测试剂盒检测细胞活力;根据检测结果计算il-5诱导tf-1细胞增殖的ec80浓度。
[0151]
tab中和人源il-5诱导的tf1细胞增殖实验:将复苏后传代3-4待次的tf-1细胞按10000个每孔铺入96孔板;将tab1和tab2配制为10μg/ml的溶液,并进行5倍梯度稀释;将梯度稀释好的tab与增殖实验中获得的ec80浓度的il-5按1:1混合,制成混合液;将混合液按细胞培养液的等体积加入细胞培养孔;孵育72h后,用发光法细胞活力检测试剂盒检测细胞活力;根据检测结果计算tab1和tab2中和il-5诱导tf-1细胞增殖的ec50浓度,结果如图6和表7所示。
[0152]
表7 ec50结果
[0153] tab1tab2hlggec500.23380.06639~0.1323
[0154]
抗il-5蛋白的单域抗体的fc融合蛋白中和il-5诱导tf1细胞增殖的检测。
[0155]
将复苏后传代3-4待次的tf-1细胞按10000个每孔铺入96孔板;将tab1和tab2以及实施例3-i提供的单域抗体的fc融合蛋白配制为10μg/ml的溶液,并进行5倍梯度稀释;将梯度稀释好的tab、单域抗体与增殖实验中获得的ec80浓度的il-5蛋白按1:1混合,制成混合液;将混合液按细胞培养液的等体积加入细胞培养孔;孵育72h后,用发光法细胞活力检测试剂盒检测细胞活力;根据检测结果计算不同单域抗体中和il-5诱导tf-1细胞增殖的ec50浓度,结果如图7~图8以及表8~表9所示。
[0156]
表8 ec50结果
[0157][0158]
表9 ec50结果
[0159][0160]
il-5结合分子的亲和动力学检测
[0161]
sd缓冲液配制:取适量牛血清白蛋白和吐温20以1
×
pbs(ph7.4)溶解,使得牛血清白蛋白和吐温20质量(或体积)分数分别为0.1%和0.02%;将il-5结合分子用sd缓冲液配制成10μg/ml的浓度;抗原工作液配制:抗原先以sd缓冲液配制成200nm,再按2倍梯度稀释,共设置5个浓度梯度,除此之外再设置一个sd缓冲液的空白对照;取适量浓度为0.1m的甘氨酸储备液,用去离子水稀释10倍,混匀,获得再生液;开启octet 96及其配套电脑中data acquisiton软件,用擦镜纸取适量75%的乙醇清洁采集探头的底面和侧面,仪器预热15min以上;sensor预湿:sensor在实验开始前置于sd缓冲液中浸泡10分钟以上,待用,然后设定机器程序按照:基线
→
抗体
→
基线
→
结合抗原
→
解离抗原
→
再生传感器的步骤进行实验操作。
[0162]
具体测定的il-5结合分子的亲和动力学参数如表10所示。
[0163]
表10克隆1b3、2b3及其人源化变体与il-5亲和动力学结果
[0164]
克隆名kd(m)kd errorka(1/ms)ka errorkd(1/s)kd errorx2r2tab10.99e-096.49e-118.26e 044.50e 028.22e-055.34e-060.19170.99782b3-v22.06e-094.60e-111.97e 051.71e 034.06e-048.35e-060.1020.98382b31.60e-094.03e-111.84e 051.35e 032.95e-047.11e-060.16180.98921b3-v21.02e-092.78e-111.80e 059.48e 021.84e-044.91e-060.09880.99411b30.88e-093.38e-111.49e 057.81e 021.32e-045.00e-060.19790.9954
[0165]
结果显示,与工具抗体相比,克隆1b3的亲和动力学常数略小,其余克隆略大,但各个检测样品间的亲和动力学常数无明显差异,不具有统计学差异。
[0166]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
