1.本发明涉及抗菌药物领域,具体而言,涉及一种用于杀菌的组合物、其应用以及药物制剂。
背景技术:
2.细菌的抗药性(resistance)和持留性(persistence)是细菌破坏抗生素杀菌活性的两种策略。抗药性通过阻止抗生素与其靶点结合,使细菌在抗生素存在的情况下能够生长;而抗生素的持留性是指一小群休眠的,不生长的常规细菌细胞(持留菌,persisters)的特性。这些细菌细胞能够在短暂暴露于高浓度抗生素的情况下幸存下来。细菌抗药性和持留性是当前抗生素危机的主要原因。例如“eskape”病原菌,即粪肠球菌,金黄色葡萄球菌,肺炎克雷伯菌,鲍曼不动杆菌,铜绿假单胞菌和肠杆菌,已经发展出了对目前临床上几乎全部可用的抗生素都产生了抗药性,因此,开发具有新颖杀菌机制的新型抗生素来治疗这些细菌的感染变得非常紧迫。不幸的是,在目前的抗生素研发的成熟度较高的情况下,再通过研发新的抗生素来对抗细菌抗药性的努力变得异常困难。
技术实现要素:
3.本发明提供了一种用于杀菌的组合物,该组合物对于已抗药耐药的细菌有良好的清除效果。
4.本发明是这样实现的:
5.第一方面,本发明实施例提供一种用于杀菌的组合物,其包括抗生素类化合物和佐剂,所述佐剂是能够通过与umud和/或umud’蛋白作用,使得reca的n端62个氨基酸序列被去除的化合物。umud’蛋白为是umud蛋白从n-末端切去24个氨基酸后的蛋白,具体地,umud’蛋白的定义也可以参见nohmi et al,proc.natl.aca.sci.usa.1988;86:1816-1820。
6.第二方面,本发明实施例还提供一种药物制剂,其包括上述用于杀菌的组合物。
7.第三方面,本发明实施例还提供一种上述用于杀菌的组合物在制备清除持留菌的清除剂中的应用。
8.第四方面,本发明实施例还提供一种上述用于杀菌的组合物在制备抗药菌的药物中的应用,所述抗药菌为抗生素类化合物的抗药菌。
9.本发明的有益效果是:本发明实施例通过将佐剂与抗生素合用,能够使得对包括抗生素具有耐药性的持留菌和抗药性的抗药菌的所有细菌被清除,继而能够用于制备多药抗药耐药的药物中。
附图说明
10.为了更清楚地说明本发明实施方式的技术方案,下面将对实施方式中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根
据这些附图获得其他相关的附图。
11.图1是本发明实验例1的检测结果图;
12.图2是本发明实验例2的检测结果图;
13.图3是本发明实验例3的检测结果图;
14.图4是本发明实验例4的检测结果图;
15.图5是本发明实验例5的检测结果图;
16.图6是本发明实验例6的检测结果图;
17.图7是本发明实验例7的检测结果图;
18.图8是本发明实验例8的检测结果图。
具体实施方式
19.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
20.下面对本发明实施例提供一种用于杀菌的组合物具体说明。
21.持留菌为细菌中一小部分休眠的,不生长的常规细菌细胞,具体是指细菌群体中能耐受致死浓度抗生素的小亚群,这一类细菌细胞能够在短暂暴露于高浓度抗生素的情况下存活,并且其mic不变。虽然过去研究人员将抗生素治疗失败通常归因于抗药性,但近年来研究发现持留菌是生物被膜感染对抗生素耐受性的主要原因。因此,细菌的持留性近年来也越来越引起关注。现在通常认为,抗生素持留性是抗生素治疗失败和复发感染的另一个主要原因。因此,如何清除持留菌是清除多药耐药的细菌的一种重要思路。同时,抗生素的持留性还可以促进抗生素抗药性的建立,因此,预防或消除持留性细菌,可以延迟抗生素抗药性细菌的出现,从而减轻抗生素危机。不幸的是,与杀死快速增长的细菌的多种选择相比,清除持留菌的选择很少。
22.基于此,本发明实施例提供一种杀菌组合物,该用于杀菌的组合物并不是常规的杀菌组合物,其不仅仅可以杀灭没有耐药性/抗药的细菌,更是对多药耐药抗药的细菌有良好的清除效果,特别是对抗生素多药耐药抗药的细菌有优异的清除效果。
23.具体地,本发明实施例提供的组合物,包括其抗生素类化合物和佐剂,该佐剂自身可能对细菌并没有抑菌或者杀菌的功效,但是抗生素与该佐剂联合使用时,使细菌表达reca蛋白。同时,该佐剂能够与umud和/或umud’蛋白作用,使得reca的n末端的62个氨基酸序列被去除,从而形成一个较短的蛋白质序列,下文称之为reca
′
。reca
′
本身具有毒性,它的表达可引起细菌发生凋亡。
24.进一步地,所述化合物为铜离子螯合物,所述铜离子螯合物具有对称结构且具有杂原子环,该化合物指的即为佐剂,且铜离子螯合物具有对称结构指的是该化合物的结构式从平面上来看呈轴对称或者中心对称;具体地,化合物选自以下结构式所示化合物中的任意一种:
[0025][0026]
其中,r选自c或o,r1选自卤素、羟基和烷基中的任意一种,r2为对萘环中任意位置进行取代的取代基,且r2选自h、烷基、羟基、卤素、取代或未取代羧基以及芳香基中的任意一种;r3表示对含有氮杂原子的六元环的任意位置进行取代的取代基,且r3选自h、烷基、羟基、卤素、取代或未取代羧基以及芳香基中的任意一种;r4选自卤素、羟基以及中的任意一种;r5表示对含有氮杂原子和氧杂原子的六元环的任意位置进行取代的取代基,且r5选自h、烷基、羟基、卤素、取代或未取代羧基以及芳香基中的任意一种;r6选自卤素、羟基、和烷基中的任意一种,r7为对萘环中任意位置进行取代的取代基,且r7选自h、烷基、羟基、卤素、取代或未取代羧基以及芳香基中的任意一种;r8表示对含有氮杂原子和氧杂原子的六元环的任意位置进行取代的取代基,且r8选自h、烷基、羟基、卤素、取代或未取代羧基以及芳香基中的任意一种。
[0027]
上述化合物能够与umud和/或umud’蛋白作用,使得reca的n端62个氨基酸序列被去除,继而能够与抗生素合用,有效杀灭病菌,特别是抗药耐药的病菌。且虽然本实施例仅列举了部分能够与umud和/或umud’蛋白作用,使得reca的n端62个氨基酸序列被去除的化合物,但是可以理解的是,只要是现有技术中,能够umud和/或umud’蛋白作用,使得reca的n端62个氨基酸序列被去除的化合物均本发明的保护范围内。
[0028]
进一步地,化合物选自以下结构式所示化合物中的任意一种:
[0029][0029]
中的任意一种,发明人仅仅是列举了具有上述母核结构的部分化合物,但是只要符合上述取代基以及母核的化合物,能够与umud和/或umud’蛋白作用,使得reca的n端62个氨基酸序列被去除的化合物均为本发明要求保护的佐剂。
[0030]
优选地,化合物为式1所示化合物,下文简称baa-1;
[0031]
baa-1自身对细菌的生长几乎没有抑制或杀灭作用,但是当其与抗生素合用后,形成的组合
物能够有效清除革兰氏阴性和革兰氏阳性细菌。具体地,baa-1和抗生素合用后,能够有效清除革兰氏阴性和革兰氏阳性细菌的持留菌和抗药性细菌,继而使得细菌,包括多药耐药或/和抗药细菌被清除,继而能够进一步治疗细菌,包括多药耐药或/和抗药菌导致的疾病,例如感染等。
[0032]
进一步研究发现,该化合物能够触发reca介导的细菌凋亡,具体地,抗生素与baa-1联合使用时促使细菌表达reca蛋白。同时baa-1与细菌中umud和/或umud’蛋白作用,使得reca的n末端的62个氨基酸序列被去除,从而形成一个较短的蛋白质序列,下文称之为reca
′
。reca
′
本身具有毒性,它的表达可引起细菌发生凋亡。通过将baa-1与各类抗生素联合使用,可在体内和体外生物被膜的模型中有效清除持留菌和抗药性细菌。
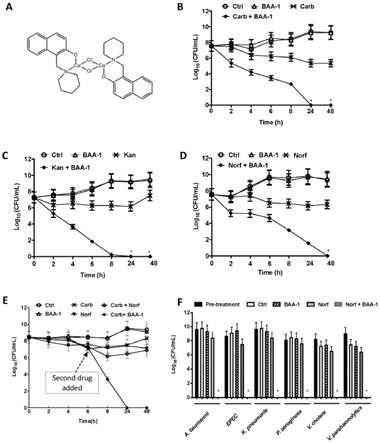
[0033]
进一步地,每10倍mic所述抗生素类化合物对应使用10-20微克所述佐剂。一般只要二者进行合用对于杀菌都有一定功效,即二者可以是任意比,对于未产生耐药抗药的细菌有清除效果。优选地,在抗生素的用量满足临床的基础上,只要添加佐剂则能够杀菌,包括未产生抗药耐药的细菌以及已经产生抗药耐药的细菌,但是本发明限定每10倍mic抗生素对应的佐剂的用量,能够进一步保证该组合物的效果,继而能够有效清除已产生抗药性和耐药性的细菌。
[0034]
需要说明的是,mic指的是mic
50
即为半抑制浓度。虽然本发明限定的是质量体积单位,但是在抗生素和佐剂处于同一溶液体系,体积相同,那么其质量体积比也相当于质量比。即相当于10倍mic时抗生素的质量对应佐剂的用量为10-20微克。一般10倍mic的浓度能够有效杀灭细菌,而在10倍mic浓度下仍然存活的细菌即为持留菌。因此,本发明实施例通过使用10倍的mic的对应抗生素来设置或者构建持留菌。
[0035]
进一步地,抗生素类化合物包括具有杀菌功效的抗生素,抗生素根据其对细菌的作用结果一般分为杀菌和抑菌,杀菌是指能够杀灭细菌,而抑菌指的是抑制细菌生长,而本发明采用的抗生素是能够杀灭细菌的抗生素。具体地,选自β-内酰胺类化合物、氨基糖苷类化合物和喹诺酮类化合物中的至少一种。其中,β-内酰胺类化合物包括羧苄青霉素和氨苄青霉素;所述氨基糖苷类化合物包括卡那霉素和妥布霉素;所述喹诺酮类化合物包括诺氟沙星和氧氟沙星。上述列举的羧苄青霉素、卡那霉素以及诺氟沙星等仅仅是对应类型的抗生素类化合物中的一部分,但是只要是其同一类的抗生素都是本发明实施例的保护范围,甚至只要是能够杀灭细菌的抗生素都要本发明的保护范围内,例如抗生素类化合物还可以选自万古霉素和/或利福霉素。
[0036]
还可以将本发明实施例提供的组合物制备为特定剂型的药物制剂,该药物制剂内含有对应剂型的辅料,例如,片剂含有崩解剂、润滑剂等,液体制剂含有对应溶剂等。
[0037]
进一步,本发明实施例还提供一种上述组合物的应用,该应用包括用于清除持留菌的清除剂,而该持留菌是大肠杆菌、鲍氏不动杆菌、霍乱弧菌、副溶血弧菌、出血性大肠杆菌、铜绿假单胞菌和肺炎克雷伯菌中的任意一种中的休眠的,不生长的细菌。本发明实施例列举了部分含有持留菌的病菌,但是其他含有持留菌的细菌也在本发明的保护范围内。
[0038]
该应用还可以包括用于制备抗耐药菌的药物或者抗耐药菌引起的疾病的药物,而该耐药菌为耐抗生素类化合物的耐药菌。
[0039]
以下结合具体实施例和实验例对本发明提供的一种用于杀菌的组合物进行具体说明。
[0040]
实施例1
[0041]
本实施例提供一种药物组合物,其中,其包括10微克baa-1和20微克羧苄青霉素,且20微克为羧苄青霉素杀灭大肠杆菌时10倍mic浓度对应采用的质量,体积均为1ml。
[0042]
实施例2
[0043]
本实施例提供一种药物组合物,其中,其包括10微克baa-1和0.6微克利福霉素,且0.6微克为利福霉素杀灭大肠杆菌时10倍mic浓度对应采用的质量,体积均为1ml。
[0044]
实验例1清除革兰氏阴性菌的持留菌
[0045]
(1)方法:
[0046]
设置空白对照(缩写为ctrl),对照组1(缩写为carb)和对照组2(缩写为baa-1)以及实验组(缩写为carb baa-1),其中,对照组1为终浓度为20μg/ml的羧苄青霉素(该浓度为10倍mic的浓度,对照组2为终浓度为10μg/ml baa-1,实验组为10倍mic的羧苄青霉素和baa-1合用,即实验组中羧苄青霉素和baa-1的终浓度分别为20μg/ml和10μg/ml。
[0047]
需要说明的是,本发明实验例记载的终浓度指的药物在含有细菌的培养液中的终浓度。
[0048]
将羧苄青霉素和baa-1分别配置于细菌mg1655的菌液中,使菌液中羧苄青霉素或/和baa-1的终浓度分别为20μg/ml和10μg/ml,在不同的时间点取部分样品用1
×
pbs缓冲液进行10倍稀释,并对稀释的菌液涂平板,记录处理一段时间后存活的大肠杆菌mg1655的数量。其中,对照组1中的carb终浓度为20μg/ml,对照组2的baa-1终浓度10μg/ml,实验组中carb终浓度为20μg/ml,baa-1的终浓度为10μg/ml,检测结果参见图1中b。
[0049]
诺氟沙星和卡那霉素对大肠杆菌的处理方法与上述方法相同,区别在于使用10倍mic的诺氟沙星或卡那霉素。菌液中诺氟沙星或/和baa-1的终浓度分别为0.9μg/ml和10μg/ml。诺氟沙星中的对照组1(缩写为norf)和对照组2(缩写为baa-1)以及实验组(缩写为norf baa-1),且配制的溶液的浓度:对照组1中的norf的终浓度为0.9μg/ml,对照组2中的baa-1终浓度为10μg/ml,norf baa-1中norf的终浓度为0.9μg/ml,baa-1的终浓度为10μg/ml。
[0050]
实验中所使用10倍mic的卡那霉素的终浓度为21μg/ml,baa-1的终浓度为10μg/ml,卡那霉素中对照组1(缩写为kan)和对照组2(缩写为baa-1)以及实验组(缩写为kan baa-1)。且配制的溶液的浓度:对照组1中kan的终浓度为21μg/ml,对照组2中的baa-1的终浓度为10μg/ml,实验组中kan的终浓度为21μg/ml,baa-1的终浓度为10μg/ml。
[0051]
检测结果参见图1中c和d。
[0052]
图1中a为baa-1的结构示意图;图1中b为抗生素为羧苄青霉素、bba-1分别以及合用后检测结果图;图1中c为抗生素为诺氟沙星、bba-1分别以及合用后检测结果图;图1中d为抗生素为卡那霉素、bba-1分别以及合用后检测结果图,根据图1中b-d可知,bba-1和抗生素合用能够快速清除对抗生素有耐受性的持留菌,继而清除大肠杆菌。
[0053]
(2)图1中e分为空白组(缩写为ctrl)、对照组1(缩写为carb)、对照组2(缩写为baa-1)、对照组3(缩写为norf)、对照组4(缩写为carb norf)以及实验组(carb baa-1),其中,对照组1为10倍mic的羧苄青霉素,终浓度为20μg/ml,对照组2的baa-1,终浓度为10μg/ml,对照组3为10倍mic的诺氟沙星,终浓度为0.9μg/ml,对照组4为10倍mic的诺氟沙星和10倍mic的羧苄青霉素合用,即对照组4中诺氟沙星的终浓度为0.9μg/ml,羧苄青霉素的终浓度为20μg/ml,实验组为10倍mic的羧苄青霉素(终浓度为20μg/ml)和baa-1(终浓度为10μg/
ml)合用。
[0054]
分别将对照组1-3的药物配置为溶液,然后加入至细菌mg1655的菌液中。其中,对照组1中carb的终浓度为20μg/ml,对照组2中的baa-1的终浓度10μg/ml,对照组3中的norf的浓度0.9μg/ml,而后处理大肠杆菌mg1655,在不同的时间点取部分样品用1
×
pbs缓冲液进行连续10倍系列稀释,并对稀释的菌液涂平板。记录处理一段时间后存活的大肠杆菌mg1655的数量。
[0055]
将对照组4中的羧苄青霉素配置为溶液,将其作用于大肠杆菌mg1655,羧苄青霉素在菌液中的终浓度为20μg/ml,6小时后加入诺氟沙星使其终浓度为0.9μg/ml。处理的菌液在不同的时间点取部分样品,用1
×
pbs缓冲液进行连续10倍系列稀释,并对稀释的菌液涂平板。记录处理一段时间后存活的大肠杆菌mg1655的数量。
[0056]
将实验组中的羧苄青霉素配置为溶液,将其作用与大肠杆菌mg1655,羧苄青霉素在菌液中的终浓度为20μg/ml,6小时后加入baa-1使其终浓度为10μg/ml,在菌液处理的不同时间点取部分样品,用1
×
pbs缓冲液进行连续10倍系列稀释,并对稀释的菌液涂平板。记录处理一段时间后存活的大肠杆菌mg1655的数量。
[0057]
参见图1中的e可知,将诺氟沙星添加到羧苄青霉素处理过的大肠杆菌(存活的持留菌)中对它们的生存没有显着影响。而加入baa-1后,所有细菌在24小时后被完全清除,培养液中无法检测到任何存活细菌,说明,持留菌对各种抗生素有耐受作用,不能被有效清除,而baa-1和抗生素合用能够有效清除对抗生素有耐受的持留菌。
[0058]
(3)采用上述方法对不同细菌进行检测,包括:鲍氏不动杆菌,霍乱弧菌,副溶血弧菌,出血性大肠杆菌,铜绿假单胞菌和肺炎克雷伯菌。将各个细菌的菌液分成四组,对加药之前菌液中的细菌进行计数,作为预处理对照组(pre-treatment)。其它组分为空白组(缩写为ctrl)、对照组1(缩写为norf)、对照组2(缩写为baa-1)、以及实验组(norf baa-1)。对照组1中10倍mic的诺氟沙星(不同细菌诺氟沙星终浓度分别为:鲍氏不动杆菌,11μg/ml;出血性大肠杆菌,12μg/ml;肺炎克雷伯菌,80μg/ml;铜绿假单胞菌,65μg/ml;霍乱弧菌,4.5μg/ml;副溶血弧菌,10μg/ml),对照组2中baa-1终浓度为10μg/ml,实验组中诺氟沙星终浓度为10倍mic(不同细菌诺氟沙星终浓度分别为:鲍氏不动杆菌,11μg/ml;出血性大肠杆菌,12μg/ml;肺炎克雷伯菌,80μg/ml;铜绿假单胞菌,65μg/ml;霍乱弧菌,4.5μg/ml;副溶血弧菌,10μg/ml),,baa-1终浓度为10μg/ml。处理的菌液在24小时后取部分样品,用1
×
pbs缓冲液进行连续10倍系列稀释,并对稀释的菌液涂平板。记录各类细菌的存活数量。
[0059]
检测结果参见图1中f,根据图1中f可知,说明本发明实施例提供的组合物能够有效清除革兰氏阴性菌的持留菌。
[0060]
实验例2清除革兰氏阳性菌的持留菌
[0061]
方法以及分组与实施例1中的(1)相同,区别在于,此处的细菌为革兰氏阳性菌金黄色葡萄球菌,此处,对照组1中carb的终浓度为187μg/ml,对照组2的baa-1浓度为10μg/ml,实验组中carb的终浓度为187μg/ml,baa-1的浓度为10μg/ml。
[0062]
10倍mic的卡那霉素终浓度为21μg/ml,具体地,对照组1中的kan的终浓度为21μg/ml,对照组2的终浓度baa-1为10μg/ml,实验组中kan的终浓度为21μg/ml,baa-1的终浓度为10μg/ml。
[0063]
10倍mic的诺氟沙星(norf)终浓度为40μg/ml,具体地:对照组1中norf的终浓度为
40μg/ml,对照组2中baa-1的终浓度为10μg/ml,实验组中norf的浓度为40μg/ml,baa-1的终浓度为10μg/ml。
[0064]
检测结果参见图2,其中,图2中a为抗生素为羧苄青霉素、bba-1分别以及合用后处理金黄色葡萄球菌的检测结果图;图2中b为抗生素为卡那霉素、bba-1分别以及合用后处理金黄色葡萄球菌的检测结果图;图2中c为抗生素为诺氟沙星、bba-1分别以及合用后处理金黄色葡萄球菌的检测结果图;图2中d为baa-1、万古霉素(缩写为van)和利福霉素(缩写为rif)分别处理耐甲氧西林金黄色葡萄球菌中的持留菌24小时后的检测结果。
[0065]
根据图2可知,本发明实施例提供的组合物可以有效清除革兰氏阳性菌的持留菌,对抗生素有耐受性的细菌有良好的清除效果。
[0066]
实验例3逆转细菌的抗药性
[0067]
细菌:鲍曼不动杆菌atcc1800为多重耐药菌,来源美国典型培养物保藏中心(atcc)。
[0068]
方法:方法以及分组与实施例1中的(1)相同,区别在于,此处氨苄青霉素终浓度为100μg/ml,具体地,对照组1(缩写为amp)的浓度为100μg/ml,对照组2的baa-1终浓度为10μg/ml,实验组中amp的终浓度为100μg/ml,baa-1的浓度为10μg/ml。
[0069]
卡那霉素(kan)的终浓度为100μg/ml,具体地:对照组1中的kan的终浓度为100μg/ml,对照组2中的baa-1终浓度为10μg/ml,实验组(kan baa-1)中kan的终浓度为100μg/ml,baa-1的终浓度为10μg/ml。
[0070]
氧氟沙星为终浓度为100μg/ml,具体地:对照组1(缩写为ofx)的ofx终浓度为100μg/ml,对照组2的baa-1终浓度为10μg/ml,实验组(ofx baa-1)中ofx的终浓度为100μg/ml,baa-1的终浓度为10μg/ml。
[0071]
检测结果参见图3中a-c,图3中a为抗生素为氨苄青霉素、bba-1分别以及合用后的检测结果图;图3中b为抗生素为卡那霉素、bba-1分别以及合用后的检测结果图;图3中c为抗生素为氧氟沙星、bba-1分别以及合用后的检测结果图。根据图3中a-c可知,在baa-1存在时,氨苄青霉素和氧氟沙星都能够在24小时完全清除具有多重抗药的鲍曼不动杆菌atcc1800,而卡那霉素能够使其存活率降低了7个数量级。
[0072]
细菌:多重耐药的鲍曼不动杆菌atcc1791,atcc1792和atcc1794。
[0073]
方法以及分组与实施例1中的(1)相同,区别在于,此处使用美罗培南(缩写为mero),终浓度为100μg/ml,具体地,对照组1中的mero的终浓度为100μg/ml,对照组2中baa-1的终浓度为10μg/ml,实验组中mero的终浓度为100μg/ml,baa-1的终浓度为10μg/ml。
[0074]
检测结果参见图3中d-f,其中,图3中d为细菌为atcc1791时的处理结果,图3中e为细菌为atcc1792时的处理结果,图3中f为细菌为atcc1794时的处理结果。由图3中的d-f可知,在baa-1存在的情况下,对美罗培南(meropenem)具有抗药性的其它鲍曼不动杆菌中也重新获得了对药物的敏感性,并且被快速清除,说明本发明实施例提供的组合物对于多药耐药细菌有良好的清除效果。
[0075]
(2)细菌:对多重耐药的耐甲氧西林金黄色葡萄球菌(mrsa)
[0076]
方法以及分组与实施例1中的(1)相同,区别在于,氨苄青霉素(amp)的终浓度为100μg/ml,具体地,对照组1中amp的浓度为100μg/ml,对照组2中baa-1的终浓度为10μg/ml,实验组中amp的终浓度为100μg/ml,baa-1的终浓度为10μg/ml。
[0077]
卡那霉素(kan)的终浓度为100μg/ml,具体地,对照组1中kan的终浓度为100μg/ml,对照组2中baa-1的终浓度为10μg/ml,实验组中kan的终浓度为100μg/ml,baa-1的终浓度为10μg/ml。
[0078]
耐甲氧西林(缩写为meth)的终浓度为100μg/ml,具体地,对照组1中meth的终浓度为100μg/ml,对照组2中baa-1的终浓度为10μg/ml,实验组中meth的终浓度为100μg/ml,baa-1的终浓度为10μg/ml。
[0079]
检测结果参见图3中g-i,其中,图3中g为氨苄青霉素的检测结果,图3中h为卡那霉素的检测结果,图3中i为耐甲氧西林的检测结果。由图3中的g-i可知,baa-1还逆转了耐甲氧西林金黄色葡萄球菌(mrsa)atcc43300的对各种类型的抗生素的抗药性,使这些抗生素能够在baa-1存在下快速杀死了耐药细菌。
[0080]
实验例4
[0081]
方法:通过三种细胞凋亡的标记物来检测baa-1对大肠杆菌mg1655细胞凋亡的激活作用:具体,使用10倍mic的氨苄青霉素,10倍mic的卡那霉素,10倍mic的氧氟沙星,或终浓度为10μg/ml baa-1,以及二者联合对培养的细菌进行处理。培养的细菌使用fitc标记的annexin v试剂按常规方法通过流式细胞仪检测暴露在外膜的磷脂酰丝氨酸;同样,通过带有fitc标记的dutp的末端脱氧核苷酸转移酶dutp缺口末端标记(tunel)来检测dna的片段化;通过dibac4检测细菌细胞膜的去极化;通过半胱天冬酶样底物fitc-z-vd-fmk检测细菌细胞与之结合能力。
[0082]
检测结果参见图4,其中图4中a为使用fitc标记的annexin v检测处理的大肠杆菌的结果,图4中b为利用半胱天冬酶样底物fitc-z-vd-fmk的检测结果,图4中c为tunel检测dna的片段化的结果,图4中d为dibac4检测细菌细胞膜的去极化的检测结果,根据图4中a-d可知,细菌在使用羧苄青霉素,诺氟沙星和卡那霉素处理时发生一定程度的凋亡。然而,在baa-1存在的情况下,发生凋亡的细菌百分比的得到了显著的增加。
[0083]
实验例5
[0084]
方法:大肠杆菌mg1655野生型和δreca突变株分别用10倍mic的羧苄青霉素、10μg/ml的baa-1单独或联合使用进行处理,在不同时间对细菌的存活进行测定。检测结果参见图5中a。
[0085]
为了验证reca在baa-1介导的细菌死亡中具有重要作用,发明人通过将reca基因克隆到质粒上,使reca能够在半乳糖的诱导下表达。发明人将该质粒转入大肠杆菌mg1655野生型菌株中。大肠杆菌mg1655野生型和含有乳糖操纵子控制表达的reca的野生型在不同浓度的半乳糖诱导reca表达的情况下,加入baa-1或卡那霉素处理24小时后,对细菌的存活情况进行测定。检测结果参见图5中b。
[0086]
由图5可知,图5中a为baa-1在缺失reca的细菌(δreca)中缺乏对抗生素的增强作用结果图;图5中b为reca过量表达时,baa-1在抗生素不存在的情况下可杀死细菌的结果图。根据图5中a-b可知,δreca细胞对抗生素羧苄青霉素具有比野生型菌株更高的敏感性。但是,baa-1在δreca中丧失了促进抗生素的清除细菌的能力。baa-1无法清除持留菌:在有或没有baa-1的情况下,从δreca检测到的存活细菌数相当。当reca在大肠杆菌野生型(wt)中过量表达时,即使在不存在任何抗生素的情况下,baa-1也单独杀死了细菌。
[0087]
为了验证baa-1通过激活reca来促发细菌发生凋亡。发明人在半乳糖的诱导的
reca高表达的细菌培养液中加入baa-1。发现,当单独用baa-1处理细菌时,过量表达reca的细菌细胞表现出典型的凋亡特征:大量细胞显示磷脂酰丝氨酸暴露于外膜;能够与z-vd-fmk结合;dna发生片段化;细菌发生膜去极化。相反,在不添加baa-1的情况下,过量表达reca的细胞中未观察到这些凋亡特征。因此结果表明,当reca高表达时,单独使用baa-1可以触发细菌发生凋亡。由于在没有baa-1的情况下,reca的过量表达不会导致细菌凋亡,因此,可能存在baa-1的情况下reca会被修饰成异构体。通过蛋白质印迹分析(结果没有展示),现在baa-1存在的情况下reca的n末端被切除了62个氨基酸序列,称这种短的reca异构体为reca
′
。
[0088]
实验例6
[0089]
为了验证reca
′
促发细菌发生凋亡。我们通过将reca
′
基因克隆到质粒上,使reca
′
可以在半乳糖的诱导下表达。同时,我们也表达reca作为对照。
[0090]
具体地,使用0.5%的半乳糖诱导reca或reca
′
表达,并在不同时间对表达reca或reca
′
的野生型细菌的存活情况进行测定。检测结果参见图6中a。
[0091]
在半乳糖诱导reca或reca
′
表达6个小时后,取部分细菌对其发生凋亡的细胞比例做鉴定。检测结果参见图6中b-e。即图6中a为表达reca
′
导致细菌死亡,图6中b-e为细胞的凋亡的指标。
[0092]
根据图6中a可知,reca
′
被诱导表达后,细菌细胞被逐渐被杀死,并在野生型大肠杆菌中诱导后24小时将细菌全部清除至检测极限。相反,在诱导全长reca时未观察到这种毒性作用。与观察到的毒性相一致,表达reca
′
的细菌细胞表现出凋亡的典型特征:细菌细胞在外膜上暴露出磷脂酰丝氨酸,能够与z-vd-fmk结合,dna发生片段化以及细菌细胞膜去极化(图6中b-e)。这些结果表明reca的异构体reca
′
导致了细菌的凋亡。
[0093]
实验例7
[0094]
方法:使用临床分离的尿路致病大肠杆菌upec并在体外培养其生物被膜,然后分别单独用10倍mic的氨苄青霉素,baa-1或氨苄青霉素与baa-1联合处理;同样,使用铜绿假单胞菌pao1并在体外培养其生物被膜,然后分别单独用10倍mic的妥布霉素或诺氟沙星,baa-1或抗生素与baa-1联合处理;使用金黄色葡萄球菌atcc 25904并在体外培养其生物被膜,然后分别单独用10倍mic的利福霉素、baa-1或抗生素与baa-1联合处理。在细菌被处理24小时后对生物被膜中的细菌存活情况进行评估。
[0095]
检测结果参见图7,其中,图7中a为氨苄青霉素、baa-1或二者联合使用清除upec的结果图;图7中b为妥布霉素(tbr)或诺氟沙星、baa-1或联合使用清除铜绿假单胞菌pao1的结果图;图7中c为利福霉素baa-1或二者联合使用清除金黄色葡萄球菌atcc 25904的结果图。
[0096]
根据图7可知,单独使用抗生素对减少生物被膜中的持留菌影响很小,而单独使用baa-1几乎没有影响。而baa-1和氨苄青霉素联合使用时生物被膜中的大肠杆菌的持留菌被完全清除,且baa-1分别和妥布霉素以及利福霉素合用可分别有效清除铜绿假单胞菌poa1和革兰氏阳性菌金黄色葡萄球菌atcc25904形成的生物被膜中的持留菌。
[0097]
实验例8
[0098]
(1)方法:将6毫米长的pe50导管置于尿路致病大肠杆菌upec培养液中72小时,使导管内部生长upec生物被膜的导管植入6-8周成年小鼠的尿道中。将小鼠随机分为四组,分
别为对照组、5毫克/kg氨苄青霉素给药组、10毫克/kg baa-1给药组、及氨苄青霉素与baa-1联合给药组。两天后,使用氨苄青霉素,baa-1或二者联合使用对小鼠腹膜内给药进行为期3天的治疗。第四天取出导管并评估生物被膜中细菌的存活情况。
[0099]
检测结果参见图8中a,由此可知,单独使用氨苄青霉素或baa-1对细菌生物被膜几乎没有影响,而氨苄青霉素和baa-1的联合使用可在绝大多数小鼠(10只中的9只)中完全清除细菌,这表明baa-1与抗生素联合使用可以有效治疗清除体内生物被膜的细菌感染。
[0100]
(2)方法:取8周成年小鼠,对其注射环磷酰胺使小鼠中性粒细胞减少,之后,对小鼠左腿注射约1
×
108耐甲氧西林金黄色葡萄球菌atcc 43300细菌,感染24小时后使用320mg/kg氨苄青霉素,10mg/kg baa-1或二者联合对小鼠进行为期两天的腹腔给药治疗,每隔12小时给药一次,共4次。最后一次治疗的12小时后,截取出受感染的小鼠大腿组织并进行匀浆以评估组织中细菌负荷。
[0101]
检测结果参见图8中b,由此可知,单独给予氨苄青霉素和baa-1表现出相似的细菌负荷,氨苄青霉素和baa-1的联合使用显著地降低了耐药菌在大腿组织中的细菌负荷,使其细菌含量比单独使用氨苄青霉素低了7数量级。因此,当与抗生素联合使用时,baa-1可以在体外和体内逆转细菌的抗药性并能对耐药菌的感染进行有效治疗。
[0102]
综上所述,baa-1与抗生素合用能够有效清除持留菌和抗药性细菌,继而对于多药耐药的病菌有良好的清除效果。
[0103]
以上所述仅为本发明的优选实施方式而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。