1.本发明涉及制药技术领域,尤其是涉及一种药物隔离层及其应用、质子泵抑制剂肠溶微丸及其制备方法。
背景技术:
2.质子泵抑制剂在酸性条件下不稳定,会发生降解,因此常用作肠溶制剂。肠溶性材料为酸性材料,与质子泵抑制剂类药物不相容,因此需采用隔离层衣膜将两组分隔开。然而,现有的隔离层材料会使小丸在溶出杯中粘连,影响药物的释放。因此需筛选合适的隔离层处方,避免影响药物的释放。
3.有鉴于此,特提出本发明。
技术实现要素:
4.本发明的第一目的在于提供一种药物隔离层,该隔离层不会影响药物的释放,以解决上述问题中的至少一种。
5.本发明的第二目的在于提供上述药物隔离层在质子泵抑制剂肠溶微丸中的应用。
6.本发明的第三目的在于提供一种质子泵抑制剂肠溶微丸,其有效成分释放速率快。
7.本发明的第四目的在于提供一种质子泵抑制剂肠溶微丸的制备方法。
8.第一方面,本发明提供了一种药物隔离层,包括按质量份数计的如下组分:羟丙基纤维素65~75份、硬脂酸镁15~20份和滑石粉250~270份。
9.作为进一步技术方案,包括按质量份数计的如下组分:羟丙基纤维素67~71份、硬脂酸镁16~18份和滑石粉255~265份。
10.优选地,包括按质量份数计的如下组分:羟丙基纤维素69份、硬脂酸镁17份和滑石粉260份。
11.第二方面,本发明提供了一种药物隔离层在质子泵抑制剂肠溶微丸中的应用。
12.第三方面,本发明提供了一种质子泵抑制剂肠溶微丸,从内至外依次包括丸芯、载药层、药物隔离层和肠溶衣层;
13.作为进一步技术方案,所述丸芯、载药层、药物隔离层和肠溶衣层的质量比为(180~200):(350~370):(340~360):(360~380);
14.优选地,所述质子泵抑制剂肠溶微丸的粒径为0.25-0.8mm。
15.作为进一步技术方案,所述质子泵抑制剂包括艾司奥美拉唑镁。
16.作为进一步技术方案,所述丸芯包括蔗糖丸芯。
17.作为进一步技术方案,按质量份数计,所述载药层包括第一表面活性剂1~2份、羟丙甲纤维素40~50份和质子泵抑制剂300~320份;
18.优选地,按质量份数计,所述载药层包括第一表面活性剂1.5份、羟丙甲纤维素48份和质子泵抑制剂311份;
19.优选地,所述第一表面活性剂包括吐温80。
20.作为进一步技术方案,按质量份数计,所述肠溶衣层包括第二表面活性剂0.1~1份、增塑剂40~60份和成膜剂310~330份;
21.优选地,所述第二表面活性剂包括吐温80;
22.优选地,所述成膜剂包括尤特奇l30d-55;
23.优选地,所述增塑剂包括单双硬脂酸甘油酯和柠檬酸三乙酯;
24.优选地,所述单双硬脂酸甘油酯和柠檬酸三乙酯的质量比为(10~20):(25~35)。
25.作为进一步技术方案,按质量份数计,所述肠溶衣层包括吐温80 0.6份、单双硬脂酸甘油酯16份、柠檬酸三乙酯32份和尤特奇l30d-55 322份。
26.第四方面,本发明提供了一种质子泵抑制剂肠溶微丸的制备方法,包括以下步骤:在所述丸芯外依次包覆载药层、药物隔离层和肠溶衣层,制备得到质子泵抑制剂肠溶微丸。
27.作为进一步技术方案,包括以下步骤:
28.将第一表面活性剂、羟丙甲纤维素和质子泵抑制剂与水混合制备得到混悬液a;
29.将羟丙基纤维素、硬脂酸镁和滑石粉与水混合制备得到混悬液b;
30.将第二表面活性剂、增塑剂和成膜剂与水混合制备得到水分散体;
31.在流化床中,向丸芯喷入混悬液a,制备得到载药小丸;然后喷入混悬液b制备得到隔离小丸;再喷入水分散体,制备得到质子泵抑制剂肠溶微丸。
32.与现有技术相比,本发明具有如下有益效果:
33.本发明提供的药物隔离层主要由特定配比的羟丙基纤维素、硬脂酸镁和滑石粉组成,一方面,该隔离层能够将载药层和肠溶衣层隔开,避免肠溶衣层对载药层中药物的影响;另一方面,该隔离层不会影响药物中有效成分的释放,药物的释放速率快,能够用于制备质子泵抑制剂肠溶微丸。
34.本发明提供的质子泵抑制剂肠溶微丸,从内至外依次包括丸芯、载药层、药物隔离层和肠溶衣层,该药物中有效成分释放快,药效快。
35.本发明提供的质子泵抑制剂肠溶微丸的制备方法,简单方便,成本低。
具体实施方式
36.下面将结合实施方式和实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施方式和实施例仅用于说明本发明,而不应视为限制本发明的范围。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
37.第一方面,本发明提供了一种药物隔离层,包括按质量份数计的如下组分:羟丙基纤维素65~75份、硬脂酸镁15~20份和滑石粉250~270份。
38.本发明的药物隔离层中,羟丙基纤维素为成膜材料,羟丙基纤维素的质量份数例如可以为,但不限于65份、67份、69份、71份、73份或75份;硬脂酸镁具有抗静电的作用,硬脂酸镁的质量份数例如可以为,但不限于15份、16份、17份、18份、19份或20份;滑石粉扛粘,降低隔离层的粘性,滑石粉的质量份数例如可以为,但不限于250份、254份、258份、262份、266
份或270份。
39.本发明提供的药物隔离层主要由特定配比的羟丙基纤维素、硬脂酸镁和滑石粉组成,一方面,该隔离层能够将载药层和肠溶衣层隔开,避免肠溶衣层对载药层中药物的影响;另一方面,该隔离层不会影响药物中有效成分的释放,药物的释放速率快。
40.在一些优选的实施方式中,包括按质量份数计的如下组分:羟丙基纤维素67~71份、硬脂酸镁16~18份和滑石粉255~265份。
41.优选地,包括按质量份数计的如下组分:羟丙基纤维素69份、硬脂酸镁17份和滑石粉260份。
42.本发明中,通过对药物隔离层中各个组分的进一步优化和调整,在保证隔离效果的同时,进一步提高药物的释放速率。
43.第二方面,本发明提供了一种药物隔离层在质子泵抑制剂肠溶微丸中的应用。
44.由于本发明提供的隔离层隔离效果好,不会影响药物中有效成分的释放,因此能够用于作为质子泵抑制剂肠溶微丸的隔离层。
45.第三方面,本发明提供了一种质子泵抑制剂肠溶微丸,从内至外依次包括丸芯、载药层、药物隔离层和肠溶衣层。
46.其中,丸芯为微丸的核心,用于承载药物;载药层用于负载药物;药物隔离层用于隔离载药层和肠溶衣层,避免肠溶衣层对载药层药物的影响;肠溶衣层包裹药物,将药物在肠道释放。
47.本发明提供的质子泵抑制剂肠溶微丸采用上述本发明的药物隔离层作为隔离材料,用于载药层和肠溶衣层的隔离,该药物中有效成分的释放速率快,药效快。
48.在一些优选的实施方式中,所述丸芯、载药层、药物隔离层和肠溶衣层的质量比为(180~200):(350~370):(340~360):(360~380),例如可以为,但不限于180:370:340:380、185:365:345:375、190:360:350:370、195:355:355:365或200:350:360:360。
49.优选地,所述质子泵抑制剂肠溶微丸的粒径例如可以为,但不限于0.25mm、0.3mm、0.4mm、0.5mm、0.6mm、0.7mm或0.8mm。
50.本发明中,通过对质子泵抑制剂肠溶微丸中各个组分配比的进一步优化和调整,使得该药物结构合理,药效佳。
51.在一些优选的实施方式中,所述质子泵抑制剂包括但不限于艾司奥美拉唑镁,例如还可以为兰索拉唑、泮托拉唑或雷贝拉唑,或者本领域技术人员所熟知的其他质子泵抑制剂。
52.在一些优选的实施方式中,所述丸芯包括蔗糖丸芯,本发明中对于丸芯不作具体限制,例如还可以为微晶纤维素丸芯,或者本领域技术人员所熟知的其他丸芯。
53.在一些优选的实施方式中,按质量份数计,所述载药层包括第一表面活性剂1~2份、羟丙甲纤维素40~50份和质子泵抑制剂300~320份。
54.载药层中,第一表面活性剂的质量份数例如可以为,但不限于1份、1.2份、1.4份、1.6份、1.8份或2份;羟丙甲纤维素的质量份数例如可以为,但不限于40份、42份、44份、46份、48份或50份;质子泵抑制剂的质量份数例如可以为,但不限于300份、304份、308份、312份、316份或320份。
55.优选地,按质量份数计,所述载药层包括第一表面活性剂1.5份、羟丙甲纤维素48
份和质子泵抑制剂311份;
56.优选地,所述第一表面活性剂包括吐温80。
57.本发明中,通过对载药层组分的进一步优化和调整,使得药物稳定包覆在丸芯上。
58.在一些优选的实施方式中,按质量份数计,所述肠溶衣层包括第二表面活性剂0.1~1份、增塑剂40~60份和成膜剂310~330份。
59.肠溶衣层中,第二表面活性剂的质量份数例如可以为,但不限于0.1份、0.2份、0.4份、0.6份、0.8份或1份;增塑剂的质量份数例如可以为,但不限于40份、44份、48份、52份、56份或60份;成膜剂的质量份数例如可以为,但不限于310份、314份、318份、322份、326份或330份。
60.优选地,所述第二表面活性剂包括吐温80;
61.优选地,所述成膜剂包括尤特奇l30d-55;
62.优选地,所述增塑剂包括单双硬脂酸甘油酯和柠檬酸三乙酯;
63.优选地,所述单双硬脂酸甘油酯和柠檬酸三乙酯的质量比为(10~20):(25~35),例如可以为,但不限于10:35、12:33、14:31、16:29、18:27或20:25。
64.在一些优选的实施方式中,按质量份数计,所述肠溶衣层包括吐温800.6份、单双硬脂酸甘油酯16份、柠檬酸三乙酯32份和尤特奇l30d-55 322份。
65.本发明中,通过对肠溶衣层中各个组分的进一步优化和调整,使得肠溶衣层稳定包覆于隔离层上,实现药物的肠道释放。
66.第四方面,本发明提供了一种质子泵抑制剂肠溶微丸的制备方法,包括以下步骤:在所述丸芯外依次包覆载药层、药物隔离层和肠溶衣层,制备得到质子泵抑制剂肠溶微丸。
67.作为进一步技术方案,包括以下步骤:
68.将第一表面活性剂、羟丙甲纤维素和质子泵抑制剂与水混合制备得到混悬液a;
69.将羟丙基纤维素、硬脂酸镁和滑石粉与水混合制备得到混悬液b;
70.将第二表面活性剂、增塑剂和成膜剂与水混合制备得到水分散体;
71.在流化床中,向丸芯喷入混悬液a,制备得到载药小丸;然后喷入混悬液b制备得到隔离小丸;再喷入水分散体,制备得到质子泵抑制剂肠溶微丸。
72.本发明提供的质子泵抑制剂肠溶微丸的制备方法简单方便,成本低,制备得到的质子泵抑制剂肠溶微丸性质稳定,质量好。
73.下面通过具体的实施例和对比例进一步说明本发明,但是,应当理解为,这些实施例仅仅是用于更详细地说明之用,而不应理解为用于以任何形式限制本发明。
74.实施例1
75.一种药物隔离层,按质量份数计,包括羟丙基纤维素69份、硬脂酸镁17份和滑石粉260份。
76.实施例2
77.一种药物隔离层,按质量份数计,包括羟丙基纤维素65份、硬脂酸镁20份和滑石粉250份。
78.实施例3
79.一种药物隔离层,按质量份数计,包括羟丙基纤维素75份、硬脂酸镁15份和滑石粉270份。
80.对比例1
81.一种药物隔离层,按质量份数计,包括羟丙基纤维素120份、硬脂酸镁16份和滑石粉210份。
82.对比例2
83.一种药物隔离层,按质量份数计,包括羟丙基纤维素30份、硬脂酸镁17份和滑石粉300份。
84.对比例3
85.一种药物隔离层,与实施例1的区别在于不含有滑石粉。
86.实施例4
87.一种艾司奥美拉唑镁肠溶微丸,采用实施例1的药物隔离层,原料组成如下:
88.丸芯:蔗糖丸芯187份;
89.载药层:艾司奥美拉唑镁311份、第一表面活性剂(吐温80)1.5份和羟丙甲纤维素48份;
90.药物隔离层:实施例1的药物隔离层346份;
91.肠溶衣层:尤特奇l30d-55 322份、柠檬酸三乙酯32份、单双硬脂酸甘油酯13份和第二表面活性剂(吐温80)0.6份。
92.制备方法如下:
93.(1)取纯化水,将聚山梨酯80和羟丙甲纤维素加入纯化水中,搅拌至完全溶解;
94.(2)将步骤(1)的溶液加入艾司奥美拉唑镁中,搅拌均匀;
95.(3)将蔗糖丸芯加入制粒锅中,喷入步骤(2)中的混悬液,制备载药小丸;
96.(4)将羟丙基纤维素溶出于纯化水中,加入硬脂酸镁和滑石粉,搅拌均匀;
97.(5)将步骤(3)中制的样品加入流化床,喷入步骤(4)中的混悬液,制得隔离小丸;
98.(6)将吐温80、单双硬脂酸甘油酯和枸橼酸三乙酯加入处方量热水分散均匀,放至室温,加入尤特奇l30d-55中;
99.(7)将步骤(5)中制的样品加入流化床,喷入步骤(6)中的水分散体,制的肠溶小丸。肠溶微丸的平均粒径为0.5mm。
100.实施例5
101.一种艾司奥美拉唑镁肠溶微丸,与实施例4的区别在于,药物隔离层为实施例2的药物隔离层。
102.实施例6
103.一种艾司奥美拉唑镁肠溶微丸,与实施例4的区别在于,药物隔离层为实施例3的药物隔离层。
104.实施例7
105.一种兰索拉唑肠溶微丸,与实施例4的区别在于,将艾司奥美拉唑镁替换为兰索拉唑。
106.实施例8
107.一种雷贝拉唑肠溶微丸,与实施例4的区别在于,将艾司奥美拉唑镁替换为雷贝拉唑。
108.实施例9
109.一种艾司奥美拉唑镁肠溶微丸,与实施例4的区别在于,原料组成如下:
110.丸芯:微晶纤维素丸芯200份;
111.载药层:艾司奥美拉唑镁300份、第一表面活性剂(吐温80)2份和羟丙甲纤维素40份;
112.药物隔离层:实施例1的药物隔离层;
113.肠溶衣层:尤特奇l30d-55 310份、柠檬酸三乙酯35份、单双硬脂酸甘油酯10份和第二表面活性剂(吐温80)1份。
114.实施例10
115.一种艾司奥美拉唑镁肠溶微丸,与实施例4的区别在于,原料组成如下:
116.丸芯:微晶纤维素丸芯180份;
117.载药层:艾司奥美拉唑镁320份、第一表面活性剂(吐温80)1份和羟丙甲纤维素50份;
118.药物隔离层:实施例1的药物隔离层;
119.肠溶衣层:尤特奇l30d-55 330份、柠檬酸三乙酯25份、单双硬脂酸甘油酯20份和第二表面活性剂(吐温80)0.1份。
120.对比例4-6
121.一种艾司奥美拉唑镁肠溶微丸,与实施例4的区别在于,药物隔离层分别为对比例1-3的药物隔离层。
122.试验例1
123.对实施例4-10和对比例4-6的质子泵肠溶微丸中药物的释放速率进行检测。
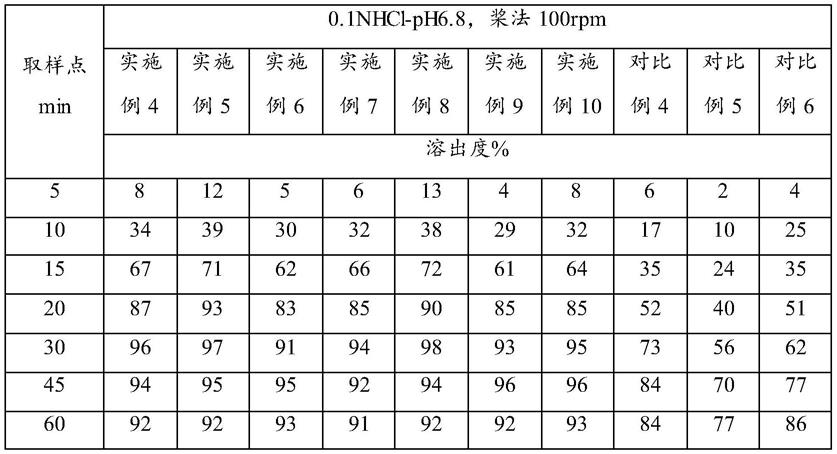
124.1.介质配置:
①
9ml盐酸加入1l纯化水中,搅拌均匀。
125.②
0.086mol/l磷酸盐缓冲液溶出介质称取30.80g十二水合磷酸氢二钠于1000ml水中,溶解混匀后,即得。
126.③
ph6.8磷酸缓冲液分别取0.1mol/l盐酸溶液300ml和0.086mol/l磷酸盐缓冲液700ml,混匀,即得。
127.2、溶出过程:设置溶出方法:桨法100rpm,37℃;将样品加入溶出仪中,设置取样点进行取样。采用液相色谱仪进行检测。
128.结果如表1所示。
129.表1
[0130][0131]
从表1的结果中可以看出,实施例4-10的质子泵肠溶微丸中药物的溶出度30min大于75%,溶出度良好,符合要求;而对比例4-6的质子泵肠溶微丸中药物的溶出度较差,不符合要求。
[0132]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。