1.本技术涉及有机合成技术领域,具体来说,本技术涉及奥达特罗关键中间体1-(4-甲氧基苯基)-2-甲基-2-丙胺或其药学上可接受的盐的合成方法。
背景技术:
2.奥达特罗(olodaterol)是一种选择性超长效β2受体激动剂,对β2受体具有高度的选择性,同时起效迅速,可维持24小时的支气管舒张作用,用于长期维持治疗慢性阻塞性肺疾病。
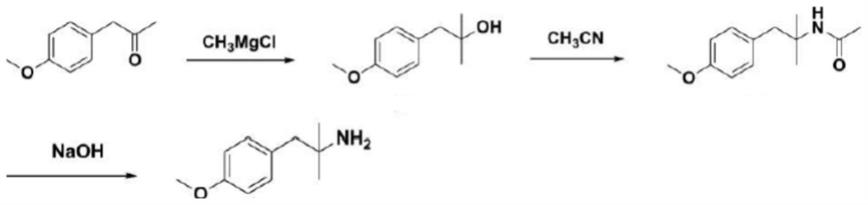
3.1-(4-甲氧基苯基)-2-甲基-2-丙胺是合成奥达特罗的关键中间体。目前,可以以对甲氧基苯基丙酮为起始化合物来合成1-(4-甲氧基苯基)-2-甲基-2-丙胺。例如,参考图1,bayrakdarian等人披露了以对甲氧基苯基丙酮为原料,依次进行羟烷基化反应、ritter反应和醇解反应得到1-(4-甲氧基苯基)-2-甲基-2-丙胺。该合成路线最后一步反应需在强碱条件下进行。祝淳君等在学位论文《奥达特罗工艺研究》中对该路线进行了工艺优化,但该合成路线中的最后一步需要在高达180℃的温度下反应。
4.为此,本领域持续需要开发新的1-(4-甲氧基苯基)-2-甲基-2-丙胺的合成方法。
技术实现要素:
5.本技术之目的在于提供一种反应条件温和的奥达特罗关键中间体的合成方法,从而克服上述现有技术中的不足。具体来说,参考图2,本技术的合成方法以市场充分供应、价格低廉的对甲氧基苯基丙酮为起始化合物,与n-苄基羟胺盐酸盐反应得到n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物。然后,使n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物与格氏试剂反应,得到n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺。最后,对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原,脱除苄基后得到1-(4-甲氧基苯基)-2-甲基-2-丙胺。
6.为了解决上述技术问题,本技术提供下述技术方案:
7.在第一方面中,本技术提供一种奥达特罗关键中间体的合成方法,其特征在于,所述方法包括以下步骤:
8.s1:在惰性气氛保护下,且存在第一催化剂的情况下,使对甲氧基苯基丙酮与n-苄基羟胺盐酸盐在第一有机溶剂中反应第一预定时间段,得到n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物;
9.s2:对n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物进行羟烷基化,得到n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺;
10.s3:对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原反应,得到所述奥达特罗关键中间体1-(4-甲氧基苯基)-2-甲基-2-丙胺。
11.在第一方面的一种实施方式中,所述第一有机溶剂为二氯甲烷、二氯乙烷、氯仿、乙酸乙酯、甲苯、醋酸异丙酯和叔丁醇中的一种或多种。
12.所述第一催化剂为氯化锌、硫酸镁和硫酸钠中的一种或两种。
13.在第一方面的一种实施方式中,在步骤s1中,反应温度为20-60℃。
14.在第一方面的一种实施方式中,在步骤s1中,所述第一预定时间段为15-24小时。
15.在第一方面的一种实施方式中,在步骤s2中,所述对n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物进行羟烷基化包括在惰性气体保护下,且在小于或等于5℃的反应温度下,使n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物与格氏试剂在第二有机溶剂中发生亲核取代反应。
16.在第一方面的一种实施方式中,所述第二有机溶剂为甲苯、四氢呋喃、2-甲基四氢呋喃、甲基叔丁基醚、异丙醚和乙二醇二甲醚中的一种或多种。
17.在第一方面的一种实施方式中,所述格氏试剂为甲基溴化镁或者甲基氯化镁。
18.在第一方面的一种实施方式中,在步骤s3中,所述对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原反应包括在存在第三催化剂的情况下,使n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺、质子酸和氢气在第三有机溶剂或者第三有机溶剂的混合溶剂中反应第二预定时间段。
19.在第一方面的一种实施方式中,所述第三催化剂为钯催化剂,优选地为pearlman's催化剂。
20.在第一方面的一种实施方式中,所述质子酸为乙酸、草酸、乳酸、三氟乙酸、硫酸或者盐酸。
21.所述第三有机溶剂为甲醇、乙醇、异丙醇、乙酸乙酯,四氢呋喃、乙酸异丙酯或者甲苯。
22.在第一方面的一种实施方式中,所述第二预定时间段为4-6小时。
23.在第二方面中,本技术提供一种奥达特罗关键中间体药学上可接受的盐的合成方法,其特征在于,所述方法包括以下步骤:
24.s1:在惰性气氛保护下,且存在第一催化剂的情况下,使对甲氧基苯基丙酮与n-苄基羟胺盐酸盐在第一有机溶剂中反应第一预定时间段,得到n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物;
25.s2:对n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物进行羟烷基化,得到n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺;
26.s3:对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原反应,得到所述奥达特罗关键中间体1-(4-甲氧基苯基)-2-甲基-2-丙胺;
27.s4:使1-(4-甲氧基苯基)-2-甲基-2-丙胺与相应的酸反应,得到奥达特罗关键中间体的药学上可接受的盐。
28.在第二方面的一种实施方式中,所述奥达特罗关键中间体的药学上可接受的盐为1-(4-甲氧基苯基)-2-甲基-2-丙胺盐酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺硫酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺氢溴酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺氢碘酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺乙酸盐或者1-(4-甲氧基苯基)-2-甲基-2-丙胺苯甲酸盐。
29.在第二方面的一种实施方式中,在步骤s4中,所述酸为选自下组中的任意一种:盐酸、硫酸、氢溴酸、氢碘酸、乙酸或者苯甲酸。
30.与现有技术相比,本文所述的合成路线采用原料是大宗商品,是一条全新的合成路线,合成路线中涉及的所有化学反应操作简便易行,反应温度不超过60℃,避免了高温危险工艺,显著减少了反应消耗的能量,有利于实现奥达特罗关键中间体或其药学上可接受的盐的量产。
附图说明
31.图1显示现有技术中的1-(4-甲氧基苯基)-2-甲基-2-丙胺的一种合成方法。
32.图2显示根据本发明一种具体实施方式的1-(4-甲氧基苯基)-2-甲基-2-丙胺的合成方法。
具体实施方式
33.如上文所述,目前文献报道的奥达特罗关键中间体1-(4-甲氧基苯基)-2-甲基-2-丙胺的合成方法中,存在需在强碱条件下进行,或者反应温度过高等问题。
34.为了解决上述问题,本技术提供一种奥达特罗关键中间体1-(4-甲氧基苯基)-2-甲基-2-丙胺的合成方法。具体来说,参考图2,本文所述的1-(4-甲氧基苯基)-2-甲基-2-丙胺的合成方法可包括三个反应步骤。
35.首先,第一个反应步骤包括在惰性气氛保护下,且存在第一催化剂的情况下,使对甲氧基苯基丙酮与n-苄基羟胺盐酸盐在第一有机溶剂中反应第一预定时间段,得到n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物。在该步骤中,第一有机溶剂可为二氯甲烷、二氯乙烷、氯仿、乙酸乙酯、甲苯、醋酸异丙酯和叔丁醇中的一种或多种。在该步骤中,第一催化剂可为氯化锌、硫酸镁和硫酸钠中的一种或两种。优选地,第一催化剂可为等摩尔的氯化锌和硫酸镁的混合物。在一种实施方式中,第一个反应步骤的反应温度可为20-60℃。优选地,第一个反应步骤的反应温度可为20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃或者它们中任意两个数值之间的范围或子范围。在该步骤中,所述第一预定时间段可为15-24小时。优选地,该步骤的反应时间可为15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时或者它们中任意两个数值之间的范围或者子范围。
36.通过使用n-苄基羟胺盐酸盐与对甲氧基苯基丙酮反应来得到亚胺化合物,并可以将反应温度降低到20-60℃,优选地降低到20-25℃。该温度范围接近室温,进行反应时无需消耗过多的热量。
37.其次,第二反应步骤包括对n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物进行羟烷基化,得到n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺。在该步骤中,对n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物进行羟烷基化包括在惰性气体保护下,且在小于或等于5℃的反应温度下,使n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物与格氏试剂在第二有机溶剂中发生亲核取代反应。
38.在该步骤中,第二有机溶剂可为甲苯、四氢呋喃、2-甲基四氢呋喃、甲基叔丁基醚、异丙醚和乙二醇二甲醚中的一种或多种。格氏试剂为甲基溴化镁或者甲基氯化镁。
39.最后,第三个反应步骤包括对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原反应,得到1-(4-甲氧基苯基)-2-甲基-2-丙胺。在该步骤中,对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原反应包括在存在pearlman's
催化剂的情况下,使n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺、质子酸和氢气在第三有机溶剂或者第三有机溶剂的混合溶剂中反应第二预定时间段。在该步骤中,所述质子酸可为乙酸、草酸、乳酸、三氟乙酸、硫酸或者盐酸。优选地,所述质子酸为乙酸、草酸或者乳酸。在该步骤中,第三有机溶剂可为甲醇、乙醇、异丙醇、乙酸乙酯,四氢呋喃、乙酸异丙酯或者甲苯。优选地,在该步骤中,所述第三有机溶剂为甲醇。在该步骤中,所述第二预定时间段为4-6小时。
40.在第二方面中,本技术提供一种1-(4-甲氧基苯基)-2-甲基-2-丙胺的药学上可接受的盐的合成方法,其特征在于,所述方法包括以下步骤:
41.s1:在惰性气氛保护下,且存在第一催化剂的情况下,使对甲氧基苯基丙酮与n-苄基羟胺盐酸盐在第一有机溶剂中反应第一预定时间段,得到n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物;
42.s2:对n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物进行羟烷基化,得到n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺;
43.s3:对n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺进行加氢还原反应,得到所述奥达特罗关键中间体1-(4-甲氧基苯基)-2-甲基-2-丙胺;
44.s4:使1-(4-甲氧基苯基)-2-甲基-2-丙胺与相应的酸反应,得到1-(4-甲氧基苯基)-2-甲基-2-丙胺的药学上可接受的盐。
45.在一种具体实施方式中,所述1-(4-甲氧基苯基)-2-甲基-2-丙胺的药学上可接受的盐为1-(4-甲氧基苯基)-2-甲基-2-丙胺盐酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺硫酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺氢溴酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺氢碘酸盐、1-(4-甲氧基苯基)-2-甲基-2-丙胺乙酸盐或者1-(4-甲氧基苯基)-2-甲基-2-丙胺苯甲酸盐。
46.与1-(4-甲氧基苯基)-2-甲基-2-丙胺的合成步骤相比,1-(4-甲氧基苯基)-2-甲基-2-丙胺的药学上可接受的盐的合成方法还包括一个反应步骤,即使1-(4-甲氧基苯基)-2-甲基-2-丙胺与相应的酸反应形成1-(4-甲氧基苯基)-2-甲基-2-丙胺的药学上可接受的盐。在步骤s4中,相应的酸可为选自下组中的任意一种:盐酸、硫酸、氢溴酸、氢碘酸、乙酸或者苯甲酸这些反应是本领域已知的,在此不再赘述。
47.实施例
48.下面将结合实施例,对本技术进行一步描述和说明。如无特别说明,所用化工原料均可从市场购买。本领域技术人员可以理解,下述实施例只是示例性的。
49.在下述实施例中,yj001-c-01指对甲氧基苯基丙酮;yj001-c-02指n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物;yj001-c-03指n-苄基-n-(1-(4-甲氧基苯基)-2-甲基丙烷-2-基)羟胺;且yj001-c-04指1-(4-甲氧基苯基)-2-甲基-2-丙胺盐酸盐。
50.实施例1
51.本实施例涉及合成1-(4-甲氧基苯基)-2-甲基-2-丙胺盐酸盐。参考图2,本实施例所示的合成路线主要包括3个反应步骤。
52.第一个反应步骤包括室温下在三口反应瓶中,依次加入yj001-c-01(对甲氧基苯基丙酮)(100g,0.61mol,1.00eq)、二氯甲烷(2.00l,20.00v)搅拌溶清。搅拌溶清后,控温20-25℃下,依次往反应瓶中加入n-苄基羟胺盐酸盐(106.9g,0.67mol,1.10eq)、氯化锌
(91.3g,0.67mol,1.10eq)、硫酸镁(80.6g,0.67mol,1.10eq),加完后,控温20-25℃搅拌反应15-20h。tlc检测反应完全后,反应液直接抽滤,除去无机盐,收集有机相,有机相用饱和氯化钠(2
×
500ml)洗涤,无水na2so4上干燥。有机相置于45-50℃下减压下去除溶剂,得目标化合物yj001-c-02粗品115.0g,收率为70%,直接下一步反应。
53.取粗品5g,用石油醚/乙酸乙酯体系硅胶柱层析纯化,得4.2g,进行nmr表征,其图谱解析数据如下:1hnmr(400mhz,cdcl3):δ7.44-7.35(m,2h),7.33-7.21(m,5h),7.18-7.06(m,2h),5.21(s,3h),3.09(s,3h),2.09(s,2h),1.92(s,2h)。表明该步骤成功合成了n-苄基-1-(4-甲氧基苯基)丙烷-2-亚胺氧化物。
54.第二个反应步骤包括室温下在三口反应瓶中,氮气体系保护下,依次加入yj001-c-02(110g,0.408mol,1.00eq)、甲苯(1.00l,10.00v)搅拌溶清,溶清后,降至温0℃下。控温5℃以下,往反应瓶中滴加甲基氯化镁四氢呋喃溶液(3.00m,146.9ml,0.449mol,1.10eq),滴加完全后控温0-5℃搅拌反应2h。tlc检测反应完全后,控温25℃以下,往反应瓶中滴加盐酸水溶液(1.00m,500ml)淬灭反应。反应静置分层,收集有机相,水相再用500ml基本萃取一次,合并所有有机相,有机相用饱和氯化钠(2
×
500ml)洗涤,无水na2so4上干燥。有机相置于55-60℃下减压下去除溶剂,得目标化合物yj001-c-03粗品75.8g,收率为65%,直接下一步反应。
55.第三个反应步骤包括在高压反应釜中,依次加入yj001-c-03(75.0g,0.263mol,1.00eq),甲醇(600ml,8.00v)、乙酸(150ml,2.00v),搅拌溶清,加入pearlman's催化剂(pd(oh)2/c20%wt,7.5g,10%)。反应体系用氮气置换三次,再用氢气置换三次,将反应釜内氢气压力加压至1.00mpa,将反应釜加热至55-60℃搅拌反应5-6h。tlc检测反应完全后,反应液直接抽滤,收集滤液,滤液置于45-50℃下减压下去除溶剂。所得浓缩物加入750ml甲苯,搅拌至溶清,有机相用10%氢氧化钠溶液(2
×
300ml)洗涤,再用用饱和氯化钠溶液(2
×
300ml)洗涤,收集有机相。将有机相冷至0-5℃,缓慢通入盐酸气至ph=3-4,通气结束后,继续搅拌0.5-1.0h。抽滤,并用少量甲苯洗涤,收集滤饼得粗品。粗品用乙酸乙酯/甲醇混合溶剂体系重结晶纯化,真空干燥得精制品白色固体yj001-c-04(1,1-二甲基-2-(4-甲氧基苯基)乙胺盐酸盐)42.5g,收率为75%。
56.对产物进行核磁表征,其图谱解析数据如下:1hnmr(400mhz,dmso-d6):δ8.18(br.s,3h),7.16(d,j=8.4hz,2h),6.90(d,j=8.4hz,2h),3.76(s,3h),2.83(s,2h),1.19(s,6h)。表明该步骤成功合成了1-(4-甲氧基苯基)-2-甲基-2-丙胺盐酸盐。
57.上述对实施例的描述是为了便于本技术领域的普通技术人员能理解和应用本技术。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其它实施例中而不必付出创造性的劳动。因此,本技术不限于这里的实施例,本领域技术人员根据本技术披露的内容,在不脱离本技术范围和精神的情况下做出的改进和修改都本技术的范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。