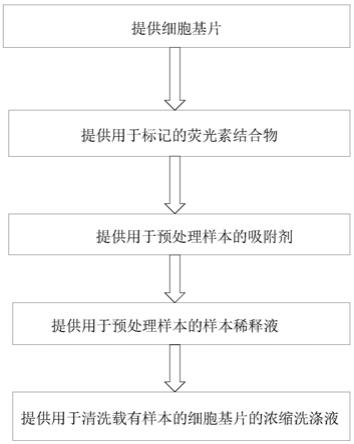
1.本发明涉及免疫检测技术领域,特别涉及制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法及多病原体的联检方法。
背景技术:
2.通常大多数感染都是通过病毒、细菌、支原体、衣原体等病原体所引起,在治疗时必须明确引起感染的病原体是何种类型,这是进行有效治疗的前提。而由于同一种类的病原体可以引起多种临床症状,而同一临床表现却有可能是由于多种病原体引起的,在例如呼吸系统感染患者中,复合感染的比例大约占据20%,而单一的病毒或者细菌等病原体的检测已不能满足临床诊断需求。
3.因此,对不同类型的病原体联检尤为必要。特别是在临床应用中,常常因为检测不同项目,而需要采集患者多管样本或者采集患者不同部位的样本类型,通过这样的检测才能基本满足临床诊断的需要。这样不仅仅增加了检测的时间和成本,而且对于患者本身的就诊体验度也非常差。
4.目前,常用实验室病原体的检测方法主要有分离培养法、抗原的测定、特异性抗体检测和分子生物学法。其中分离培养法具有耗费时间较长、敏感性低且对技术要求高的缺点;在抗原的测定中虽然能够明确感染证据、实现快速检测,但是其敏感性太低;而在特异性抗体的检测中特异性高和灵敏度低,导致不能及时辅助临床诊断,进而使得患者不能及时得到有效治疗;分子生物学的方法虽然具有敏感性高、检测快速的优点,但由于对实验环境要求高非常不利于推广。
技术实现要素:
5.为了解决现有技术中存在的上述问题和缺陷的至少一个方面,本发明提供了一种用于多病原体联检的间接免疫荧光检测试剂盒。所述技术方案如下:
6.本发明的一个目的是提供了一种制备用于多病原体联检的细胞基片的方法。
7.本发明的另一目的是提供了一种制备用于多病原体联检的试剂盒的方法。
8.本发明的还一目的是提供了一种多病原体的联检方法。
9.根据本发明的一个方面,提供了一种制备用于多病原体联检的细胞基片的方法,所述方法包括以下步骤:
10.步骤s1将多种病原体分别进行细胞传代培养;
11.步骤s2将多种病原体中的至少两种传代细胞分别制成细胞悬液;
12.步骤s3将制成的细胞悬液分别施加于同一载玻片上的不同载玻孔中,待所述不同载玻片孔中的细胞悬液中的细胞均吸附后,在相同的条件下固定所述不同载玻片孔中的细胞;
13.所述多种病原体包括从呼吸系统感染病原体、消化系统感染病原体和生殖系统感染病原体中选择的任意一种病原体中的至少两种病原微生物,
14.在步骤s3中,所述相同的条件为在相同的温度条件下使用无水乙醇固定相同的时间,之后在湿度小于50%的同一湿度环境下干燥相同的时间形成所述细胞基片。
15.具体地,所述相同的温度条件为环境温度选自范围23℃~27℃之间的同一温度,所述固定相同的时间是固定时间选自范围30min~3h之间的同一时间,所述干燥相同的时间是干燥时间选自范围30min~3h之间的同一时间。
16.优选地,所述相同的温度条件是25℃,所述固定相同的时间是1h,所述干燥相同的时间是2h,所述无水乙醇为
‑
20℃无水乙醇,
17.所述湿度小于50%的同一湿度是选自范围10%~20%之间的同一湿度,
18.在步骤s2中,细胞悬液的制备包括细菌悬液的制备和感染非细菌的细胞悬液的制备。
19.进一步地,所述细菌悬液的制备包括以下步骤:
20.将传代培养的细菌细胞放入无菌生理盐水中制成细菌悬液;
21.感染非细菌的细胞悬液的制备包括以下步骤:
22.步骤s21将多种病原体中的至少两种传代细胞分别用浓度范围在0.1%~0.5%之间的胰酶消化分离,待所述至少两种传代细胞脱离培养器皿的底时停止消化分离并吸出所述胰酶;
23.步骤s22将消化分离后的至少两种传代细胞分别置于湿度≥90%且温度 37℃、co2浓度为5%的co2培养箱中吸附1h~3h;
24.步骤s23将吸附后的至少两种传代细胞的补充浓度范围在5%~20%的胎牛血清培养基,之后继续在湿度≥90%且温度37℃、co2浓度为5%的co2培养箱中感染细胞24h~96h,直至至少两种传代细胞中所有的病原体细胞均发生病变;
25.步骤s24将发生病变的至少两种传代细胞分别用浓度范围在0.1%~0.5%之间的胰酶消化分离,待所述至少两种感染的病原体细胞脱离培养器皿的底部时加入浓度范围在1%~5%之间的胎牛血清培养基停止消化,形成细胞悬液。
26.进一步地,所述感染非细菌的细胞悬液的制备包括以下步骤:
27.将所述多种病原体的细胞分别加入多种病原体中对应的病原体传代细胞中感染预定时间;
28.将多种病原体中的至少两种转染的病原体细胞分别进行细胞消化分离以确保细胞活力,将消化分离后的至少两种转染的病原体细胞继续培养至细胞发生病变,之后将发生病变的至少两种转染的病原体细胞制成细胞悬液;
29.其中,多种病原体的原代细胞不包括细菌细胞,
30.原代细胞与传代细胞的数量比例范围在1:2~1:1之间,感染预定时间的范围为24h~72h。
31.进一步地,在步骤s1中,细胞传代培养包括细菌细胞的传代培养和非细菌细胞的传代培养,所述细菌细胞的传代培养包括以下步骤:
32.将高压灭菌后的培养基待凝固后接种细菌菌种,之后置于湿度小于50%且温度为37℃培养箱中培养24h~48h长成菌膜形成细菌传代细胞;
33.所述非细菌细胞的传代培养包括以下步骤:
34.步骤s11将多种病原体的原代细胞分别放入不同的培养器皿中,之后分别加入浓
度范围在5%~20%之间的胎牛血清培养基,再置于湿度小于50%且温度为37℃的浓度为5%的co2培养箱中培养第一预定时间进行复苏;
35.步骤s12将复苏的多种病原体用浓度范围在0.1%~0.5%之间的胰酶消化分离,待多种病原体的细胞脱离培养器皿的底时停止消化并吸出所述胰酶,之后置于湿度≥90%且温度为37℃的浓度为5%的co2培养箱中培养第二预定时间,
36.所述第一预定时间小于第二预定时间。
37.根据本发明的另一方面,提供了一种制备用于多病原体联检的试剂盒的方法,所述方法包括以下步骤:
38.提供细胞基片,所述细胞基片为根据上述任一项所述的方法所制备的细胞基片;
39.提供用于标记的荧光素结合物;
40.提供用于预处理样本的吸附剂;
41.提供用于预处理样本的样本稀释液;
42.提供用于清洗载有样本的细胞基片的浓缩洗涤液。
43.根据本发明的还一方面,提供了一种多病原体的联检方法,所述联检方法包括以下步骤:
44.步骤s100提供试剂盒,所述试剂盒为根据权利要求7所述的方法所制备的试剂盒;
45.步骤s200配置所述试剂盒中的浓缩洗涤液并预处理样本;
46.步骤s300将预处理后的样本分别加入至细胞基片上的不同载玻片孔中,之后放入湿盒并在温度范围在4℃~37℃之间的环境中温育20min~12h;
47.步骤s400使用配置后的浓缩洗涤液清洗温育后的细胞基片,之后在清洗后的细胞基片的不同载玻片孔中加入所述试剂盒中的荧光素结合物进行标记,将标记后的细胞基片放入湿盒并在温度范围在4℃~37℃之间的环境中温育 20min~12h,获得能够判读结果的细胞基片,
48.所述能够判读结果的细胞基片中阳性结果为第一颜色,阴性结果为第二颜色,所述第一颜色与第二颜色为不同的两种颜色,
49.在步骤s300中的细胞基片为根据上述任一项所述的方法所制备的细胞基片或上述的方法所制备的试剂盒中的细胞基片。
50.具体地,在步骤s200中,所述预处理样本包括以下步骤:
51.步骤s201将样本与所述样本等体积的所述试剂盒中的吸附剂混匀,之后在预定的转速下离心预定时间;
52.步骤s202将吸附后的样本按照预定比例加入至所述试剂盒中的样本稀释液中混匀。
53.优选地,在步骤s201中,预定转速为10000rpm,离心预定时间为5~15min,
54.在步骤s202中,预定比例为吸附后的样本与样本稀释液的体积比范围为 1:5~1:3之间,
55.在步骤s200中,配置所述试剂盒中的浓缩洗涤液为将所述试剂盒中的浓缩洗涤液稀释30~50倍。
56.根据本发明的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法具有以下优点中的至少一个:
57.(1)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的所述细胞基片能够在同一反应条件下,将含两种或两种以上的病原体如病毒、细菌、支原体等不同种类的病原微生物固定于同一细胞基片上,使得在联检过程中能够同步完成多种疑似病原体鉴别诊断,一次性操作即可获得多个结果;
58.(2)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的细胞基片制备过程中无生化提纯步骤,就能使得抗原接近于真实三维构象,由于荧光结合物的加入使得能够通过荧光双色显影进行结果判读,避免了非特异荧光的干扰;
59.(3)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的细胞基片制备中,细胞无需使用封闭剂包被即可使抗原吸附至载玻片上,同时还能保证在不同种类的病原体之间不会发生交叉反应,并且大大缩短了制备细胞基片的时间;
60.(4)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的试剂盒不仅能有效用于监测外源病原体感染,还可以用于病原体的临床检测和流行病学调查。
附图说明
61.本发明的这些和/或其他方面和优点从下面结合附图对优选实施例的描述中将变得明显和容易理解,其中:
62.图1是根据本发明的一个实施例的制备用于多病原体联检的试剂盒的方法的流程图;
63.图2是图1所示的用于多病原体联检的细胞基片的制备方法流程图;
64.图3是使用图1所示的试验盒进行多病原体的联检方法的流程图。
具体实施方式
65.下面通过实施例,并结合附图,对本发明的技术方案作进一步具体的说明。在说明书中,相同或相似的附图标号指示相同或相似的部件。下述参照附图对本发明实施方式的说明旨在对本发明的总体发明构思进行解释,而不应当理解为对本发明的一种限制。
66.由于在临床应用中,常常为了满足临床诊断的基本需求,因此需要对患者化验检测多个不同的项目。这样使得需要采集患者多管样本或者不同部位的样本类型来进行检测。而这样的操作不仅仅增加了检测的时间和成本,而且对于患者本身的就诊体验度也非常差。为了能够实现采集一次样本即可完成多个项目的检测我们进行了进一步的研究,发现如何能够将不同种类的病原体固定在同一介质上,且由于不同种类的病原体各自的阳性检出率和反应条件各不相同,又如何使不同种类的病原体在同一介质上对同一样本在相同的反应条件下能够检测出符合检测要求的阳性检出率成为了技术难题。经过长期研究,本发明提供了以下方案来解决上述技术难题,具体为:
67.参见图1,其示出了根据本发明的一个实施例的制备用于多病原体联检的试剂盒的方法,所述方法包括以下步骤:提供细胞基片;提供用于标记的荧光素结合物;提供用于
预处理样本的吸附剂;提供用于预处理样本的样本稀释液;提供用于清洗载有样本的细胞基片的浓缩洗涤液。
68.在一个示例中,荧光素结合物为通过荧光素标记的单克隆抗体,所述吸附剂为igg单克隆抗体。所述荧光素包括异硫氰荧光素(fitc)和藻红蛋白(pe),浓缩洗涤液为磷酸盐缓冲液。优选地,所述荧光素结合物为通过fitc标记的抗人igm单克隆抗体,所述吸附剂为鼠人igg单克隆抗体。本示例是一种说明性示例,本领域技术人员可以采用其它具有相同作用的荧光素、荧光素结合物、吸附剂、浓缩洗涤液替代对应的试剂,本示例不应当理解为对本发明的一种限制。
69.在一个示例中,样本稀释液为磷酸盐缓冲液(pbs),包括10mm磷酸二氢钠
‑
磷酸氢二钠系统,其中含0.9%nacl且ph7.2,冲洗细胞,并加入了0.5%的triton以增加细胞通透性。
70.在一个示例中,制备用于多病原体联检的试剂盒的方法还包括提供阳性对照和阴性对照,阴性对照可以选择为10%的正常人体血清,阳性对照为同一载玻片上的所有载玻片孔中的病原体。
71.如图2所示,试剂盒中所使用的细胞基片通过以下方法制备,具体方法包括以下步骤:
72.步骤s1将多种病原体分别进行细胞传代培养;
73.步骤s2将多种病原体中的至少两种传代细胞分别制成细胞悬液;
74.步骤s3将制成的细胞悬液分别施加于同一载玻片上的不同载玻片孔中,待所述不同载玻片孔中的细胞悬液中的细胞均吸附后,在相同的条件下固定所述不同载玻片孔中的细胞(即在不同的载玻片孔中固定有不同种类的抗原)。
75.在一个示例中,所述多种病原体包括从呼吸系统感染病原体、消化系统感染病原体(例如肠道感染病原体)和生殖系统感染病原体中选择的任意一种病原体中的至少两种病原微生物。所述病原微生物包括病毒、细菌、支原体、衣原体、真菌、螺旋体和立克次体。例如,呼吸系统感染病原体中的至少两种病原微生物包括肺炎支原体、肺炎衣原体、甲型流感病毒、乙型流感病毒、呼吸道合胞疱疹病毒、嗜肺军团菌等等中的两种或两种以上的任意组合。也就是说,在同一生理功能系统(例如在同一呼吸系统,或者在同一消化系统)中,病毒、细菌、衣原体、支原体等等中的两种或两种以上的任意组合。
76.在一个示例中,所述多种病原体也可以包括从呼吸系统感染病原体、消化系统感染病原体(例如肠道感染病原体)和生殖系统感染病原体中选择的任意一种病原体中的具体的某一类病原微生物下的具体分类之间的任意组合。例如呼吸系统感染病毒下的具体分类中的两种及其以上的任意组合,泌尿系统感染细菌下的具体分类中的两种及其以上的任意组合。
77.在一个示例中,在步骤s3中,所述相同的条件为在相同的温度条件下使用无水乙醇固定相同的时间,之后在湿度小于50%的同一湿度环境下干燥相同的时间形成所述细胞基片。优选地,所述相同的温度条件为选自温度范围
‑
30℃~
‑
10℃之间的同一温度,更加优选地温度范围为
‑
25℃~
‑
15℃之间,例如
‑
25℃、
‑
22℃、
ꢀ‑
20℃、
‑
17℃或
‑
15℃,特别优选地相同的温度条件可以为
‑
20℃。换句话说,当环境温度设置在23℃~27℃之间,湿度保持在10%~20%之间(优选地湿度为15%) ,通过选择
‑
20℃无水乙醇在相同的时间下固定(例
如固定1小时)不同载玻片孔中的细胞进行,使得在不同细胞基片中的细胞彼此之间不发生交叉反应,因此无需使用封闭剂进行细胞包被。同时在整个细胞基片制备过程中本发明均采用的无生化提纯步骤,就能使得抗原接近于真实三维构象。
78.在一个示例中,所述固定相同的时间是固定时间选自范围30分钟(min)~3 小时(h)之间的同一时间,更加优选地时间范围为50min~1.5h,特别优选地固定相同的时间是1h。优选地,所述干燥相同的时间是干燥时间选自范围30min~3h 之间的同一时间。更加优选地干燥时间选自范围1h~2.5h之间的同一时间。特别优选地干燥相同的时间是1.5h、2h。在湿度小于50%的同一湿度是湿度是选自范围20%~40%之间的同一湿度,例如可以在湿度为20%、25%、30%、35%、 40%中任一湿度环境中培养,优选地为多种病原体中所有的病原体均选择湿度为 20%~30%(例如28%或29%)的环境中培养。
79.在一个示例中,载玻片上设置有至少3个载玻片孔,所述至少3个载玻片孔中包括一个空白对照孔和固定有至少两种抗原的至少两个载玻片孔。
80.在一个示例中,在步骤s1中,细胞传代培养包括细菌细胞的传代培养和非细菌细胞的传代培养,所述非细菌细胞为不包括细菌细胞在内的其它病原体细胞,所述细菌细胞的传代培养包括以下步骤:
81.将高压灭菌后的培养基待凝固后接种细菌菌种,之后置于湿度小于50%且温度为37℃的浓度为5%的co2培养箱中培养24h~48h长成菌膜形成细菌传代细胞;
82.所述非细菌细胞的传代培养包括以下步骤:
83.步骤s11将多种病原体的原代细胞分别放入不同的培养器皿中,之后分别加入浓度范围在5%~20%之间的胎牛血清培养基,再置于湿度≥90%且温度为37℃的浓度为5%的co2培养箱中培养第一预定时间进行复苏;
84.步骤s12将复苏的多种病原体用浓度范围在0.1%~0.5%之间的胰酶消化分离,待多种病原体的细胞脱离培养器皿的底部(例如培养瓶底部),呈现立体状时停止消化并吸出所述胰酶,并计数,之后置于湿度≥90%且温度为37℃的浓度为5%的co2培养箱中培养第二预定时间,当培养器皿中的细胞密度达到 80%
‑
90%时,去除该培养器皿汇总的培养基,停止该培养器皿中的病原体的细胞传代培养。
85.在一个示例中,培养器皿包括培养瓶和培养皿,本领域技术人员可以根据需要进行相应的选择。
86.在一个示例中,在步骤s11中的胎牛血清的浓度可以选择为5%、10%、15%或20%,优选地选择浓度为10%的胎牛血清。
87.在一个示例中,在步骤s11中,所述第一预定时间的范围为24h~72h,优选地,培养48h复苏所述多种病原体的原代细胞。
88.在一个示例中,在步骤s12中,胰酶的浓度优选为0.1%、0.15%、0.2%、 0.25%、0.3%、0.35%、0.4%、0.45%或0.5%,更加优选地选择浓度为0.25%的胰酶消化分离所述多种病原体细胞。
89.在一个示例中,在步骤s11和s12中,培养箱中的湿度≥90%,优选地培养箱中的湿度可以自范围95%
‑
98%之间选择,例如95%、97%、98%。
90.在一个示例中,在步骤s12中,所述第二预定时间小于所述第一预定时间,所述第二预定时间的范围为10h~48h,优选地选择12h、15h、20h、24h、30h、 35h培养,更加优选地
选择培养24h。
91.在一个示例中,细菌细胞传代培养还可以通过以下方法实现,具体包括以下步骤:将不同种类的病原体对应的专用培养基粉溶解,在120℃~130℃的温度下高压灭菌10min~20min,之后待培养基凝固,接种一定量的与专用培养基对应的病原体,例如接种lp菌种。湿度小于50%且温度为37℃的浓度为5%的co2 培养箱中培养第一预定时间进行复苏;湿度小于50%且温度为37℃的浓度为5%的co2培养箱中培养24h~48h,待长出例如菌膜停止传代培养。
92.在一个示例中,在培养箱中的湿度≥90%,优选地培养箱中的湿度可以自范围95%
‑
98%之间选择,例如95%、97%、98%。
93.在步骤s2中,细胞悬液的制备包括细菌悬液的制备和感染非细菌的细胞悬液的制备。所述细菌细胞悬液的制备包括以下步骤:将传代培养的细菌细胞放入无菌生理盐水中制成细菌悬液。
94.感染非细菌的细胞悬液的制备包括以下步骤:
95.步骤s21将多种病原体中的至少两种传代细胞(例如在步骤s12中培养获得的传代细胞)分别用浓度范围在0.1%~0.5%之间,优选浓度为0.25%的胰酶消化分离,待所述至少两种传代细胞脱离培养器皿的底部(例如培养瓶底部),呈现立体状时停止消化分离并吸出所述胰酶;
96.步骤s22将消化分离后的至少两种传代细胞分别置于湿度≥90%,优选为湿度为96%且温度37℃的浓度为5%的co2培养箱中吸附1h~3h,优选吸附2h;
97.步骤s23将吸附后的至少两种传代细胞的补充浓度范围在5%~20%,优选浓度为10%的胎牛血清培养基,之后继续在湿度≥90%,优选为湿度为96%且温度37℃的浓度为5%的co2培养箱中感染细胞24h~96h,需根据不同的病原体细胞设定不同的感染时间(例如coxb细胞感染时间为24h),直至至少两种传代细胞中所有的病原体细胞均发生病变;
98.步骤s24将发生病变的至少两种传代细胞分别用浓度范围在0.1%~0.5%之间,优选浓度为0.25%的胰酶消化分离,待所述至少两种传代细胞脱离培养器皿的底部(例如培养瓶底部),呈现立体状时加入浓度范围在1%~5%之间的胎牛血清培养基(优选地选择2%的胎牛血清培养基)停止消化形成细胞悬液。
99.在一个示例中,在步骤s22和s23中,在培养箱中的湿度≥90%,优选地培养箱中的湿度可以自范围95%
‑
98%之间选择,例如95%、97%、98%。
100.在一个示例中,在步骤s2中,感染非细菌的细胞悬液的制备还可以采用以下方法制成,具体包括以下步骤:
101.将所述多种病原体的原代细胞分别加入多种病原体中对应的病原体传代细胞(即在步骤s12中培养获得的传代细胞)中感染预定时间;
102.将多种病原体中的至少两种转染的病原体细胞分别进行细胞消化分离以确保细胞活力,将消化分离后的至少两种转染的病原体细胞继续培养至细胞发生病变,之后将发生病变的至少两种转染的病原体细胞制成细胞悬液。
103.其中,多种病原体的原代细胞不包括细菌细胞,即包括例如病毒、支原体、衣原体等等。
104.原代细胞与传代细胞的数量比例范围在1:2~1:1之间,优选地为1:2,即将多种病
原体的传代细胞一半数量的原代细胞加入到与该原代细胞类型相同的传代细胞中接毒感染,感染的时间的范围为24h~72h,优选地为24h、48h和72h,根据病原体细胞种类的不同,选择不同的接毒感染时间。
105.参见图3,其示出了使用上述试剂盒对多病原体进行联检的方法,联检方法包括以下步骤:
106.步骤s100提供试剂盒;
107.步骤s200配置浓缩洗涤液并预处理样本;
108.步骤s300将预处理后的样本分别加入至细胞基片上的不同载玻片孔中,之后放入湿盒并在温度范围在4℃~37℃之间的环境中温育20min~12h;
109.步骤s400使用配置后的浓缩洗涤液清洗温育后的细胞基片,之后在清洗后的细胞基片的不同载玻片孔中加入所述试剂盒中的荧光素结合物进行标记,将标记后的细胞基片放入湿盒并在温度范围在4℃~37℃之间的环境中温育 20min~12h,获得能够判读结果的细胞基片。
110.在一个示例中,所述能够判读结果的细胞基片中阳性结果为第一颜色,阴性结果为第二颜色,所述第一颜色与第二颜色为不同的两种颜色。优选地,第一颜色为红色,第二颜色为绿色。
111.在一个示例中,在步骤s300中,例如温度选择4℃时,温育8h~12h;当温度选择37℃时,温育1h;当选择室温时,可以温育2h。
112.在步骤s200中,所述预处理样本包括以下步骤:
113.步骤s201将样本与所述样本等体积的所述试剂盒中的吸附剂混匀,之后在预定的转速下离心预定时间;
114.步骤s202将吸附后的样本按照预定比例加入至所述试剂盒中的样本稀释液中混匀。
115.在一个示例中,在步骤s201中,预定转速为10000rpm,离心预定时间为 5~15min,优选为10min。
116.在一个示例中,在步骤s202中,预定比例为吸附后的样本与样本稀释液的体积比范围为1:5~1:3之间,优选为1:4。
117.在一个示例中,在步骤s200中,配置所述试剂盒中的浓缩洗涤液为将所述试剂盒中的浓缩洗涤液稀释30~50倍,优选为40倍。
118.实施例1
119.1.制备用于呼吸系统感染联检的细胞基片的方法包括以下步骤:
120.(1)细胞传代培养:
121.方法一病原体感染细胞培养:将待固定的hep
‑
2、mdck、mk2、a549 细胞中加入10%胎牛血清的mdem培养基,之后置于温度为37℃、湿度为40%、 co2浓度为5%的co2培养箱中培养48小时复苏;然后用0.25%胰酶消化分离,吸出胰酶并计数600万/t75,再次置于温度为37℃、湿度为90%的5%co2培养箱中培养24小时进行传代培养。
122.方法二噬肺军团菌lp细胞培养:lp专用培养基粉末溶解后,在温度为121℃下进行高压灭菌15min,冷却后倒入平皿,使每皿约15ml培养基,待培养基凝固后,接种50ul lp菌种,置于温度为37℃、湿度为90%的5%co2培养箱中培养24
‑
48小时,长出菌膜后停止传代
培养。
123.(2)病原体感染细胞:
124.计数传代的细胞弃掉培养基,将多种病原体加入对应的细胞中(hep
‑
2细胞—肺炎支原体mp、肺炎衣原体cp、呼吸道合胞病毒rsv、柯萨奇病毒b组病毒coxb;mdck细胞—甲型流感病毒flua、乙型流感病毒flub;mk2细胞—副流感病毒piv;a549细胞—腺病毒adv),置于温度为37℃、湿度为90%的5%co2培养箱中吸附2小时后,补充培养基至16ml,继续培养至细胞发生病变。
125.(3)细胞悬液制备:
126.方法一病原体感染的细胞病变后,用0.25%胰酶消化,加入2%胎牛血清的 dmem培养基36ml,制成细胞悬液。
127.方法二噬肺军团菌lp菌悬液制备:将lp菌膜刮下,放入无菌生理盐水中,吹打均匀,制成菌悬液。
128.(4)病原体固定:
129.方法一将上述病原体感染细胞悬液分别滴加于载玻片孔中,待细胞吸附后,去掉培养基,在环境温度为25℃的条件下,用
‑
20℃无水乙醇固定1小时,晾干;在湿度15%的环境中进行干燥2小时。
130.方法二噬肺军团菌lp细胞悬液滴加载玻片孔,晾干即可。
131.2.用于呼吸系统感染中多病原体的联检方法中预处理样本包括以下步骤:
132.(1)将25ul血清与等体积吸附剂混匀后,10000rpm离心10min.取吸附后血清样本40ul加入到160ul样本稀释液种,混匀待用。阴性对照试剂和阳性对照试剂不需要处理。
133.(2)在细胞基片的每孔中加入15ul预处理过的血清,同时将15ul不稀释的阳性对照和15ul不稀释的阴性对照分别加入两个不同的细胞基本孔中,放入湿盒中,37℃温育60分钟。
134.3.用于呼吸系统感染中多病原体的联检方法中其结果的判读方法如下:
135.终点结果确定方法:将实施例2中湿盒温育后的细胞基片在洗液中重复洗3 次,自然晾干,细胞基片每孔中加入15ul fitc结合物,湿盒中37℃温育30分钟后,即可用荧光显微镜(推荐滤光片波长为470
‑
495nm)下观察结果。
136.结果判读具体为:
137.(1)空白对照:第0孔无绿色荧光,细胞呈现红色。
138.(2)阳性对照:肺炎支原体、肺炎衣原体、呼吸道病毒:甲型流感病毒、异性流感病毒、副流感病毒、呼吸道合胞病毒、腺病毒、柯萨奇病毒b组细胞的细胞核、细胞浆或胞膜出现苹果绿荧光;细菌:军团菌呈现出苹果绿荧光。
139.(3)阴性对照:细菌:军团菌无荧光;肺炎支原体、肺炎衣原体、呼吸道病毒:甲型流感病毒、异性流感病毒、副流感病毒、呼吸道合胞病毒、腺病毒、柯萨奇病毒b组的细胞呈现红色;细菌:军团菌可观察到无荧光。
140.(4)阳性结果:肺炎支原体mp、肺炎衣原体cp、呼吸道病毒:甲型流感病毒、异性流感病毒、副流感病毒、呼吸道合胞病毒、腺病毒、柯萨奇病毒b 组细胞的细胞核、细胞浆或胞膜出现苹果绿荧光;细菌:军团菌呈现出苹果绿荧光。
141.(5)阴性结果:细菌:军团菌无荧光、肺炎支原体、肺炎衣原体、呼吸道病毒:甲型流
感病毒、异性流感病毒、副流感病毒、呼吸道合胞病毒、腺病毒、柯萨奇病毒b组的细胞呈现红色。
142.实施例2
143.肠道感染常见病原体包括轮状病毒rv、腺病毒adv、星状病毒astrovirus、肠道病毒71型ev71。
144.1.用于肠道感染联检的细胞基片制备方法包括以下步骤:
145.(1)细胞传代培养:
146.方法一病原体感染细胞培养:将待固定的ma
‑
104、adv、mk2、caco
‑
2 细胞中加入10%胎牛血清的mdem培养基,之后置于温度为37℃、湿度为98%的5%co2培养箱中培养48小时复苏;然后用0.25%胰酶消化分离,吸出胰酶并计数600万/t75,再次置于温度为37℃、湿度为98%的5%co2培养箱中培养 24小时进行传代培养。
147.(2)病原体感染细胞:
148.通过选择tcid50的一半毒种量进行接毒感染细胞,在细胞出现病变之前进行消化分离,以确保细胞活力。计数传代的细胞弃掉培养基,将多种病原体加入对应的细胞中(ma
‑
104细胞;adv细胞;mk2细胞;caco
‑
2细胞),置于温度为37℃、湿度为98%的5%co2培养箱中吸附2小时后,补充培养基至 16ml,按表一中的时间继续培养至细胞发生病变。
149.表一细胞感染时间表
150.病原体种类rvadvastrovirusev71细胞ma
‑
104advcaco
‑
2mk2感染时间48h24h96h24h
151.(3)细胞悬液制备:
152.病原体感染的细胞病变后,用0.25%胰酶消化,加入2%胎牛血清的dmem 培养基36ml,制成细胞悬液。
153.(4)病原体固定:
154.将上述病原体感染细胞悬液分别滴加于载玻片孔中,待细胞吸附后,去掉培养基,在环境温度为24℃的条件下,用
‑
20℃无水乙醇固1小时,在湿度13%的环境中进行干燥2小时。
155.2.其联检过程中预处理样本的方法如下:
156.(1)将25ul血清与等体积吸附剂混匀后,10000rpm离心10min.取吸附后血清样本40ul加入到160ul样本稀释液中,混匀待用。阴性对照试剂和阳性对照试剂不需要处理。
157.(2)在细胞基片的每孔中加入15ul预处理过的血清,同时将15ul不稀释的阳性对照和15ul不稀释的阴性对照分别加入两个不同的细胞基本孔中,放入湿盒中,37℃温育60分钟。
158.3.其联检后的结果的判读方法如下:
159.终点结果确定方法:将1.2中湿盒温育后的细胞基片在洗涤液中重复洗3次,自然晾干,细胞基片每孔中加入15ul fitc结合物,湿盒中37℃温育30分钟后,即可用荧光显微镜(推荐滤光片波长为470
‑
495nm)下观察结果。
160.双色系统结果判读具体方法:
161.(1)空白对照:第0孔无绿色荧光,细胞呈现红色。
162.(2)阳性对照:轮状病毒、腺病毒、星状病毒、肠道病毒71型的细胞核、细胞浆或胞膜出现苹果绿荧光;
163.(3)阴性对照:轮状病毒、腺病毒、星状病毒、肠道病毒71型的细胞呈现红色。
164.(4)阳性结果:轮状病毒、腺病毒、星状病毒、肠道病毒71型的细胞核、细胞浆或胞膜出现苹果绿荧光。
165.(5)阴性结果:轮状病毒、腺病毒、星状病毒、肠道病毒71型的细胞呈现红色。
166.实施例3
167.生殖系统感染常见为沙眼衣原体、解脲脲原体感染。
168.1.制备用于生殖系统感染联检的细胞基片通过以下制备方法获得:
169.(1)细胞传代培养:
170.方法一病原体感染细胞培养:将待固定的hep
‑
2细胞,用10%胎牛血清的 mdem培养基,置于温度为37℃、湿度为95%的5%co2培养箱中培养48小时复苏;用0.25%胰酶消化后,计数600万/t75,再次置于温度为37℃、湿度为 95%的5%co2培养箱中培养24小时进行传代培养。
171.方法二解脲脲原体uu细胞培养:uu专用培养基粉末溶解后,121℃,15min 高压灭菌,冷却后倒平皿,约15ml/皿,培养基凝固后,接种50ul uu菌种,置于温度为37℃、湿度为95%的5%co2培养箱中培养24
‑
48小时,长出菌膜。
172.(2)病原体感染细胞:
173.通过选择病毒感染力测定(tcid50)的一半毒种量进行接毒感染细胞,在细胞出现病变之前消化滴片,确保细胞活力。计数传代的细胞弃掉培养基,将沙眼衣原体加入对应的细胞中(hela细胞),置于温度为37℃、湿度为95%的 5%co2培养箱中吸附2小时后,补充培养基至16ml,继续将沙眼衣原体培养72h 直至细胞发生病变。
174.(3)细胞悬液制备:
175.方法一沙眼衣原体感染的细胞病变后,用0.25%胰酶消化,加入2%胎牛血清的dmem培养基36ml,制成细胞悬液。
176.方法二解脲脲原体uu悬液制备:将uu菌膜刮下,放入无菌生理盐水中,吹打均匀,制成菌悬液。
177.(4)病原体固定:
178.方法一将上述沙眼衣原体感染细胞悬液分别滴加于载玻片孔中,待细胞吸附后,去掉培养基,在环境温度为26℃的条件下,用
‑
20℃无水乙醇固定1小时;解脲脲原体细胞悬液滴加载玻片孔,晾干即可。在湿度17%的环境中进行干燥2 小时。
179.方法二解脲脲原体uu菌悬液滴加载玻片孔,晾干即可。
180.2.在对生殖系统感染进行联检中其预处理样本的方法如下:
181.(1)将25ul血清与等体积吸附剂混匀后,10000rpm离心10min.取吸附后血清样本40ul加入到160ul样本稀释液种,混匀待用。阴性对照试剂和阳性对照试剂不需要处理。
182.(2)在细胞基片的每孔中加入15ul预处理过的血清,同时将15ul不稀释的阳性对照和15ul不稀释的阴性对照分别加入两个不同的细胞基本孔中,放入湿盒中,37℃温育60分钟。
183.3.联检后的结果的判读方法如下:
184.终点结果确定方法:将湿盒温育后的细胞基片在洗涤液中重复洗3次,自然晾干,细胞基片每孔中加入15ul fitc结合物,湿盒中37℃温育30分钟后,即可用荧光显微镜(推荐滤光片波长为470
‑
495nm)下观察结果。
185.双色系统结果判读具体方法:
186.(1)空白对照:第0孔无绿色荧光,细胞呈现红色。
187.(2)阳性对照:沙眼衣原体、解脲脲原体的细胞核、细胞浆或胞膜出现苹果绿荧光;
188.(3)阴性对照:沙眼衣原体、解脲脲原体的细胞呈现红色。
189.(4)阳性结果:沙眼衣原体、解脲脲原体的细胞核、细胞浆或胞膜出现苹果绿荧光。
190.(5)阴性结果:沙眼衣原体、解脲脲原体的细胞核、细胞浆或胞膜出现苹果绿荧光的细胞呈现红色。
191.根据本发明的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法具有以下优点中的至少一个:
192.(1)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的所述细胞基片能够在同一反应条件下,将含两种或两种以上的病原体如病毒、细菌、支原体等不同种类的病原微生物固定于同一细胞基片上,使得在联检过程中能够同步完成多种疑似病原体鉴别诊断,一次性操作即可获得多个结果;
193.(2)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的细胞基片制备过程中无生化提纯步骤,就能使得抗原接近于真实三维构象,由于荧光结合物的加入使得能够通过荧光双色显影进行结果判读,避免了非特异荧光的干扰;
194.(3)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的细胞基片制备中,细胞无需使用封闭剂包被即可使抗原吸附至载玻片上,同时还能保证在不同种类的病原体之间不会发生交叉反应,并且大大缩短了制备细胞基片的时间;
195.(4)本发明提供的制备用于多病原体联检的细胞基片的方法、制备用于多病原体联检的试剂盒的方法以及多病原体的联检方法中的试剂盒不仅能有效用于监测外源病原体感染,还可以用于病原体的临床检测和流行病学调查。
196.虽然本总体发明构思的一些实施例已被显示和说明,本领域普通技术人员将理解,在不背离本总体发明构思的原则和精神的情况下,可对这些实施例做出改变,本发明的范围以权利要求和它们的等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。